HLA-Ⅱ类基因DRα、DRB1*0401转基因鼠模型的建立及体内表达研究
作者:邓军卫 吴轰* 游学科 冯清泉 李芬 朱亚辉 卢光琇
单位:邓军卫 吴轰 游学科 冯清泉 李芬 410011 长沙,湖南医科大学附属第二医医学实验中心;朱亚辉、卢光琇 生殖工程研究室 *课题负责人
关键词:基因DRα;基因DRB1*0401;转基因动物模型;基因表达
中华医学遗传学杂志990604 【摘要】 目的 建立携带人HLA-Ⅱ类基因DRα、DRB1*0401转基因鼠模型。方法 利用受精卵原核的显微注射技术,将HLA-DRα、DRB1*0401两种基因显微注射至C57BL/6×DBA/1杂交小鼠受精卵中,并移植到假孕受体鼠的输卵管内,然后应用PCR、Southern印迹杂交和Northern杂交方法分析子代鼠中基因的整合及表达情况。结果 实验先后有5只Found鼠,稳定遗传5代。经PCR检测有95只鼠HLA-DR阳性,Southern印迹杂交出68只整合含有DRα、DRB1*0401混合型的转基因小鼠。经Northern杂交和RT-PCR检测,其HLA-DR基因在脾脏和肾脏中均有表达。结论 携带人HLA-Ⅱ类DRα、DRB1*401基因的转基因鼠动物模型构建成功。
, http://www.100md.com
Construction and expression of HLA-DRα, DRB1*0401 transgenic mice model
DENG Junwei, WU Hong*, YOU Xueke, FENG Qingquan, LI Feng, ZHU Yahui, LU Guangxiu.*Medical Research Laboratory Center, 2nd Affiliated Hospital of Hunan Medical University, Changsha, 410011 P.R.China.
【Abstract】 Objective To construct transgenic mice model on DRα and DRB1*0401 of human MHC-Ⅱ molecules.Methods By microinjection techniques on germ nucleus of zygotes, DRα and DRB1*0401 genes were injected into zygotes of C57BL/6×DBA/1 hybrid mice and transplanted into the oviducts of pseudopregnancy female mice. The integration and expression of exogenous genes in offspring were detected by PCR, Southern blot and Northern blot, RT-PCR analysis.Results There were 5 founders of all injected mice, which had steadily inherited to the fifth generation. It was found that 95 mice were positive by PCR and 68 mice were integrated exogenous gene by Southern blot analysis. DRα and DRB1*0401 genes were expressed on spleen and kidney of transgenic mice.Conclusion This experiment on the construction of DRα and DRB1*0401 transgenic mice model is a success.
, 百拇医药
【Key words】 DRα gene DRB1*0401 gene Transgenic mice model Gene expression
主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类抗原,是分布于机体所有有核细胞表面的糖蛋白,其参与外源抗原的加工和提呈。MHC与人类某些自身免疫性疾病相关。为了研究人类MHCⅡ类抗原与自身免疫性疾病的关系及其生物学功能,Woods,Yamamoto等[1,2]已用C57BL/6×STL F2小鼠建立了HLA DRα、DRβ及DQ转基因动物模型。我们将人类HLA-Ⅱ类基因DRα、DRβ1经显微注射法导入C57BL/6×DBA/1小鼠受精卵中,建立DRα、DRB1*0401混合型转基因小鼠模型并对其表达进行研究。
, http://www.100md.com
1 材料与方法
1.1 材料 质粒:HLA-Ⅱ类基因DRα、DRB1*0401 cDNA来自质粒pRC/CMV,该质粒由美国康纳大学教学医院北海岸大学医院Jack Sliver分子医学研究室惠赠。实验动物:C57BL/6及DBA/1小鼠购自中国科学院上海分院实验动物中心。PCR引物:根据HLA-DRB1 cDNA全序列自行设计,由上海中国科学院细胞生物研究所合成。试剂:分子量标准、内切酶、Taq DNA多聚酶、dNTP及探针随机引物标记盒均购自Promega公司,α-32P-dCTP购自北京亚辉生物医学工程公司,TRI20l、RT-PCR试剂盒为GIBcoBRL公司产品。
1.2 方法
1.2.1 HLA-DRα、DRB1*0401重组质粒的制备、分离和纯化 DRα和DRB1*0401 DNA经PCR放大后,用T/A克隆方法插于PCR1000质粒中;再用Not Ⅰ和ApaⅠ内切酶切下DRα、DRB1片段,再插入pRC/CMV质粒相同酶点的位置中,点在滤纸上并注明含量。质粒载体各元件构建如图1。剪下滤纸上的质粒纸片,用50μl 10mmol/L Tris pH7.6溶液洗脱5分钟,离心;取上清液用于转化感受态细菌。提取质粒,用Not Ⅰ和Apa Ⅰ内切酶从质粒上切下DRα、DRB1片段(图2);经0.8%琼脂糖凝胶电泳,回收1.9kb条带,纯化后溶于10mmol/L Tris-EDTA pH8.0溶液中作为转基因备用[3]。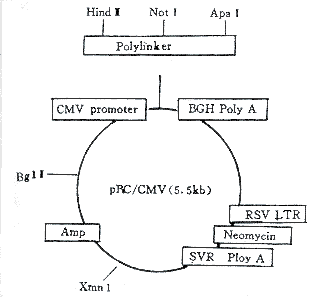
, 百拇医药
图1 pRC/CMV质粒载体结构图
Fig 1 Construction map of pRC/CMV plasmid vector
图2 DRα、DRB1质粒酶切图谱 1:λDNA/EcoRⅠ+HindⅢ为分子量标准;2、3:DRα、DRB1质粒DNA经NotⅠ/ApaⅠ酶切后,大小为1.9kb
Fig 2 Identification of DRα, DRB1 cDNA plasmid using electrophoresis Lane 1:λ DNA/EcoRⅠ+Hind Ⅲ marker;lanes 2,3:DRα and DRB1 plasmids digested with Not Ⅰ/ApaⅠ. The size of target DNA is 1.9kb
, http://www.100md.com
1.2.2 转基因小鼠的制备 按美国Gorden[4]报道的方法进行。共注射1146枚受精卵。将其中805枚形态完好的受精卵分别对28只假孕母鼠进行了单侧输卵管移植。HLA-DRα、DRB1*0401基因导入受精卵之前,用TE(0.1mmol/L EDTA,8mmol/L Trsi-HCl,pH8.0)将其溶融,调整浓度至1.8ng/μl,用显微注射法将其注入C57BL/6×DBA/1品系小鼠受精卵雄性前核中,注入量为每个卵1~2pl。再将该受精卵移植至6周龄的假孕母鼠输卵管中,每侧输卵管输入5~30个卵细胞,待其发育并产仔;对仔鼠进行检测。
1.2.3 仔鼠尾组织DNA的制备及基因整合鉴定 按文献[5,6]制备小鼠尾组织基因组DNA和基因的PCR扩增。当仔鼠长至2周龄,剪下长约0.5~1 cm、重约0.2 g的尾部,剪碎置入500 μl TES(0.5%SDS,0.1mol/L EDTA,0.05mol/LTris-HCl,pH8.0)中,用20mg/ml蛋白酶K和50mg/L RNAase37℃消化过夜。酚抽提1次,酚∶氯仿∶异戊醇(25∶24∶1)提取2次,再单用氯仿提取1次,无水乙醇沉淀,75%乙醇洗1次,室温干燥,溶于TE(1mmol/L EDTA,10mol/L Tris-HCl pH8.0)中,浓度为0.5~0.8g/L。
, http://www.100md.com
PCR引物设计参考HLA-DRB1基因序列,两引物分别由20bp和21bp组成,(C+G)含量为65%。二者之间无同源序列,不互补配对。引物3′端不形成“二聚体”,引物内部不形成二级结构,长度合适、特异性高。P1和P2引物序列分别为:P1:5′-GTTTCTTGG-AGCAGGTTAAAC-3′;P2:5′-CCGCTGCACTG-TGAAGCTCT-3′。
HLA-DR基因的PCR扩增:在0.5ml Eppendorf管中加入25 μl反应液,其中含KCl 50mol/L,MgCl2 1.5 mol/L,Tris-HCl 10mol/L,pH8.3。4种dNTPS各为200mol/L,引物各为20pmol,模板浓度为0.5~1.0μg。混合后加20μl石腊油,96℃变性5分钟;加Taq酶1.5U于PCR仪上;94℃60秒,53℃ 60秒,70℃ 90秒,循环30次。取10μl PCR产物于2%琼脂糖凝胶中电泳,阳性小鼠PCR产物或基因组DNA经Hind Ⅲ酶切消化,琼脂糖电泳并进行Southern印迹试验。
, 百拇医药
1.2.4 Southern印迹杂交 DNA探针的制备:用NotⅠ及ApaⅠ酶切质粒pRC/CMV,琼脂糖电泳分离1.9kb DRα和DRB1.0401基因片段,按文献[3]回收该片段作为探针。以α-32P-dCTP为标记物,按随机引物标记盒说明标记探针,标记50ng DNA,探针的比放射活性大于1×104CPM/g。
印迹杂交:用100~150U Hind Ⅲ内切酶消化10 μg鼠尾部组织DNA,以λDNA/Hind Ⅲ为分子量标准,在0.8%琼脂糖凝胶上电泳过夜(1×TBE 30V)。用传统的纸巾法将凝胶中的DNA转移至NC膜上,按下述方法杂交:NC膜在蒸馏水中浸湿,6×SSC中浸泡10分钟。在6×SSC,5×Den-hart's,0.5%SDS,100mg/L ssDNA、10mmol/L Tris-HCl pH8.0中68℃预杂交6小时;弃预杂交液,换上同样的液体加同位素标记的探针,68℃杂交过夜。用1×SSC、0.1%SDS,37℃,洗膜两次,每次10分钟;再用0.1%SSC,0.1%SDS,68℃洗膜3次,每次10分钟。放入暗匣内,-70℃过夜。取出X胶片显影,定影并观察结果。
, http://www.100md.com
1.2.5 转基因小鼠基因表达的检测 按文献[7,8],在整合鉴定阳性的小鼠中,分别从其肝脏、肾脏、脾脏中提取总RNA,经RT-PCR、Northern印迹杂交检测外源基因DRα、DRB1的表达[9]。
总RNA的制备:取新鲜的小鼠肝脏、肾脏、脾脏组织放入玻璃匀浆器中,加5倍体积的TRIzoL试剂5分钟内迅速匀浆,加入1/10体积的NaAc(pH4.0),1/5体积的氯仿∶异戊醇(24∶1)提取2次;取上清后加等体积的异丙醇沉淀,30%的乙醇洗1次,沉淀用DEPC水溶解。RT-PCR扩增按GIB coBRL公司试剂盒说明书操作。DNA探针的制备(同前)。
Northern印迹杂交:所有物品及试剂均经DEPC处理。将组织中提取的总RNA,取30μl与20μl甲酰胺、5μl载样缓冲液混合后,65℃保温10分钟,然后迅速置冰浴中,稍稍离心;加入1%甲醛变性凝胶中电泳(1×MOPS 3V/cm)。电泳过程中,用电泵不断将阴极、阳极缓冲液混合。电泳后用0.01×SSC脱甲醛、EB染色、切下分子量标准参照物条带,紫外线下照像。此凝胶用于Northern印迹杂交(Northern印迹杂交与前Southern印迹杂交法基本相同)。
, http://www.100md.com
2 结果
2.1 转基因鼠的遗传 实验先后有8只母鼠妊娠(怀孕率为28.5%),并稳定遗传至F5代,一共产下326只仔鼠,283只存活(存活率为87%)。
2.2 转基因鼠的整合分析 制备的小鼠尾组织基因组DNA,经PCR扩增检测出HLA-DR阳性小鼠95只,阳性率为29.1%。其中首建(Found)鼠5只、F130只、F229只、F319只、F48只、F53只。先后对子代阳性小鼠尾组织基因组DNA进行PCR-Southern、Dot blot和DNA-Southern印迹杂交检测,发现68只仔鼠基因组DNA中整合有外源DRα、DRB1基因,阳性整合率为20.9%(图3)。
, 百拇医药
图3 HLA-DR转基因鼠整合图谱 Southern印迹杂交中,(-)非转基因鼠DNA杂交,(+)转基因鼠DNA杂交;鼠尾DNA经Hind Ⅲ酶消化后,0.8%琼脂糖凝胶电泳转移至硝基纤维膜上
Fig 3 Integration of HLA-DR in transgenic mice Southern blot hybridized of mouse tail DNA Lane(-):nontransgenic DNA;lane(+):transgenic DNA; DNA from tail was digested with Hind Ⅲ, electrophoresed in 0.8% agarose gel, blotted onto nitrocellulose
2.3 转基因小鼠的基因表达分析 在68只整合鉴定阳性的小鼠中,取其中10只小鼠分别从其肝脏、肾脏、脾脏中提取总RNA;经RT-PCR、Northern印迹杂交(图4)检测出6只小鼠在脾脏、肾脏中有外源基因DRα、DRB1*0401的表达。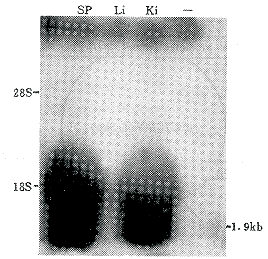
, 百拇医药
图4 HLA-DR转基因鼠表达图谱 转基因鼠肝、脾、肾Northern印迹分析,用TRIzol TM试剂提取肝、脾、肾脏组织总RNA。(-):非转基因鼠RNA;ki:转基因鼠肾;sp:转基因鼠脾;Li:转基因鼠肝;印迹转移至硝基纤维膜上
Fig 4 Expression of HLA-DR transgenic mice Northern blot analysis of transgenic mice spleen, liver and kidney RNA. Total RNA extracted from sp. Li. ki tissues samples by TRIzolTM regent as indicated. Lane(-):nontransgenic mice RNA; lane ki:transgenic mice kidney; lane sp: transgenic mice spleen;lane Li:transgenic mice liver.Blotted onto nitrocellulose
, 百拇医药
结果表明,通过显微注射所导入的HLA-Ⅱ类基因DRα、DRB1*0401已经整合入C57BL/6×DBA/1小鼠基因组中。DRα、DRB1*0401基因不仅能整合而且稳定遗传到F5代,并在脾脏、肾脏得到有效表达。
3 讨论
转基因动物技术中,慎重选用转基因整合与表达的检测方法至关重要。
3.1 外源基因的检测,包括检测外源基因是否整合于动物体细胞的基因组。多聚酶链反应是近年来常用的一种快速、灵敏的检测方法[10]。根据全序列cDNA设计合成引物,对大批量转基因鼠子代进行筛查,以质粒DNA作为阳性对照,筛查出阳性仔鼠95只。该方法缺点是易出现假阳性。当目的基因与内源基因DNA无同源性时,我们采用斑点杂交,Southern印迹杂交实验,以内源基因组DNA作阴性对照,用质粒DNA作阳性对照,证实有68只转基因小鼠整合有DRα、DRB1基因。本法中,虽Southern印迹杂交准确可靠,但对样品质量和纯度要求高,操作烦琐,费用也较高。而斑点杂交对样品纯度要求低,快速、简便、经济,尤其对大批子代转基因鼠的粗筛颇具优越性,可作为首选方法。
, 百拇医药
3.2 转录水平的检测 在有足够子代转基因鼠的情况下,通常作完整合鉴定后,在mRNA水平检测外源基因是否表达, 可采用逆转录聚合酶链反应(RT-PCR)和Northern印迹杂交法。RT-PCR法灵敏度高,对内、外源基因的同源性要求低,故比Northern印迹法适用范围大,还可用内标准进行定量,但费用昂贵。当外源基因和转基因动物基因组DNA同源性较小时,Northern印迹杂交法是确定外源基因是否被转录的有效方法。我们所导入转基因鼠内的HLA-Ⅱ类基因DRα、DRB1*0401主要分布在人B淋巴细胞和巨噬细胞中,用以上两种方法检测出在小鼠脾脏、肾脏中有表达,而国外未发现在肾脏有表达。
3.3 转基因小鼠整体表型的观察 转入外源基因的动物,除用上述方法分析表达产物外,还需在整体水平观察转入外源基因后,其基因型与表型的关系。分析基因型对动物整体性状和生理功能的影响,以进一步鉴定基因的性质,包括转基因后是否引起基因组DNA突变,是否为嵌合型,外源基因是否会丢失及转基因小鼠的表型等。
, 百拇医药
我们应用显微注射法成功建立了HLA-Ⅱ类基因DRα、DRB1*0401转入C57BL/6×DBA/1品系小鼠的动物模型,检测出外源基因的整合与表达,证实转基因小鼠模型所携带的外源基因已稳定地遗传至F5代,并一直在进行复制。该模型的建立,为研究人类某些疾病(特别是自身免疫性疾病)的发病机理,以及探索其防治方法提供了较好的实验模型。
本课题受国家自然科学基金(39370865)资助
参考文献
1 Andrea W, Howard Y, Myrna E, et al. Human major histocompatibility complex class Ⅱ-restricted T cell responses in transgenic mice. J Exp Med, 1994, 180(1)∶173-181.
, 百拇医药
2 Ken Y,Yoshinori F, Yukio E, et al. Functional interaction between human histocompatibility leukocyte antigen recognition by T cell in HLA-DR and DQ transgenic mice. J Exp Med, 1994, 180(1)∶165-171.
3 邓军卫,吴轰,佘鸥,等.玻璃筛柱快速回收DNA片段的方法.湖南医科大学学报,1998,23(4)∶421-422.
4 Gorden JW.Genetic transformation of mouse embryos by microinjection of purification DNA. Proc Natl Acad Sci, 1980, 77(12)∶7380-7384.
, 百拇医药 5 White BA. Current methods and application.In: Totowa.ed.PCR Protocols. New Jersey: Humana Press Inc., 1993. 81-84.
6 Lee SB, Milgroom MG, Taylor JW. A rapid, high yield mini-prep method for isolation of total genomic DNA from fungi. Fungal Genetics Newsletter, 1988, 35(1)∶23-24.
7 Piotr C, Nicoletta S. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry, 1987, 162(1)∶156-159.
, 百拇医药
8 Piotr C. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biote-chniques, 1993, 15(3)∶532-536.
9 Chomczynski P. One-hour downward alkaline capillary blotting of DNA and RNA Anal. Biochem, 1992, 201(1)∶134-139.
10 Carl T, Darid J. Rapid cycle DNA amplification: time and temperature optimization. Biotechniques, 1991, 10(1)∶76-83.
(收稿:1998-11-23 修回:1999-03-02), 百拇医药(邓军卫 吴轰* 游学科 冯清泉 李芬 朱亚辉 卢光琇)
单位:邓军卫 吴轰 游学科 冯清泉 李芬 410011 长沙,湖南医科大学附属第二医医学实验中心;朱亚辉、卢光琇 生殖工程研究室 *课题负责人
关键词:基因DRα;基因DRB1*0401;转基因动物模型;基因表达
中华医学遗传学杂志990604 【摘要】 目的 建立携带人HLA-Ⅱ类基因DRα、DRB1*0401转基因鼠模型。方法 利用受精卵原核的显微注射技术,将HLA-DRα、DRB1*0401两种基因显微注射至C57BL/6×DBA/1杂交小鼠受精卵中,并移植到假孕受体鼠的输卵管内,然后应用PCR、Southern印迹杂交和Northern杂交方法分析子代鼠中基因的整合及表达情况。结果 实验先后有5只Found鼠,稳定遗传5代。经PCR检测有95只鼠HLA-DR阳性,Southern印迹杂交出68只整合含有DRα、DRB1*0401混合型的转基因小鼠。经Northern杂交和RT-PCR检测,其HLA-DR基因在脾脏和肾脏中均有表达。结论 携带人HLA-Ⅱ类DRα、DRB1*401基因的转基因鼠动物模型构建成功。
, http://www.100md.com
Construction and expression of HLA-DRα, DRB1*0401 transgenic mice model
DENG Junwei, WU Hong*, YOU Xueke, FENG Qingquan, LI Feng, ZHU Yahui, LU Guangxiu.*Medical Research Laboratory Center, 2nd Affiliated Hospital of Hunan Medical University, Changsha, 410011 P.R.China.
【Abstract】 Objective To construct transgenic mice model on DRα and DRB1*0401 of human MHC-Ⅱ molecules.Methods By microinjection techniques on germ nucleus of zygotes, DRα and DRB1*0401 genes were injected into zygotes of C57BL/6×DBA/1 hybrid mice and transplanted into the oviducts of pseudopregnancy female mice. The integration and expression of exogenous genes in offspring were detected by PCR, Southern blot and Northern blot, RT-PCR analysis.Results There were 5 founders of all injected mice, which had steadily inherited to the fifth generation. It was found that 95 mice were positive by PCR and 68 mice were integrated exogenous gene by Southern blot analysis. DRα and DRB1*0401 genes were expressed on spleen and kidney of transgenic mice.Conclusion This experiment on the construction of DRα and DRB1*0401 transgenic mice model is a success.
, 百拇医药
【Key words】 DRα gene DRB1*0401 gene Transgenic mice model Gene expression
主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类抗原,是分布于机体所有有核细胞表面的糖蛋白,其参与外源抗原的加工和提呈。MHC与人类某些自身免疫性疾病相关。为了研究人类MHCⅡ类抗原与自身免疫性疾病的关系及其生物学功能,Woods,Yamamoto等[1,2]已用C57BL/6×STL F2小鼠建立了HLA DRα、DRβ及DQ转基因动物模型。我们将人类HLA-Ⅱ类基因DRα、DRβ1经显微注射法导入C57BL/6×DBA/1小鼠受精卵中,建立DRα、DRB1*0401混合型转基因小鼠模型并对其表达进行研究。
, http://www.100md.com
1 材料与方法
1.1 材料 质粒:HLA-Ⅱ类基因DRα、DRB1*0401 cDNA来自质粒pRC/CMV,该质粒由美国康纳大学教学医院北海岸大学医院Jack Sliver分子医学研究室惠赠。实验动物:C57BL/6及DBA/1小鼠购自中国科学院上海分院实验动物中心。PCR引物:根据HLA-DRB1 cDNA全序列自行设计,由上海中国科学院细胞生物研究所合成。试剂:分子量标准、内切酶、Taq DNA多聚酶、dNTP及探针随机引物标记盒均购自Promega公司,α-32P-dCTP购自北京亚辉生物医学工程公司,TRI20l、RT-PCR试剂盒为GIBcoBRL公司产品。
1.2 方法
1.2.1 HLA-DRα、DRB1*0401重组质粒的制备、分离和纯化 DRα和DRB1*0401 DNA经PCR放大后,用T/A克隆方法插于PCR1000质粒中;再用Not Ⅰ和ApaⅠ内切酶切下DRα、DRB1片段,再插入pRC/CMV质粒相同酶点的位置中,点在滤纸上并注明含量。质粒载体各元件构建如图1。剪下滤纸上的质粒纸片,用50μl 10mmol/L Tris pH7.6溶液洗脱5分钟,离心;取上清液用于转化感受态细菌。提取质粒,用Not Ⅰ和Apa Ⅰ内切酶从质粒上切下DRα、DRB1片段(图2);经0.8%琼脂糖凝胶电泳,回收1.9kb条带,纯化后溶于10mmol/L Tris-EDTA pH8.0溶液中作为转基因备用[3]。

, 百拇医药
图1 pRC/CMV质粒载体结构图
Fig 1 Construction map of pRC/CMV plasmid vector

图2 DRα、DRB1质粒酶切图谱 1:λDNA/EcoRⅠ+HindⅢ为分子量标准;2、3:DRα、DRB1质粒DNA经NotⅠ/ApaⅠ酶切后,大小为1.9kb
Fig 2 Identification of DRα, DRB1 cDNA plasmid using electrophoresis Lane 1:λ DNA/EcoRⅠ+Hind Ⅲ marker;lanes 2,3:DRα and DRB1 plasmids digested with Not Ⅰ/ApaⅠ. The size of target DNA is 1.9kb
, http://www.100md.com
1.2.2 转基因小鼠的制备 按美国Gorden[4]报道的方法进行。共注射1146枚受精卵。将其中805枚形态完好的受精卵分别对28只假孕母鼠进行了单侧输卵管移植。HLA-DRα、DRB1*0401基因导入受精卵之前,用TE(0.1mmol/L EDTA,8mmol/L Trsi-HCl,pH8.0)将其溶融,调整浓度至1.8ng/μl,用显微注射法将其注入C57BL/6×DBA/1品系小鼠受精卵雄性前核中,注入量为每个卵1~2pl。再将该受精卵移植至6周龄的假孕母鼠输卵管中,每侧输卵管输入5~30个卵细胞,待其发育并产仔;对仔鼠进行检测。
1.2.3 仔鼠尾组织DNA的制备及基因整合鉴定 按文献[5,6]制备小鼠尾组织基因组DNA和基因的PCR扩增。当仔鼠长至2周龄,剪下长约0.5~1 cm、重约0.2 g的尾部,剪碎置入500 μl TES(0.5%SDS,0.1mol/L EDTA,0.05mol/LTris-HCl,pH8.0)中,用20mg/ml蛋白酶K和50mg/L RNAase37℃消化过夜。酚抽提1次,酚∶氯仿∶异戊醇(25∶24∶1)提取2次,再单用氯仿提取1次,无水乙醇沉淀,75%乙醇洗1次,室温干燥,溶于TE(1mmol/L EDTA,10mol/L Tris-HCl pH8.0)中,浓度为0.5~0.8g/L。
, http://www.100md.com
PCR引物设计参考HLA-DRB1基因序列,两引物分别由20bp和21bp组成,(C+G)含量为65%。二者之间无同源序列,不互补配对。引物3′端不形成“二聚体”,引物内部不形成二级结构,长度合适、特异性高。P1和P2引物序列分别为:P1:5′-GTTTCTTGG-AGCAGGTTAAAC-3′;P2:5′-CCGCTGCACTG-TGAAGCTCT-3′。
HLA-DR基因的PCR扩增:在0.5ml Eppendorf管中加入25 μl反应液,其中含KCl 50mol/L,MgCl2 1.5 mol/L,Tris-HCl 10mol/L,pH8.3。4种dNTPS各为200mol/L,引物各为20pmol,模板浓度为0.5~1.0μg。混合后加20μl石腊油,96℃变性5分钟;加Taq酶1.5U于PCR仪上;94℃60秒,53℃ 60秒,70℃ 90秒,循环30次。取10μl PCR产物于2%琼脂糖凝胶中电泳,阳性小鼠PCR产物或基因组DNA经Hind Ⅲ酶切消化,琼脂糖电泳并进行Southern印迹试验。
, 百拇医药
1.2.4 Southern印迹杂交 DNA探针的制备:用NotⅠ及ApaⅠ酶切质粒pRC/CMV,琼脂糖电泳分离1.9kb DRα和DRB1.0401基因片段,按文献[3]回收该片段作为探针。以α-32P-dCTP为标记物,按随机引物标记盒说明标记探针,标记50ng DNA,探针的比放射活性大于1×104CPM/g。
印迹杂交:用100~150U Hind Ⅲ内切酶消化10 μg鼠尾部组织DNA,以λDNA/Hind Ⅲ为分子量标准,在0.8%琼脂糖凝胶上电泳过夜(1×TBE 30V)。用传统的纸巾法将凝胶中的DNA转移至NC膜上,按下述方法杂交:NC膜在蒸馏水中浸湿,6×SSC中浸泡10分钟。在6×SSC,5×Den-hart's,0.5%SDS,100mg/L ssDNA、10mmol/L Tris-HCl pH8.0中68℃预杂交6小时;弃预杂交液,换上同样的液体加同位素标记的探针,68℃杂交过夜。用1×SSC、0.1%SDS,37℃,洗膜两次,每次10分钟;再用0.1%SSC,0.1%SDS,68℃洗膜3次,每次10分钟。放入暗匣内,-70℃过夜。取出X胶片显影,定影并观察结果。
, http://www.100md.com
1.2.5 转基因小鼠基因表达的检测 按文献[7,8],在整合鉴定阳性的小鼠中,分别从其肝脏、肾脏、脾脏中提取总RNA,经RT-PCR、Northern印迹杂交检测外源基因DRα、DRB1的表达[9]。
总RNA的制备:取新鲜的小鼠肝脏、肾脏、脾脏组织放入玻璃匀浆器中,加5倍体积的TRIzoL试剂5分钟内迅速匀浆,加入1/10体积的NaAc(pH4.0),1/5体积的氯仿∶异戊醇(24∶1)提取2次;取上清后加等体积的异丙醇沉淀,30%的乙醇洗1次,沉淀用DEPC水溶解。RT-PCR扩增按GIB coBRL公司试剂盒说明书操作。DNA探针的制备(同前)。
Northern印迹杂交:所有物品及试剂均经DEPC处理。将组织中提取的总RNA,取30μl与20μl甲酰胺、5μl载样缓冲液混合后,65℃保温10分钟,然后迅速置冰浴中,稍稍离心;加入1%甲醛变性凝胶中电泳(1×MOPS 3V/cm)。电泳过程中,用电泵不断将阴极、阳极缓冲液混合。电泳后用0.01×SSC脱甲醛、EB染色、切下分子量标准参照物条带,紫外线下照像。此凝胶用于Northern印迹杂交(Northern印迹杂交与前Southern印迹杂交法基本相同)。
, http://www.100md.com
2 结果
2.1 转基因鼠的遗传 实验先后有8只母鼠妊娠(怀孕率为28.5%),并稳定遗传至F5代,一共产下326只仔鼠,283只存活(存活率为87%)。
2.2 转基因鼠的整合分析 制备的小鼠尾组织基因组DNA,经PCR扩增检测出HLA-DR阳性小鼠95只,阳性率为29.1%。其中首建(Found)鼠5只、F130只、F229只、F319只、F48只、F53只。先后对子代阳性小鼠尾组织基因组DNA进行PCR-Southern、Dot blot和DNA-Southern印迹杂交检测,发现68只仔鼠基因组DNA中整合有外源DRα、DRB1基因,阳性整合率为20.9%(图3)。

, 百拇医药
图3 HLA-DR转基因鼠整合图谱 Southern印迹杂交中,(-)非转基因鼠DNA杂交,(+)转基因鼠DNA杂交;鼠尾DNA经Hind Ⅲ酶消化后,0.8%琼脂糖凝胶电泳转移至硝基纤维膜上
Fig 3 Integration of HLA-DR in transgenic mice Southern blot hybridized of mouse tail DNA Lane(-):nontransgenic DNA;lane(+):transgenic DNA; DNA from tail was digested with Hind Ⅲ, electrophoresed in 0.8% agarose gel, blotted onto nitrocellulose
2.3 转基因小鼠的基因表达分析 在68只整合鉴定阳性的小鼠中,取其中10只小鼠分别从其肝脏、肾脏、脾脏中提取总RNA;经RT-PCR、Northern印迹杂交(图4)检测出6只小鼠在脾脏、肾脏中有外源基因DRα、DRB1*0401的表达。

, 百拇医药
图4 HLA-DR转基因鼠表达图谱 转基因鼠肝、脾、肾Northern印迹分析,用TRIzol TM试剂提取肝、脾、肾脏组织总RNA。(-):非转基因鼠RNA;ki:转基因鼠肾;sp:转基因鼠脾;Li:转基因鼠肝;印迹转移至硝基纤维膜上
Fig 4 Expression of HLA-DR transgenic mice Northern blot analysis of transgenic mice spleen, liver and kidney RNA. Total RNA extracted from sp. Li. ki tissues samples by TRIzolTM regent as indicated. Lane(-):nontransgenic mice RNA; lane ki:transgenic mice kidney; lane sp: transgenic mice spleen;lane Li:transgenic mice liver.Blotted onto nitrocellulose
, 百拇医药
结果表明,通过显微注射所导入的HLA-Ⅱ类基因DRα、DRB1*0401已经整合入C57BL/6×DBA/1小鼠基因组中。DRα、DRB1*0401基因不仅能整合而且稳定遗传到F5代,并在脾脏、肾脏得到有效表达。
3 讨论
转基因动物技术中,慎重选用转基因整合与表达的检测方法至关重要。
3.1 外源基因的检测,包括检测外源基因是否整合于动物体细胞的基因组。多聚酶链反应是近年来常用的一种快速、灵敏的检测方法[10]。根据全序列cDNA设计合成引物,对大批量转基因鼠子代进行筛查,以质粒DNA作为阳性对照,筛查出阳性仔鼠95只。该方法缺点是易出现假阳性。当目的基因与内源基因DNA无同源性时,我们采用斑点杂交,Southern印迹杂交实验,以内源基因组DNA作阴性对照,用质粒DNA作阳性对照,证实有68只转基因小鼠整合有DRα、DRB1基因。本法中,虽Southern印迹杂交准确可靠,但对样品质量和纯度要求高,操作烦琐,费用也较高。而斑点杂交对样品纯度要求低,快速、简便、经济,尤其对大批子代转基因鼠的粗筛颇具优越性,可作为首选方法。
, 百拇医药
3.2 转录水平的检测 在有足够子代转基因鼠的情况下,通常作完整合鉴定后,在mRNA水平检测外源基因是否表达, 可采用逆转录聚合酶链反应(RT-PCR)和Northern印迹杂交法。RT-PCR法灵敏度高,对内、外源基因的同源性要求低,故比Northern印迹法适用范围大,还可用内标准进行定量,但费用昂贵。当外源基因和转基因动物基因组DNA同源性较小时,Northern印迹杂交法是确定外源基因是否被转录的有效方法。我们所导入转基因鼠内的HLA-Ⅱ类基因DRα、DRB1*0401主要分布在人B淋巴细胞和巨噬细胞中,用以上两种方法检测出在小鼠脾脏、肾脏中有表达,而国外未发现在肾脏有表达。
3.3 转基因小鼠整体表型的观察 转入外源基因的动物,除用上述方法分析表达产物外,还需在整体水平观察转入外源基因后,其基因型与表型的关系。分析基因型对动物整体性状和生理功能的影响,以进一步鉴定基因的性质,包括转基因后是否引起基因组DNA突变,是否为嵌合型,外源基因是否会丢失及转基因小鼠的表型等。
, 百拇医药
我们应用显微注射法成功建立了HLA-Ⅱ类基因DRα、DRB1*0401转入C57BL/6×DBA/1品系小鼠的动物模型,检测出外源基因的整合与表达,证实转基因小鼠模型所携带的外源基因已稳定地遗传至F5代,并一直在进行复制。该模型的建立,为研究人类某些疾病(特别是自身免疫性疾病)的发病机理,以及探索其防治方法提供了较好的实验模型。
本课题受国家自然科学基金(39370865)资助
参考文献
1 Andrea W, Howard Y, Myrna E, et al. Human major histocompatibility complex class Ⅱ-restricted T cell responses in transgenic mice. J Exp Med, 1994, 180(1)∶173-181.
, 百拇医药
2 Ken Y,Yoshinori F, Yukio E, et al. Functional interaction between human histocompatibility leukocyte antigen recognition by T cell in HLA-DR and DQ transgenic mice. J Exp Med, 1994, 180(1)∶165-171.
3 邓军卫,吴轰,佘鸥,等.玻璃筛柱快速回收DNA片段的方法.湖南医科大学学报,1998,23(4)∶421-422.
4 Gorden JW.Genetic transformation of mouse embryos by microinjection of purification DNA. Proc Natl Acad Sci, 1980, 77(12)∶7380-7384.
, 百拇医药 5 White BA. Current methods and application.In: Totowa.ed.PCR Protocols. New Jersey: Humana Press Inc., 1993. 81-84.
6 Lee SB, Milgroom MG, Taylor JW. A rapid, high yield mini-prep method for isolation of total genomic DNA from fungi. Fungal Genetics Newsletter, 1988, 35(1)∶23-24.
7 Piotr C, Nicoletta S. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry, 1987, 162(1)∶156-159.
, 百拇医药
8 Piotr C. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biote-chniques, 1993, 15(3)∶532-536.
9 Chomczynski P. One-hour downward alkaline capillary blotting of DNA and RNA Anal. Biochem, 1992, 201(1)∶134-139.
10 Carl T, Darid J. Rapid cycle DNA amplification: time and temperature optimization. Biotechniques, 1991, 10(1)∶76-83.
(收稿:1998-11-23 修回:1999-03-02), 百拇医药(邓军卫 吴轰* 游学科 冯清泉 李芬 朱亚辉 卢光琇)