一种碘化钾提取外周血基因组DNA的方法
作者:赵书平 张俊洁 尤建 杨玉红 郭峰
单位:赵书平 尤建 杨玉红 271000山东省泰安,解放军第88医院中心实验室;张俊洁 郭峰 上海长海医院妇产科
关键词:基因组DNA;碘化钾;提取;外周血
一种碘化钾提取外周血基因组DNA的方法 【摘要】 目的 建立外周血基因组DNA的快速提取方法。方法 用碘化钾直接从外周血中提取基因组DNA。结果 用该方法提取的DNA为大分子量DNA;A260/A280为1.85,A260/A230为2.2;提取效率大于90%;DNA体外扩增结果良好。结论 该方法简便、快速、经济,可用于大量临床标本的研究。
The establishment and application of genomic DNA extraction from peripheral blood
, http://www.100md.com
ZHAO Shuping*,ZHANG Junjie,YOU Jian,YANG Yuhong,GUO Feng.No.88 Hospital of PLA,Tai'an 271000 P.R.China.E-mail:88 hosp@public.taptt.sd.cn
【Abstract】 Objective To establish the method of genomic DNA extraction.Methods Genomic DNA was directly extracted from peripheral blood with the use of KI.Results The genomic DNA extracted with KI was of large molecular weight.A260/A280 and A260/A230 were 1.85 and 2.2 respectively. The extraction efficiency was greater than 90%.The result of PCR for the DNA was good.Conclusion The method is simple,quick,economical and could be used for studying numbers of clinical samples.
, 百拇医药
【Key words】 Genomic DNA Potassium iodide Extraction Peripheral blood
近年来,基因分析技术广泛应用于医学的各个领域,基因组DNA的提取则是首要的问题。目前基因组DNA的提取方法比较多,有传统的蛋白酶K消化法、尿素提取法、碘化钠(NaI)法以及氯化锌法[1-4]等。我们经反复试验,建立了用碘化钾(KI)提取外周血基因组DNA的方法,并以该方法提取的DNA为模板进行了红细胞CR1密度基因型的研究,取得了满意结果。现报告如下。
1 材料与方法
1.1 外周血基因组DNA的提取 取EDTA-Na2抗凝血100μl加至1.5ml Eppendorf管中,加无菌重蒸水500μl;10 000r/分钟离心3分钟,弃净上清;加20μl 5mol/L KI,旋涡振荡30秒;0.9%NaCl 100μl,150μl氯仿/异戊醇(24∶1),振荡30秒;10 000r/分钟离心5分钟,吸上清100μl于另一Eppendorf管中,加异丙醇60μl,轻轻混匀,10 000r/分钟离心5分钟,弃上清;加冷无水乙醇1000μl,10 000r/分钟离心5分钟;弃去无水乙醇,37℃烤干;50μl无菌重蒸水或TE,混匀溶解备用。
, http://www.100md.com
1.2 基因组DNA的鉴定
1.2.1 直接琼脂糖凝胶电泳 取溶解备用DNA 4μl,加TBE缓冲液6μl,上样缓冲液2μl混匀,0.8%琼脂糖凝胶5V/cm电压条件下电泳40分钟。
1.2.2 紫外分光光度计检测 用紫外分光光度计(日本岛津UVPC-2401型)测定提取的基因组DNA的紫外吸收峰,计算DNA浓度、纯度。
1.2.3 基因组DNA体外PCR扩增 引物参照文献[5]设计,序列为:P1 CGTCAATGGAATGGTG-CAT,P2 CCCTTGTAAGGCAAGTCTGG,利用该引物扩增红细胞CR1密度相关基因。30μl反应体系中加模板3μl,在DNA扩增仪(PTC-100型,美国MJ公司)上进行扩增。PCR循环参数为93.5℃变性2分钟后按93.5℃ 60秒,60℃50秒,72℃ 50秒30个循环,72℃延伸5分钟。然后,凝胶电泳检查扩增结果。
, 百拇医药
2 结果
2.1 琼脂糖凝胶电泳结果 在紫外检测仪上可以发现靠近原点处有一致密的橙色条带,为大分子基因组DNA,与传统的酚氯仿法、碘化钠法提取的DNA分子量基本相同(图1)。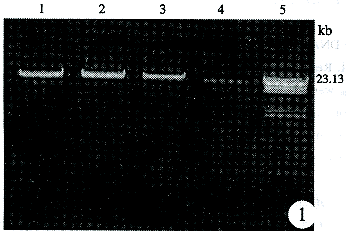
图1 基因组DNA电泳结果 1、2:KI法提取的基因组DNA,3:NaI法提取的基因组DNA,4:蛋白酶K法提取的基因组DNA,5:λDNA/HindⅢ分子量标志 Fig 1 The result of genomic DNA electrophoresis Lanes 1,2:DNA extracted with KI;lane 3:DNA extracted with NaI;lane 4:DNA extracted with proteinase K;lane 5:λ DNA/HindⅢmarker
, http://www.100md.com
2.2 紫外吸收测定结果 用此方法提取的基因组DNA在260nm处呈吸收高峰,而在280nm处光吸收值(A)剧烈下降,为典型的DNA吸收曲线。
2.3 该方法提取DNA的效率[6] 根据260nm吸光度值计算DNA的提取效率,1ml外周血平均得DNA22~27μg。得率大于理论值的90%,从图1电泳结果可以看出该法比酚氯仿及NaI法提取的DNA量高。
2.4 DNA纯度测定结果 用此方法提取的基因组DNA,碘化物的残余量以及蛋白质的残余量均低于NaI法,且A260/A230>2.0,A260/A280>1.8(表1),说明DNA纯度较高。
表1 KI法与NaI法提取的基因组DNA纯度比较(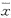 ±s)
±s)
, http://www.100md.com
Tab 1 Comparison of DNA extracted with KI and NaI(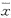 ±s)
±s)
Groups
(组别)
Number
(数量)
Remains of I
[I残余量(A)]
A260/A230
, 百拇医药
(A260/A230比值)
A260/A280
(A260/A280比值)
KI
(碘化钾组)
30
0.45±0.11
2.19±0.20
1.85±0.18
NaI
, 百拇医药 (碘化钠组)
30
3.46±0.42
1.97±0.17
1.80±0.11
P<0.05,Comparison between the two groups(两组比较)
2.5 DNA的体外扩增 用该方法提取的DNA为模板进行红细胞CR1密度相关基因的扩增,引物设计扩增片段为1.8kb,琼脂糖凝胶电泳后与标准分子量比较,该片段与预计片段的大小一致(图2)。
, 百拇医药
图2 KI法提取DNA的PCR结果 1~4:KI法提取的DNA PCR结果,5:λDNA/HindⅢ分子量标志
Fig 2 The result of PCR for DNA extraction with KI Lanes 1-4:the result of PCR for the genomic DNA extracted with KI; lane 5:λDNA/HindⅢ marker
3 讨论
快速、经济地从血液或组织中得到高产量、高纯度的DNA对于基因研究是非常重要的。目前基因组DNA的提取方法比较多,有传统蛋白酶K消化法、尿素法等,它们存在操作步骤繁杂、用时长、效率低等不足之处。目前市场上也有多种DNA提取试剂盒,虽然操作简便,但价格比较高,因此以上方法均不宜于大量临床标本的科学研究。Loparev等报道利用NaI提取DNA的方法,该方法简便、快速,但所提取的DNA存在NaI、卟啉化合物以及蛋白质含量较高。我们利用KI与NaI化学性质相近,其溶液比NaI稳定,价格便宜等特点,建立了KI快速提取外周血基因组DNA的方法。该方法尽可能地去除了红细胞的诸成分和白细胞的膜蛋白等成分,利用高浓度KI在短时间内(<30秒)直接裂解白细胞膜、核膜,使DNA释放出来而又不被破坏,经氯仿、异丙醇、冷无水乙醇等步骤的处理,在半小时内即可完成DNA的提取。由于该方法步骤少、时间短,DNA丢失少,因此,DNA得率比较高。KI法与NaI法所提取的DNA进行比较,电泳结果基本一致(图1),但KI法提取的DNA中碘化物的残余量以及A260/A280、A260/A230比值与NaI法比较均有统计学意义(表1),说明KI法提取的DNA中碘化物残余量以及蛋白质残余量均低于NaI法,DNA的纯度较高。此外,KI法用血量只需50~100μl,所用试剂价格便宜、性质稳定,不需特殊实验条件以及蛋白酶K,一般实验室就能进行。我们以该方法提取的DNA为模板进行红细胞CR1密度相关基因研究,取得了满意的结果(图2)。因此,利用碘化钾提取基因组DNA法可望成为基因研究较为理想的方法。
, 百拇医药
参考文献
1 Pencz M,Soloweiwjczyk D,Harpel B,et al.Construction of human genelibraries from small amounts of peripheral blood.Hemoglobin,1982,6(1)∶27-36.
2 周郁,余伍忠,滕葵,等.尿素用于DNA提取.中华医学检验杂志,1993,16(6)∶349-350.
3 Loparev VN,Cartas MA,Monken CE,et al.An efficient and simple method of DNA extraction from whole blood and cell line to identify infectious agents. J Virolo Methods,1992,34(1)∶105-112.
, http://www.100md.com
4 Kejnovsky E,Kypr J.DNA extraction by zinc.Nucleic Acids Res,1997,25∶1870-1871.
5 Cornillet P,Philert F,Kazatchkine MD,et al.Genomic determination of the CR1(CD35) density polymorphism on erythrocytes using polymerase chain reaction amplification and HindⅢ restriction enzyme digestion.J Immnol Methods,1991,136(2)∶193-197.
6 杨道理,王宝成.DNA扩增技术与医学应用.济南:山东科学技术出版社,1992.5-7.
(收稿:1999-01-05 修回:1999-05-05), 百拇医药
单位:赵书平 尤建 杨玉红 271000山东省泰安,解放军第88医院中心实验室;张俊洁 郭峰 上海长海医院妇产科
关键词:基因组DNA;碘化钾;提取;外周血
一种碘化钾提取外周血基因组DNA的方法 【摘要】 目的 建立外周血基因组DNA的快速提取方法。方法 用碘化钾直接从外周血中提取基因组DNA。结果 用该方法提取的DNA为大分子量DNA;A260/A280为1.85,A260/A230为2.2;提取效率大于90%;DNA体外扩增结果良好。结论 该方法简便、快速、经济,可用于大量临床标本的研究。
The establishment and application of genomic DNA extraction from peripheral blood
, http://www.100md.com
ZHAO Shuping*,ZHANG Junjie,YOU Jian,YANG Yuhong,GUO Feng.No.88 Hospital of PLA,Tai'an 271000 P.R.China.E-mail:88 hosp@public.taptt.sd.cn
【Abstract】 Objective To establish the method of genomic DNA extraction.Methods Genomic DNA was directly extracted from peripheral blood with the use of KI.Results The genomic DNA extracted with KI was of large molecular weight.A260/A280 and A260/A230 were 1.85 and 2.2 respectively. The extraction efficiency was greater than 90%.The result of PCR for the DNA was good.Conclusion The method is simple,quick,economical and could be used for studying numbers of clinical samples.
, 百拇医药
【Key words】 Genomic DNA Potassium iodide Extraction Peripheral blood
近年来,基因分析技术广泛应用于医学的各个领域,基因组DNA的提取则是首要的问题。目前基因组DNA的提取方法比较多,有传统的蛋白酶K消化法、尿素提取法、碘化钠(NaI)法以及氯化锌法[1-4]等。我们经反复试验,建立了用碘化钾(KI)提取外周血基因组DNA的方法,并以该方法提取的DNA为模板进行了红细胞CR1密度基因型的研究,取得了满意结果。现报告如下。
1 材料与方法
1.1 外周血基因组DNA的提取 取EDTA-Na2抗凝血100μl加至1.5ml Eppendorf管中,加无菌重蒸水500μl;10 000r/分钟离心3分钟,弃净上清;加20μl 5mol/L KI,旋涡振荡30秒;0.9%NaCl 100μl,150μl氯仿/异戊醇(24∶1),振荡30秒;10 000r/分钟离心5分钟,吸上清100μl于另一Eppendorf管中,加异丙醇60μl,轻轻混匀,10 000r/分钟离心5分钟,弃上清;加冷无水乙醇1000μl,10 000r/分钟离心5分钟;弃去无水乙醇,37℃烤干;50μl无菌重蒸水或TE,混匀溶解备用。
, http://www.100md.com
1.2 基因组DNA的鉴定
1.2.1 直接琼脂糖凝胶电泳 取溶解备用DNA 4μl,加TBE缓冲液6μl,上样缓冲液2μl混匀,0.8%琼脂糖凝胶5V/cm电压条件下电泳40分钟。
1.2.2 紫外分光光度计检测 用紫外分光光度计(日本岛津UVPC-2401型)测定提取的基因组DNA的紫外吸收峰,计算DNA浓度、纯度。
1.2.3 基因组DNA体外PCR扩增 引物参照文献[5]设计,序列为:P1 CGTCAATGGAATGGTG-CAT,P2 CCCTTGTAAGGCAAGTCTGG,利用该引物扩增红细胞CR1密度相关基因。30μl反应体系中加模板3μl,在DNA扩增仪(PTC-100型,美国MJ公司)上进行扩增。PCR循环参数为93.5℃变性2分钟后按93.5℃ 60秒,60℃50秒,72℃ 50秒30个循环,72℃延伸5分钟。然后,凝胶电泳检查扩增结果。
, 百拇医药
2 结果
2.1 琼脂糖凝胶电泳结果 在紫外检测仪上可以发现靠近原点处有一致密的橙色条带,为大分子基因组DNA,与传统的酚氯仿法、碘化钠法提取的DNA分子量基本相同(图1)。

图1 基因组DNA电泳结果 1、2:KI法提取的基因组DNA,3:NaI法提取的基因组DNA,4:蛋白酶K法提取的基因组DNA,5:λDNA/HindⅢ分子量标志 Fig 1 The result of genomic DNA electrophoresis Lanes 1,2:DNA extracted with KI;lane 3:DNA extracted with NaI;lane 4:DNA extracted with proteinase K;lane 5:λ DNA/HindⅢmarker
, http://www.100md.com
2.2 紫外吸收测定结果 用此方法提取的基因组DNA在260nm处呈吸收高峰,而在280nm处光吸收值(A)剧烈下降,为典型的DNA吸收曲线。
2.3 该方法提取DNA的效率[6] 根据260nm吸光度值计算DNA的提取效率,1ml外周血平均得DNA22~27μg。得率大于理论值的90%,从图1电泳结果可以看出该法比酚氯仿及NaI法提取的DNA量高。
2.4 DNA纯度测定结果 用此方法提取的基因组DNA,碘化物的残余量以及蛋白质的残余量均低于NaI法,且A260/A230>2.0,A260/A280>1.8(表1),说明DNA纯度较高。
表1 KI法与NaI法提取的基因组DNA纯度比较(
, http://www.100md.com
Tab 1 Comparison of DNA extracted with KI and NaI(
Groups
(组别)
Number
(数量)
Remains of I
[I残余量(A)]
A260/A230
, 百拇医药
(A260/A230比值)
A260/A280
(A260/A280比值)
KI
(碘化钾组)
30
0.45±0.11
2.19±0.20
1.85±0.18
NaI
, 百拇医药 (碘化钠组)
30
3.46±0.42
1.97±0.17
1.80±0.11
P<0.05,Comparison between the two groups(两组比较)
2.5 DNA的体外扩增 用该方法提取的DNA为模板进行红细胞CR1密度相关基因的扩增,引物设计扩增片段为1.8kb,琼脂糖凝胶电泳后与标准分子量比较,该片段与预计片段的大小一致(图2)。

, 百拇医药
图2 KI法提取DNA的PCR结果 1~4:KI法提取的DNA PCR结果,5:λDNA/HindⅢ分子量标志
Fig 2 The result of PCR for DNA extraction with KI Lanes 1-4:the result of PCR for the genomic DNA extracted with KI; lane 5:λDNA/HindⅢ marker
3 讨论
快速、经济地从血液或组织中得到高产量、高纯度的DNA对于基因研究是非常重要的。目前基因组DNA的提取方法比较多,有传统蛋白酶K消化法、尿素法等,它们存在操作步骤繁杂、用时长、效率低等不足之处。目前市场上也有多种DNA提取试剂盒,虽然操作简便,但价格比较高,因此以上方法均不宜于大量临床标本的科学研究。Loparev等报道利用NaI提取DNA的方法,该方法简便、快速,但所提取的DNA存在NaI、卟啉化合物以及蛋白质含量较高。我们利用KI与NaI化学性质相近,其溶液比NaI稳定,价格便宜等特点,建立了KI快速提取外周血基因组DNA的方法。该方法尽可能地去除了红细胞的诸成分和白细胞的膜蛋白等成分,利用高浓度KI在短时间内(<30秒)直接裂解白细胞膜、核膜,使DNA释放出来而又不被破坏,经氯仿、异丙醇、冷无水乙醇等步骤的处理,在半小时内即可完成DNA的提取。由于该方法步骤少、时间短,DNA丢失少,因此,DNA得率比较高。KI法与NaI法所提取的DNA进行比较,电泳结果基本一致(图1),但KI法提取的DNA中碘化物的残余量以及A260/A280、A260/A230比值与NaI法比较均有统计学意义(表1),说明KI法提取的DNA中碘化物残余量以及蛋白质残余量均低于NaI法,DNA的纯度较高。此外,KI法用血量只需50~100μl,所用试剂价格便宜、性质稳定,不需特殊实验条件以及蛋白酶K,一般实验室就能进行。我们以该方法提取的DNA为模板进行红细胞CR1密度相关基因研究,取得了满意的结果(图2)。因此,利用碘化钾提取基因组DNA法可望成为基因研究较为理想的方法。
, 百拇医药
参考文献
1 Pencz M,Soloweiwjczyk D,Harpel B,et al.Construction of human genelibraries from small amounts of peripheral blood.Hemoglobin,1982,6(1)∶27-36.
2 周郁,余伍忠,滕葵,等.尿素用于DNA提取.中华医学检验杂志,1993,16(6)∶349-350.
3 Loparev VN,Cartas MA,Monken CE,et al.An efficient and simple method of DNA extraction from whole blood and cell line to identify infectious agents. J Virolo Methods,1992,34(1)∶105-112.
, http://www.100md.com
4 Kejnovsky E,Kypr J.DNA extraction by zinc.Nucleic Acids Res,1997,25∶1870-1871.
5 Cornillet P,Philert F,Kazatchkine MD,et al.Genomic determination of the CR1(CD35) density polymorphism on erythrocytes using polymerase chain reaction amplification and HindⅢ restriction enzyme digestion.J Immnol Methods,1991,136(2)∶193-197.
6 杨道理,王宝成.DNA扩增技术与医学应用.济南:山东科学技术出版社,1992.5-7.
(收稿:1999-01-05 修回:1999-05-05), 百拇医药