一种联会消失突变水稻的发现及其细胞学研究
作者:于恒秀 程祝宽 龚志云 顾铭洪
单位:扬州大学农学院农学系, 江苏扬州 225009
关键词:水稻;联会消失
遗传学报000506
摘要:从品种轮回422的群体中发现一不育单株,经细胞学观察证明是发生了联会消失突变,由于该植株的花粉母细胞在减数分裂终变期晚期平均有8.69个二价体发生了联会消失,占二价体总数的72.4%,并且发生联会消失的最多二价体数目为12,根据联会消失的最多二价体数目
以及单位细胞的二价体频率,确定该联会消失变异为完全联会消失变异。
中图分类号:Q343 文献标识码:A 文章编号:0379-4172(2000)05-0418-05
, 百拇医药
Isolation and Cytological Identification of a Desynaptic
Variant in Rice
YU HengXiu, CHENG ZhuKuan, GONG ZhiYun, GU MingHong
(Agriculture College Yangzhou University, Yangzhou Jiangsu 225009, China)
Abstract: A sterile variant was found from the population of a japonica rice variety Lunhui 422. Cytological investigation was conducted in meiosis. It is showed that the sterility was caused by desynapsis. As there were 8.69 bivalents in average occurred to be desynaptic, moreover, the most number of the desynaptic bivalents reached 12 at post diakinsis. It can be considered that the desynaptic variation is a
, 百拇医药
complete desynapsis found in rice so far.
Key words: rice; desynapsis
生物体的减数分裂过程是一种规律性很强的过程,这种规律性既保证了物种染色体数目的恒定,又使得来自父母本的染色体能够最大限度地交换和重组。同时减数分裂过程又是一个十分复杂的过程,在该过程中往往会产生一些突变,从而破坏其正常的规律性。在有关减数分裂过程异常的变异中,联会消失突变是主要的变异类型之一。它在减数分裂粗线期可见有同源染色体的联会,而在后期I之前,这种联会便已提前消失,形成数目不等的单价体。根据单价体形成数目的多少,可以将这类变异分为完全联会消失和不完全联会消失。由于这类突变体在后期I之前形成大量单价体,从而导致减数分裂形成的配子染色体不平衡,这在很大程度上降低了变异株的育性。
联会消失突变目前在大麦[1]、小麦[2]、黑麦[3]、玉米[4]、高粱[5]等许多作物上已有不少报道。在水稻上有关联会消失的突变亦有报道[6~15],这些变异的产生一般都来自人工诱变或组织培养后代,而在自然状态下发生联会消失还很少见报道。本研究在轮回422的群体植株中发现一不育株,经细胞学鉴定,证明该植株发生了联会消失突变。本文着重报道的是对该变异株的细胞学研究结果。
, http://www.100md.com
1 材料和方法
取变异株及正常品种轮回422减数分裂期的幼穗,以酒精冰醋酸为31的卡诺氏固定液(附加0.5% FeCl3)固定,醋酸洋红染色,研究它们在减数分裂期的染色体行为,Opton超常规显微镜观察摄影。
2 结果与分析
2.1 联会消失突变植株的形态特性
比较品种轮回422正常株与联会消失突变株的特性,可以看出它们在生育期、株高、叶片长度与宽度、穗长、每穗粒数等方面没有明显差异。它们之间差异主要表现在叶片的卷曲的程度上,正常轮回422植株叶片向内卷曲的程度高,而突变株的叶片只是轻微向内卷曲。因此,根据叶片的卷曲程度,可以明显地区分正常株与联会消失突变株。在花粉育性及结实率上,两植株的区别更为明显,以I2朘I 染色,突变株的花粉完全为典败花粉(图版I-A),可染花粉率为0;而正常株可染花粉率为91.5%。在结实率上,突变株完全败育,结实率为0;而正常株为81.2%。突变株剪颖后,授以正常轮回422的花粉,仍不结实,说明在花粉发生败育的同时,雌配子亦发生了败育。
, 百拇医药
2.2 联会消失突变植株的减数分裂行为
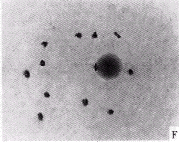
对联会消失突变植株的减数分裂过程进行观察,结果表明在粗线期,同源染色体联会正常,形成12个二价体(图I-B)。在粗线期过后的双线期早期,二价体出现正常的交叉,同源染色体相互交叉,形成交叉结(图版I-C),这说明在双线期之前,同源染色体在联会的同时,已发生过非姊妹染色单体的交换。这时尚未有单价体的形成,因此,可以认为此时同源染色体的联会仍是正常的。在双线期晚期和终变期早期,已可见数目不等的单价体出现,比较正常株和突变株在这一时期的染色体形态可以看出,不仅突变株此时已形成数目不等的单价体,即使尚存二价体的联会亦不如正常株的二价体紧密(图版I-D),说明联会消失在终变期之前已经发生,在光学显微镜下,这种变异已得以表现。
在终变期晚期,联会消失现象表现得更为明显,与正常株的花粉母细胞在此时的联会相比(图版I-F),不同花粉母细胞均有一定数目的二价体发生了联会消失。观察表明,此时二价体最多的为8个(图版Ⅱ-G),最少的为0个,表现为所有二价体均解离成单价体(图版Ⅱ-H)。为了准确统计发生联会消失的二价体数目,在终变期晚期调查了195个花粉母细胞,结果见表1。
, 百拇医药
表1 联会消失突变体在减数分裂终变期晚期具有不同联会方式的花粉母细胞分布情况
Table 1 Distribution of the PMCs of the desynaptic variant with different synaptic configurations at late diakinesis in meiosis 类型
Configuration
细胞数
No.of cells
百分率
%
类型
Configuration
, http://www.100md.com
细胞数
No.of cells
百分率
%
8Ⅱ+8Ⅰ
6
3.08
3Ⅱ+18Ⅰ
41
21.03
7Ⅱ+10Ⅰ
8
4.10
, 百拇医药
2Ⅱ+20Ⅰ
38
19.49
6Ⅱ+12Ⅰ
11
5.64
1Ⅱ+22Ⅰ
26
13.33
5Ⅱ+14Ⅰ
22
11.28
24Ⅰ
, 百拇医药
8
4.10
4Ⅱ+16Ⅰ
35
17.95
总数(Total)
195
100
从表1可以看出,所有花粉母细胞在终变期晚期均会有8个以上的单价体出现,而且76%左右的细胞在终变期晚期出现了16个以上的单价体,单位细胞二价体的频率为3.31,发生联会消失的二价体占二价体总数的72.4%,说明该植株发生联会消失突变的频率是相当高的。在中期,二价体排列在赤道板上,这与正常株的二价体类似(图版Ⅱ-I),而单价体则分散在赤道板两侧(图版Ⅱ-J~L)。由于单价体在后期移向细胞两极的任何一极是随机的,因此在中期如此多的单价体形成,必然使得后期移向两极的染色体不仅在数量上不平衡,在质量上更难保证移向同一极的染色体为
, http://www.100md.com
一完整的染色体组,从而导致花粉大量败育。由于该联会消失突变在授以正常轮回422花粉的情况下仍不结实,说明在雄配子发生败育的同时,雌配子亦发生了败育。
3 讨论
联会消失突变作为一种重要的遗传研究材料,对于研究生物体同源染色体联会的机理以及用它来产生非整倍体等,有着很强的理论研究和应用价值。在水稻上有关联会消失突变已有一些报道,并利用这些突变体育成了成套三体或部分三体系列[6~8]。分析这些突变产生的途径,它们均来自人工诱变或组织培养后代。其中, Kitada等利用化学诱变剂MUN处理获得了11个联会消失突变体[9]; Yamguchi以及Ratho等利用辐射处理获得了水稻联会消失突变体[10,11]; Wang等利用低温处理诱发了水稻联会消失突变体[12];凌定厚等则从组织培养后代中筛选出一株水稻联会消失突变体[13]。与这些联会突变产生途径不同的是,本研究则在完全自然状态下筛选出了联会消失突变体。从联会消失突变的性质上分析,上述突变均为部分联会消失, Kitada等获得的11个联会消失突变体中,有9个突变体最多只涉及1~4个二价体发生联会消失,单位花粉母细胞中,二价体的频率从11.97~10.58,说明这些变异体仍以形成二价体为主,只有少数花粉母细胞发生了联会消失突变。另外2个突变体最多只涉及6个和9个二价体发生联会消失,其单位细胞二价体频率分别为9.34和6.13。凌定厚等从组织培养后代中筛选出的联会消失突变株,其发生联会消失最多的二价体数目为5个,单位细胞二价体频率为10.40。从发生联会消失最多的二价体数目以及单位细胞二价体的频率分析,这些突变均属部分联会消失突变。而本研究获得的联会消失突变体,其发生联会消失最多的二价体数目为12个,最少亦为4个,单位细胞二价体频率为3.31,发生联会消失的二价体占全部二价体的72.4%,说明在该联会消失突变中,二价体联会消失的频率是相当高的,从数量上分析已接近完全联会消失。在育性上, Kitada等获得的11个联会消失突变体,其单位细胞二价体频率与结实率之间存在显著的正相关。二价体频率最高的为11.97,结实率为82.5%;二价体频率最低的为6.13,结实率仅为1.7%。凌定厚等从IR54中发现的突变体,二价体频率为10.40,结实率为2.01%。而本研究发现的突变体,由于有72.4%的二价体发生了联会消失,单位细胞二价体频率仅为3.31,由于大量单价体的形成,从而导致花粉完全败育,结实率为0。
, 百拇医药
到目前为止,已有很多研究证明联会消失突变是受隐性单基因控制的[14,15],那么本研究所获得的联会消失突变是否也受隐性单基因控制,还有待进一步证实。另外,本突变株的所有二价体均能在一定程度上发生联会消失,从理论上推测,可以从它的有性后代中选出一整套三体系列,但由于该植株完全不育,因此如何利用花药培养等途径使其获得有性后代,是利用它合成全套三体的关键。由于品种轮回422为广亲和品种,一旦该三体能够育成,必将改变现有籼稻三体或粳稻三体只能在亚种内应用的局限性,使得无论是籼稻的基因定位还是粳稻的基因定位,均可利用它作为工具材料得以完成。










, http://www.100md.com
图 版 说 明
图版I
A. 经I2-KI染色后的突变株花粉;B. 突变株的花粉母细胞在粗线期同源染色体配对正常;C. 突变株的花粉母细胞二价体在双线期早期出现正常的分叉;D. 正常株的花粉细胞在终变期早期二价体的形态;E. 突变株的花粉母细胞在终变期早期部分联会消失形成单价体;F. 正常株的花粉母细胞在终变期晚期二价体形态
图版II
G. 突变株的花粉母细胞在终变期晚期部分联会消失形成8II+8I;H. 突变株的花粉母细胞在终变期晚期联会消失形成24I:I. 正常株的花粉母细胞在中期I形成12II;J. 突变株的花粉母细胞在中期形成8II+8I;K.突变株的花粉母细胞在中期形成1II+22I;L.突变株的花粉母细胞在中期I形成24个单价体
, 百拇医药
Explanation of Plates
Plate I
A. Pollens of the desynaptic variant stained with I2-KI; B. Pachytene chromosomes of the desynaptic variant; C. Chromosomes of the desynaptic variant at early diplotene; D. Chromosomes of the normal plant of LH422 at early diakinesis; E. Chromosomes of the desynaptic variant at early diakinesis; F. Chromosomes of the normal plant of LH422 at late diakinesis
, http://www.100md.com
PlateII
G. Chromosomes of the desynaptic variant at late diakinesis, 8II+8I; H. Chromosomes of the desynaptic variant at late diakinesis,24I:I; . Chromosomes of the normal plant of LH422 at metaphase ,12II; J. Chromosomes of the desynaptic variant at metaphase ,8II+8I; K. Chromosomes of the desynaptic variant at metaphase , 1II+22I; L. Chromosomes of the desynaptic variant at metaphase I,24 I
国爱自然科学基金资助项目(项目编号:39700076)
, 百拇医药
参考文献
[1] Enns H, Larter E N. Likage relations of ds, a gene governing chromosome behaviour in barley and its effect on gene recombination. Can. J. Genet. Cytol., 1962, 4:263~266.
[2] Bozzini A, Martini G. Analysis of desynaptic mutants induced in durum wheat (Triticum durum desf.). Caryologia, 1971, 24:307~316.
[3] Ahloowaila B S. Genetic control of post synaptic phase of meiosis in rye grass. Chromosomes Today, 1972, 3:93~103.
, http://www.100md.com
[4] Miller O L. Cytological studies in asynaptic maize. Genetics, 1963, 48:1445~1466.
[5] Krishnaswamy N, Meenakshi K. Abnormal meiosis in grain Sorghum I. Desynapsis. Cytologia, 1957, 22:250~263.
[6] Yasui H, Satoh N, Iwata N. Establishment of a trisomic series in rice by using a desynaptic mutant. Rice Genetic Newsletter, 1989, 6:50~51.
[7] Katayama T. Studies on the progenies of autotriploid and asynaptic rice plant. Japan J. Breed., 1963, 13:83~87.
, http://www.100md.com
[8] Katayama T. Relationships between seed-weight and somatic chromosome number in the progeny of partially asynaptic rice plants: The occurrence of trisomic and monosomic plants. Japan J. Breed., 1966, 16:10~14.
[9] Kitada K, Kurata N, Satoh H et al. Genetic control of meiosis of rice, Oryza sativa L., I. Classification of meiotic mutants induced by MUN and their cytogenetical characteristics. Jpn. J. Genet., 1983, 58:231~240.
, http://www.100md.com [10] Yamaguchi H. Mutations with gamma irradiation on
dormant seeds of a partially asynaptic strain in rice. Japan J. Breed., 1974, 24:81~85.
[11] Ratho S N, Misra R N. Induced desynaptic mutant in rice (Oryza sativa L.). Sci. Cult., 1973, 39:267~269.
[12] Wang S, Yeh P, Lee S et al. Effect of low temperature on desynapsis in rice. Bot. Bull. Acad. Sinica, 1965, 6:197~207.
, 百拇医药
[13] 凌定厚,陈梅芳,陈琬英等. 起源于籼稻体细胞培养的联会消失变异的细胞遗传学研究. 遗传学报,1988,15(2):86~88.
[14] Kitada K, Omura T. Genetic control of meiosis of rice, Oryza sativa L. II. Cytological analysis of desynaptic mutants. Jpn. J. Genet., 1983, 58:567~577.
[15] Yasui H, Saiki S, Iwata N. A desynaptic gene ds3(t) located on chromosome 7 in rice. Rice Genetic Newsletter, 1993, 10:80~83.
1999-05-17
1999-11-20, 百拇医药
单位:扬州大学农学院农学系, 江苏扬州 225009
关键词:水稻;联会消失
遗传学报000506
摘要:从品种轮回422的群体中发现一不育单株,经细胞学观察证明是发生了联会消失突变,由于该植株的花粉母细胞在减数分裂终变期晚期平均有8.69个二价体发生了联会消失,占二价体总数的72.4%,并且发生联会消失的最多二价体数目为12,根据联会消失的最多二价体数目
以及单位细胞的二价体频率,确定该联会消失变异为完全联会消失变异。
中图分类号:Q343 文献标识码:A 文章编号:0379-4172(2000)05-0418-05
, 百拇医药
Isolation and Cytological Identification of a Desynaptic
Variant in Rice
YU HengXiu, CHENG ZhuKuan, GONG ZhiYun, GU MingHong
(Agriculture College Yangzhou University, Yangzhou Jiangsu 225009, China)
Abstract: A sterile variant was found from the population of a japonica rice variety Lunhui 422. Cytological investigation was conducted in meiosis. It is showed that the sterility was caused by desynapsis. As there were 8.69 bivalents in average occurred to be desynaptic, moreover, the most number of the desynaptic bivalents reached 12 at post diakinsis. It can be considered that the desynaptic variation is a
, 百拇医药
complete desynapsis found in rice so far.
Key words: rice; desynapsis
生物体的减数分裂过程是一种规律性很强的过程,这种规律性既保证了物种染色体数目的恒定,又使得来自父母本的染色体能够最大限度地交换和重组。同时减数分裂过程又是一个十分复杂的过程,在该过程中往往会产生一些突变,从而破坏其正常的规律性。在有关减数分裂过程异常的变异中,联会消失突变是主要的变异类型之一。它在减数分裂粗线期可见有同源染色体的联会,而在后期I之前,这种联会便已提前消失,形成数目不等的单价体。根据单价体形成数目的多少,可以将这类变异分为完全联会消失和不完全联会消失。由于这类突变体在后期I之前形成大量单价体,从而导致减数分裂形成的配子染色体不平衡,这在很大程度上降低了变异株的育性。
联会消失突变目前在大麦[1]、小麦[2]、黑麦[3]、玉米[4]、高粱[5]等许多作物上已有不少报道。在水稻上有关联会消失的突变亦有报道[6~15],这些变异的产生一般都来自人工诱变或组织培养后代,而在自然状态下发生联会消失还很少见报道。本研究在轮回422的群体植株中发现一不育株,经细胞学鉴定,证明该植株发生了联会消失突变。本文着重报道的是对该变异株的细胞学研究结果。
, http://www.100md.com
1 材料和方法
取变异株及正常品种轮回422减数分裂期的幼穗,以酒精冰醋酸为31的卡诺氏固定液(附加0.5% FeCl3)固定,醋酸洋红染色,研究它们在减数分裂期的染色体行为,Opton超常规显微镜观察摄影。
2 结果与分析
2.1 联会消失突变植株的形态特性
比较品种轮回422正常株与联会消失突变株的特性,可以看出它们在生育期、株高、叶片长度与宽度、穗长、每穗粒数等方面没有明显差异。它们之间差异主要表现在叶片的卷曲的程度上,正常轮回422植株叶片向内卷曲的程度高,而突变株的叶片只是轻微向内卷曲。因此,根据叶片的卷曲程度,可以明显地区分正常株与联会消失突变株。在花粉育性及结实率上,两植株的区别更为明显,以I2朘I 染色,突变株的花粉完全为典败花粉(图版I-A),可染花粉率为0;而正常株可染花粉率为91.5%。在结实率上,突变株完全败育,结实率为0;而正常株为81.2%。突变株剪颖后,授以正常轮回422的花粉,仍不结实,说明在花粉发生败育的同时,雌配子亦发生了败育。
, 百拇医药
2.2 联会消失突变植株的减数分裂行为
对联会消失突变植株的减数分裂过程进行观察,结果表明在粗线期,同源染色体联会正常,形成12个二价体(图I-B)。在粗线期过后的双线期早期,二价体出现正常的交叉,同源染色体相互交叉,形成交叉结(图版I-C),这说明在双线期之前,同源染色体在联会的同时,已发生过非姊妹染色单体的交换。这时尚未有单价体的形成,因此,可以认为此时同源染色体的联会仍是正常的。在双线期晚期和终变期早期,已可见数目不等的单价体出现,比较正常株和突变株在这一时期的染色体形态可以看出,不仅突变株此时已形成数目不等的单价体,即使尚存二价体的联会亦不如正常株的二价体紧密(图版I-D),说明联会消失在终变期之前已经发生,在光学显微镜下,这种变异已得以表现。
在终变期晚期,联会消失现象表现得更为明显,与正常株的花粉母细胞在此时的联会相比(图版I-F),不同花粉母细胞均有一定数目的二价体发生了联会消失。观察表明,此时二价体最多的为8个(图版Ⅱ-G),最少的为0个,表现为所有二价体均解离成单价体(图版Ⅱ-H)。为了准确统计发生联会消失的二价体数目,在终变期晚期调查了195个花粉母细胞,结果见表1。
, 百拇医药
表1 联会消失突变体在减数分裂终变期晚期具有不同联会方式的花粉母细胞分布情况
Table 1 Distribution of the PMCs of the desynaptic variant with different synaptic configurations at late diakinesis in meiosis 类型
Configuration
细胞数
No.of cells
百分率
%
类型
Configuration
, http://www.100md.com
细胞数
No.of cells
百分率
%
8Ⅱ+8Ⅰ
6
3.08
3Ⅱ+18Ⅰ
41
21.03
7Ⅱ+10Ⅰ
8
4.10
, 百拇医药
2Ⅱ+20Ⅰ
38
19.49
6Ⅱ+12Ⅰ
11
5.64
1Ⅱ+22Ⅰ
26
13.33
5Ⅱ+14Ⅰ
22
11.28
24Ⅰ
, 百拇医药
8
4.10
4Ⅱ+16Ⅰ
35
17.95
总数(Total)
195
100
从表1可以看出,所有花粉母细胞在终变期晚期均会有8个以上的单价体出现,而且76%左右的细胞在终变期晚期出现了16个以上的单价体,单位细胞二价体的频率为3.31,发生联会消失的二价体占二价体总数的72.4%,说明该植株发生联会消失突变的频率是相当高的。在中期,二价体排列在赤道板上,这与正常株的二价体类似(图版Ⅱ-I),而单价体则分散在赤道板两侧(图版Ⅱ-J~L)。由于单价体在后期移向细胞两极的任何一极是随机的,因此在中期如此多的单价体形成,必然使得后期移向两极的染色体不仅在数量上不平衡,在质量上更难保证移向同一极的染色体为
, http://www.100md.com
一完整的染色体组,从而导致花粉大量败育。由于该联会消失突变在授以正常轮回422花粉的情况下仍不结实,说明在雄配子发生败育的同时,雌配子亦发生了败育。
3 讨论
联会消失突变作为一种重要的遗传研究材料,对于研究生物体同源染色体联会的机理以及用它来产生非整倍体等,有着很强的理论研究和应用价值。在水稻上有关联会消失突变已有一些报道,并利用这些突变体育成了成套三体或部分三体系列[6~8]。分析这些突变产生的途径,它们均来自人工诱变或组织培养后代。其中, Kitada等利用化学诱变剂MUN处理获得了11个联会消失突变体[9]; Yamguchi以及Ratho等利用辐射处理获得了水稻联会消失突变体[10,11]; Wang等利用低温处理诱发了水稻联会消失突变体[12];凌定厚等则从组织培养后代中筛选出一株水稻联会消失突变体[13]。与这些联会突变产生途径不同的是,本研究则在完全自然状态下筛选出了联会消失突变体。从联会消失突变的性质上分析,上述突变均为部分联会消失, Kitada等获得的11个联会消失突变体中,有9个突变体最多只涉及1~4个二价体发生联会消失,单位花粉母细胞中,二价体的频率从11.97~10.58,说明这些变异体仍以形成二价体为主,只有少数花粉母细胞发生了联会消失突变。另外2个突变体最多只涉及6个和9个二价体发生联会消失,其单位细胞二价体频率分别为9.34和6.13。凌定厚等从组织培养后代中筛选出的联会消失突变株,其发生联会消失最多的二价体数目为5个,单位细胞二价体频率为10.40。从发生联会消失最多的二价体数目以及单位细胞二价体的频率分析,这些突变均属部分联会消失突变。而本研究获得的联会消失突变体,其发生联会消失最多的二价体数目为12个,最少亦为4个,单位细胞二价体频率为3.31,发生联会消失的二价体占全部二价体的72.4%,说明在该联会消失突变中,二价体联会消失的频率是相当高的,从数量上分析已接近完全联会消失。在育性上, Kitada等获得的11个联会消失突变体,其单位细胞二价体频率与结实率之间存在显著的正相关。二价体频率最高的为11.97,结实率为82.5%;二价体频率最低的为6.13,结实率仅为1.7%。凌定厚等从IR54中发现的突变体,二价体频率为10.40,结实率为2.01%。而本研究发现的突变体,由于有72.4%的二价体发生了联会消失,单位细胞二价体频率仅为3.31,由于大量单价体的形成,从而导致花粉完全败育,结实率为0。
, 百拇医药
到目前为止,已有很多研究证明联会消失突变是受隐性单基因控制的[14,15],那么本研究所获得的联会消失突变是否也受隐性单基因控制,还有待进一步证实。另外,本突变株的所有二价体均能在一定程度上发生联会消失,从理论上推测,可以从它的有性后代中选出一整套三体系列,但由于该植株完全不育,因此如何利用花药培养等途径使其获得有性后代,是利用它合成全套三体的关键。由于品种轮回422为广亲和品种,一旦该三体能够育成,必将改变现有籼稻三体或粳稻三体只能在亚种内应用的局限性,使得无论是籼稻的基因定位还是粳稻的基因定位,均可利用它作为工具材料得以完成。












, http://www.100md.com
图 版 说 明
图版I
A. 经I2-KI染色后的突变株花粉;B. 突变株的花粉母细胞在粗线期同源染色体配对正常;C. 突变株的花粉母细胞二价体在双线期早期出现正常的分叉;D. 正常株的花粉细胞在终变期早期二价体的形态;E. 突变株的花粉母细胞在终变期早期部分联会消失形成单价体;F. 正常株的花粉母细胞在终变期晚期二价体形态
图版II
G. 突变株的花粉母细胞在终变期晚期部分联会消失形成8II+8I;H. 突变株的花粉母细胞在终变期晚期联会消失形成24I:I. 正常株的花粉母细胞在中期I形成12II;J. 突变株的花粉母细胞在中期形成8II+8I;K.突变株的花粉母细胞在中期形成1II+22I;L.突变株的花粉母细胞在中期I形成24个单价体
, 百拇医药
Explanation of Plates
Plate I
A. Pollens of the desynaptic variant stained with I2-KI; B. Pachytene chromosomes of the desynaptic variant; C. Chromosomes of the desynaptic variant at early diplotene; D. Chromosomes of the normal plant of LH422 at early diakinesis; E. Chromosomes of the desynaptic variant at early diakinesis; F. Chromosomes of the normal plant of LH422 at late diakinesis
, http://www.100md.com
PlateII
G. Chromosomes of the desynaptic variant at late diakinesis, 8II+8I; H. Chromosomes of the desynaptic variant at late diakinesis,24I:I; . Chromosomes of the normal plant of LH422 at metaphase ,12II; J. Chromosomes of the desynaptic variant at metaphase ,8II+8I; K. Chromosomes of the desynaptic variant at metaphase , 1II+22I; L. Chromosomes of the desynaptic variant at metaphase I,24 I
国爱自然科学基金资助项目(项目编号:39700076)
, 百拇医药
参考文献
[1] Enns H, Larter E N. Likage relations of ds, a gene governing chromosome behaviour in barley and its effect on gene recombination. Can. J. Genet. Cytol., 1962, 4:263~266.
[2] Bozzini A, Martini G. Analysis of desynaptic mutants induced in durum wheat (Triticum durum desf.). Caryologia, 1971, 24:307~316.
[3] Ahloowaila B S. Genetic control of post synaptic phase of meiosis in rye grass. Chromosomes Today, 1972, 3:93~103.
, http://www.100md.com
[4] Miller O L. Cytological studies in asynaptic maize. Genetics, 1963, 48:1445~1466.
[5] Krishnaswamy N, Meenakshi K. Abnormal meiosis in grain Sorghum I. Desynapsis. Cytologia, 1957, 22:250~263.
[6] Yasui H, Satoh N, Iwata N. Establishment of a trisomic series in rice by using a desynaptic mutant. Rice Genetic Newsletter, 1989, 6:50~51.
[7] Katayama T. Studies on the progenies of autotriploid and asynaptic rice plant. Japan J. Breed., 1963, 13:83~87.
, http://www.100md.com
[8] Katayama T. Relationships between seed-weight and somatic chromosome number in the progeny of partially asynaptic rice plants: The occurrence of trisomic and monosomic plants. Japan J. Breed., 1966, 16:10~14.
[9] Kitada K, Kurata N, Satoh H et al. Genetic control of meiosis of rice, Oryza sativa L., I. Classification of meiotic mutants induced by MUN and their cytogenetical characteristics. Jpn. J. Genet., 1983, 58:231~240.
, http://www.100md.com [10] Yamaguchi H. Mutations with gamma irradiation on
dormant seeds of a partially asynaptic strain in rice. Japan J. Breed., 1974, 24:81~85.
[11] Ratho S N, Misra R N. Induced desynaptic mutant in rice (Oryza sativa L.). Sci. Cult., 1973, 39:267~269.
[12] Wang S, Yeh P, Lee S et al. Effect of low temperature on desynapsis in rice. Bot. Bull. Acad. Sinica, 1965, 6:197~207.
, 百拇医药
[13] 凌定厚,陈梅芳,陈琬英等. 起源于籼稻体细胞培养的联会消失变异的细胞遗传学研究. 遗传学报,1988,15(2):86~88.
[14] Kitada K, Omura T. Genetic control of meiosis of rice, Oryza sativa L. II. Cytological analysis of desynaptic mutants. Jpn. J. Genet., 1983, 58:567~577.
[15] Yasui H, Saiki S, Iwata N. A desynaptic gene ds3(t) located on chromosome 7 in rice. Rice Genetic Newsletter, 1993, 10:80~83.
1999-05-17
1999-11-20, 百拇医药