基因枪法转基因水稻中hpt基因稳定遗传
作者:唐祚舜 王象坤 李良才 田文忠
单位:中国科学院遗传研究所,北京 100101
关键词:水稻;转基因遗传;潮霉素磷酸转移酶基因
遗传学报000105
摘要:基因枪转化将潮霉素磷酸转移酶基因(hpt)导入粳稻品种77170,获得可育的转基因植株,研究外源基因遗传的稳定性。自交后代(T1和T2)经潮霉素筛选获得抗性植株和敏感植株,分子鉴定结果表明抗性植株带有hpt基因,而敏感植株中没有hpt基因存在。T1和T2代中潮霉素抗性表现为显性单基因位点的遗传方式,符合孟德尔分离规律,并得到分子鉴定结果的证实。Southern杂交结果显示,hpt基因多拷贝整合在水稻基因组中,并成紧密连锁状态在T1和T2代中稳定遗传。SG-15的部分T2代株系中发现hpt基因不完全失活现象,并且与甲基化状态可能无关。
, 百拇医药
中图分类号:Q943 文献标识码:A
文章编号:0379-4172(2000)01-0026-0033
Stable Inheritance of hpt Gene in Transgenic Rice Plants Mediated by Biolistic Bombardment
TANG Zuo-Shun,LI Liang-Cai,TIAN Wen-Zhong
(Institute of Genetics,Chinese Academy of Sciences,Beijing 100101,China)
TANG Zuo-Shun,WANG Xiang-Kun
(China Agricultural University,Beijing 100094,China)
, http://www.100md.com
Abstract:Japonica rice cv 77170 was transformed with pBI222 carrying hygromycin phosphotransferase gene (hpt) by using biolistic bombardment and fertile transgenic rice plants were obtained.In T1 and most T2 generation the performance of hygromycin resistance was normal.Only in T2 progeny of SG-15 some lines showed decreased resistance.Mendelian inheritance of hygromycin resistance was showed as single dominant locus and proved by Southern blotting analysis in T1 and T2 generation of all transgenic plants.Multiple copies of hpt integrated into rice genome.These copies linked closely and inherited stablly.MspⅠ digested Southern blotting showed that methylation of hpt existed commonly in transgenic plants and their progeny,therefore uncomplete silencing of hpt in some T2 progeny of SG-15 was not associated with hpt methylation probably.
, http://www.100md.com
Key words:rice;transgene inheritance;hygromycin phosphotransferase gene (hpt)
1989年Shimamoto等首次获得可育的转基因水稻,研究证实外源基因可以遗传给后代[1]。关于水稻转基因遗传和表达的稳定性,目前还缺乏比较系统的研究,Goto等(1993)对电击法获得的转基因植株进行了T1、T2和T3代分析,发现了hpt基因非孟德尔遗传现象[2],Peng等(1995)在PEG法转基因水稻的遗传研究中,观察到nptⅡ和gus遗传的不稳定性[3],基因枪法转基因水稻中外源基因的遗传表现,多数符合31分离[4~6]。影响水稻转基因稳定性的因素并不清楚,Kohli等(1995)研究发现,基因枪转化获得的转基因水稻,外源基因(hpt/gus)和(Bt/bar)在T1代中分离异常,分子检测表明,外源基因多拷贝插入,结构状态复杂,启动子和编码区中的胞嘧啶已被甲基化[7]。所以,水稻转基因的稳定性仍是一个值得深入研究的问题。
, http://www.100md.com
1 材料和方法
1.1 实验材料(表1)
图1 实验材料
Table1 Materials 转基因植株
Transgenic plants
后代编号说明
Serial number of the progeny
SG-1 (T0)
TSA-T1 代潮霉素抗性株 resistive plant in T1 generation
, http://www.100md.com
SG-2 (T0)
TSB-T1 代潮霉素抗性株 resistive plant in T1 generation
SG-3-1 (T0)
TSC-T1 代潮霉素抗性株 resistive plant in T1 generation
TSF-T1 代潮霉素敏感株 sensitive plant in T1 generation
SG-3-2 (T0)
TSD-T1 代潮霉素抗性株 resistive plant in T1 generation
, http://www.100md.com
TSG-T1 代潮霉素敏感株 sensitive plant in T1 generation
SG-15 (T0)
TSE-T1 代潮霉素抗性株 resistive plant in T1 generation
SG系列转基因植株,系由基因枪转化获得,转化受体品种为77170(粳稻)。转化质粒为pBI222(图1),带有潮霉素磷酸转移酶基因(hpt)、35S启动子和nos终止子。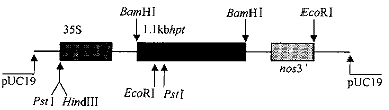
图1 pBI222(4.8kb)简图
Fig.1 pBI222(4.8kb)
, 百拇医药
1.2 实验方法
1.2.1 转基因植株后代潮霉素抗性检测 每份材料取饱满种子50粒,25℃光照条件下发芽6~7天,发芽正常的个体转入培养瓶中,内盛20ml 1/2 N6培养液及50mg/L潮霉素(Hygromycin B),25℃光照条件下培养。对照品种77170相同条件下发芽,发芽正常的个体分别转入到2个培养瓶中(20ml 1/2 N6培养液),其中1瓶不加潮霉素(正对照),另1瓶加入潮霉素50mg/L(负对照)。潮霉素筛选4~5d后,与正对照和负对照对比,统计潮霉素抗性植株和敏感植株的数量,再转入到1/2 N6培养液中恢复生长,存活的个体移栽大田。
1.2.2 Southern杂交分析 水稻叶片总DNA的提取参照Dellaporta等的方法[8],Southern杂交参见《分子克隆》实验指南[9]。随机引物32P标记的1.1kb hpt基因片段用作探针。
, 百拇医药
2 结果分析
2.1 转基因水稻后代潮霉素抗性表现
种子发芽6d左右,将发芽正常的个体转入到含潮霉素50mg/L的1/2 N6培养液中,3d后,正负对照表现出明显差异。负对照芽和根的生长被抑制,几乎没有新根发生或生长,外观表现为苗小根少;随处理时间延长,根部逐渐发黄,心叶卷成针状且退绿,14d左右死亡。
转基因植株自交1代中(T1),潮霉素抗性表现分离,抗性植株与正对照相同,敏感植株与负对照相同,没有发现中间状态植株,表明hpt在这些株系中得到正常表达。
T1代抗性植株的自交后代(T2)中,TSA、TSB、TSC、TSD的后代潮霉素抗性表现正常,抗感株差异明显,外观形态分别与正对照和负对照相同,而TSE后代出现了不同情况,部分株系潮霉素抗性表现为中间状态(表2),不同株系程度不同,这可能是由于hpt在这些株系中不同程度地失活,故此称之为不完全失活。T1代中敏感植株TSF和TSG的自交后代全部不抗潮霉素。
, 百拇医药
表2 TSE3自交后代(T2)潮霉素筛选种子苗形态结果
Table2 Performance of hygromycin resistance in T2 progeny of TSE3 材料
Plants
平均苗长
Length of seedling
(cm)
第1叶叶鞘长
Length of first leaf sheath
(cm)
, 百拇医药
第1、2叶间距
Distance between first and second leaf
(cm)
正对照
22.3±1.4
4.0±0.0
6.9±0.2
TSE-3
20.7±1.4
2.6±0.2
3.9±0.6
负对照
, 百拇医药
Negative control
9.6±1.0
1.7±0.2
1.3±0.2
2.2 转基因水稻潮霉素抗性的遗传分离
结果见表3和表4。T1代株系潮霉素抗性表现分离,卡平方测验显示,均符合3:1分离,由于SG-3-1和SG-3-2的T1代种子量较大,所以都分别进行了3次潮霉素抗性鉴定,其中2次是采用种子苗,1次是采用小分蘖,3次结果表现一致,重复之间没有明显差异,说明每次鉴定结果是可靠的,对各次结果进行卡平方测验,均符合31分离。表3 转基因水稻后代(T1)潮霉素抗性遗传分离情况
Table3 Segregation of hygromycin resistance in T1 generation of transgenic plants 株系
, 百拇医药
Lines
种子数
No.of seed
成苗数
No.of seedling
抗性板株数
R-plants
敏感株数
S-plants
分离比
Segregation
x2
, http://www.100md.com
P(%)
备注
Notes
SG-3-1
50
45
30
15
3:1
1.252
>25
种子苗
seedling
, http://www.100md.com
50
44
28
16
3:1
2.450
>10
种子苗
seedling
-
18
12
6
, http://www.100md.com 3:1
0.300
>50
小分蘖
tiller
SG-3-2
50
49
37
12
3:1
0.007
>90
, 百拇医药
种子苗
seedling
50
41
31
10
3:1
0.008
>90
种子苗
seedling
-
27
, 百拇医药
20
7
3:1
0.020
>90
小分蘖
tiller
SG-1
35
24
18
6
3:1
, 百拇医药
0.056
>75
种子苗
seedling
SG-2
37
13
7
6
3:1
2.077
>10
种子苗
, http://www.100md.com
seedling
SG-15
41
41
27
14
3:1
1.374
>10
种子苗
seedling
77170(CK)
50
, http://www.100md.com
47
0
47
0:1
-
-
种子苗
seedling
表4 转基因水稻后代(T2)潮霉素抗性遗传分离
Table4 Segregation of hygromycin resistance in T2 generation of transgenic plants 株系
, http://www.100md.com
Lines
种子数
No.of seeds
成苗数
No.of seedling
抗性株数
R-plants
敏感株数
S-plants
分离比
Segregation
x2
, 百拇医药
P(%)
TSC1
50
38
30
8
3:1
0.140
>50
TSC3
50
39
27
, http://www.100md.com 12
3:1
0.419
>50
TSC6
53
48
38
10
3:1
0.250
>50
TSC7
, 百拇医药 50
44
28
16
3:1
2.455
>10
TSC8
50
43
34
9
3:1
0.194
, http://www.100md.com
>50
TSC9
50
49
49
0
1:0
-
-
TSC10
50
48
37
11
, 百拇医药
3:1
0.027
>75
TSC14
50
49
49
0
1:0
-
-
TSC20
34
, http://www.100md.com 23
18
5
3:1
0.014
>90
TSC21
50
36
36
0
1:0
-
-
, 百拇医药
TSF1
50
38
0
38
0:1
-
-
TSF3
20
12
0
12
0:1
, http://www.100md.com
-
TSF4
50
38
0
38
0:1
-
-
TSF5
40
14
0
14
, 百拇医药
0:1
-
-
TSF6
50
37
0
37
0:1
-
-
TSE1
50
31
, 百拇医药
21
10
3:1
0.527
>25
TSE2
50
46
29
17
3:1
2.899
>5
, 百拇医药
TSE3
50
49
49
1
1:0
-
-
TSE6
50
49
48
0
1:0
, http://www.100md.com
-
-
TSE8
50
50
40
10
3:1
0.427
>50
TSE9
50
41
, 百拇医药 31
10
3:1
0.008
>90
TSE10
50
47
47
0
1:0
-
-
TSE11
, 百拇医药
50
49
41
8
3:1
1.531
>10
TSE12
50
50
37
13
3:1
, http://www.100md.com 0.000
>90
TSE14
50
50
37
13
3:1
0.000
>90
TSE15
50
50
, http://www.100md.com 40
10
3:1
0.427
>50
TSE16
50
50
38
12
3:1
0.000
>90
, http://www.100md.com TSE17
50
49
49
0
1:0
-
-
TSE18
50
50
50
0
1:0
, http://www.100md.com
-
-
TSE19
50
50
40
10
3:1
0.427
>50
TSE20
50
50
, http://www.100md.com 39
11
3:1
0.107
>50
TSE21
50
48
48
0
1:0
-
-
TSE22
, 百拇医药
51
51
35
16
3:1
0.791
>25
TSE23
50
50
50
0
1:0
, 百拇医药 -
-
TSE24
50
50
50
0
1:0
-
-
TSE25
50
50
40
, 百拇医药
10
3:1
0.427
>50
对T1代结实的单株,全部进行了自交2代(T2)潮霉素抗性鉴定。 T1代潮霉素敏感植株(TSF和TSG),后代全部为敏感植株,T1代潮霉素抗性植株,后代潮霉素抗性表现两种分离结果,3:1和1:0(纯合),其中TSA、TSC和TSE 3:1与1:0株系的比例接近2:1,TSD中1:0的纯合株系偏少,而TSB因株系少,没有发现纯合株系。另外在TSE中出现一些轻度抗潮霉素的株系,TSE3、TSE6、TSE23和TSE24为纯合株系,TSE8、TSE9、TSE11、TSE12、TSE14和TSE20则为杂合株系。
从本实验所分析的转基因植株及其后代(T1和T2)潮霉素抗性遗传结果来看,hpt基因表现为显性单基因位点的遗传方式,能稳定遗传,但hpt的表达在TSE的2代株系中不稳定。
, 百拇医药
2.3 转基因植株后代中hpt基因的分子杂交分析
结果见图版Ⅰ-A~C。
转基因植株总DNA经BamHⅠ酶切,Southern杂交结果显示,转基因植株均有多条杂交带,并且大于阳性对照的1.1kb杂交带,这表明在不同的转化事件中,多拷贝整合普遍存在。
自交1代(T1)Southern杂交结果可以看出,潮霉素抗性植株全部有杂交信号,而敏感植株无杂交信号,只是在SG-3-2的T1代中发现一敏感植株有杂交信号,但该植株田间生长势弱,进入孕穗期死亡,因而可能是该个体生长发育慢而被误认为敏感植株。从Southern杂交带型看,同一株系T1代个体间杂交带型完全相同,并且与转基因母株(T0)的杂交带型也相同,仅有SG-2中的TSB1缺少了1.2kb杂交带。T2代Southern杂交结果,潮霉素抗性纯合株系全部有杂交信号,杂合株系表现分离(符合3:1),杂交带型与T1代的完全相同。以上结果说明hpt多个拷贝紧密连锁稳定遗传,与潮霉素抗性遗传结果是一致的,并且在大多数株系中hpt表达正常。
, 百拇医药
2.4 转基因植株中hpt基因的甲基化分析
前文提到,SG-5自交2代的部分株系(如TSE3、TSE6),潮霉素抗性减弱,这反映了 hpt基因的表达水平下降。从转基因沉默研究中,可以了解到外源基因失活往往伴随着甲基化,而植物DNA甲基化主要发生在对称靶序列CG或CNG的胞嘧啶残基上,MspⅠ的识别序列和甲基化敏感特性见表5,用MspⅠ对pBI222和转基因植株样品DNA做酶切,hpt探针Southern杂交,如果不存在甲基化,则pBI222与样品能得到同样大小的杂交信号带,如果hpt被甲基化,那么转基因植株样品中得到的杂交信号带要大于pBI222的杂交信号带。表5 限制性内切酶Msp Ⅰ识别序列和甲基化敏感特性
Fig.5 Recognition sequence and sensitivity to mathylation of Msp Ⅰ 识别序列
Sequence
, 百拇医药
可切割位点
Cleavable site
不可切割位点
Uncleavable site
CCGG
Cm5CGG
m5CCGG
m4CCGG
m5Cm5CGG
Cm4CGG
, http://www.100md.com 结果见图版Ⅰ朌。pBI222MspⅠ酶切,Southern杂交后在大约500bp、400bp和200bp处,可以检测到3条杂交信号带。转基因植株样品中,也能检测到500bp、400bp和200bp
3条杂交带,然而在大于500bp的分子区段内,所有样品还有复杂的杂交信号,T1和T2代的杂交带型基本相同。由此推测,在所有转基因植株中,hpt基因的不同拷贝可能是以甲基化和非甲基化两种状态同时存在,并且得到稳定遗传。潮霉素抗性正常株系(TSE10)与弱抗性株系(TSE6和TSE14),甲基化状态相同,因而TSE自交后代(T2)中部分株系潮霉素抗性减弱与hpt基因甲基化可能没有直接关系。
3 讨论
3.1 转基因植物后代潮霉素抗性检测方法
分析hpt在转基因植株后代中的遗传分离,有的是采用将消毒的种子放置在含潮霉素的培养基上进行筛选,2星期左右统计存活个体数和死亡个体数[1,5,6]。Goto(1993)和Sivamani(1996)则是将发芽7d的幼苗转入含潮霉素的培养基中筛选2星期,统计存活数和死亡数[2,11]。这两种潮霉素抗性检测方法简便易行,一定程度上可以反映hpt的遗传表现,但也有不足之处。由于敏感植株全部死亡,进一步的分析只能针对抗性植株,hpt遗传的真实性难以全面揭示,特别是当hpt表达异常或失活时,所得分离结果会偏离正常的分离比,因而有必要保留敏感植株,并进行相应的分子检测。直接采用种子发芽进行潮霉素抗性鉴定,所得结果会因发芽率的好坏而受到很大影响,不发芽或发芽不正常的个体将被视为敏感个体,其结果自然不是hpt遗传的真实反映。本实验中就发现,不同转基因植株的后代发芽率有相当大的差异,尤其是自交一代(T1),如SG-1为68.6%,SG-2只有35.1%,自交2代(T2)中仍有少量株系发芽率偏低(表3,表4)。另外,SG-3-2的T1代中有一单株被视为敏感株,田间表现植株矮小,进入孕穗期时死亡,而分子杂交结果显示有hpt存在,由此也可以看出保留敏感植株(或阴性个体)并进行分析的必要性。
, http://www.100md.com
3.2 转基因植株后代潮霉素抗性表现及其与甲基化的关系
已有的研究中,潮霉素抗性的确认是以存活或死亡来界定的,为了保存敏感植株,潮霉素处理时间不能过长,如何确认抗性植株和敏感植株至关重要。多次实验中仔细观察发现,用对照品种设置正对照(不加潮霉素处理)和负对照(加潮霉素处理),通过比较可以很好地对抗感植株加以区分。T1代,抗性植株生长正常,生长发育进程和外观形态与正对照相同,敏感植株与负对照相同,T2代中,除SG-15外,其他转基因植株的后代抗性表现正常,表明hpt在T1代和多数T2代植株中得到了正常表达。SG-15的自交2代(T2)中,潮霉素抗性表现可分为4种情况:纯合抗性株系、杂合抗性株系、纯合弱抗株系和杂合弱抗株系(杂合弱抗株系中存在正常抗性植株、弱抗性植株和敏感植株)。分子检测表明,弱抗性株系或单株中有hpt存在,说明hpt的表达在这些植株中存在障碍,但没有完全失活,这种失活现象在水稻转基因遗传研究中还未见报道。虽然BamHⅠ酶切Southern杂交结果显示,有多个hpt拷贝整合在受体基因组中,但是T0、T1、T2之间Southern杂交带型完全相同,没有出现变异,抗性植株与弱抗植株之间Southern杂交带型也相同,所以重复诱导失活和位置效应均不能解释这种失活现象。MspⅠ酶切对转基因植株中hpt的甲基化状态进行分析,结果表明所有分析的个体中均存在甲基化的hpt拷贝,同时也存在非甲基化的hpt拷贝,hpt正常表达个体与弱表达个体之间甲基化状态没有明显差异,因此本实验中hpt的不完全失活可能与甲基化无关。因而推测可能存在其他调控因子影响hpt的表达,这有待进一步研究。这一结果与他人的研究结果不同。Kohli(1995)报道,在4个基因枪转化的转基因水稻植株中,hpt和gus有多拷贝整合,其中gus表现失活,用5-氮胞嘧啶(5-zacytidine)处理,gus恢复表达,表明沉默的gus基因中胞嘧啶被甲基化[7]。
, http://www.100md.com
3.3 水稻转基因遗传的稳定性
水稻转基因的遗传研究,多数报道只给出T1代的分离结果[5,6,10~12],多代分析还不多见。Goto(1993)选用电击法获得的转基因植株,对hpt的遗传进行了T1、T2、T3 3代分析,发现P12的T1和T2代中hpt遗传分离异常[2]。Peng(1995)对PEG法获得的3个转基因植株中nptⅡ和gus的遗传也进行了3代分析,AR2表现遗传稳定,而R3和54?表现异常[3]。Qu(1996)报道,基因枪转化的部分转基因植株中,hpt、gus或CP基因能稳定遗传到T3代,但没有提供具体数据[6]。
在本次实验研究中,潮霉素抗性表现为显性单基因位点的遗传方式,并且在T1和T2代中遗传稳定,分子检测也证实了这一遗传结果。从实验结果看,SG-3-1和SG-2的T1代中,抗性植株和敏感植株的比例,更接近2:1和1:1,到T2代时表现为3:1或1:0两种分离状态,这种情况在Goto的研究结果中也存在,P8的T1代抗感个体为37:20(2:1分离),T2代的表现为3:1或1:0。产生这一现象的原因尚不清楚,可能与配子活力、转基因植株的遗传组成和生理状态有关,但从中可以认识到,某些T1代的分离结果有可能不是转基因遗传的真实反映,对转基因的遗传行为需要进行多代研究。
, 百拇医药
报告基因或筛选标记基因的遗传研究,对于我们了解和认识植物转基因的遗传表现及其稳定性,是非常有益的。导入有用目的基因改良植物品种是植物转基因工作的目的,研究转基因植株中目的基因的遗传规律及其稳定性,则更具有实际意义,然而这方面的研究还比较缺乏,有待加强。
参考文献
[1]Shimamoto K et al.Fertile transgenic rice plants regenerated from transformed protoplasts.Nature,1989,338:274~276.
[2]Goto F et al.Inheritance of a co-transferred foreign gene in the progeny of transgenic rice plants.Transgenic Research,1993,2:300~305.
, 百拇医药
[3]Peng J et al.Inheritance of gusA and neo genes in transgenic rice.Plant Molecular Biology,1995,27:91~104.
[4]Cooly J et al.Molecular and genetic characterization of elite transgenic rice plants produced by electric-discharge particle acceleration.Theor.Appl.Genet.,1995,90:97~104.
[5]LiL et al.An improved rice transformation system using the biolistic method.Plant Cell Reports,1993,12:250~255.
, 百拇医药 [6]Qu R et al.Analysis of a large number of independent transgenic rice plants produced by the biolistic method.In Vitro Cell.Dev.Biol.Plant,1996,32:233~240.
[7]Kohli A et al.Cytosine methylation implicated in silencing of β-glucuronidase genes in transgenic rice.RiceGenetics III,IRRI,1995.
[8]Dellaporta S L et al.A plant DNA minipreparation.Plant Mol.Biol.Rep.,1983,1:19~21.
[9]Sambrook J et al.Molecular Cloning.Cold Spring Harbor Laboratory Press,1989.
, http://www.100md.com
[10]Christou P et al.Production of transgenic rice (Oryza sativa L.) plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos.Bio/Technology,1991,9:957~962.
[11]Sivamani E et al.Selection of large quantities of embryogenic calli from indca rice seeds for production offertile plants using the biolistic method.Plant Cell Reports,1996,15:322~327.
[12]Zhang S et al.Regeneration of fertile transgenic indica (group 1) rice plants following microprojectile transformation of embryogenic suspension culture cells.Plant Cell Reports,1996,15:465~469., http://www.100md.com
单位:中国科学院遗传研究所,北京 100101
关键词:水稻;转基因遗传;潮霉素磷酸转移酶基因
遗传学报000105
摘要:基因枪转化将潮霉素磷酸转移酶基因(hpt)导入粳稻品种77170,获得可育的转基因植株,研究外源基因遗传的稳定性。自交后代(T1和T2)经潮霉素筛选获得抗性植株和敏感植株,分子鉴定结果表明抗性植株带有hpt基因,而敏感植株中没有hpt基因存在。T1和T2代中潮霉素抗性表现为显性单基因位点的遗传方式,符合孟德尔分离规律,并得到分子鉴定结果的证实。Southern杂交结果显示,hpt基因多拷贝整合在水稻基因组中,并成紧密连锁状态在T1和T2代中稳定遗传。SG-15的部分T2代株系中发现hpt基因不完全失活现象,并且与甲基化状态可能无关。
, 百拇医药
中图分类号:Q943 文献标识码:A
文章编号:0379-4172(2000)01-0026-0033
Stable Inheritance of hpt Gene in Transgenic Rice Plants Mediated by Biolistic Bombardment
TANG Zuo-Shun,LI Liang-Cai,TIAN Wen-Zhong
(Institute of Genetics,Chinese Academy of Sciences,Beijing 100101,China)
TANG Zuo-Shun,WANG Xiang-Kun
(China Agricultural University,Beijing 100094,China)
, http://www.100md.com
Abstract:Japonica rice cv 77170 was transformed with pBI222 carrying hygromycin phosphotransferase gene (hpt) by using biolistic bombardment and fertile transgenic rice plants were obtained.In T1 and most T2 generation the performance of hygromycin resistance was normal.Only in T2 progeny of SG-15 some lines showed decreased resistance.Mendelian inheritance of hygromycin resistance was showed as single dominant locus and proved by Southern blotting analysis in T1 and T2 generation of all transgenic plants.Multiple copies of hpt integrated into rice genome.These copies linked closely and inherited stablly.MspⅠ digested Southern blotting showed that methylation of hpt existed commonly in transgenic plants and their progeny,therefore uncomplete silencing of hpt in some T2 progeny of SG-15 was not associated with hpt methylation probably.
, http://www.100md.com
Key words:rice;transgene inheritance;hygromycin phosphotransferase gene (hpt)
1989年Shimamoto等首次获得可育的转基因水稻,研究证实外源基因可以遗传给后代[1]。关于水稻转基因遗传和表达的稳定性,目前还缺乏比较系统的研究,Goto等(1993)对电击法获得的转基因植株进行了T1、T2和T3代分析,发现了hpt基因非孟德尔遗传现象[2],Peng等(1995)在PEG法转基因水稻的遗传研究中,观察到nptⅡ和gus遗传的不稳定性[3],基因枪法转基因水稻中外源基因的遗传表现,多数符合31分离[4~6]。影响水稻转基因稳定性的因素并不清楚,Kohli等(1995)研究发现,基因枪转化获得的转基因水稻,外源基因(hpt/gus)和(Bt/bar)在T1代中分离异常,分子检测表明,外源基因多拷贝插入,结构状态复杂,启动子和编码区中的胞嘧啶已被甲基化[7]。所以,水稻转基因的稳定性仍是一个值得深入研究的问题。
, http://www.100md.com
1 材料和方法
1.1 实验材料(表1)
图1 实验材料
Table1 Materials 转基因植株
Transgenic plants
后代编号说明
Serial number of the progeny
SG-1 (T0)
TSA-T1 代潮霉素抗性株 resistive plant in T1 generation
, http://www.100md.com
SG-2 (T0)
TSB-T1 代潮霉素抗性株 resistive plant in T1 generation
SG-3-1 (T0)
TSC-T1 代潮霉素抗性株 resistive plant in T1 generation
TSF-T1 代潮霉素敏感株 sensitive plant in T1 generation
SG-3-2 (T0)
TSD-T1 代潮霉素抗性株 resistive plant in T1 generation
, http://www.100md.com
TSG-T1 代潮霉素敏感株 sensitive plant in T1 generation
SG-15 (T0)
TSE-T1 代潮霉素抗性株 resistive plant in T1 generation
SG系列转基因植株,系由基因枪转化获得,转化受体品种为77170(粳稻)。转化质粒为pBI222(图1),带有潮霉素磷酸转移酶基因(hpt)、35S启动子和nos终止子。

图1 pBI222(4.8kb)简图
Fig.1 pBI222(4.8kb)
, 百拇医药
1.2 实验方法
1.2.1 转基因植株后代潮霉素抗性检测 每份材料取饱满种子50粒,25℃光照条件下发芽6~7天,发芽正常的个体转入培养瓶中,内盛20ml 1/2 N6培养液及50mg/L潮霉素(Hygromycin B),25℃光照条件下培养。对照品种77170相同条件下发芽,发芽正常的个体分别转入到2个培养瓶中(20ml 1/2 N6培养液),其中1瓶不加潮霉素(正对照),另1瓶加入潮霉素50mg/L(负对照)。潮霉素筛选4~5d后,与正对照和负对照对比,统计潮霉素抗性植株和敏感植株的数量,再转入到1/2 N6培养液中恢复生长,存活的个体移栽大田。
1.2.2 Southern杂交分析 水稻叶片总DNA的提取参照Dellaporta等的方法[8],Southern杂交参见《分子克隆》实验指南[9]。随机引物32P标记的1.1kb hpt基因片段用作探针。
, 百拇医药
2 结果分析
2.1 转基因水稻后代潮霉素抗性表现
种子发芽6d左右,将发芽正常的个体转入到含潮霉素50mg/L的1/2 N6培养液中,3d后,正负对照表现出明显差异。负对照芽和根的生长被抑制,几乎没有新根发生或生长,外观表现为苗小根少;随处理时间延长,根部逐渐发黄,心叶卷成针状且退绿,14d左右死亡。
转基因植株自交1代中(T1),潮霉素抗性表现分离,抗性植株与正对照相同,敏感植株与负对照相同,没有发现中间状态植株,表明hpt在这些株系中得到正常表达。
T1代抗性植株的自交后代(T2)中,TSA、TSB、TSC、TSD的后代潮霉素抗性表现正常,抗感株差异明显,外观形态分别与正对照和负对照相同,而TSE后代出现了不同情况,部分株系潮霉素抗性表现为中间状态(表2),不同株系程度不同,这可能是由于hpt在这些株系中不同程度地失活,故此称之为不完全失活。T1代中敏感植株TSF和TSG的自交后代全部不抗潮霉素。
, 百拇医药
表2 TSE3自交后代(T2)潮霉素筛选种子苗形态结果
Table2 Performance of hygromycin resistance in T2 progeny of TSE3 材料
Plants
平均苗长
Length of seedling
(cm)
第1叶叶鞘长
Length of first leaf sheath
(cm)
, 百拇医药
第1、2叶间距
Distance between first and second leaf
(cm)
正对照
22.3±1.4
4.0±0.0
6.9±0.2
TSE-3
20.7±1.4
2.6±0.2
3.9±0.6
负对照
, 百拇医药
Negative control
9.6±1.0
1.7±0.2
1.3±0.2
2.2 转基因水稻潮霉素抗性的遗传分离
结果见表3和表4。T1代株系潮霉素抗性表现分离,卡平方测验显示,均符合3:1分离,由于SG-3-1和SG-3-2的T1代种子量较大,所以都分别进行了3次潮霉素抗性鉴定,其中2次是采用种子苗,1次是采用小分蘖,3次结果表现一致,重复之间没有明显差异,说明每次鉴定结果是可靠的,对各次结果进行卡平方测验,均符合31分离。表3 转基因水稻后代(T1)潮霉素抗性遗传分离情况
Table3 Segregation of hygromycin resistance in T1 generation of transgenic plants 株系
, 百拇医药
Lines
种子数
No.of seed
成苗数
No.of seedling
抗性板株数
R-plants
敏感株数
S-plants
分离比
Segregation
x2
, http://www.100md.com
P(%)
备注
Notes
SG-3-1
50
45
30
15
3:1
1.252
>25
种子苗
seedling
, http://www.100md.com
50
44
28
16
3:1
2.450
>10
种子苗
seedling
-
18
12
6
, http://www.100md.com 3:1
0.300
>50
小分蘖
tiller
SG-3-2
50
49
37
12
3:1
0.007
>90
, 百拇医药
种子苗
seedling
50
41
31
10
3:1
0.008
>90
种子苗
seedling
-
27
, 百拇医药
20
7
3:1
0.020
>90
小分蘖
tiller
SG-1
35
24
18
6
3:1
, 百拇医药
0.056
>75
种子苗
seedling
SG-2
37
13
7
6
3:1
2.077
>10
种子苗
, http://www.100md.com
seedling
SG-15
41
41
27
14
3:1
1.374
>10
种子苗
seedling
77170(CK)
50
, http://www.100md.com
47
0
47
0:1
-
-
种子苗
seedling
表4 转基因水稻后代(T2)潮霉素抗性遗传分离
Table4 Segregation of hygromycin resistance in T2 generation of transgenic plants 株系
, http://www.100md.com
Lines
种子数
No.of seeds
成苗数
No.of seedling
抗性株数
R-plants
敏感株数
S-plants
分离比
Segregation
x2
, 百拇医药
P(%)
TSC1
50
38
30
8
3:1
0.140
>50
TSC3
50
39
27
, http://www.100md.com 12
3:1
0.419
>50
TSC6
53
48
38
10
3:1
0.250
>50
TSC7
, 百拇医药 50
44
28
16
3:1
2.455
>10
TSC8
50
43
34
9
3:1
0.194
, http://www.100md.com
>50
TSC9
50
49
49
0
1:0
-
-
TSC10
50
48
37
11
, 百拇医药
3:1
0.027
>75
TSC14
50
49
49
0
1:0
-
-
TSC20
34
, http://www.100md.com 23
18
5
3:1
0.014
>90
TSC21
50
36
36
0
1:0
-
-
, 百拇医药
TSF1
50
38
0
38
0:1
-
-
TSF3
20
12
0
12
0:1
, http://www.100md.com
-
TSF4
50
38
0
38
0:1
-
-
TSF5
40
14
0
14
, 百拇医药
0:1
-
-
TSF6
50
37
0
37
0:1
-
-
TSE1
50
31
, 百拇医药
21
10
3:1
0.527
>25
TSE2
50
46
29
17
3:1
2.899
>5
, 百拇医药
TSE3
50
49
49
1
1:0
-
-
TSE6
50
49
48
0
1:0
, http://www.100md.com
-
-
TSE8
50
50
40
10
3:1
0.427
>50
TSE9
50
41
, 百拇医药 31
10
3:1
0.008
>90
TSE10
50
47
47
0
1:0
-
-
TSE11
, 百拇医药
50
49
41
8
3:1
1.531
>10
TSE12
50
50
37
13
3:1
, http://www.100md.com 0.000
>90
TSE14
50
50
37
13
3:1
0.000
>90
TSE15
50
50
, http://www.100md.com 40
10
3:1
0.427
>50
TSE16
50
50
38
12
3:1
0.000
>90
, http://www.100md.com TSE17
50
49
49
0
1:0
-
-
TSE18
50
50
50
0
1:0
, http://www.100md.com
-
-
TSE19
50
50
40
10
3:1
0.427
>50
TSE20
50
50
, http://www.100md.com 39
11
3:1
0.107
>50
TSE21
50
48
48
0
1:0
-
-
TSE22
, 百拇医药
51
51
35
16
3:1
0.791
>25
TSE23
50
50
50
0
1:0
, 百拇医药 -
-
TSE24
50
50
50
0
1:0
-
-
TSE25
50
50
40
, 百拇医药
10
3:1
0.427
>50
对T1代结实的单株,全部进行了自交2代(T2)潮霉素抗性鉴定。 T1代潮霉素敏感植株(TSF和TSG),后代全部为敏感植株,T1代潮霉素抗性植株,后代潮霉素抗性表现两种分离结果,3:1和1:0(纯合),其中TSA、TSC和TSE 3:1与1:0株系的比例接近2:1,TSD中1:0的纯合株系偏少,而TSB因株系少,没有发现纯合株系。另外在TSE中出现一些轻度抗潮霉素的株系,TSE3、TSE6、TSE23和TSE24为纯合株系,TSE8、TSE9、TSE11、TSE12、TSE14和TSE20则为杂合株系。
从本实验所分析的转基因植株及其后代(T1和T2)潮霉素抗性遗传结果来看,hpt基因表现为显性单基因位点的遗传方式,能稳定遗传,但hpt的表达在TSE的2代株系中不稳定。
, 百拇医药
2.3 转基因植株后代中hpt基因的分子杂交分析
结果见图版Ⅰ-A~C。
转基因植株总DNA经BamHⅠ酶切,Southern杂交结果显示,转基因植株均有多条杂交带,并且大于阳性对照的1.1kb杂交带,这表明在不同的转化事件中,多拷贝整合普遍存在。
自交1代(T1)Southern杂交结果可以看出,潮霉素抗性植株全部有杂交信号,而敏感植株无杂交信号,只是在SG-3-2的T1代中发现一敏感植株有杂交信号,但该植株田间生长势弱,进入孕穗期死亡,因而可能是该个体生长发育慢而被误认为敏感植株。从Southern杂交带型看,同一株系T1代个体间杂交带型完全相同,并且与转基因母株(T0)的杂交带型也相同,仅有SG-2中的TSB1缺少了1.2kb杂交带。T2代Southern杂交结果,潮霉素抗性纯合株系全部有杂交信号,杂合株系表现分离(符合3:1),杂交带型与T1代的完全相同。以上结果说明hpt多个拷贝紧密连锁稳定遗传,与潮霉素抗性遗传结果是一致的,并且在大多数株系中hpt表达正常。
, 百拇医药
2.4 转基因植株中hpt基因的甲基化分析
前文提到,SG-5自交2代的部分株系(如TSE3、TSE6),潮霉素抗性减弱,这反映了 hpt基因的表达水平下降。从转基因沉默研究中,可以了解到外源基因失活往往伴随着甲基化,而植物DNA甲基化主要发生在对称靶序列CG或CNG的胞嘧啶残基上,MspⅠ的识别序列和甲基化敏感特性见表5,用MspⅠ对pBI222和转基因植株样品DNA做酶切,hpt探针Southern杂交,如果不存在甲基化,则pBI222与样品能得到同样大小的杂交信号带,如果hpt被甲基化,那么转基因植株样品中得到的杂交信号带要大于pBI222的杂交信号带。表5 限制性内切酶Msp Ⅰ识别序列和甲基化敏感特性
Fig.5 Recognition sequence and sensitivity to mathylation of Msp Ⅰ 识别序列
Sequence
, 百拇医药
可切割位点
Cleavable site
不可切割位点
Uncleavable site
CCGG
Cm5CGG
m5CCGG
m4CCGG
m5Cm5CGG
Cm4CGG
, http://www.100md.com 结果见图版Ⅰ朌。pBI222MspⅠ酶切,Southern杂交后在大约500bp、400bp和200bp处,可以检测到3条杂交信号带。转基因植株样品中,也能检测到500bp、400bp和200bp
3条杂交带,然而在大于500bp的分子区段内,所有样品还有复杂的杂交信号,T1和T2代的杂交带型基本相同。由此推测,在所有转基因植株中,hpt基因的不同拷贝可能是以甲基化和非甲基化两种状态同时存在,并且得到稳定遗传。潮霉素抗性正常株系(TSE10)与弱抗性株系(TSE6和TSE14),甲基化状态相同,因而TSE自交后代(T2)中部分株系潮霉素抗性减弱与hpt基因甲基化可能没有直接关系。
3 讨论
3.1 转基因植物后代潮霉素抗性检测方法
分析hpt在转基因植株后代中的遗传分离,有的是采用将消毒的种子放置在含潮霉素的培养基上进行筛选,2星期左右统计存活个体数和死亡个体数[1,5,6]。Goto(1993)和Sivamani(1996)则是将发芽7d的幼苗转入含潮霉素的培养基中筛选2星期,统计存活数和死亡数[2,11]。这两种潮霉素抗性检测方法简便易行,一定程度上可以反映hpt的遗传表现,但也有不足之处。由于敏感植株全部死亡,进一步的分析只能针对抗性植株,hpt遗传的真实性难以全面揭示,特别是当hpt表达异常或失活时,所得分离结果会偏离正常的分离比,因而有必要保留敏感植株,并进行相应的分子检测。直接采用种子发芽进行潮霉素抗性鉴定,所得结果会因发芽率的好坏而受到很大影响,不发芽或发芽不正常的个体将被视为敏感个体,其结果自然不是hpt遗传的真实反映。本实验中就发现,不同转基因植株的后代发芽率有相当大的差异,尤其是自交一代(T1),如SG-1为68.6%,SG-2只有35.1%,自交2代(T2)中仍有少量株系发芽率偏低(表3,表4)。另外,SG-3-2的T1代中有一单株被视为敏感株,田间表现植株矮小,进入孕穗期时死亡,而分子杂交结果显示有hpt存在,由此也可以看出保留敏感植株(或阴性个体)并进行分析的必要性。
, http://www.100md.com
3.2 转基因植株后代潮霉素抗性表现及其与甲基化的关系
已有的研究中,潮霉素抗性的确认是以存活或死亡来界定的,为了保存敏感植株,潮霉素处理时间不能过长,如何确认抗性植株和敏感植株至关重要。多次实验中仔细观察发现,用对照品种设置正对照(不加潮霉素处理)和负对照(加潮霉素处理),通过比较可以很好地对抗感植株加以区分。T1代,抗性植株生长正常,生长发育进程和外观形态与正对照相同,敏感植株与负对照相同,T2代中,除SG-15外,其他转基因植株的后代抗性表现正常,表明hpt在T1代和多数T2代植株中得到了正常表达。SG-15的自交2代(T2)中,潮霉素抗性表现可分为4种情况:纯合抗性株系、杂合抗性株系、纯合弱抗株系和杂合弱抗株系(杂合弱抗株系中存在正常抗性植株、弱抗性植株和敏感植株)。分子检测表明,弱抗性株系或单株中有hpt存在,说明hpt的表达在这些植株中存在障碍,但没有完全失活,这种失活现象在水稻转基因遗传研究中还未见报道。虽然BamHⅠ酶切Southern杂交结果显示,有多个hpt拷贝整合在受体基因组中,但是T0、T1、T2之间Southern杂交带型完全相同,没有出现变异,抗性植株与弱抗植株之间Southern杂交带型也相同,所以重复诱导失活和位置效应均不能解释这种失活现象。MspⅠ酶切对转基因植株中hpt的甲基化状态进行分析,结果表明所有分析的个体中均存在甲基化的hpt拷贝,同时也存在非甲基化的hpt拷贝,hpt正常表达个体与弱表达个体之间甲基化状态没有明显差异,因此本实验中hpt的不完全失活可能与甲基化无关。因而推测可能存在其他调控因子影响hpt的表达,这有待进一步研究。这一结果与他人的研究结果不同。Kohli(1995)报道,在4个基因枪转化的转基因水稻植株中,hpt和gus有多拷贝整合,其中gus表现失活,用5-氮胞嘧啶(5-zacytidine)处理,gus恢复表达,表明沉默的gus基因中胞嘧啶被甲基化[7]。
, http://www.100md.com
3.3 水稻转基因遗传的稳定性
水稻转基因的遗传研究,多数报道只给出T1代的分离结果[5,6,10~12],多代分析还不多见。Goto(1993)选用电击法获得的转基因植株,对hpt的遗传进行了T1、T2、T3 3代分析,发现P12的T1和T2代中hpt遗传分离异常[2]。Peng(1995)对PEG法获得的3个转基因植株中nptⅡ和gus的遗传也进行了3代分析,AR2表现遗传稳定,而R3和54?表现异常[3]。Qu(1996)报道,基因枪转化的部分转基因植株中,hpt、gus或CP基因能稳定遗传到T3代,但没有提供具体数据[6]。
在本次实验研究中,潮霉素抗性表现为显性单基因位点的遗传方式,并且在T1和T2代中遗传稳定,分子检测也证实了这一遗传结果。从实验结果看,SG-3-1和SG-2的T1代中,抗性植株和敏感植株的比例,更接近2:1和1:1,到T2代时表现为3:1或1:0两种分离状态,这种情况在Goto的研究结果中也存在,P8的T1代抗感个体为37:20(2:1分离),T2代的表现为3:1或1:0。产生这一现象的原因尚不清楚,可能与配子活力、转基因植株的遗传组成和生理状态有关,但从中可以认识到,某些T1代的分离结果有可能不是转基因遗传的真实反映,对转基因的遗传行为需要进行多代研究。
, 百拇医药
报告基因或筛选标记基因的遗传研究,对于我们了解和认识植物转基因的遗传表现及其稳定性,是非常有益的。导入有用目的基因改良植物品种是植物转基因工作的目的,研究转基因植株中目的基因的遗传规律及其稳定性,则更具有实际意义,然而这方面的研究还比较缺乏,有待加强。
参考文献
[1]Shimamoto K et al.Fertile transgenic rice plants regenerated from transformed protoplasts.Nature,1989,338:274~276.
[2]Goto F et al.Inheritance of a co-transferred foreign gene in the progeny of transgenic rice plants.Transgenic Research,1993,2:300~305.
, 百拇医药
[3]Peng J et al.Inheritance of gusA and neo genes in transgenic rice.Plant Molecular Biology,1995,27:91~104.
[4]Cooly J et al.Molecular and genetic characterization of elite transgenic rice plants produced by electric-discharge particle acceleration.Theor.Appl.Genet.,1995,90:97~104.
[5]LiL et al.An improved rice transformation system using the biolistic method.Plant Cell Reports,1993,12:250~255.
, 百拇医药 [6]Qu R et al.Analysis of a large number of independent transgenic rice plants produced by the biolistic method.In Vitro Cell.Dev.Biol.Plant,1996,32:233~240.
[7]Kohli A et al.Cytosine methylation implicated in silencing of β-glucuronidase genes in transgenic rice.RiceGenetics III,IRRI,1995.
[8]Dellaporta S L et al.A plant DNA minipreparation.Plant Mol.Biol.Rep.,1983,1:19~21.
[9]Sambrook J et al.Molecular Cloning.Cold Spring Harbor Laboratory Press,1989.
, http://www.100md.com
[10]Christou P et al.Production of transgenic rice (Oryza sativa L.) plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos.Bio/Technology,1991,9:957~962.
[11]Sivamani E et al.Selection of large quantities of embryogenic calli from indca rice seeds for production offertile plants using the biolistic method.Plant Cell Reports,1996,15:322~327.
[12]Zhang S et al.Regeneration of fertile transgenic indica (group 1) rice plants following microprojectile transformation of embryogenic suspension culture cells.Plant Cell Reports,1996,15:465~469., http://www.100md.com