细胞因子对活化淋巴细胞粘附血管内皮细胞影响机理的研究
作者:侯桂华 韩建奎 张庆殷 宋 静 卢红霞
单位:山东医科大学微生物教研室,济南250012
关键词:血管内皮细胞;活化淋巴细胞;粘附;细胞因子
中国免疫学杂志990308 中国图书分类号 R322.1 R331.14
摘 要 目的:探讨细胞因子对rIL-2活化的脐血淋巴细胞粘附脐静脉血管内皮细胞(HUVEC)的影响机理。方法:计数粘附率和APAAP法测细胞表型。结果:rIL-2活化淋巴细胞粘附HUVEC的能力明显大于未刺激组,前者的粘附率是56.52%,后者是24.54%。rIL-1、2、8、rTNF-α可明显增强其粘附,而rIL-10使粘附率明显下降至38.12%;rIL-1、8、rTNF-α增强CD4+细胞的粘附,rIL-10抑制CD4+、CD56+的粘附。结论:活化淋巴细胞粘附HUVEC的作用明显增强,rIL-1、2、8、10和rTNF-α对这一过程具有重要的调节作用。
, 百拇医药
Effects of cytokine on adherence of activated lymphocyte to vascular endothelial cells
HOU Gui-Hua,HAN Jian-Kui,ZHANG Qing-Yin et al.
Department of Microbiology, Shandong Medical University,Jinan 250012
Abstract Objective:To explore the effects of different cytokine on the adherence of rIL-2 activated umbilical lymphocytes to HUVEC(human umbilical vein endothelial cells).Methods :Activated umbilical lymphocytes were laid on the surface of the cultured HUVEC monolayer. After a certain period of time,the adherence rate was determined. The phenotypes of adherent lymphocytes were studied with APAAP method.Results:rIL-2 activated lymphocytes exhibited a stronger adherence to HUVEC than that of control group.rIL-1(10 U/ml)\,rIL-2(1 000 U/ml)\,rIL-8(1 mg/ml)and rTNF-α(250 U/ml) could promote the adherence of rIL-2 activated lymphocytes,but rIL-10 decreased the adhesion rate to 38.12%.Conclusions:The adherent activity of activated lymphocytes is obviously stronger than that of unactivated ones and cytokine may play an important role in regulating lymphocyte adherence to vascular endothelium.
, 百拇医药
Key words Vascular endothelium Activated lymphocyte Adherence Cytokine
近年来国外研究表明[1],进入体内的活化淋巴细胞在粘附、穿越血管内皮细胞过程中受到某些细胞因子和粘附分子的重要调节[2]。我们利用人脐静脉内皮细胞(HUVEC)原代培养物,研究了IL-2活化的淋巴细胞对HUVEC的粘附作用和rIL-1、2、6、8、10和rTNF-α对这一过程的影响,旨在探讨活化淋巴细胞对内皮细胞的粘附机理及影响因素,从而为肿瘤局部继承性免疫治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 脐带标本 剖宫产后健康新生儿脐带,取自本校附属医院妇产科。
, http://www.100md.com
1.1.2 试剂 胰蛋白酶为Sigma公司产品。用RPMI1640培养液配成0.25%浓度,-20℃冻存。rIL-1、2、6、TNF-α购于北京邦定生物医学公司,rIL-10、8由北京医大马大龙教授惠赠。CD3、CD4、CD8、CD56、HLA-DP单抗购于军事医科院生物制剂发展中心。
1.2 方法
1.2.1 HUVEC的分离培养 见参考文献[3]。
1.2.2 活化淋巴细胞的诱导 无菌取脐静脉血分离淋巴细胞,用10%FCS-RPMI1640液洗涤后调整浓度为5×106ml-1,加入rIL-2(1 000 U/ml),放入细胞培养瓶后置37℃、5%CO2条件下培养4 d即为IL-2活化的淋巴细胞。
1.2.3 粘附活性的测定[3] 培养的HUVEC在24孔板上生长至致密融合的单层后,用10%FCS-RPMI1640液洗涤后做粘附试验:在相应孔中加入37℃预温10 min的对照组脐血淋巴细胞(Umbilical cord blood lymphocyte,UCBL)和IL-2活化的UCBL,2×106ml-1,0.5 ml/孔。每一标本设6个复孔。将培养板置37℃、5%CO2孵箱中孵育30 min后,加入含0.1 mol/L EDTA的RPMI1640液洗涤2次,收集各孔上清液及洗涤液,混合后计数细胞,按下式计算出粘附百分率:
, 百拇医药
1.2.4 粘附细胞表型测定 粘附试验结束后,用含0.25%的胰蛋白酶和0.02%EDTA的RPMI1640液洗下粘附的淋巴细胞,离心,沉淀物涂片。用APAAP桥联酶标法测定细胞表型。
1.2.5 统计学处理 采用t检验。
2 结果
2.1 活化淋巴细胞对HUVEC的粘附作用 3次试验中,rIL-2活化的UCBL粘附HUVEC的能力均明显高于对照组,P<0.01,见表1。
表1 三次试验中活化淋巴细胞对HUVEC的粘附作用
Tab.1 Adherence of activated lymphocytes to HUVEC
1
, 百拇医药
2
3
Mean value
Activated UCBL
69.60±1.62
74.52±1.40
56.52±1.91
66.88±9.30
UCBL
29.80±1.70
25.46±1.49
24.54±1.35
, http://www.100md.com
26.60±2.81
Note: ±s, n=6,P<0.052.2 细胞因子对活化淋巴细胞粘附HUVEC的影响 将rIL-1(10 U/ml)、rIL-8、10(1 μg/ml),TNF-α(250 U/ml)与内皮细胞作用24 h后,测其对IL-2活化UCBL的粘附能力,同时设未经细胞因子刺激的内皮细胞做对照,结果rIL-1、8和rTNF-α明显增强活化UCBL对HUVEC的粘附,而rIL-10对其有抑制作用,(P<0.05,图1)。
±s, n=6,P<0.052.2 细胞因子对活化淋巴细胞粘附HUVEC的影响 将rIL-1(10 U/ml)、rIL-8、10(1 μg/ml),TNF-α(250 U/ml)与内皮细胞作用24 h后,测其对IL-2活化UCBL的粘附能力,同时设未经细胞因子刺激的内皮细胞做对照,结果rIL-1、8和rTNF-α明显增强活化UCBL对HUVEC的粘附,而rIL-10对其有抑制作用,(P<0.05,图1)。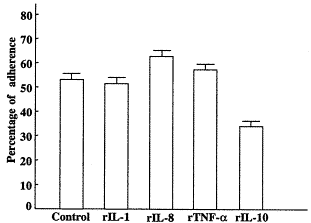
图1 细胞因子对活化淋巴细胞粘附HUVEC的影响
Fig.1 Effect of cytokine(24 h)on adherence of activated lymphocytes to HUVEC
, http://www.100md.com
2.3 不同作用时间细胞因子对活化淋巴细胞粘附的影响 与对照组相比,用rIL-1、6(10 U/ml), rIL-2(1 000 U/ml),rIL-8、10(1 μg/ml)处理内皮细胞1 h后,rIL-1、2、8即可明显促进活化UCBL对HUVEC的粘附;处理24 h后,rIL-2、6、8可明显促进粘附,而rIL-10具有明显抑制作用,rIL-1组与对照组无明显差别;处理48 h后,rIL-2、8仍显示较强的促粘附作用,而rIL-1、6、10显示明显的抑制作用;处理72 h后,除rIL-2仍具有较强的促粘附作用外,其他细胞因子均显示出深度的抑制。
2.4 粘附淋巴细胞的表型测定 粘附的活化淋巴细胞中,CD3+、CD8+、CD56+、HLA-DP+细胞均明显高于未刺激的淋巴细胞,P<0.05(表2)。不同的细胞因子作用内皮细胞24 h后,rIL-1、8、rTNF-α增加CD4+细胞的粘附;rIL-8降低CD8+细胞的粘附;rIL-10明显抑制CD3+、CD4+、CD56+细胞的粘附;rIL-1明显抑制HLA-DP+细胞的粘附(P<0.05),见表3。
, http://www.100md.com
表2 粘附的淋巴细胞的表型特征
Tab.2 Phenotypes of adherent lymphocytes
CD3
CD4
CD8
CD56
HLA-DP
Activated UCBL
64.11±1.031)
27.60±2.50
34.52±1.771)
, http://www.100md.com
22.57±0.521)
35.17±1.071)
UCBL
48.58±0.46
31.10±0.97
11.27±1.06
6.29±1.15
9.34±0.84
Note: ±s,n=6,1) P<0.05表3 细胞因子对粘附的活化淋巴细胞表型的影响
±s,n=6,1) P<0.05表3 细胞因子对粘附的活化淋巴细胞表型的影响
, 百拇医药
Tab.3 Effects of cytokine on phenotypes of adherent activated lymphocytes HLA-DP
CD3
CD4
CD8
CD56
rIL-1
62.45±2.07
42.46±3.291)
34.74±0.92
18.66±1.29
, http://www.100md.com
23.94±1.511)
rIL-8
64.68±1.30
38.04±2.321)
24.76±1.751)
20.49±0.54
30.70±1.62
rIL-10
50.23±1.122)
21.61±1.562)
, 百拇医药
33.51±2.11
13.40±1.081)
31.29±1.19
rTNF-α
63.69±2.82
36.85±0.371)
35.16±1.06
21.93±0.74
31.31±1.04
Control
64.11±1.03
, 百拇医药
27.60±2.50
34.52±1.77
22.57±0.52
35.17±1.07
Note: ±s,n=6,1) P<0.01,2)P<0.05
±s,n=6,1) P<0.01,2)P<0.05
3 讨论
血管内皮细胞是组织与血液之间的重要屏障。在继承性免疫治疗中进入机体的活化淋巴细胞欲有效杀伤肿瘤,必须先粘附于血管内皮细胞。内皮细胞可分泌多种细胞因子影响白细胞对内皮的粘附及穿越[4,5]。本研究结果表明,IL-2活化的淋巴细胞对HUVEC的粘附作用明显大于未活化淋巴细胞;IL-1、2、6、8、TNF-α均可增强这一作用,而IL-10则具有明显的抑制效用。
, 百拇医药
研究证实白细胞与内皮细胞的粘附的第一阶段主要依赖选择素家族介导松散粘附;第二阶段是某些信号使粘附的白细胞表达有活性的整合素分子,第三阶段是整合素介导的强有力的粘附[6]。IL-8可作为激发信号,激发中性粒细胞通过β2整合素粘附于内皮细胞,IL-1、TNF-α均可诱导内皮细胞产生IL-8[7]。本文证实IL-8也可增强活化淋巴细胞对内皮的粘附,且最佳作用时间是不长于48 h,IL-1、TNF-α也明显促进活化淋巴细胞的粘附,其机理可能是通过诱生IL-8,促进β2整合素的表达。IL-10是一种新近发现的抑制性细胞因子。可抑制Th1细胞的增殖,抑制IL-2、IL-8、TNF等细胞因子产生[8]。本文表明IL-10可明显抑制活化淋巴细胞粘附HUVEC,且作用时间较长,其作用机理可能是通过抑制IL-8等细胞因子的产生,IL-10是否能直接作用于整合素分子尚需进一步研究。
作者简介:侯桂华,女,38岁,免疫学硕士,副教授,硕士生导师,主要研究肿瘤免疫学
, http://www.100md.com
4 参考文献
1 Kitayama J,Juji T,Atomi Y et al. Transendothelial migration activity of lymphokine-activated killer cells.J Immunol,1993;151:1663
2 Charles R M,Beat A I. Cell adhesion in the immune system.Immunology Today,1993:14(3):99
3 Bianchi G,Sironi M,Ghibaudi E et al. Migration of NK cells across endothelial cell monolayers.J of Immunol,1993;151:5135
4 Jordans P,Ramzis C.Cytokine and endothelial cell biology.Physiological Reviews,1990;70(2):427
, 百拇医药
5 Tanaka Y,David H A,Stephen H.Proteoglycans on endothelial cell present adhesion-induced cytokines to leukocytes.Immunology Today,1993;14(3):111
6 Nancy H,Cornelia B.Structure and function of adhesion receptors in leukocyte trafficking. Immunology Today,1995;16(7):327
7 Guy A Z,Stephen M P,Thomas M M.Endothelial cell interactions with granulocytes:tethering and signaling molecules.Immunology Today,1992;13(3):93
8 金伯泉.细胞因子及其受体.见:金伯泉主编.细胞和分子免疫学.北京:世界图书出版公司,1995:114-115
〔收稿1997-07-16 修回1998-02-04〕, 百拇医药
单位:山东医科大学微生物教研室,济南250012
关键词:血管内皮细胞;活化淋巴细胞;粘附;细胞因子
中国免疫学杂志990308 中国图书分类号 R322.1 R331.14
摘 要 目的:探讨细胞因子对rIL-2活化的脐血淋巴细胞粘附脐静脉血管内皮细胞(HUVEC)的影响机理。方法:计数粘附率和APAAP法测细胞表型。结果:rIL-2活化淋巴细胞粘附HUVEC的能力明显大于未刺激组,前者的粘附率是56.52%,后者是24.54%。rIL-1、2、8、rTNF-α可明显增强其粘附,而rIL-10使粘附率明显下降至38.12%;rIL-1、8、rTNF-α增强CD4+细胞的粘附,rIL-10抑制CD4+、CD56+的粘附。结论:活化淋巴细胞粘附HUVEC的作用明显增强,rIL-1、2、8、10和rTNF-α对这一过程具有重要的调节作用。
, 百拇医药
Effects of cytokine on adherence of activated lymphocyte to vascular endothelial cells
HOU Gui-Hua,HAN Jian-Kui,ZHANG Qing-Yin et al.
Department of Microbiology, Shandong Medical University,Jinan 250012
Abstract Objective:To explore the effects of different cytokine on the adherence of rIL-2 activated umbilical lymphocytes to HUVEC(human umbilical vein endothelial cells).Methods :Activated umbilical lymphocytes were laid on the surface of the cultured HUVEC monolayer. After a certain period of time,the adherence rate was determined. The phenotypes of adherent lymphocytes were studied with APAAP method.Results:rIL-2 activated lymphocytes exhibited a stronger adherence to HUVEC than that of control group.rIL-1(10 U/ml)\,rIL-2(1 000 U/ml)\,rIL-8(1 mg/ml)and rTNF-α(250 U/ml) could promote the adherence of rIL-2 activated lymphocytes,but rIL-10 decreased the adhesion rate to 38.12%.Conclusions:The adherent activity of activated lymphocytes is obviously stronger than that of unactivated ones and cytokine may play an important role in regulating lymphocyte adherence to vascular endothelium.
, 百拇医药
Key words Vascular endothelium Activated lymphocyte Adherence Cytokine
近年来国外研究表明[1],进入体内的活化淋巴细胞在粘附、穿越血管内皮细胞过程中受到某些细胞因子和粘附分子的重要调节[2]。我们利用人脐静脉内皮细胞(HUVEC)原代培养物,研究了IL-2活化的淋巴细胞对HUVEC的粘附作用和rIL-1、2、6、8、10和rTNF-α对这一过程的影响,旨在探讨活化淋巴细胞对内皮细胞的粘附机理及影响因素,从而为肿瘤局部继承性免疫治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 脐带标本 剖宫产后健康新生儿脐带,取自本校附属医院妇产科。
, http://www.100md.com
1.1.2 试剂 胰蛋白酶为Sigma公司产品。用RPMI1640培养液配成0.25%浓度,-20℃冻存。rIL-1、2、6、TNF-α购于北京邦定生物医学公司,rIL-10、8由北京医大马大龙教授惠赠。CD3、CD4、CD8、CD56、HLA-DP单抗购于军事医科院生物制剂发展中心。
1.2 方法
1.2.1 HUVEC的分离培养 见参考文献[3]。
1.2.2 活化淋巴细胞的诱导 无菌取脐静脉血分离淋巴细胞,用10%FCS-RPMI1640液洗涤后调整浓度为5×106ml-1,加入rIL-2(1 000 U/ml),放入细胞培养瓶后置37℃、5%CO2条件下培养4 d即为IL-2活化的淋巴细胞。
1.2.3 粘附活性的测定[3] 培养的HUVEC在24孔板上生长至致密融合的单层后,用10%FCS-RPMI1640液洗涤后做粘附试验:在相应孔中加入37℃预温10 min的对照组脐血淋巴细胞(Umbilical cord blood lymphocyte,UCBL)和IL-2活化的UCBL,2×106ml-1,0.5 ml/孔。每一标本设6个复孔。将培养板置37℃、5%CO2孵箱中孵育30 min后,加入含0.1 mol/L EDTA的RPMI1640液洗涤2次,收集各孔上清液及洗涤液,混合后计数细胞,按下式计算出粘附百分率:

, 百拇医药
1.2.4 粘附细胞表型测定 粘附试验结束后,用含0.25%的胰蛋白酶和0.02%EDTA的RPMI1640液洗下粘附的淋巴细胞,离心,沉淀物涂片。用APAAP桥联酶标法测定细胞表型。
1.2.5 统计学处理 采用t检验。
2 结果
2.1 活化淋巴细胞对HUVEC的粘附作用 3次试验中,rIL-2活化的UCBL粘附HUVEC的能力均明显高于对照组,P<0.01,见表1。
表1 三次试验中活化淋巴细胞对HUVEC的粘附作用
Tab.1 Adherence of activated lymphocytes to HUVEC
1
, 百拇医药
2
3
Mean value
Activated UCBL
69.60±1.62
74.52±1.40
56.52±1.91
66.88±9.30
UCBL
29.80±1.70
25.46±1.49
24.54±1.35
, http://www.100md.com
26.60±2.81
Note:
 ±s, n=6,P<0.052.2 细胞因子对活化淋巴细胞粘附HUVEC的影响 将rIL-1(10 U/ml)、rIL-8、10(1 μg/ml),TNF-α(250 U/ml)与内皮细胞作用24 h后,测其对IL-2活化UCBL的粘附能力,同时设未经细胞因子刺激的内皮细胞做对照,结果rIL-1、8和rTNF-α明显增强活化UCBL对HUVEC的粘附,而rIL-10对其有抑制作用,(P<0.05,图1)。
±s, n=6,P<0.052.2 细胞因子对活化淋巴细胞粘附HUVEC的影响 将rIL-1(10 U/ml)、rIL-8、10(1 μg/ml),TNF-α(250 U/ml)与内皮细胞作用24 h后,测其对IL-2活化UCBL的粘附能力,同时设未经细胞因子刺激的内皮细胞做对照,结果rIL-1、8和rTNF-α明显增强活化UCBL对HUVEC的粘附,而rIL-10对其有抑制作用,(P<0.05,图1)。
图1 细胞因子对活化淋巴细胞粘附HUVEC的影响
Fig.1 Effect of cytokine(24 h)on adherence of activated lymphocytes to HUVEC
, http://www.100md.com
2.3 不同作用时间细胞因子对活化淋巴细胞粘附的影响 与对照组相比,用rIL-1、6(10 U/ml), rIL-2(1 000 U/ml),rIL-8、10(1 μg/ml)处理内皮细胞1 h后,rIL-1、2、8即可明显促进活化UCBL对HUVEC的粘附;处理24 h后,rIL-2、6、8可明显促进粘附,而rIL-10具有明显抑制作用,rIL-1组与对照组无明显差别;处理48 h后,rIL-2、8仍显示较强的促粘附作用,而rIL-1、6、10显示明显的抑制作用;处理72 h后,除rIL-2仍具有较强的促粘附作用外,其他细胞因子均显示出深度的抑制。
2.4 粘附淋巴细胞的表型测定 粘附的活化淋巴细胞中,CD3+、CD8+、CD56+、HLA-DP+细胞均明显高于未刺激的淋巴细胞,P<0.05(表2)。不同的细胞因子作用内皮细胞24 h后,rIL-1、8、rTNF-α增加CD4+细胞的粘附;rIL-8降低CD8+细胞的粘附;rIL-10明显抑制CD3+、CD4+、CD56+细胞的粘附;rIL-1明显抑制HLA-DP+细胞的粘附(P<0.05),见表3。
, http://www.100md.com
表2 粘附的淋巴细胞的表型特征
Tab.2 Phenotypes of adherent lymphocytes
CD3
CD4
CD8
CD56
HLA-DP
Activated UCBL
64.11±1.031)
27.60±2.50
34.52±1.771)
, http://www.100md.com
22.57±0.521)
35.17±1.071)
UCBL
48.58±0.46
31.10±0.97
11.27±1.06
6.29±1.15
9.34±0.84
Note:
 ±s,n=6,1) P<0.05表3 细胞因子对粘附的活化淋巴细胞表型的影响
±s,n=6,1) P<0.05表3 细胞因子对粘附的活化淋巴细胞表型的影响, 百拇医药
Tab.3 Effects of cytokine on phenotypes of adherent activated lymphocytes HLA-DP
CD3
CD4
CD8
CD56
rIL-1
62.45±2.07
42.46±3.291)
34.74±0.92
18.66±1.29
, http://www.100md.com
23.94±1.511)
rIL-8
64.68±1.30
38.04±2.321)
24.76±1.751)
20.49±0.54
30.70±1.62
rIL-10
50.23±1.122)
21.61±1.562)
, 百拇医药
33.51±2.11
13.40±1.081)
31.29±1.19
rTNF-α
63.69±2.82
36.85±0.371)
35.16±1.06
21.93±0.74
31.31±1.04
Control
64.11±1.03
, 百拇医药
27.60±2.50
34.52±1.77
22.57±0.52
35.17±1.07
Note:
 ±s,n=6,1) P<0.01,2)P<0.05
±s,n=6,1) P<0.01,2)P<0.053 讨论
血管内皮细胞是组织与血液之间的重要屏障。在继承性免疫治疗中进入机体的活化淋巴细胞欲有效杀伤肿瘤,必须先粘附于血管内皮细胞。内皮细胞可分泌多种细胞因子影响白细胞对内皮的粘附及穿越[4,5]。本研究结果表明,IL-2活化的淋巴细胞对HUVEC的粘附作用明显大于未活化淋巴细胞;IL-1、2、6、8、TNF-α均可增强这一作用,而IL-10则具有明显的抑制效用。
, 百拇医药
研究证实白细胞与内皮细胞的粘附的第一阶段主要依赖选择素家族介导松散粘附;第二阶段是某些信号使粘附的白细胞表达有活性的整合素分子,第三阶段是整合素介导的强有力的粘附[6]。IL-8可作为激发信号,激发中性粒细胞通过β2整合素粘附于内皮细胞,IL-1、TNF-α均可诱导内皮细胞产生IL-8[7]。本文证实IL-8也可增强活化淋巴细胞对内皮的粘附,且最佳作用时间是不长于48 h,IL-1、TNF-α也明显促进活化淋巴细胞的粘附,其机理可能是通过诱生IL-8,促进β2整合素的表达。IL-10是一种新近发现的抑制性细胞因子。可抑制Th1细胞的增殖,抑制IL-2、IL-8、TNF等细胞因子产生[8]。本文表明IL-10可明显抑制活化淋巴细胞粘附HUVEC,且作用时间较长,其作用机理可能是通过抑制IL-8等细胞因子的产生,IL-10是否能直接作用于整合素分子尚需进一步研究。
作者简介:侯桂华,女,38岁,免疫学硕士,副教授,硕士生导师,主要研究肿瘤免疫学
, http://www.100md.com
4 参考文献
1 Kitayama J,Juji T,Atomi Y et al. Transendothelial migration activity of lymphokine-activated killer cells.J Immunol,1993;151:1663
2 Charles R M,Beat A I. Cell adhesion in the immune system.Immunology Today,1993:14(3):99
3 Bianchi G,Sironi M,Ghibaudi E et al. Migration of NK cells across endothelial cell monolayers.J of Immunol,1993;151:5135
4 Jordans P,Ramzis C.Cytokine and endothelial cell biology.Physiological Reviews,1990;70(2):427
, 百拇医药
5 Tanaka Y,David H A,Stephen H.Proteoglycans on endothelial cell present adhesion-induced cytokines to leukocytes.Immunology Today,1993;14(3):111
6 Nancy H,Cornelia B.Structure and function of adhesion receptors in leukocyte trafficking. Immunology Today,1995;16(7):327
7 Guy A Z,Stephen M P,Thomas M M.Endothelial cell interactions with granulocytes:tethering and signaling molecules.Immunology Today,1992;13(3):93
8 金伯泉.细胞因子及其受体.见:金伯泉主编.细胞和分子免疫学.北京:世界图书出版公司,1995:114-115
〔收稿1997-07-16 修回1998-02-04〕, 百拇医药