人淋巴毒素cDNA在大肠杆菌表达的研究①
作者:张津利 朱锡华
单位:张津利 朱锡华 (第三军医大学免疫学教研室,重庆400038)
关键词:人淋巴毒素;表达;大肠杆菌
中国免疫学杂志/990506
摘 要 目的:在大肠杆菌表达人淋巴毒素cDNA。方法:将本室克隆的人淋巴毒素cDNA亚克隆于原核表达载体pBV220,温控法诱导重组菌,SDS-PAGE和Western-blotting检测和鉴定结果,MTT比色法测定重组LT活性。结果:成功地表达了人淋巴毒素重组蛋白;重组蛋白占细菌总蛋白的12%,并具有细胞毒活性,活性单位相当于2×105 U/L菌液。结论:为重组LT的大量生产、临床应用,为进一步研究人LT的生物学功能奠定了基础。
中国图书分类号 Q785
, http://www.100md.com
Expression of cDNA for human lymphotoxin in E.coli
ZHANG Jin-Li,ZHU Xi-Hua.
Department of Immunology,the Third Military Medical University,Chongqing 400038
Abstract Objective:To express human lymphotoxin (LT or TNF-β) cDNA in E.coli.Method: A LT cDNA fragment isolated in this laboratory was subcloned into prokaryotic expression plasmid pBV220 and expressed in E.coli DH5α by temperature shifting from 30℃ to 42℃。The expressed protein(rLT) was confirmed by SDS-PAGE and Western blotting analysis,and its cytotoxic activity on L929 cells was evaluated by MTT colorimeric assay.Results: Recombinant LT had been successfully expressed in E.coli.It has a molecular weight 18~19 kD,approximating to its molecular mass calculated from the primary amino acid sequence,and showed positive reaction with anti-LT monoclonal antibodies and cytotoxic effect on L929 cells. The expressed protein band constituted 12% of total bacterial protein and the cytotoxic activity of rLT was 2×105 U /L of E.coli fermentation broth.Conclusion:These results paved the ways for production,clinical use and researches of LT.
, 百拇医药
Key words Human lymphotoxin Expression E.coli
淋巴毒素(Lymphotoxin,LT)又称肿瘤坏死因子β(TNF-β),它可在体内或体外特异地杀伤多种肿瘤细胞,并具有抗病毒及免疫调节活性,因其细胞毒作用与TNF-α相似,而毒副作用大大低于TNF-α而倍受重视,是一种非常有前途的抗肿瘤和抗病毒生物制剂[1]。本实验将本室克隆的人淋巴毒素cDNA[2]构建于原核表达载体,以期在大肠杆菌表达人淋巴毒素(rLT)。
1 材料与方法
1.1 pBV-LT表达载体的构建 原核表达载体pBV220由中国预防医学科学院病毒所提供[3],经内切酶SmaI切成双平端,同时将克隆于pUC18-LT中的去信号肽LTcDNA[2]经HindⅢ/Nco I双酶切,Klenow酶填平,载体与LTcDNA按常规方法连接并转化大肠杆菌DH5α,地高辛标记探针菌落原位杂交法初步筛选阳性重组子,可疑阳性重组子经酶切进一步鉴定并确定插入方向[4],获得的正向阳性重组子命名为pBV-LT。
, http://www.100md.com
1.2 人LT cDNA在大肠杆菌的诱导表达 将含有pBV-LT的DH5α在30℃培养过夜,按1∶100稀释至LB培养液中,继续在30℃摇床培养至OD0.4~0.6,迅速转至42℃摇床诱生2~6 h,同时作未诱生菌和空载体对照[3]。
1.3 重组人LT的检测与鉴定 于诱生不同时相离心收集菌体,以1×SDS上样缓冲液溶解并煮沸后行SDS-PAGE,考马斯亮蓝染色,脱色后观察结果,并在DU-600型紫外分光光度计上作薄层扫描分析,以计算阳性蛋白带的相对比例。Western-blotting按常规方法进行,以抗LT McAb(宝灵曼产品)与转移至NC膜上的重组LT蛋白带作免疫印迹反应[4]。
1.4 重组LT活性测定 按文献方法分离包涵体[4]。收集42℃诱导5 h的细菌100 ml,离心后每克湿菌加3 ml TE Buffer悬浮,超声粉碎、变性、复性后浓缩至1 ml,过滤除菌、备用。MTT比色法测定LT对培养的L929细胞的细胞毒活性[5],以已知活性单位的rTNF-α(本校大坪医院产品,活性单位20 000 U/ml)为阳性对照。
, 百拇医药
2 结果
2.1 阳性重组子的筛选与鉴定 从108个pBV220/LT转化的菌落中经地高辛标记探针筛选出5个阳性菌落,质粒快速小量抽提后经RE酶切确认,这些阳性菌落均为带有插入片段的阳性重组子,其中1个为正向插入,4个为反向插入。
2.2 重组LT的表达与鉴定 pBV-LT经诱导后,在18~19 kD处出现一新的蛋白带,其表达高峰在诱导后4~6 h,包涵体样品在同样位置有一较浓的蛋白带,与文献报道的重组LT分子量大小一致[5],薄层扫描分析表明,重组LT蛋白带占细菌总蛋白量的12%(图1A),Western-blotting显示,仅经诱导的pBV-LT在18~19 kD处有阳性反应,表明前述蛋白带确属人淋巴毒素蛋白(图1B)。
2.3 重组蛋白的生物学活性 经MTT比色法测定,rLT与rTNF-α活性单位相当,均为20 000 U/ml,此1 ml rLT为100 ml菌液所得,因此相当于2×105 U/L菌液。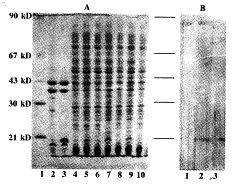
, http://www.100md.com
图1 重组LT的表达与鉴定
Fig.1 Expression and identification of rLT
Note:A.SDS-PAGE:Lanel,protein molecular weight markers,Lanes2 and3,pellet fraction of sonicated cells carrying the control plasmid(lane2) or pBV-LT(lane3).Lanes4,6,8 and Lanes5,7,9,total cell lysate of cells harboring pBV-LT grown at 30℃ or 42℃ for 2,4,6 h respectively.Lane10,total cell lysate of cells harboring pBV220 grown at 42℃ for 4 h.B.Western blotting.Lanes1,2,3 total cell lysate of cells harboring respectively pBV220(Lane 1,grown at 42℃ for 4 h)and pBV-LT(Lanes 2,3,grown at 42℃ for 4 and 6 h)
, http://www.100md.com
3 讨论
本实验将本室克隆的人淋巴毒素cDNA构建于原核表达载体pBV220,筛选出的阳性重组子pBV-LT经温控诱导,成功地表达了人淋巴毒素重组蛋白,该重组蛋白占细菌总蛋白的12%,并具有细胞毒活性,其活性单位相当于2×105 U/L菌液。本实验为rLT的大量生产和临床应用,以及进一步研究LT的功能奠定了基础。
本实验rLT表达量占细胞总蛋白量的12%,尚有进一步提高的必要,试用合适的高效表达载体,调整SD与ATG间的距离可能是有效的途径。另外,据文献报道,人LTcDNA具有多态性,即在其成熟肽第26位氨基酸有天冬酰胺(Asn,密码子AAC)和酪氨酸(Thr,密码子TAC)之分,而26位为Thr的cDNA,其蛋白表达量明显高于该氨基酸为Asn者[6],本实验克隆的人LTcDNA正好是后一种形式。因此,通过定点突变将该编码基因由AAC改为TAC,有可能提高rLT的表达水平,而建立高效的rLT纯化方法也是获得高活性重组蛋白的重要条件,这些均是下一步将要开展的工作。
, 百拇医药
①全军“八五”重点课题资助项目
作者简介:张津利,男,34岁,博士,主要从事细胞因子研究;
朱锡华,男,76岁,教授,博导,主要从事分子免疫学研究
4 参考文献
[1] Ruddle N H.Tumor necrosis factor(TNF-α)and lymphotoxin(TNF-β).Curr Opin Immunol,1992;4:327
[2] 张津利,朱锡华.人淋巴毒素cDNA克隆及在大肠杆菌表达的研究(博士论文摘要).第三军医大学学报,1997;19(1):58
[3] 张智清,姚立红,侯云德.含PRPL启动子的原核表达载体的组建及其应用.病毒学报,1990;6(2):111
, http://www.100md.com
[4] 金冬雁,黎孟枫译.分子克隆实验指南.第2版.北京:科学出版社,1992:602-691
[5] Schoenfeld H J,Poeschl B,Frey J R et al.Efficient purification of recombinant human tumor necrosis factor β from Escherichia coli yields biologically active protein with a trimeric structure that binds to both tumor necrosis factor receptors.J Bio Chem,1991;266:3863
[6] Messer G U,Spengler M C,Jung G et al.Polymorphic stucture of the tumor necrosis factor (TNF)locus:an NcoI polymorphism in the first intron of the human TNF-β gene correlates with a variant amino acid in position 26 and a reduced level of TNF-β production.J Exp Med,1991;173:209
〔收稿1997-03-16 修回1998-02-04〕, 百拇医药
单位:张津利 朱锡华 (第三军医大学免疫学教研室,重庆400038)
关键词:人淋巴毒素;表达;大肠杆菌
中国免疫学杂志/990506
摘 要 目的:在大肠杆菌表达人淋巴毒素cDNA。方法:将本室克隆的人淋巴毒素cDNA亚克隆于原核表达载体pBV220,温控法诱导重组菌,SDS-PAGE和Western-blotting检测和鉴定结果,MTT比色法测定重组LT活性。结果:成功地表达了人淋巴毒素重组蛋白;重组蛋白占细菌总蛋白的12%,并具有细胞毒活性,活性单位相当于2×105 U/L菌液。结论:为重组LT的大量生产、临床应用,为进一步研究人LT的生物学功能奠定了基础。
中国图书分类号 Q785
, http://www.100md.com
Expression of cDNA for human lymphotoxin in E.coli
ZHANG Jin-Li,ZHU Xi-Hua.
Department of Immunology,the Third Military Medical University,Chongqing 400038
Abstract Objective:To express human lymphotoxin (LT or TNF-β) cDNA in E.coli.Method: A LT cDNA fragment isolated in this laboratory was subcloned into prokaryotic expression plasmid pBV220 and expressed in E.coli DH5α by temperature shifting from 30℃ to 42℃。The expressed protein(rLT) was confirmed by SDS-PAGE and Western blotting analysis,and its cytotoxic activity on L929 cells was evaluated by MTT colorimeric assay.Results: Recombinant LT had been successfully expressed in E.coli.It has a molecular weight 18~19 kD,approximating to its molecular mass calculated from the primary amino acid sequence,and showed positive reaction with anti-LT monoclonal antibodies and cytotoxic effect on L929 cells. The expressed protein band constituted 12% of total bacterial protein and the cytotoxic activity of rLT was 2×105 U /L of E.coli fermentation broth.Conclusion:These results paved the ways for production,clinical use and researches of LT.
, 百拇医药
Key words Human lymphotoxin Expression E.coli
淋巴毒素(Lymphotoxin,LT)又称肿瘤坏死因子β(TNF-β),它可在体内或体外特异地杀伤多种肿瘤细胞,并具有抗病毒及免疫调节活性,因其细胞毒作用与TNF-α相似,而毒副作用大大低于TNF-α而倍受重视,是一种非常有前途的抗肿瘤和抗病毒生物制剂[1]。本实验将本室克隆的人淋巴毒素cDNA[2]构建于原核表达载体,以期在大肠杆菌表达人淋巴毒素(rLT)。
1 材料与方法
1.1 pBV-LT表达载体的构建 原核表达载体pBV220由中国预防医学科学院病毒所提供[3],经内切酶SmaI切成双平端,同时将克隆于pUC18-LT中的去信号肽LTcDNA[2]经HindⅢ/Nco I双酶切,Klenow酶填平,载体与LTcDNA按常规方法连接并转化大肠杆菌DH5α,地高辛标记探针菌落原位杂交法初步筛选阳性重组子,可疑阳性重组子经酶切进一步鉴定并确定插入方向[4],获得的正向阳性重组子命名为pBV-LT。
, http://www.100md.com
1.2 人LT cDNA在大肠杆菌的诱导表达 将含有pBV-LT的DH5α在30℃培养过夜,按1∶100稀释至LB培养液中,继续在30℃摇床培养至OD0.4~0.6,迅速转至42℃摇床诱生2~6 h,同时作未诱生菌和空载体对照[3]。
1.3 重组人LT的检测与鉴定 于诱生不同时相离心收集菌体,以1×SDS上样缓冲液溶解并煮沸后行SDS-PAGE,考马斯亮蓝染色,脱色后观察结果,并在DU-600型紫外分光光度计上作薄层扫描分析,以计算阳性蛋白带的相对比例。Western-blotting按常规方法进行,以抗LT McAb(宝灵曼产品)与转移至NC膜上的重组LT蛋白带作免疫印迹反应[4]。
1.4 重组LT活性测定 按文献方法分离包涵体[4]。收集42℃诱导5 h的细菌100 ml,离心后每克湿菌加3 ml TE Buffer悬浮,超声粉碎、变性、复性后浓缩至1 ml,过滤除菌、备用。MTT比色法测定LT对培养的L929细胞的细胞毒活性[5],以已知活性单位的rTNF-α(本校大坪医院产品,活性单位20 000 U/ml)为阳性对照。
, 百拇医药
2 结果
2.1 阳性重组子的筛选与鉴定 从108个pBV220/LT转化的菌落中经地高辛标记探针筛选出5个阳性菌落,质粒快速小量抽提后经RE酶切确认,这些阳性菌落均为带有插入片段的阳性重组子,其中1个为正向插入,4个为反向插入。
2.2 重组LT的表达与鉴定 pBV-LT经诱导后,在18~19 kD处出现一新的蛋白带,其表达高峰在诱导后4~6 h,包涵体样品在同样位置有一较浓的蛋白带,与文献报道的重组LT分子量大小一致[5],薄层扫描分析表明,重组LT蛋白带占细菌总蛋白量的12%(图1A),Western-blotting显示,仅经诱导的pBV-LT在18~19 kD处有阳性反应,表明前述蛋白带确属人淋巴毒素蛋白(图1B)。
2.3 重组蛋白的生物学活性 经MTT比色法测定,rLT与rTNF-α活性单位相当,均为20 000 U/ml,此1 ml rLT为100 ml菌液所得,因此相当于2×105 U/L菌液。

, http://www.100md.com
图1 重组LT的表达与鉴定
Fig.1 Expression and identification of rLT
Note:A.SDS-PAGE:Lanel,protein molecular weight markers,Lanes2 and3,pellet fraction of sonicated cells carrying the control plasmid(lane2) or pBV-LT(lane3).Lanes4,6,8 and Lanes5,7,9,total cell lysate of cells harboring pBV-LT grown at 30℃ or 42℃ for 2,4,6 h respectively.Lane10,total cell lysate of cells harboring pBV220 grown at 42℃ for 4 h.B.Western blotting.Lanes1,2,3 total cell lysate of cells harboring respectively pBV220(Lane 1,grown at 42℃ for 4 h)and pBV-LT(Lanes 2,3,grown at 42℃ for 4 and 6 h)
, http://www.100md.com
3 讨论
本实验将本室克隆的人淋巴毒素cDNA构建于原核表达载体pBV220,筛选出的阳性重组子pBV-LT经温控诱导,成功地表达了人淋巴毒素重组蛋白,该重组蛋白占细菌总蛋白的12%,并具有细胞毒活性,其活性单位相当于2×105 U/L菌液。本实验为rLT的大量生产和临床应用,以及进一步研究LT的功能奠定了基础。
本实验rLT表达量占细胞总蛋白量的12%,尚有进一步提高的必要,试用合适的高效表达载体,调整SD与ATG间的距离可能是有效的途径。另外,据文献报道,人LTcDNA具有多态性,即在其成熟肽第26位氨基酸有天冬酰胺(Asn,密码子AAC)和酪氨酸(Thr,密码子TAC)之分,而26位为Thr的cDNA,其蛋白表达量明显高于该氨基酸为Asn者[6],本实验克隆的人LTcDNA正好是后一种形式。因此,通过定点突变将该编码基因由AAC改为TAC,有可能提高rLT的表达水平,而建立高效的rLT纯化方法也是获得高活性重组蛋白的重要条件,这些均是下一步将要开展的工作。
, 百拇医药
①全军“八五”重点课题资助项目
作者简介:张津利,男,34岁,博士,主要从事细胞因子研究;
朱锡华,男,76岁,教授,博导,主要从事分子免疫学研究
4 参考文献
[1] Ruddle N H.Tumor necrosis factor(TNF-α)and lymphotoxin(TNF-β).Curr Opin Immunol,1992;4:327
[2] 张津利,朱锡华.人淋巴毒素cDNA克隆及在大肠杆菌表达的研究(博士论文摘要).第三军医大学学报,1997;19(1):58
[3] 张智清,姚立红,侯云德.含PRPL启动子的原核表达载体的组建及其应用.病毒学报,1990;6(2):111
, http://www.100md.com
[4] 金冬雁,黎孟枫译.分子克隆实验指南.第2版.北京:科学出版社,1992:602-691
[5] Schoenfeld H J,Poeschl B,Frey J R et al.Efficient purification of recombinant human tumor necrosis factor β from Escherichia coli yields biologically active protein with a trimeric structure that binds to both tumor necrosis factor receptors.J Bio Chem,1991;266:3863
[6] Messer G U,Spengler M C,Jung G et al.Polymorphic stucture of the tumor necrosis factor (TNF)locus:an NcoI polymorphism in the first intron of the human TNF-β gene correlates with a variant amino acid in position 26 and a reduced level of TNF-β production.J Exp Med,1991;173:209
〔收稿1997-03-16 修回1998-02-04〕, 百拇医药