牛膝多糖对人胸腔巨噬细胞的激活作用①
作者:吕建新 俞 康 金丽琴 袁 谦 谢克俭 陆永绥
单位:吕建新 袁 谦 谢克俭 陆永绥 (温州医学院检验医学系,温州325027);俞 康 温州医学院附属第一医院血液科,温州325000;金丽琴 温州医学院生物化学教研室,温州325027
关键词:牛膝多糖;胸腔巨噬细胞;酶活性;细胞因子;激活作用
中国免疫学杂志990916 摘 要 目的:研究牛膝多糖对巨噬细胞的激活作用。方法:0.312、0.625、1.250、2.500和5.000 mg/ml牛膝多糖对体外培养的人胸腔巨噬细胞进行诱导培养24 h,用全自动生化分析仪测定胸腔巨噬细胞内乳酸脱氢酶与酸性磷酸酶活性,用放射免疫分析法测定胸腔巨噬细胞内肿瘤坏死因子-α与白细胞介素-6的含量。结果:牛膝多糖能上调胸腔巨噬细胞内乳酸脱氢酶和酸性磷酸酶活性,并能显著诱导胸腔巨噬细胞表达肿瘤坏死因子-α和白细胞介素-6,而且对肿瘤坏死因子-α的诱导表达具有显著的剂量效应。结论:牛膝多糖可诱导巨噬细胞表达细胞因子,并对巨噬细胞具有激活作用。
, 百拇医药
中国图书分类号 R392.12
The activated effect of achyrathes bidentata polysaccharides on thoracic cavity macrophages of human
LU Jian-Xin, YU Kang, JIN Li-Qin et al.
Department of Clinical Laboratory Medicine, Wenzhou Medical College, Wenzhou 325027
Abstract Objective:To study the activated effects of Achyrathes bidentata polysaccharides (ABPS) on thoracic cavity macrophages of human (hTMφ) .Methods:After the hTMφ were cultured with 0.312, 0.625, 1.250, 2.500, 5.000 mg/ml Achyrathes bidentata polysaccharides (ABPS)-RPMI1640 for 24 h in vitro. The activities of lactate dehydrogenase (LDH) and acid phosphatase (ACP) in the hTMφ were detected by automatic biochemistry analyzer, and the expression levels of tumor necrosis factor alpha (TNF-α) and interleukin-6 (IL-6) in the hTMφ were analyzed by radioimmunoassay. Results:The activities of LDH and ACP increased in the hTMφ induced by ABPS, and the expression levels of TNF-α and IL-6 in the hTMφ induced by ABPS increased markedly too, and the expression of TNF-α had significantly dose effect. Conclusion:ABPS can induce the expression of cytokines in the macrophages, and activate the macrophages.
, 百拇医药
Key words Achyrathes bidentata polysaccharides Thoracic cavity macrophage Enzyme activity Cytokine Activation
牛膝多糖(Achyranthes bidentata polysaccharides,ABPS)是从牛膝(Achyranthes bidentata blume)根中分离提取得到的一种小分子水溶性的多糖化合物,其化学结构已经明确,糖基组成为果糖和葡萄糖,糖基摩尔比为8.7:1.0,平均分子量为1 400。已有研究报道ABPS对大鼠、小鼠均具有免疫调节作用,并提示ABPS可以启动和活化巨噬细胞(macrophages,Mφ)[1]。本文研究ABPS对体外培养的人胸腔巨噬细胞(thoracic cavity macrophages ,TMφ)、内乳酸脱氢酶(lactate dehydrogenase,LDH,EC 1 ,1 ,1 ,27 )和酸性磷酸酶(acid phosphatase,ACP, EC 3,1,3,2 )活性的调节作用,以及ABPS对人TMφ表达肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6
, http://www.100md.com
1 材料与方法
1.1 药品与试剂 ABPS为白色结晶粉末,纯度为99.9%,由中国科学院上海有机化学研究所田庚元教授提供;RPMI1640细胞培养液购自Gibco公司,TNF-α试剂盒、IL-6试剂盒由解放军总医院东亚免疫技术研究所提供; LDH试剂盒由上海长征医学科学技术有限公司生产;ACP试剂盒为本系自配。
1.2 ABPS细胞培养液配制 准确称取ABPS 1.000 g溶解于适量RPMI1640细胞培养液,用5%NaHCO3 调pH至7.2~7.4,定容至100 ml,蔡氏滤器0.22 μm微孔滤膜无菌过滤,配制成含10%新生牛血清的10 mg/ml ABPS-RPMI1640细胞培养液,再用含10%新生牛血清的RPMI1640稀释成ABPS浓度为5.000,2.500,1.250,0.625,0.312 mg/ml的RPMI1640细胞培养液。
1.3 TMφ的分离、培养与破碎 抽取多发性骨髓瘤病人左侧胸腔积液,总量为650 ml,无菌室内用50 ml圆筒离心管分次离心收集沉淀细胞,用含10%新生牛血清的RPMI1640悬浮沉淀细胞,并在流式细胞仪(美国 BETON DICKINSON 公司产品,型号为FACSCal:bnr)上计数调节单核细胞6×105 ml-1, 加入96孔细胞培养板,每孔0.3 ml,于37℃培养箱培养2 h,弃上清及非贴壁的细胞,贴壁的为TMφ,加不同浓度的ABPS-RPMI1640细胞培养液,每孔0.3 ml,每种浓度重复6孔,37℃培养24 h ,吸去每孔中的细胞培养上清液,用Hank’s液洗涤贴壁的TMφ后,每孔加0.2 ml双蒸水,超声波清洗机上振摇2 min,置-30℃冰箱,通过-30℃、+30℃反复冻融5次破碎Mφ,制成破碎的TMφ悬液。
, 百拇医药
1.4 LDH测定 采用Wahlefeld方法,以L-乳酸为底物全自动生化分析仪上速率法测定NADH+H+的生成(全自动生化分析仪由日本日立公司制造,型号为7170),反应体系为:温度37℃,破碎的TMφ悬液18 μl,延迟时间30 s,反应总体积360 μl,每隔15 s测1点,共测34点,以19~24连续6点直线回归求值。酶活力单位采用国际单位(U),即每升破碎的TMφ悬液37℃每分钟使1 μmol乳酸转化为丙酮酸所需的酶量为1 U。
1.5 ACP测定 采用全自动生化分析仪(日立7170)双试剂终点法,R1为基质液(对硝基苯酚磷酸酯-柠檬酸buf,pH5.0),R4为1 mol/L NaOH,λ1 405 nm,λ2 546 nm,反应体系为:破碎的TMφ悬液10 μl,R1 200 μl,反应10 min (测定34点) 后加R4 100 μl终止反应求值,酶活力单位采用国际单位(U), 即每升破碎的TMφ悬液在pH5.0、37℃、每分钟水解1 μmol 对硝基苯酚磷酸酯为对硝基酚所需的酶量为1 U。
, 百拇医药
1.6 TNF-α和IL-6测定 采用放射免疫分析法,操作按试剂盒说明书。
1.7 统计分析 数据以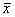 ±s表示,用t检验分析组间的显著性差异。
±s表示,用t检验分析组间的显著性差异。
2 结 果
2.1 ABPS对TMφ酶活性的调节作用 表1所示,ABPS的5种不同浓度均对TMφ内LDH活性具有上调作用,其中0.625和1.250 mg/ml ABPS浓度对LDH活性的调节作用与对照组相比具有显著性差异(P<0.05),这一结果表明ABPS对TMφ内LDH活性具有上调作用,但无显著的剂量效应;ABPS对TMφ内ACP活性虽有上调作用,但上调的幅度较小与对照组相比均无显著性差异(P>0.05)。
表1 ABPS对TMφ酶活性的调节作用(n=6)
, http://www.100md.com
Tab.1 Regulation effects of ABPS on the enzymes activity of TMφ(n=6) Concentration of ABPS(mg/ml)
LDH(U)
ACP(U)
0
5.44±1.84
0.96±0.57
0.312
7.50±2.49
1.23±0.48
0.625
, http://www.100md.com
9.17±2.481)
1.20±0.24
1.250
9.75±3.511)
1.22±0.41
2.500
8.92±4.04
1.07±0.46
5.000
7.92±2.80
1.13±0.54
, http://www.100md.com
Note: 1)P<0.025,compared with 0 mg/ml ABPS (control group)
2.2 ABPS对TMφ表达TNF-α与IL-6的诱导作用 表2所示,ABPS 5种不同的浓度均可非常显著地诱导TMφ表达TNF-α和IL-6,其中对 TNF-α的诱导表达随着ABPS浓度的增加而增加,具有显著的剂量效应,而对IL-6的诱导表达却没有显著的剂量效应。
表2 ABPS对TMφ表达TNF-α与IL-6 诱导作用(n=6)
Tab.2 Induced expression effects of ABPS on the TNF-α and IL-6 of
TMφ(n=6) Concentration of ABPS (mg/ml)
, http://www.100md.com
TNF-α(ng/ml)
IL-6(ng/ml)
0
0.447±0.045
0.276±0.057
0.312
0.954±0.0662)
0.317±0.075
0.625
1.671±0.2762)
0.486±0.0412)
, 百拇医药
1.250
1.884±0.2882)
0.500±0.0592)
2.500
2.342±0.0542)
0.412±0.0491)
5.000
2.538±0.3042)
0.425±0.0412)
Note: 1)P<0.01,2)P<0.001,compared with 0 mg/ml ABPS (control group)
, http://www.100md.com
3 讨 论
有许多研究表明LDH与ACP是Mφ的标志酶,LDH与ACP活性随着Mφ的激活而升高,又随着Mφ的抑制而降低[2,3],ABPS可使TMφ LDH和ACP活性升高,表明ABPS对TMφ具有激活作用。
TNF-α主要由 Mφ分泌的,Mφ分泌TNF-α 往往需要经历启动和诱出两个阶段,其中启动阶段主要是引起Mφ激活,也就是说Mφ内TNF-α的表达依赖于Mφ的激活,Mφ激活剂LPS、BCG均可诱导Mφ大量分泌TNF-α也证明了这一点[4,5]。鉴于ABPS可诱导TMφ表达TNF-α,而且诱导表达作用随着ABPS浓度增大而增强,具有非常显著的剂量效应,因此可以认为ABPS确是TMφ的激活剂。
IL-6主要由淋巴细胞和单核细胞产生,经LPS、PHA等诱导激活的Mφ可大量表达IL-6[6,7]。ABPS可诱导TMφ表达IL-6,这又表明 ABPS可激活Mφ,但由于IL-6表达与ABPS浓度没有剂量效应关系,因此,可以认为ABPS对IL-6的诱导表达很可能是间接的,可能是TNF-α等表达后的网络调控所致,这有待进一步研究。
, 百拇医药
有人认为多糖的免疫调节作用需要其它物质的介导,因此在体外很难或不能起作用,而本研究结果表明ABPS在没有其它物质介导时能激活TMφ并诱导TMφ表达TNF-α和IL-6,这提示了ABPS是Mφ激活的启动剂,与文献[1]的结果一致。因此,多糖在体外的免疫调节作用是否一定需要介导尚待进一步研究阐明。
①浙江省自然科学基金资助项目(№.397510)
作者简介:吕建新,男,35岁,副教授,硕士生导师,主要研究细胞免疫功能调控及基因诊断
(interleukin-6,IL-6)的诱导作用,从而探讨ABPS对Mφ的激活作用。
4 参考文献
1 李宗楷,李电东.牛膝多糖的免疫调节作用.药学学报,1997;32(12)∶881
, 百拇医药
2 吕建新,金丽琴,陈国荣 et al. 细脚拟青霉对大鼠腹腔巨噬细胞的激活作用.中国免疫学杂志,1997;3(3)∶139
3 Cohn Z A.The activation of mononuclear phagocytes: Fact,fancy,and future. J Immunol,1978;121:813
4 Dong Z,Lu S,Zhang Y. Effects of pretreatment with protein kinase C ac-tivators on macrophage activation for tumor cytotoxicity, secretion of tumor necrosis factor, and its mRNA expression. Immunobiology, 1989;179∶382
5 Dong Z, Qi X, Fidler I J.Tyrosine phosphorylation of mitogen-activated protein kinases is necessary for activation of murine macrophages by natural and synthetic bacterial products. J Exp Med, 1993; 177∶1071
, 百拇医药
6 Scamurra R, Arriaga C, Sprunger L et al. Regulation of interleukin-6 expression in porcine immune cells. J Interferon Cytokine Res, 1996;16∶289
7 Ayala A, Deol Z K, Lehman D L et al. Dose endotoxin play a major role in inducing the depression of macrophage function during polymicrobial sepsis. Arch Surg,1995;130∶1178
〔收稿日期:1998-09-11 修稿蟆:1999-02-12〕, http://www.100md.com
单位:吕建新 袁 谦 谢克俭 陆永绥 (温州医学院检验医学系,温州325027);俞 康 温州医学院附属第一医院血液科,温州325000;金丽琴 温州医学院生物化学教研室,温州325027
关键词:牛膝多糖;胸腔巨噬细胞;酶活性;细胞因子;激活作用
中国免疫学杂志990916 摘 要 目的:研究牛膝多糖对巨噬细胞的激活作用。方法:0.312、0.625、1.250、2.500和5.000 mg/ml牛膝多糖对体外培养的人胸腔巨噬细胞进行诱导培养24 h,用全自动生化分析仪测定胸腔巨噬细胞内乳酸脱氢酶与酸性磷酸酶活性,用放射免疫分析法测定胸腔巨噬细胞内肿瘤坏死因子-α与白细胞介素-6的含量。结果:牛膝多糖能上调胸腔巨噬细胞内乳酸脱氢酶和酸性磷酸酶活性,并能显著诱导胸腔巨噬细胞表达肿瘤坏死因子-α和白细胞介素-6,而且对肿瘤坏死因子-α的诱导表达具有显著的剂量效应。结论:牛膝多糖可诱导巨噬细胞表达细胞因子,并对巨噬细胞具有激活作用。
, 百拇医药
中国图书分类号 R392.12
The activated effect of achyrathes bidentata polysaccharides on thoracic cavity macrophages of human
LU Jian-Xin, YU Kang, JIN Li-Qin et al.
Department of Clinical Laboratory Medicine, Wenzhou Medical College, Wenzhou 325027
Abstract Objective:To study the activated effects of Achyrathes bidentata polysaccharides (ABPS) on thoracic cavity macrophages of human (hTMφ) .Methods:After the hTMφ were cultured with 0.312, 0.625, 1.250, 2.500, 5.000 mg/ml Achyrathes bidentata polysaccharides (ABPS)-RPMI1640 for 24 h in vitro. The activities of lactate dehydrogenase (LDH) and acid phosphatase (ACP) in the hTMφ were detected by automatic biochemistry analyzer, and the expression levels of tumor necrosis factor alpha (TNF-α) and interleukin-6 (IL-6) in the hTMφ were analyzed by radioimmunoassay. Results:The activities of LDH and ACP increased in the hTMφ induced by ABPS, and the expression levels of TNF-α and IL-6 in the hTMφ induced by ABPS increased markedly too, and the expression of TNF-α had significantly dose effect. Conclusion:ABPS can induce the expression of cytokines in the macrophages, and activate the macrophages.
, 百拇医药
Key words Achyrathes bidentata polysaccharides Thoracic cavity macrophage Enzyme activity Cytokine Activation
牛膝多糖(Achyranthes bidentata polysaccharides,ABPS)是从牛膝(Achyranthes bidentata blume)根中分离提取得到的一种小分子水溶性的多糖化合物,其化学结构已经明确,糖基组成为果糖和葡萄糖,糖基摩尔比为8.7:1.0,平均分子量为1 400。已有研究报道ABPS对大鼠、小鼠均具有免疫调节作用,并提示ABPS可以启动和活化巨噬细胞(macrophages,Mφ)[1]。本文研究ABPS对体外培养的人胸腔巨噬细胞(thoracic cavity macrophages ,TMφ)、内乳酸脱氢酶(lactate dehydrogenase,LDH,EC 1 ,1 ,1 ,27 )和酸性磷酸酶(acid phosphatase,ACP, EC 3,1,3,2 )活性的调节作用,以及ABPS对人TMφ表达肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6
, http://www.100md.com
1 材料与方法
1.1 药品与试剂 ABPS为白色结晶粉末,纯度为99.9%,由中国科学院上海有机化学研究所田庚元教授提供;RPMI1640细胞培养液购自Gibco公司,TNF-α试剂盒、IL-6试剂盒由解放军总医院东亚免疫技术研究所提供; LDH试剂盒由上海长征医学科学技术有限公司生产;ACP试剂盒为本系自配。
1.2 ABPS细胞培养液配制 准确称取ABPS 1.000 g溶解于适量RPMI1640细胞培养液,用5%NaHCO3 调pH至7.2~7.4,定容至100 ml,蔡氏滤器0.22 μm微孔滤膜无菌过滤,配制成含10%新生牛血清的10 mg/ml ABPS-RPMI1640细胞培养液,再用含10%新生牛血清的RPMI1640稀释成ABPS浓度为5.000,2.500,1.250,0.625,0.312 mg/ml的RPMI1640细胞培养液。
1.3 TMφ的分离、培养与破碎 抽取多发性骨髓瘤病人左侧胸腔积液,总量为650 ml,无菌室内用50 ml圆筒离心管分次离心收集沉淀细胞,用含10%新生牛血清的RPMI1640悬浮沉淀细胞,并在流式细胞仪(美国 BETON DICKINSON 公司产品,型号为FACSCal:bnr)上计数调节单核细胞6×105 ml-1, 加入96孔细胞培养板,每孔0.3 ml,于37℃培养箱培养2 h,弃上清及非贴壁的细胞,贴壁的为TMφ,加不同浓度的ABPS-RPMI1640细胞培养液,每孔0.3 ml,每种浓度重复6孔,37℃培养24 h ,吸去每孔中的细胞培养上清液,用Hank’s液洗涤贴壁的TMφ后,每孔加0.2 ml双蒸水,超声波清洗机上振摇2 min,置-30℃冰箱,通过-30℃、+30℃反复冻融5次破碎Mφ,制成破碎的TMφ悬液。
, 百拇医药
1.4 LDH测定 采用Wahlefeld方法,以L-乳酸为底物全自动生化分析仪上速率法测定NADH+H+的生成(全自动生化分析仪由日本日立公司制造,型号为7170),反应体系为:温度37℃,破碎的TMφ悬液18 μl,延迟时间30 s,反应总体积360 μl,每隔15 s测1点,共测34点,以19~24连续6点直线回归求值。酶活力单位采用国际单位(U),即每升破碎的TMφ悬液37℃每分钟使1 μmol乳酸转化为丙酮酸所需的酶量为1 U。
1.5 ACP测定 采用全自动生化分析仪(日立7170)双试剂终点法,R1为基质液(对硝基苯酚磷酸酯-柠檬酸buf,pH5.0),R4为1 mol/L NaOH,λ1 405 nm,λ2 546 nm,反应体系为:破碎的TMφ悬液10 μl,R1 200 μl,反应10 min (测定34点) 后加R4 100 μl终止反应求值,酶活力单位采用国际单位(U), 即每升破碎的TMφ悬液在pH5.0、37℃、每分钟水解1 μmol 对硝基苯酚磷酸酯为对硝基酚所需的酶量为1 U。
, 百拇医药
1.6 TNF-α和IL-6测定 采用放射免疫分析法,操作按试剂盒说明书。
1.7 统计分析 数据以
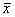 ±s表示,用t检验分析组间的显著性差异。
±s表示,用t检验分析组间的显著性差异。2 结 果
2.1 ABPS对TMφ酶活性的调节作用 表1所示,ABPS的5种不同浓度均对TMφ内LDH活性具有上调作用,其中0.625和1.250 mg/ml ABPS浓度对LDH活性的调节作用与对照组相比具有显著性差异(P<0.05),这一结果表明ABPS对TMφ内LDH活性具有上调作用,但无显著的剂量效应;ABPS对TMφ内ACP活性虽有上调作用,但上调的幅度较小与对照组相比均无显著性差异(P>0.05)。
表1 ABPS对TMφ酶活性的调节作用(n=6)
, http://www.100md.com
Tab.1 Regulation effects of ABPS on the enzymes activity of TMφ(n=6) Concentration of ABPS(mg/ml)
LDH(U)
ACP(U)
0
5.44±1.84
0.96±0.57
0.312
7.50±2.49
1.23±0.48
0.625
, http://www.100md.com
9.17±2.481)
1.20±0.24
1.250
9.75±3.511)
1.22±0.41
2.500
8.92±4.04
1.07±0.46
5.000
7.92±2.80
1.13±0.54
, http://www.100md.com
Note: 1)P<0.025,compared with 0 mg/ml ABPS (control group)
2.2 ABPS对TMφ表达TNF-α与IL-6的诱导作用 表2所示,ABPS 5种不同的浓度均可非常显著地诱导TMφ表达TNF-α和IL-6,其中对 TNF-α的诱导表达随着ABPS浓度的增加而增加,具有显著的剂量效应,而对IL-6的诱导表达却没有显著的剂量效应。
表2 ABPS对TMφ表达TNF-α与IL-6 诱导作用(n=6)
Tab.2 Induced expression effects of ABPS on the TNF-α and IL-6 of
TMφ(n=6) Concentration of ABPS (mg/ml)
, http://www.100md.com
TNF-α(ng/ml)
IL-6(ng/ml)
0
0.447±0.045
0.276±0.057
0.312
0.954±0.0662)
0.317±0.075
0.625
1.671±0.2762)
0.486±0.0412)
, 百拇医药
1.250
1.884±0.2882)
0.500±0.0592)
2.500
2.342±0.0542)
0.412±0.0491)
5.000
2.538±0.3042)
0.425±0.0412)
Note: 1)P<0.01,2)P<0.001,compared with 0 mg/ml ABPS (control group)
, http://www.100md.com
3 讨 论
有许多研究表明LDH与ACP是Mφ的标志酶,LDH与ACP活性随着Mφ的激活而升高,又随着Mφ的抑制而降低[2,3],ABPS可使TMφ LDH和ACP活性升高,表明ABPS对TMφ具有激活作用。
TNF-α主要由 Mφ分泌的,Mφ分泌TNF-α 往往需要经历启动和诱出两个阶段,其中启动阶段主要是引起Mφ激活,也就是说Mφ内TNF-α的表达依赖于Mφ的激活,Mφ激活剂LPS、BCG均可诱导Mφ大量分泌TNF-α也证明了这一点[4,5]。鉴于ABPS可诱导TMφ表达TNF-α,而且诱导表达作用随着ABPS浓度增大而增强,具有非常显著的剂量效应,因此可以认为ABPS确是TMφ的激活剂。
IL-6主要由淋巴细胞和单核细胞产生,经LPS、PHA等诱导激活的Mφ可大量表达IL-6[6,7]。ABPS可诱导TMφ表达IL-6,这又表明 ABPS可激活Mφ,但由于IL-6表达与ABPS浓度没有剂量效应关系,因此,可以认为ABPS对IL-6的诱导表达很可能是间接的,可能是TNF-α等表达后的网络调控所致,这有待进一步研究。
, 百拇医药
有人认为多糖的免疫调节作用需要其它物质的介导,因此在体外很难或不能起作用,而本研究结果表明ABPS在没有其它物质介导时能激活TMφ并诱导TMφ表达TNF-α和IL-6,这提示了ABPS是Mφ激活的启动剂,与文献[1]的结果一致。因此,多糖在体外的免疫调节作用是否一定需要介导尚待进一步研究阐明。
①浙江省自然科学基金资助项目(№.397510)
作者简介:吕建新,男,35岁,副教授,硕士生导师,主要研究细胞免疫功能调控及基因诊断
(interleukin-6,IL-6)的诱导作用,从而探讨ABPS对Mφ的激活作用。
4 参考文献
1 李宗楷,李电东.牛膝多糖的免疫调节作用.药学学报,1997;32(12)∶881
, 百拇医药
2 吕建新,金丽琴,陈国荣 et al. 细脚拟青霉对大鼠腹腔巨噬细胞的激活作用.中国免疫学杂志,1997;3(3)∶139
3 Cohn Z A.The activation of mononuclear phagocytes: Fact,fancy,and future. J Immunol,1978;121:813
4 Dong Z,Lu S,Zhang Y. Effects of pretreatment with protein kinase C ac-tivators on macrophage activation for tumor cytotoxicity, secretion of tumor necrosis factor, and its mRNA expression. Immunobiology, 1989;179∶382
5 Dong Z, Qi X, Fidler I J.Tyrosine phosphorylation of mitogen-activated protein kinases is necessary for activation of murine macrophages by natural and synthetic bacterial products. J Exp Med, 1993; 177∶1071
, 百拇医药
6 Scamurra R, Arriaga C, Sprunger L et al. Regulation of interleukin-6 expression in porcine immune cells. J Interferon Cytokine Res, 1996;16∶289
7 Ayala A, Deol Z K, Lehman D L et al. Dose endotoxin play a major role in inducing the depression of macrophage function during polymicrobial sepsis. Arch Surg,1995;130∶1178
〔收稿日期:1998-09-11 修稿蟆:1999-02-12〕, http://www.100md.com