M1与7TD1细胞中IL-6激活核因子的比较
作者:张纪岩 沈倍奋 黎燕 王建安
单位:张纪岩(军事医学科学院基础医学研究所, 北京 100850);沈倍奋(军事医学科学院基础医学研究所, 北京 100850);黎燕(军事医学科学院基础医学研究所, 北京 100850);王建安(军事医学科学院基础医学研究所, 北京 100850)
关键词:IL-6;M1;7TD1;STAT3;NF-IL6
中国免疫学杂志000401 摘 要 目的:探讨IL-6在不同靶细胞中引起不同生物学效应的分子 基础。方法:检测IL-6对M1与7TD1细胞生长及分化的影响,通过凝胶 阻滞电脉(EMSA)比较IL-6在M1与7TD1细胞中激活STAT3(代表JAK-STATs通路)和NF-IL6(代 表P21ras/MAPK/NF-IL6通路)的情况。结果:IL-6诱导M1细胞生长停 止并向巨噬细胞方向分化,却促进7TD1细胞生长。在这两种细胞中,低剂量IL-6均可激活S TAT3,但M1细胞中STAT3的激活是持续性的,7TD1细胞中STAT3的激活是一过性的;而IL-6 在7 TD1细胞中激活NF-IL6所需的剂量(0.1 ng/ml)远低于在M1细胞中所需的剂量(100.0 ng/ml) , 不过活化的NF-IL6在两种细胞中持续的时间均超过60 min。结论:JAK -STATs通路与P21ras/MAPK/NF-IL6通路可能分别代表生长抑制信号与生长促进信号。
, http://www.100md.com
中国图书分类号 R392.11
Comparison of IL-6-activated-nuclear factor s in M1 and 7TD1 cells
ZHANG Ji-Yan SHEN Bei-Fen LI Yan
(Institute of Ba sic Medical Science,Academy of Military Medical Science,Beijing 100850)
Abstract Objective:To make clear the molecular mechanis m of how IL-6 can exert distinct biological activities on different target cells .Methods:The influence of IL-6 on the growth and differen tiation of M1 and 7TD1 cells were detected.Furthermore,compared the IL-6-acti vated-nuclear factors——STAT3(standing for JAK-STATs pathway)and NF-IL6(stan ding for P21ras/MAPK/NF-IL6 pathway) by electrophoresis mobility shift assay(EM SA) in the two cell lines.Results:IL-6 induced growth-arrest and resumption of terminal differentiation in M1 myeloid leukemic cells,but promote d proliferation of 7TD1 hybridoma cells.Low dose of IL-6 activated STAT3 in bot h cell lines,but STAT3 activity lasted far longer in M1 cells than 7TD1 cells.Th e dose needed to activate NF-IL6 in 7TD1 cells(0.1 ng/ml)is much lower than in M1 cells(100.0 ng/ml),however,activated-NF-IL6 persisted>60 min in both c ell li nes.Conclusion:These results indicated that JAK-STATs pat hway and P21ras/MAPK/NF-IL6 pathway may stand for growth-suppressing signal an d growth-enhancing signal respectively.
, 百拇医药
Key words IL-6 M1 7TD1 STAT3 NF-IL6
IL-6是一种具有广泛生物学效应的细胞因子,它既可促进7TD1、B9等B淋巴 细胞杂交瘤、T细胞、造血干细胞的增殖,又可抑制M1小鼠急性髓样白血病细胞系的生长, 诱导其向巨噬细胞方向分化;IL-6还可诱导B细胞分化为Ig分泌细胞,加速肝细胞急性期蛋 白的合成。细胞因子何以在不同靶细胞中引起不同甚至截然相反的效应,一直是人们关注而 尚未找到答案的焦点。为阐明这一现象的可能机制,我们将兴趣放在了IL-6信号转导通路 上。现在知道,IL-6主要通过两条通路——JAK-STATs通路与P21ras/MAPK/NF-IL6通路— —将信号转导至核内,调节靶基因的表达。那么,在效应完全不同的细胞中,这两条通路的 激活水平是否有差异呢?我们以M1和7TD1细胞为模型,以代表JAK-STATs通路的STAT3和代表P21ras/MAPK/NF-IL6通路的NF-IL6为指标,检测了IL-6刺激前后这两种核因子激活水平的改变。并以无关核因子NF-κB为参照,校正实验系统。
, http://www.100md.com
1 材料与方法
1.1 材料
1.1.1 细胞 M1与7TD1细胞均为本所王嘉玺教授惠赠,培养于10% FCS-16 40中 ,7TD1培养基补加2 ng/ml rhIL-6及50 μmol/L β-ME。
1.1.2 双链脱氧寡核苷酸探针[1~3] 由本室合成, PAGE纯化,见表1。
表1 双链脱氧寡核苷酸探针序列
Tab.1 Sequence of the double-chain oligonucleotide probe Probe
Nuclear factor
Sequence of each DNA probe
, 百拇医药
APRE
APRF/STAT3
5’cgatCTTCTGGGAATTCCTA3’
3’GAAGACCCTTAAGGATtagc5’
ATF/NF-IL6
NF-IL6
5’ctgaGATGACGTAGTTTTGGCGCT3’
3’CTACTGCATCAAAACCGCGAagtc5’
Class I MHC
NF-κB
, 百拇医药
5’gatcCATGGGGATTCCCCATG3’
NF-κB site
3’GTACCCCTAAGGGGTACagtc5’
1.1.3 试剂 rhIL-6(溶于含0.1% BSA的PBS中)的活性为107 U/mg,α -醋酸萘酯、副品红、精胺、亚精胺、PMSF、丙烯酰胺/双丙烯酰胺购自Sigma公司,dNTP、 Klenow酶购自Promega公司,[α-32P]dATP购自北京亚辉公司。
1.2 方法
1.2.1 细胞增殖检测 将7TD1细胞用PBS洗2次后,在无血清1640中饥饿5 h,然后将细胞密度调至2×104ml-1,种入96孔板,0.1 ml/孔。M1细胞不饥饿,每 孔1×104 细胞/0.1 ml。每孔补加梯度稀释的rhIL-6 0.1 ml,设空白对照及不加rhIL-6的阴性 对照(n=3)。37℃培养68 h后,各孔加5 g/L MTT 10 μl,继续培养4 h,各孔吸出0.1 ml 上清,加10% SDS-0.01 mol/L HCl 0.1 ml,室温溶解过夜,测OD 570 nm。
, http://www.100md.com
1.2.2 细胞形态观察及细胞化学染色 将不同剂量rhIL-6处理0,1,2,3 ,4,5 d的M1细胞用冰冷PBS洗2次后,甩片,吹干后经Wright’s染色观察形态变化,并常 规 进行ANAE、POX等细胞化学染色[4]。油镜下计数胞浆中含棕红色沉淀的ANAE染色阳 性细胞及含蓝色颗粒的POX染色阳性细胞。
1.2.3 墨汁吞噬试验 将不同剂量rhIL-6处理0,1,2,3,4,5 d的M1细 胞用冰冷PBS洗2次后,调细胞密度为5×105 ml-1,每0.1 ml加入滤纸滤过的优质 墨汁10 μl。37℃温育30 min或4 h,洗去游离墨粒,甩片,Wright’s染色,油镜下计数胞浆中吞 有大小墨粒5个以上的阳性细胞。
1.2.4 探针标记与凝胶阻滞电泳(EMSA) 采用Klenow酶补平5’端突出粘端 的方法,从双链探针3’末端掺入[α-32P]dATP(3 000 Ci/mmol)。按文献所述的 方 法提取核蛋白并电泳[1]。简言之,采用裂解缓冲液(10 mmol/L HEPES,pH7.8;0. 75 mmol/L 亚精胺;0.15 mmol/L 精胺;10 mmol/L KCl;0.1 mmol/L EDTA;0.1 mmol/L EGTA;1 mmol/L DTT;0.5 mmol/L PMSF;临用前加入10 μg/ml aprotinin; 1 mmo l/L Na3VO4;2 μg/ml leupeptin)裂解细胞,12 000 r/min离心10 min沉淀细胞核, 用核 提取液(50 mmol/L TrisCl,pH7.5;10%庶糖;420 mmol/L KCl;5 mmol/L MgCl2;0.1 mmo l/L EDTA;2 mmol/L DTT;0.5 mmol/L PMSF;20%甘油)重悬沉淀,4 ℃振摇30 min后,1 2 000 r/min离心30 min。取适量上清,加等量结合缓冲液(10 mmol/L HEPES;50 mmol/L KCl ;0 .1% BSA;临用前加入0.5 mmol/L PMSF;20 μg/ml 鲑精DNA)室温结合20 min后,加入[α -32P]dATP标记的双链脱氧寡核苷酸探针,4℃条件下进行凝胶阻滞电泳。
, http://www.100md.com
2 结果
2.1 rhIL-6抑制M1细胞增殖,促进7TD1生长 0.1 ng/ml rhIL-6即 可明 显抑制M1细胞增殖,随rhIL-6剂量增加,抑制效应更为显著,到10 ng/ml达最大抑制。7TD 1细胞对rhIL-6产生反应所需要的rhIL-6剂量与M1细胞显著不同,为了能够更准确地反映7 TD1细胞的生长曲线,我们对rhIL-6进行了3 倍倍比稀释,而不是M1细胞中的10 倍倍比稀释。很明确,7TD1细胞的生长依赖于rhIL-6,IC50为0.1 ng/ml(图1)。 图1 rhIL-6对M1与7TD1细胞增殖的影响
图1 rhIL-6对M1与7TD1细胞增殖的影响
Fig.1 Effect of rhIL-6 on the growth of M1 and 7TD1 cells
2.2 rhIL-6诱导M1细胞向巨噬细胞方向分化 M1细胞具有典型的白血病母 细胞特征,核大而圆,有1个或多个清晰的核仁,核浆比很高,无明显颗粒成分。经100 ng/ ml rhIL-6处理1 d后,Wright’s染色即可见少量 细胞体积变大,核浆比下降。2 d时出现变化的细胞比例明显增高,到3 d时90%以上的细胞 出现如下改变:细胞体积变大,核浆比明显下降,核呈肾形或类杆状;胞浆空泡化,并出现 染成紫红色的颗粒。培养中可见细胞明显贴壁。4 d时,这种变化更为显著(图2)。
, http://www.100md.com
图2 100 ng/ml rhIL-6处理前后M1细胞的形态变化
Fig.2 Morphological changes of M1 cells induced by 100
ng/ml of rhIL -6
Note:A.Normal control;B.Incubation with rhIL-6 for 4 days
在形态改变的同时,ANAE活性迅速增高,而POX 却无明显改变。说明M1是向巨噬细胞方 向分化。另外,M1细胞也迅速获得了墨汁吞噬能力,且这种吞噬在30 min即达高峰,与4 h无明 显 差异,更说明M1是向巨噬细胞方向分化(图3)。1、10 ng/ml处理组亦呈上述改变,但效应相对较弱。
, http://www.100md.com
图3 rhIL-6对M1细胞ANAE,POX和墨汁吞噬活性的影响
Fig.3 Time course of change in ANAE,POX and
phagocytic activities of M 1 cells incubated with 100 ng/ml rhIL-6
Note:ANAE activity(— —);POX activity(—. —);Ink phagocytic activity(----)
2.3 三种探针与其核因子的结合都是特异的 为检测所用探针的特异性 ,我们做了特异性竞争结合实验,即在加入同位素标记探针孵育的同时,加入100 倍的冷探 针,若探针与核因子的结合是特异的,那么同位素标记探针与核因子结合所产生的条带就会 被其冷探针抑制,而其他冷探针则对此没有影响。我们的结果说明,三种探针与其核因子的 结合都是特异的(图4)。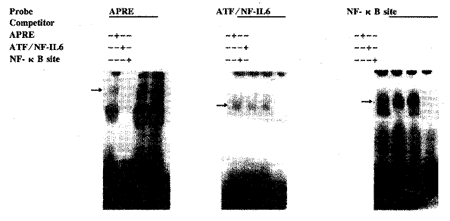
, http://www.100md.com
图4 3种探针的特异性检验
Fig.4 Specificity inspection of three probes
2.4 rhIL-6在M1与7TD1细胞中均激活STAT3,但STAT3激活的持续时间不同 在M1与7TD1细胞中,STAT3激活所需rhIL-6的剂量均较低,分别为1.0与0.1 ng/ml 。 随剂量增加,STAT3激活水平亦增强,其量效关系与rhIL-6对细胞生长的影响是一致的(图5 ),但两种细胞中活化STAT3持续的时间不同。在M1细胞中,rhIL-6刺激7.5 min STAT3即明 显激活,15 min达最大激活,60 min时仍无明显减弱(图6)。事实上,M1细胞中STAT3的激活 是持续性的,至少可持续24 h以上(图7)。而7TD1细胞中STAT3的激活却是一过性的,到60 m in时特异带完全消失(图6)。提示M1细胞中JAK-STATs通路的激活水平较7TD1细胞要强一 些。
, 百拇医药
图5 rhIL-6激活核因子的剂量效应
Fig.5 Dose course of nuclear factors activated
by incubation with rhIL -6 for 15 min
图6 rhIL-6激活核因子的时间效应
Fig.6 Time course of nuclear factors activated
by incubation with 100 ng /ml rhIL-6
, http://www.100md.com
图7 M1细胞中rhIL-6对STAT3的持续激活作用
Fig.7 The sustained nature of STAT3 activity
in M1 cells induced by 10 ng/ml rhIL-6
2.5 rhIL-6在M1与7TD1细胞中均可激活NF-IL6, 但所需rhIL-6剂量不同 对M1与7TD1细胞而言,更大差异体现在P21ras/MAPK/NF-IL6通路上。
在M1细胞中,低 剂量rhIL-6对NF-IL6无明显激活作用,100 ng/ml rhIL-6才可使NF-IL6有较明显的激活 。而7TD1中激活NF-IL6所需rhIL-6的剂量则与STAT3相似,其激活有明显的量效关系,7 TD1中P21ras/MAPK/NF-IL6通路的激活水平相对于M1来说要强一些(图5)。不过,这两 种细胞中NF-IL6激活后持续的时间均较长,到60 min时仍无明显减弱(图6)。
, 百拇医药
3 讨论
近年来,随着新的细胞因子被发现,新的受体单位被克隆,有关细胞因子的研究已取得 很大 进展。不同细胞因子效应相似或重叠的机制已经比较清楚了,但同一种细胞因子 在不同靶细胞中为何有截然不同的生物学效应却仍是一个谜。为此,Hirano T 等人于1997年提出以下 3种可能的机制:①同一种细胞因子在不同靶细胞中激活不同的信号转导通路;②激 活相 同的信号转导通路,但不同靶细胞中表达不同的信号转导调控分子;③同一靶细胞中,效 应不同甚至相反的信号转导通路同时被激活,其平衡状态或相互作用决定了最终的效应[5]。
为探讨可能的机制,我们选择M1与7TD1细胞为模型进行研究。我们首先明确了IL-6对这两 种细胞的生物学效应。结果表明:IL-6可诱导M1细胞生长停止并向巨噬细胞方向分化,而7 TD1细胞的生长却依赖于IL-6的存在,这与国内外的报道是一致的。在此基础上,我们检测 了 这两种细胞中IL-6作用后STAT3(代表JAK-STATs途径)与NF-IL6(代表P21ras/MAPK/NF-IL 6途径)的激活情况。结果表明在IL-6效应中第3种机制可能起主要作用:在M1与7TD1细胞 中,JAK-STATs途径与P21ras/MAPK/NF-IL6途径均可被IL-6激活,但其平衡状态不同。在 M1细胞中,高剂量(100 ng/ml)rhIL-6才能明显激活NF-IL6,而低剂量(1 ng/ml)rhIL-6 即可显著激活STAT3,且STAT3的激活可持续24 h以上,故JAK-STATs通路的激活水平要强于 P21ras/MAPK/NF-IL6通路。而在IL-6依赖株7TD1中,虽然STAT3与NF-IL6均可被低剂量(0 .1 ng/ml)rhIL-6激活,但STAT3活化的持续时间短,P21ras/MAPK/NF-IL6通路占优势。我 们的结果还提示JAK-STATs通路与P21ras/MAPK/NF-IL6通路可能分别代表生长抑制信号与 生长促进信号。
, http://www.100md.com
据报道,当M1细胞中STAT3激活受抑时,IL-6诱导的生长停止与终末分化亦被阻断,而且M1 细胞还表现出G1期缩短、生长加快的效应[6,7]。我们结果与此一致, 说 明IL-6在M1细胞中既产生生长增强信号,又产生生长停止与分化信号,只是一般情况下后 者将前者遮蔽,而后者是JAK-STATs通路(主要是STAT3)介导的。鉴于在依赖IL-6的骨髓瘤 细胞中表达有活性的N-ras可致细胞不再依赖IL-6[5],可以推测这两种细胞生长 增强信号主要是P21ras/MAPK/NF-IL6通路介导的。
IL-6激活的JAK-STATs通路中也包括STAT1与STAT5,但目前未发现STAT1与STAT5的独立 效应[5]。有报道表明STAT5a可能与IL-6的M1 细胞终末分化有关[8]。
作者简介:张纪岩,女, 27岁,在读博士生;
, http://www.100md.com
沈倍奋 指导教师,女,研究员, 博士生导师,工程院院士,主要从事分子免疫学研究
4 参考文献
1,Wegenka U M,Buschmann J,Luttichen C et al.Acute-phase re sponsive factor,a nuclear factor binding to acute-phase responsive elements,is rapidly activated by
interleukin-6 at the posttranslational level.Mol Cell Biol ,1993;13(1):276
2,Hsu W,Kerppola T K,Chen P L et al.Fos and Jun repress transcrip tion activation by NF-IL6 through association at the basic zipper region.Mol Ce ll Biol,1994;14(1):268
, http://www.100md.com
3,Baldwin AS JR,Azizkhan J C,Jensen D E et al.Induction of NF-κ B DNA-binding activity during the G0-to-G1 transition in mouse fibroblasts.Mol Cell Biol,1991;11(10):4943
4,Yam L T,Li C Y,Crosby W W.Cytochemical identification of monocytes and gran ulocytes.Amer J Clin Path,1971;55:283
5,Hirano T,Nakajima K,Hibi M.Signaling mechanism through gp130:a model of the cytokine system.Cytokine Growth Factor Rev,1997;8(4):241
, 百拇医药
6,Yamanaka Y,Nakajima K,Fukada T et al.Differentiation and growth arrest signals are generated through the cytoplasmic region of gp130 that is es sential for STAT3 activation.EMBO J,1996;15:1557
7,Nakajima K,Yamanaka Y,Nakae K et al.A central role for STAT3 in IL-6-induced regulation of growth and differentiation in M1 leukemia cells.EM BO J,1996;15:3651
8,Piekorz R P,HOCKE G M.Induction of differentiation by IL-6-type cytokines is impaired in myeloid leukaemia cells unable to activate STAT5α.Cytokine,1997 ;9(9):639
[收稿1999-06-09 修回1999-09-30], 百拇医药
单位:张纪岩(军事医学科学院基础医学研究所, 北京 100850);沈倍奋(军事医学科学院基础医学研究所, 北京 100850);黎燕(军事医学科学院基础医学研究所, 北京 100850);王建安(军事医学科学院基础医学研究所, 北京 100850)
关键词:IL-6;M1;7TD1;STAT3;NF-IL6
中国免疫学杂志000401 摘 要 目的:探讨IL-6在不同靶细胞中引起不同生物学效应的分子 基础。方法:检测IL-6对M1与7TD1细胞生长及分化的影响,通过凝胶 阻滞电脉(EMSA)比较IL-6在M1与7TD1细胞中激活STAT3(代表JAK-STATs通路)和NF-IL6(代 表P21ras/MAPK/NF-IL6通路)的情况。结果:IL-6诱导M1细胞生长停 止并向巨噬细胞方向分化,却促进7TD1细胞生长。在这两种细胞中,低剂量IL-6均可激活S TAT3,但M1细胞中STAT3的激活是持续性的,7TD1细胞中STAT3的激活是一过性的;而IL-6 在7 TD1细胞中激活NF-IL6所需的剂量(0.1 ng/ml)远低于在M1细胞中所需的剂量(100.0 ng/ml) , 不过活化的NF-IL6在两种细胞中持续的时间均超过60 min。结论:JAK -STATs通路与P21ras/MAPK/NF-IL6通路可能分别代表生长抑制信号与生长促进信号。
, http://www.100md.com
中国图书分类号 R392.11
Comparison of IL-6-activated-nuclear factor s in M1 and 7TD1 cells
ZHANG Ji-Yan SHEN Bei-Fen LI Yan
(Institute of Ba sic Medical Science,Academy of Military Medical Science,Beijing 100850)
Abstract Objective:To make clear the molecular mechanis m of how IL-6 can exert distinct biological activities on different target cells .Methods:The influence of IL-6 on the growth and differen tiation of M1 and 7TD1 cells were detected.Furthermore,compared the IL-6-acti vated-nuclear factors——STAT3(standing for JAK-STATs pathway)and NF-IL6(stan ding for P21ras/MAPK/NF-IL6 pathway) by electrophoresis mobility shift assay(EM SA) in the two cell lines.Results:IL-6 induced growth-arrest and resumption of terminal differentiation in M1 myeloid leukemic cells,but promote d proliferation of 7TD1 hybridoma cells.Low dose of IL-6 activated STAT3 in bot h cell lines,but STAT3 activity lasted far longer in M1 cells than 7TD1 cells.Th e dose needed to activate NF-IL6 in 7TD1 cells(0.1 ng/ml)is much lower than in M1 cells(100.0 ng/ml),however,activated-NF-IL6 persisted>60 min in both c ell li nes.Conclusion:These results indicated that JAK-STATs pat hway and P21ras/MAPK/NF-IL6 pathway may stand for growth-suppressing signal an d growth-enhancing signal respectively.
, 百拇医药
Key words IL-6 M1 7TD1 STAT3 NF-IL6
IL-6是一种具有广泛生物学效应的细胞因子,它既可促进7TD1、B9等B淋巴 细胞杂交瘤、T细胞、造血干细胞的增殖,又可抑制M1小鼠急性髓样白血病细胞系的生长, 诱导其向巨噬细胞方向分化;IL-6还可诱导B细胞分化为Ig分泌细胞,加速肝细胞急性期蛋 白的合成。细胞因子何以在不同靶细胞中引起不同甚至截然相反的效应,一直是人们关注而 尚未找到答案的焦点。为阐明这一现象的可能机制,我们将兴趣放在了IL-6信号转导通路 上。现在知道,IL-6主要通过两条通路——JAK-STATs通路与P21ras/MAPK/NF-IL6通路— —将信号转导至核内,调节靶基因的表达。那么,在效应完全不同的细胞中,这两条通路的 激活水平是否有差异呢?我们以M1和7TD1细胞为模型,以代表JAK-STATs通路的STAT3和代表P21ras/MAPK/NF-IL6通路的NF-IL6为指标,检测了IL-6刺激前后这两种核因子激活水平的改变。并以无关核因子NF-κB为参照,校正实验系统。
, http://www.100md.com
1 材料与方法
1.1 材料
1.1.1 细胞 M1与7TD1细胞均为本所王嘉玺教授惠赠,培养于10% FCS-16 40中 ,7TD1培养基补加2 ng/ml rhIL-6及50 μmol/L β-ME。
1.1.2 双链脱氧寡核苷酸探针[1~3] 由本室合成, PAGE纯化,见表1。
表1 双链脱氧寡核苷酸探针序列
Tab.1 Sequence of the double-chain oligonucleotide probe Probe
Nuclear factor
Sequence of each DNA probe
, 百拇医药
APRE
APRF/STAT3
5’cgatCTTCTGGGAATTCCTA3’
3’GAAGACCCTTAAGGATtagc5’
ATF/NF-IL6
NF-IL6
5’ctgaGATGACGTAGTTTTGGCGCT3’
3’CTACTGCATCAAAACCGCGAagtc5’
Class I MHC
NF-κB
, 百拇医药
5’gatcCATGGGGATTCCCCATG3’
NF-κB site
3’GTACCCCTAAGGGGTACagtc5’
1.1.3 试剂 rhIL-6(溶于含0.1% BSA的PBS中)的活性为107 U/mg,α -醋酸萘酯、副品红、精胺、亚精胺、PMSF、丙烯酰胺/双丙烯酰胺购自Sigma公司,dNTP、 Klenow酶购自Promega公司,[α-32P]dATP购自北京亚辉公司。
1.2 方法
1.2.1 细胞增殖检测 将7TD1细胞用PBS洗2次后,在无血清1640中饥饿5 h,然后将细胞密度调至2×104ml-1,种入96孔板,0.1 ml/孔。M1细胞不饥饿,每 孔1×104 细胞/0.1 ml。每孔补加梯度稀释的rhIL-6 0.1 ml,设空白对照及不加rhIL-6的阴性 对照(n=3)。37℃培养68 h后,各孔加5 g/L MTT 10 μl,继续培养4 h,各孔吸出0.1 ml 上清,加10% SDS-0.01 mol/L HCl 0.1 ml,室温溶解过夜,测OD 570 nm。
, http://www.100md.com
1.2.2 细胞形态观察及细胞化学染色 将不同剂量rhIL-6处理0,1,2,3 ,4,5 d的M1细胞用冰冷PBS洗2次后,甩片,吹干后经Wright’s染色观察形态变化,并常 规 进行ANAE、POX等细胞化学染色[4]。油镜下计数胞浆中含棕红色沉淀的ANAE染色阳 性细胞及含蓝色颗粒的POX染色阳性细胞。
1.2.3 墨汁吞噬试验 将不同剂量rhIL-6处理0,1,2,3,4,5 d的M1细 胞用冰冷PBS洗2次后,调细胞密度为5×105 ml-1,每0.1 ml加入滤纸滤过的优质 墨汁10 μl。37℃温育30 min或4 h,洗去游离墨粒,甩片,Wright’s染色,油镜下计数胞浆中吞 有大小墨粒5个以上的阳性细胞。
1.2.4 探针标记与凝胶阻滞电泳(EMSA) 采用Klenow酶补平5’端突出粘端 的方法,从双链探针3’末端掺入[α-32P]dATP(3 000 Ci/mmol)。按文献所述的 方 法提取核蛋白并电泳[1]。简言之,采用裂解缓冲液(10 mmol/L HEPES,pH7.8;0. 75 mmol/L 亚精胺;0.15 mmol/L 精胺;10 mmol/L KCl;0.1 mmol/L EDTA;0.1 mmol/L EGTA;1 mmol/L DTT;0.5 mmol/L PMSF;临用前加入10 μg/ml aprotinin; 1 mmo l/L Na3VO4;2 μg/ml leupeptin)裂解细胞,12 000 r/min离心10 min沉淀细胞核, 用核 提取液(50 mmol/L TrisCl,pH7.5;10%庶糖;420 mmol/L KCl;5 mmol/L MgCl2;0.1 mmo l/L EDTA;2 mmol/L DTT;0.5 mmol/L PMSF;20%甘油)重悬沉淀,4 ℃振摇30 min后,1 2 000 r/min离心30 min。取适量上清,加等量结合缓冲液(10 mmol/L HEPES;50 mmol/L KCl ;0 .1% BSA;临用前加入0.5 mmol/L PMSF;20 μg/ml 鲑精DNA)室温结合20 min后,加入[α -32P]dATP标记的双链脱氧寡核苷酸探针,4℃条件下进行凝胶阻滞电泳。
, http://www.100md.com
2 结果
2.1 rhIL-6抑制M1细胞增殖,促进7TD1生长 0.1 ng/ml rhIL-6即 可明 显抑制M1细胞增殖,随rhIL-6剂量增加,抑制效应更为显著,到10 ng/ml达最大抑制。7TD 1细胞对rhIL-6产生反应所需要的rhIL-6剂量与M1细胞显著不同,为了能够更准确地反映7 TD1细胞的生长曲线,我们对rhIL-6进行了3 倍倍比稀释,而不是M1细胞中的10 倍倍比稀释。很明确,7TD1细胞的生长依赖于rhIL-6,IC50为0.1 ng/ml(图1)。
 图1 rhIL-6对M1与7TD1细胞增殖的影响
图1 rhIL-6对M1与7TD1细胞增殖的影响Fig.1 Effect of rhIL-6 on the growth of M1 and 7TD1 cells
2.2 rhIL-6诱导M1细胞向巨噬细胞方向分化 M1细胞具有典型的白血病母 细胞特征,核大而圆,有1个或多个清晰的核仁,核浆比很高,无明显颗粒成分。经100 ng/ ml rhIL-6处理1 d后,Wright’s染色即可见少量 细胞体积变大,核浆比下降。2 d时出现变化的细胞比例明显增高,到3 d时90%以上的细胞 出现如下改变:细胞体积变大,核浆比明显下降,核呈肾形或类杆状;胞浆空泡化,并出现 染成紫红色的颗粒。培养中可见细胞明显贴壁。4 d时,这种变化更为显著(图2)。

, http://www.100md.com
图2 100 ng/ml rhIL-6处理前后M1细胞的形态变化
Fig.2 Morphological changes of M1 cells induced by 100
ng/ml of rhIL -6
Note:A.Normal control;B.Incubation with rhIL-6 for 4 days
在形态改变的同时,ANAE活性迅速增高,而POX 却无明显改变。说明M1是向巨噬细胞方 向分化。另外,M1细胞也迅速获得了墨汁吞噬能力,且这种吞噬在30 min即达高峰,与4 h无明 显 差异,更说明M1是向巨噬细胞方向分化(图3)。1、10 ng/ml处理组亦呈上述改变,但效应相对较弱。

, http://www.100md.com
图3 rhIL-6对M1细胞ANAE,POX和墨汁吞噬活性的影响
Fig.3 Time course of change in ANAE,POX and
phagocytic activities of M 1 cells incubated with 100 ng/ml rhIL-6
Note:ANAE activity(— —);POX activity(—. —);Ink phagocytic activity(----)
2.3 三种探针与其核因子的结合都是特异的 为检测所用探针的特异性 ,我们做了特异性竞争结合实验,即在加入同位素标记探针孵育的同时,加入100 倍的冷探 针,若探针与核因子的结合是特异的,那么同位素标记探针与核因子结合所产生的条带就会 被其冷探针抑制,而其他冷探针则对此没有影响。我们的结果说明,三种探针与其核因子的 结合都是特异的(图4)。

, http://www.100md.com
图4 3种探针的特异性检验
Fig.4 Specificity inspection of three probes
2.4 rhIL-6在M1与7TD1细胞中均激活STAT3,但STAT3激活的持续时间不同 在M1与7TD1细胞中,STAT3激活所需rhIL-6的剂量均较低,分别为1.0与0.1 ng/ml 。 随剂量增加,STAT3激活水平亦增强,其量效关系与rhIL-6对细胞生长的影响是一致的(图5 ),但两种细胞中活化STAT3持续的时间不同。在M1细胞中,rhIL-6刺激7.5 min STAT3即明 显激活,15 min达最大激活,60 min时仍无明显减弱(图6)。事实上,M1细胞中STAT3的激活 是持续性的,至少可持续24 h以上(图7)。而7TD1细胞中STAT3的激活却是一过性的,到60 m in时特异带完全消失(图6)。提示M1细胞中JAK-STATs通路的激活水平较7TD1细胞要强一 些。

, 百拇医药
图5 rhIL-6激活核因子的剂量效应
Fig.5 Dose course of nuclear factors activated
by incubation with rhIL -6 for 15 min

图6 rhIL-6激活核因子的时间效应
Fig.6 Time course of nuclear factors activated
by incubation with 100 ng /ml rhIL-6

, http://www.100md.com
图7 M1细胞中rhIL-6对STAT3的持续激活作用
Fig.7 The sustained nature of STAT3 activity
in M1 cells induced by 10 ng/ml rhIL-6
2.5 rhIL-6在M1与7TD1细胞中均可激活NF-IL6, 但所需rhIL-6剂量不同 对M1与7TD1细胞而言,更大差异体现在P21ras/MAPK/NF-IL6通路上。
在M1细胞中,低 剂量rhIL-6对NF-IL6无明显激活作用,100 ng/ml rhIL-6才可使NF-IL6有较明显的激活 。而7TD1中激活NF-IL6所需rhIL-6的剂量则与STAT3相似,其激活有明显的量效关系,7 TD1中P21ras/MAPK/NF-IL6通路的激活水平相对于M1来说要强一些(图5)。不过,这两 种细胞中NF-IL6激活后持续的时间均较长,到60 min时仍无明显减弱(图6)。
, 百拇医药
3 讨论
近年来,随着新的细胞因子被发现,新的受体单位被克隆,有关细胞因子的研究已取得 很大 进展。不同细胞因子效应相似或重叠的机制已经比较清楚了,但同一种细胞因子 在不同靶细胞中为何有截然不同的生物学效应却仍是一个谜。为此,Hirano T 等人于1997年提出以下 3种可能的机制:①同一种细胞因子在不同靶细胞中激活不同的信号转导通路;②激 活相 同的信号转导通路,但不同靶细胞中表达不同的信号转导调控分子;③同一靶细胞中,效 应不同甚至相反的信号转导通路同时被激活,其平衡状态或相互作用决定了最终的效应[5]。
为探讨可能的机制,我们选择M1与7TD1细胞为模型进行研究。我们首先明确了IL-6对这两 种细胞的生物学效应。结果表明:IL-6可诱导M1细胞生长停止并向巨噬细胞方向分化,而7 TD1细胞的生长却依赖于IL-6的存在,这与国内外的报道是一致的。在此基础上,我们检测 了 这两种细胞中IL-6作用后STAT3(代表JAK-STATs途径)与NF-IL6(代表P21ras/MAPK/NF-IL 6途径)的激活情况。结果表明在IL-6效应中第3种机制可能起主要作用:在M1与7TD1细胞 中,JAK-STATs途径与P21ras/MAPK/NF-IL6途径均可被IL-6激活,但其平衡状态不同。在 M1细胞中,高剂量(100 ng/ml)rhIL-6才能明显激活NF-IL6,而低剂量(1 ng/ml)rhIL-6 即可显著激活STAT3,且STAT3的激活可持续24 h以上,故JAK-STATs通路的激活水平要强于 P21ras/MAPK/NF-IL6通路。而在IL-6依赖株7TD1中,虽然STAT3与NF-IL6均可被低剂量(0 .1 ng/ml)rhIL-6激活,但STAT3活化的持续时间短,P21ras/MAPK/NF-IL6通路占优势。我 们的结果还提示JAK-STATs通路与P21ras/MAPK/NF-IL6通路可能分别代表生长抑制信号与 生长促进信号。
, http://www.100md.com
据报道,当M1细胞中STAT3激活受抑时,IL-6诱导的生长停止与终末分化亦被阻断,而且M1 细胞还表现出G1期缩短、生长加快的效应[6,7]。我们结果与此一致, 说 明IL-6在M1细胞中既产生生长增强信号,又产生生长停止与分化信号,只是一般情况下后 者将前者遮蔽,而后者是JAK-STATs通路(主要是STAT3)介导的。鉴于在依赖IL-6的骨髓瘤 细胞中表达有活性的N-ras可致细胞不再依赖IL-6[5],可以推测这两种细胞生长 增强信号主要是P21ras/MAPK/NF-IL6通路介导的。
IL-6激活的JAK-STATs通路中也包括STAT1与STAT5,但目前未发现STAT1与STAT5的独立 效应[5]。有报道表明STAT5a可能与IL-6的M1 细胞终末分化有关[8]。
作者简介:张纪岩,女, 27岁,在读博士生;
, http://www.100md.com
沈倍奋 指导教师,女,研究员, 博士生导师,工程院院士,主要从事分子免疫学研究
4 参考文献
1,Wegenka U M,Buschmann J,Luttichen C et al.Acute-phase re sponsive factor,a nuclear factor binding to acute-phase responsive elements,is rapidly activated by
interleukin-6 at the posttranslational level.Mol Cell Biol ,1993;13(1):276
2,Hsu W,Kerppola T K,Chen P L et al.Fos and Jun repress transcrip tion activation by NF-IL6 through association at the basic zipper region.Mol Ce ll Biol,1994;14(1):268
, http://www.100md.com
3,Baldwin AS JR,Azizkhan J C,Jensen D E et al.Induction of NF-κ B DNA-binding activity during the G0-to-G1 transition in mouse fibroblasts.Mol Cell Biol,1991;11(10):4943
4,Yam L T,Li C Y,Crosby W W.Cytochemical identification of monocytes and gran ulocytes.Amer J Clin Path,1971;55:283
5,Hirano T,Nakajima K,Hibi M.Signaling mechanism through gp130:a model of the cytokine system.Cytokine Growth Factor Rev,1997;8(4):241
, 百拇医药
6,Yamanaka Y,Nakajima K,Fukada T et al.Differentiation and growth arrest signals are generated through the cytoplasmic region of gp130 that is es sential for STAT3 activation.EMBO J,1996;15:1557
7,Nakajima K,Yamanaka Y,Nakae K et al.A central role for STAT3 in IL-6-induced regulation of growth and differentiation in M1 leukemia cells.EM BO J,1996;15:3651
8,Piekorz R P,HOCKE G M.Induction of differentiation by IL-6-type cytokines is impaired in myeloid leukaemia cells unable to activate STAT5α.Cytokine,1997 ;9(9):639
[收稿1999-06-09 修回1999-09-30], 百拇医药