恶性疟原虫保护性抗原复合基因-痘苗病毒重组活疫苗株在换人血猕猴模的抗攻击试验董文其
作者:李明 毕惠祥 李英杰 吴军 曲利芝
单位:董文其(第一军医大学热带医学研究所,广州510515);李明(第一军医大学热带医学研究所,广州510515);毕惠祥(第一军医大学热带医学研究所,广州510515);李英杰(第一军医大学热带医学研究所,广州510515);吴军(中山大学生物系,广州510275);曲利芝(第一军医大学实验动物中心,广州510515)
关键词:恶性疟原虫;痘苗病毒;疫苗;攻击
中国免疫学杂志000514 摘 要 目的:探讨恶性疟原虫保护性抗原复合基因-痘苗病毒重组活 疫苗候选株在实验动物 的抗疟原虫攻击能力,为下一步进入夜猴及人体试验奠定基础。方法:利用多次部分换人血 猕猴模经静脉输血法进行了抗疟原虫红内期虫体的攻击试验。结果: 在免疫后1个月攻虫, 重组痘苗病毒免疫猴从第3天一直到第12 d的采血检查中均未发现疟原虫;非重组痘苗病毒 ( 对照病毒)免疫猴第3天后原虫感染率上升,第6天原虫感染率最高达到6.0%,而后原虫感染 率逐渐下降,原虫持续时间为13天;空白对照猴第3天后原虫感染率也上升,第8天原虫感 染率最高达到2.5%,而后原虫感染率逐渐下降,原虫持续出现时间为12 d。结论 :初步说明该候选疫苗株具有一定的抗恶性疟原虫红内期虫体攻击的能力。
, 百拇医药
中国图书分类号 R382.3
Evaluation of protective immunity of a vaccini a virus vectored multi-epitope live vaccine candidate for plasmodium f alciparum using multiple partialy replacement transfused human blood macaca monkey models
DNOG Wen-Qi LI Ming BI Hui-Xiang
(Institute of Tropical Medicine, First Military Medical University, Guangzhou510 515)
Abstract Objective:To evaluate the protective ability of vaccinia virus vectored multi-epito pe live vaccine candidate for plasmodium falciparum(P.f)in experimental anim als, and to lay foundation for next testing on Aotus sp. monkey or human volunteers. Methods:The multiple partialy replacement transfused hum an blood macaca monkey mo dels were used. Challenge was made after one month of immunization by vein. Re sults:The parasitemia of recombinant virus immunized monkey was 0.0 1%in first tw o days of post-challenge. No parasites were determined from third to 12th day. W hereas the parasitemia of control virus immunized-monkey and blank control monk ey rose progressively,went to 2.5%~6.0% at 6th~8th days of post-challenge, an d the t ime of parasitemia was 12~13 days. Conclusion: These results preliminary indicate d that the monkey model immunized with recombinant vaccinia virus could resist the challenge of blood stage P.f.
, 百拇医药
Key words Plasmodium falciparum Vaccinia virus Vacc ine Challenge
恶性疟原虫是对人类健康危害十分严重的寄生虫之一,特别是近年来随着疟原虫和蚊媒 对化学药 物产生抗药性的范围不断扩大,周期不断缩短,研制疫苗用于免疫预防这一传统思路和方法 再次受到重视[1]。减毒痘苗病毒曾经在国内外成功地预防和消灭了人的天花,目前已报道利用其作为载体成功地进行了多种病毒、细菌、哺乳动物细胞等基因的表达,有些 已经可能成为重组活疫苗,有的已经进入 人体初步试验。在疟原虫的一些重要保护性抗原,如CSP[2]、SEAR[3]、RESA[4]、MSA[5]等已有报道,但大 多为单基因表达。Tine等(1 996)报道将疟原虫的7个基因分别克隆到了同一个痘苗病毒载体,并进行了表达,目前正在 进行人体试验[6]。痘苗病毒载体-真核细胞表达系统概括起来具有安全性好、外源基因插入量大、宿主细胞广泛、表达产物可以进行各种翻译后修饰、无需佐剂就可刺激机 体 产生体液免疫和细胞免疫[7]、纯化过程相对简单、产物对外界环境相对稳定及易 于保存运输等特点,并且许多实验已证实,利用痘苗病毒系统表达的外源目的的基因在实验 动物可提供保护性免疫反应[8]。
, 百拇医药
综合疟原虫的种种特点,疟原虫多个基因在同一真核活载体系统表达多个基因组成复合基因 进 行表达,代表了当前疟疾基因工程疫苗研究的方向。国内目前尚无疟原虫 基因在痘苗病毒系统表达的报道。本文所用目的基因为编码恶性疟原虫不同发育阶段抗原表 位基因,包括裂殖子表面抗原MSA1、MSA2、环子孢子蛋白CSP及环状体感染红细胞表面蛋 白RESA以及来自白细胞介素-1(IL-1)和破伤风类毒素(TT)上的T细胞激活位点等的复合抗 原基因,经在大肠杆菌表达证实,表达产物具有体外抑制疟原虫生长和细胞毒等作用[ 9],利用该复合基因构建的重组痘苗病毒活疫苗株,其免疫兔血清及IgG也具有一定的 体外抑虫作用,并且在家兔、大鼠及小鼠的免疫血清中测到了明显的白细胞介素-Ⅱ及干扰 素活性(另文报道)。本研究的目的是利用多次部分换人血猕猴模进行该疫苗候选株的抗攻击 试验,为下一步进入人体试验奠定基础。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 恶性疟原虫保护性抗原复合基因-痘苗病毒重组活疫苗株(R.Viru s) 由董文其等构建 [10] ,所用痘苗病毒为中国天坛株。痘苗病毒表达载体为pJ2-16质粒,由农牧 大学 军队基因工程重点实验室金宁一教授等构建并惠赠[11],内含痘苗病毒血凝素基因 部 分同源序列片段及4个多克隆位点,启动子为在牛痘病毒A型包涵体(Bovine poxvirus A-ty pe inclusion body, ATI)晚期启动子下游串联了16个痘苗病毒突变型P7.5早晚期启 动子形成的复合启动子。
1.1.2 非重组痘苗病毒株(V.Virus) 为痘苗病毒中国天坛株,由农牧大 学军队基因工程重点实验室金宁一教授惠赠。
1.1.3 恶性疟原虫Fcc/HN株 本实验室采自海南,经体外培养扩增传 代后液氮冷冻保存。使用时用含10%人血清的RPMI-1640培养基培养扩增虫体。
, http://www.100md.com
1.1.4 猕猴(Macaca mulatta) 来源于广州华南濒危动物研究所。
1.2 方法
1.2.1 多次部分换人血猕猴模的建立 实验前进行一次耳缘静脉采血 涂片,做血液寄生 虫检查。符合要求者在动物的下肢静脉进行血液的抽出和输入。换血时使用一次性输血针头 ,待抽血结束后直接换接输人血的针筒。
1.2.2 动物免疫 纯化后的重组痘苗病毒用PBS进行10-2、10 -3、 10-4及10-5稀释,分别取0.3 ml接种于提前培养有BHK21单层 细胞的6孔板内,加入含2%小牛血清和0.5%甲基纤维素的MEM作维持液,37C、CO2箱培养36~48 h,待细胞形成明显的病毒斑后,倾去培养液,用含Ca++、Mg++的PB S 洗2次,用含1%甲醛的PBS固定5 min,自来水洗涤,用0.1%结晶紫染色30 min,自来水冲洗 ,计算每孔形成的病毒斑数,最后算出每ml病毒液中所含的空斑形成数(PFU):
, 百拇医药
PFU=每孔病毒形成斑数×样品稀释倍数/样品量(ml)。
将已经鉴定和纯化的重组痘苗病毒及未重组野生痘苗病毒天坛株分别肩背部皮下多点免疫接 种 ,剂量为1.0 ml×108 PFU/猴,免疫期30 d,空白对照猴不免疫。免疫后每周采血一次 进行血象测定。
1.2.3 换血及攻击疟原虫 动物免疫30 d后,在换血的同时接种体外 培养的红内期恶性 疟原虫。换血前将疟原虫混入洗涤红细胞中,接虫量为2.0×105/只猴。攻虫后每天定时 采血涂片镜检疟原虫感染率及虫体形态,同时进行红细胞数、白细胞数及白细胞分类计数。
2 结果
2.1 攻虫后第1天及第2天检查原虫感染率均为0.001%。重组痘苗病毒免 疫猴,从第3天一直到 第12天的采血检查中均未发现疟原虫;非重组痘苗病毒免疫猴第3天后原虫感染率上升,第 6天原虫感染率最高达到6.0%,而后原虫感染率逐渐下降,原虫持续时间为13 d;空白对照 猴第3天后原虫感染率也上升,第8天原虫感染率最高达到2.5%,而后原虫感染率逐渐下降 ,原虫持续出现时间为12 d。具体结果见表1及图1。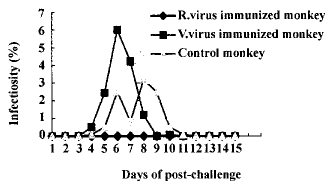
, 百拇医药
图1 攻虫后不同时间猴体疟原虫感染率变化
Fig.1 The infectious rate of Plasmodium falciparum
of mo nkeys after challenge
表1 攻虫后不同时间猴体疟原虫感染率(%)
Tab.1 The infectious rate of plasmodium falciparum
of monkeys a fter challenge(%)
R.virus immunized monkey
V.virus immunized monkey
, 百拇医药
Control monkey
Days
Ring
Mero
-zoite
Schizont
Infec
-tiosity
Ring
Mero
-zoite
Schizont
, http://www.100md.com
Infec
-tiosity
Ring
Mero
-zoite
Schizont
Infec
-tiosit y
1
+
+
-
0.001
, http://www.100md.com
+
+
-
0.001
+
+
-
0.001
2
+
+
-
0.001
+
, 百拇医药
+
-
0.001
+
+
-
0.001
3
-
-
-
0
+
+
, 百拇医药
-
0.010
+
+
-
0.010
4
-
-
-
0
+
+
-
, 百拇医药
0.500
+
+
+
0.100
5
-
-
-
0
+
+
+
2.500
, 百拇医药
+
+
+
0.500
6
-
-
-
0
+
+
+
6.000
+
, http://www.100md.com
+
+
2.500
7
-
-
-
0
+
+
+
4.250
+
+
, http://www.100md.com
-
0.800
8
-
-
-
0
+
+
+
1.200
+
+
+
, 百拇医药
3.200
9
-
-
-
0
+
+
-
0.010
+
+
+
2.500
, 百拇医药
10
-
-
-
0
+
+
-
0.100
+
+
-
0.500
11
, http://www.100md.com
-
-
-
0
+
-
-
0.010
+
+
-
0.100
12
-
, 百拇医药
-
-
0
+
-
-
0.001
+
-
-
0.010
13
-
-
, http://www.100md.com
-
0
+
-
-
0.001
-
-
-
0
14
-
-
-
, 百拇医药
0
-
-
-
0
-
-
-
0
15
-
-
-
0
, 百拇医药
-
-
-
0
-
-
-
0
表2 接种痘苗病毒后动物血象变化
Tab.2 The hemoram change of monkeys immunized with vaccinia virus Days
R.virus immunized monkey
, http://www.100md.com
V.virus immunized
Control monkey
Red blood cells
(1012)
White blood cells
(109)
Red bood cel l s
(1012)
White blood cells
(109)
, 百拇医药
Red blood cells
(10 12)
White blood cells
(109)
1
6.50
20.00
5.50
18.75
7.50
11.56
7
, http://www.100md.com
6.50
17.50
5.65
27.50
7.00
9.51
14
5.00
22.50
4.75
20.00
6.58
10.00
, http://www.100md.com
21
5.00
15.54
4.50
18.50
6.85
12.85
28
5.25
21.85
4.50
20.00
7.25
, http://www.100md.com
11.00
表3 攻虫后动物血象变化
Tab.3 The hemogram change of monkeys after challenge Days
R.virus immunized monkey
V.virus immunized
Control monkey
Red blood cells
(1012)
White blood
cells
, 百拇医药
(109)
Red blood
cells
(1012)
White blood cells
(109)
Red blood
cells
(10 12)
White blood cells
(109)
, 百拇医药
1
5.56
15.60
4.65
18.80
6.50
10.00
4
5.31
10.00
4.85
13.50
5.31
, http://www.100md.com
8.50
7
5.20
11.30
4.43
12.80
5.25
10.00
10
5.45
12.60
4.65
16.20
, 百拇医药
5.31
12.50
2.2 用痘苗病毒免疫后,每周静脉采血1次,检查动物红细胞及白细胞变化 。由表2可以看出,动 物在接种痘苗病毒后,红细胞和白细胞数无明显变化。攻虫后,重组痘苗病毒及非重组痘苗 病 毒免疫猴红细胞数无明显变化,白细胞数略有下降,空白对照猴红细胞和白细胞数均无明显 变化(表3)。
3 讨论
到目前为止,恶性疟原虫疫苗临床前保护性评价最理想的实验动物是夜猴(Aotus sp.) 和松 鼠猴(Simiry sp.),国外一些恶性疟原候选疫苗已经用夜猴进行了保护性试验[12] 。但 这两种产于中、南美洲的小型猴均为珍稀保护动物,野外数量少,人工饲养繁殖困难,而且 价格较为昂贵,特别在我国更加难以得到,这种情况在某种程度上对恶性疟原虫疫苗的研究 进程起到了一定的限制作用。目前国内常用的方法仍是体外实验评价,在体液免疫方面,主 要是测定免疫血清抗体及体外培养抑制试验,在细胞免疫方面也是测定一些体外实验指标。 然而,体外实验的结果往往与体内实验结果存在一定差异。
, 百拇医药
本试验所用多次部分换人血猕猴模,虽然只允许体外培养的恶性疟原虫在其体内“ 临时” 存活13 d左右,疟原虫也仍是寄生在换入的红细胞内,但却提供了一种模拟人体T、B 细胞免疫的综合“立体”环境,这一点是任何体外试验条件不可比拟之处。再者,猕猴的 很多生理指标与人体相近,来源较丰富,价格适宜,在缺乏夜猴和松鼠猴的情况下进行恶性 疟原虫候选疫苗的保护性评价,使用换人血猕猴模是一种比较经济、适用的选择。试验证实 ,在免疫后1个月攻虫,重组痘苗病毒免疫猴从第3天到第12天的采血检查中均未发现疟原 虫。 而非重组痘苗病毒免疫猴及空白对照猴从第3天后原虫感染率上升,第6~8天原虫感染率最 高 可达2.5%~6.0%(体外培养恶性疟原虫的最高红细胞感染率一般在5%左右),而后原虫感 染率 逐渐下降,原虫持续时间为12~13 d。值得指出的是,本次试验由于实验动物数较少,每组 仅 为一只动物,试验中非重组病毒免疫对照猴与空白对照猴攻虫后原虫感染率的差异,一方面 与猴体个体差异有关,这点在鼠疟原虫接种小鼠后其原虫感染率在不同鼠间不完全一致相符 ;另一方面还可能与疟原虫在体内的增殖特点有关,疟原虫在体内是以裂体增殖的方式繁殖 的,而不是二分裂方式,即下一代上一代与在数量关系上的差别是数倍至数十倍的关系,由 于在本试验所使用的猴模体内疟原虫只能生存13 d左右,因而这一差别应该属正常现象。尽 管本试验的结果只是初步的,但却为该候选疫苗株在实验动物体内的评价迈出了重要的 一步, 并使我们从中看到了一线希望。因为到目前为止,国内所进行的恶性疟原虫疫苗研究,基本 上是在体外评价水平。因此,本实验所用的疟疾候选疫苗株在换人血猕猴模上具有一定的抗 恶 性疟原虫红内期虫体攻击的能力这一初步结果,为下一步在夜猴及人体的抗攻击保护性评价 试验奠定了一定基础。
, 百拇医药
本课题受到UNDP/WHO Special Programme for Research and Training in Tropi cal Disease(TDR)的资助
作者简介:董文其,男,36岁,博士,副教授(硕士导师),主要研究疟疾基因工程 疫苗、基因工程抗体
4 参考文献
1,Quakyi I A,Taylor D W, Jonhson A H et al. Development of a malari a T-cell vaccine for blood stage immunity. Scand J Immunol, 1992;36(11):9
2,Lanar D E, Tine J A,De-Taisne C et al. Attenuated vaccinia virus-circu msporozo ite protein recombinant cofer protection against rodent malaria.Infect Immun, 19 96;65(5):1666
, http://www.100md.com
3,Tine J A, Conseil V,Delpace P et al. Immunogenicity of the Plasmodium f alciparum serinerepeat antigen(P126)expressed by vaccinia virus. Infect Imm un,1993;161(9):3633
4,Pye D, Edwards S J,Anders R F et al. Failure of recombinant vaccinia viru s exp ression Plasmodiun falciparum antigens to protect saimiri monkeys against ma laria.Infect Immun, 1991;59(7):2403
5,Yang S, Carroll M V, Torred-Duarte A P et al. Addition of the MSA-1 sig nal and anchor sequence to the malaria merozoite surface antigen 1 C-terminal region en hances immunogenicity when expressed by recombinant vaccinia virus. Vaccine,1997 ;15(12~13):1303
, 百拇医药
6,Tine J A,Lanar D E,Smith D M et al. NYVAC-pf7:a poxviurs-vectored,mul tiantige n, multistage vaccine candidate for Plasmodium falciparum malaria. Infect Im mun, 1996;64(9):3833
7,Satchidanandan V, Zavala F, Moss B. Studies using a recombinant vaccinia viru s expressing the circumsporozoitd protein of Plasmodium berghei. Mol Biochem Parasitol,1991;48:89
8,Moss B. Vaccinia virus:a tool for research and vaccine development. Science, 1991;252(5013):1662
, 百拇医药
9,李全贞,毕惠祥,李英杰 et al. 抗恶性疟重组复合抗原的免疫血清对恶性疟原虫 体外生长的抑制作用.中国寄生虫学与寄生虫病杂志,1995;13(3):209
10,董文其,李 明,毕惠祥 et al. 恶性疟原虫保护性抗原复合基因-痘苗病毒重组 活疫苗株的构建.寄生虫与医学昆虫学报,1998;5(2):72
11,金宁一,殷 震,舟桥真一 et al. 痘苗病毒高效表达载体的构建研究.中国兽医 学报,1994;14(1):5
12,Bundy D A P, Chan M S, Guyatt H L et al. The practicality and sustain ab ility of vaccination as an approach to parasite control. Parasitology,1995;110(supple ):S51
[收稿1998-10-10 修回1998-10-22], 百拇医药
单位:董文其(第一军医大学热带医学研究所,广州510515);李明(第一军医大学热带医学研究所,广州510515);毕惠祥(第一军医大学热带医学研究所,广州510515);李英杰(第一军医大学热带医学研究所,广州510515);吴军(中山大学生物系,广州510275);曲利芝(第一军医大学实验动物中心,广州510515)
关键词:恶性疟原虫;痘苗病毒;疫苗;攻击
中国免疫学杂志000514 摘 要 目的:探讨恶性疟原虫保护性抗原复合基因-痘苗病毒重组活 疫苗候选株在实验动物 的抗疟原虫攻击能力,为下一步进入夜猴及人体试验奠定基础。方法:利用多次部分换人血 猕猴模经静脉输血法进行了抗疟原虫红内期虫体的攻击试验。结果: 在免疫后1个月攻虫, 重组痘苗病毒免疫猴从第3天一直到第12 d的采血检查中均未发现疟原虫;非重组痘苗病毒 ( 对照病毒)免疫猴第3天后原虫感染率上升,第6天原虫感染率最高达到6.0%,而后原虫感染 率逐渐下降,原虫持续时间为13天;空白对照猴第3天后原虫感染率也上升,第8天原虫感 染率最高达到2.5%,而后原虫感染率逐渐下降,原虫持续出现时间为12 d。结论 :初步说明该候选疫苗株具有一定的抗恶性疟原虫红内期虫体攻击的能力。
, 百拇医药
中国图书分类号 R382.3
Evaluation of protective immunity of a vaccini a virus vectored multi-epitope live vaccine candidate for plasmodium f alciparum using multiple partialy replacement transfused human blood macaca monkey models
DNOG Wen-Qi LI Ming BI Hui-Xiang
(Institute of Tropical Medicine, First Military Medical University, Guangzhou510 515)
Abstract Objective:To evaluate the protective ability of vaccinia virus vectored multi-epito pe live vaccine candidate for plasmodium falciparum(P.f)in experimental anim als, and to lay foundation for next testing on Aotus sp. monkey or human volunteers. Methods:The multiple partialy replacement transfused hum an blood macaca monkey mo dels were used. Challenge was made after one month of immunization by vein. Re sults:The parasitemia of recombinant virus immunized monkey was 0.0 1%in first tw o days of post-challenge. No parasites were determined from third to 12th day. W hereas the parasitemia of control virus immunized-monkey and blank control monk ey rose progressively,went to 2.5%~6.0% at 6th~8th days of post-challenge, an d the t ime of parasitemia was 12~13 days. Conclusion: These results preliminary indicate d that the monkey model immunized with recombinant vaccinia virus could resist the challenge of blood stage P.f.
, 百拇医药
Key words Plasmodium falciparum Vaccinia virus Vacc ine Challenge
恶性疟原虫是对人类健康危害十分严重的寄生虫之一,特别是近年来随着疟原虫和蚊媒 对化学药 物产生抗药性的范围不断扩大,周期不断缩短,研制疫苗用于免疫预防这一传统思路和方法 再次受到重视[1]。减毒痘苗病毒曾经在国内外成功地预防和消灭了人的天花,目前已报道利用其作为载体成功地进行了多种病毒、细菌、哺乳动物细胞等基因的表达,有些 已经可能成为重组活疫苗,有的已经进入 人体初步试验。在疟原虫的一些重要保护性抗原,如CSP[2]、SEAR[3]、RESA[4]、MSA[5]等已有报道,但大 多为单基因表达。Tine等(1 996)报道将疟原虫的7个基因分别克隆到了同一个痘苗病毒载体,并进行了表达,目前正在 进行人体试验[6]。痘苗病毒载体-真核细胞表达系统概括起来具有安全性好、外源基因插入量大、宿主细胞广泛、表达产物可以进行各种翻译后修饰、无需佐剂就可刺激机 体 产生体液免疫和细胞免疫[7]、纯化过程相对简单、产物对外界环境相对稳定及易 于保存运输等特点,并且许多实验已证实,利用痘苗病毒系统表达的外源目的的基因在实验 动物可提供保护性免疫反应[8]。
, 百拇医药
综合疟原虫的种种特点,疟原虫多个基因在同一真核活载体系统表达多个基因组成复合基因 进 行表达,代表了当前疟疾基因工程疫苗研究的方向。国内目前尚无疟原虫 基因在痘苗病毒系统表达的报道。本文所用目的基因为编码恶性疟原虫不同发育阶段抗原表 位基因,包括裂殖子表面抗原MSA1、MSA2、环子孢子蛋白CSP及环状体感染红细胞表面蛋 白RESA以及来自白细胞介素-1(IL-1)和破伤风类毒素(TT)上的T细胞激活位点等的复合抗 原基因,经在大肠杆菌表达证实,表达产物具有体外抑制疟原虫生长和细胞毒等作用[ 9],利用该复合基因构建的重组痘苗病毒活疫苗株,其免疫兔血清及IgG也具有一定的 体外抑虫作用,并且在家兔、大鼠及小鼠的免疫血清中测到了明显的白细胞介素-Ⅱ及干扰 素活性(另文报道)。本研究的目的是利用多次部分换人血猕猴模进行该疫苗候选株的抗攻击 试验,为下一步进入人体试验奠定基础。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 恶性疟原虫保护性抗原复合基因-痘苗病毒重组活疫苗株(R.Viru s) 由董文其等构建 [10] ,所用痘苗病毒为中国天坛株。痘苗病毒表达载体为pJ2-16质粒,由农牧 大学 军队基因工程重点实验室金宁一教授等构建并惠赠[11],内含痘苗病毒血凝素基因 部 分同源序列片段及4个多克隆位点,启动子为在牛痘病毒A型包涵体(Bovine poxvirus A-ty pe inclusion body, ATI)晚期启动子下游串联了16个痘苗病毒突变型P7.5早晚期启 动子形成的复合启动子。
1.1.2 非重组痘苗病毒株(V.Virus) 为痘苗病毒中国天坛株,由农牧大 学军队基因工程重点实验室金宁一教授惠赠。
1.1.3 恶性疟原虫Fcc/HN株 本实验室采自海南,经体外培养扩增传 代后液氮冷冻保存。使用时用含10%人血清的RPMI-1640培养基培养扩增虫体。
, http://www.100md.com
1.1.4 猕猴(Macaca mulatta) 来源于广州华南濒危动物研究所。
1.2 方法
1.2.1 多次部分换人血猕猴模的建立 实验前进行一次耳缘静脉采血 涂片,做血液寄生 虫检查。符合要求者在动物的下肢静脉进行血液的抽出和输入。换血时使用一次性输血针头 ,待抽血结束后直接换接输人血的针筒。
1.2.2 动物免疫 纯化后的重组痘苗病毒用PBS进行10-2、10 -3、 10-4及10-5稀释,分别取0.3 ml接种于提前培养有BHK21单层 细胞的6孔板内,加入含2%小牛血清和0.5%甲基纤维素的MEM作维持液,37C、CO2箱培养36~48 h,待细胞形成明显的病毒斑后,倾去培养液,用含Ca++、Mg++的PB S 洗2次,用含1%甲醛的PBS固定5 min,自来水洗涤,用0.1%结晶紫染色30 min,自来水冲洗 ,计算每孔形成的病毒斑数,最后算出每ml病毒液中所含的空斑形成数(PFU):
, 百拇医药
PFU=每孔病毒形成斑数×样品稀释倍数/样品量(ml)。
将已经鉴定和纯化的重组痘苗病毒及未重组野生痘苗病毒天坛株分别肩背部皮下多点免疫接 种 ,剂量为1.0 ml×108 PFU/猴,免疫期30 d,空白对照猴不免疫。免疫后每周采血一次 进行血象测定。
1.2.3 换血及攻击疟原虫 动物免疫30 d后,在换血的同时接种体外 培养的红内期恶性 疟原虫。换血前将疟原虫混入洗涤红细胞中,接虫量为2.0×105/只猴。攻虫后每天定时 采血涂片镜检疟原虫感染率及虫体形态,同时进行红细胞数、白细胞数及白细胞分类计数。
2 结果
2.1 攻虫后第1天及第2天检查原虫感染率均为0.001%。重组痘苗病毒免 疫猴,从第3天一直到 第12天的采血检查中均未发现疟原虫;非重组痘苗病毒免疫猴第3天后原虫感染率上升,第 6天原虫感染率最高达到6.0%,而后原虫感染率逐渐下降,原虫持续时间为13 d;空白对照 猴第3天后原虫感染率也上升,第8天原虫感染率最高达到2.5%,而后原虫感染率逐渐下降 ,原虫持续出现时间为12 d。具体结果见表1及图1。

, 百拇医药
图1 攻虫后不同时间猴体疟原虫感染率变化
Fig.1 The infectious rate of Plasmodium falciparum
of mo nkeys after challenge
表1 攻虫后不同时间猴体疟原虫感染率(%)
Tab.1 The infectious rate of plasmodium falciparum
of monkeys a fter challenge(%)
R.virus immunized monkey
V.virus immunized monkey
, 百拇医药
Control monkey
Days
Ring
Mero
-zoite
Schizont
Infec
-tiosity
Ring
Mero
-zoite
Schizont
, http://www.100md.com
Infec
-tiosity
Ring
Mero
-zoite
Schizont
Infec
-tiosit y
1
+
+
-
0.001
, http://www.100md.com
+
+
-
0.001
+
+
-
0.001
2
+
+
-
0.001
+
, 百拇医药
+
-
0.001
+
+
-
0.001
3
-
-
-
0
+
+
, 百拇医药
-
0.010
+
+
-
0.010
4
-
-
-
0
+
+
-
, 百拇医药
0.500
+
+
+
0.100
5
-
-
-
0
+
+
+
2.500
, 百拇医药
+
+
+
0.500
6
-
-
-
0
+
+
+
6.000
+
, http://www.100md.com
+
+
2.500
7
-
-
-
0
+
+
+
4.250
+
+
, http://www.100md.com
-
0.800
8
-
-
-
0
+
+
+
1.200
+
+
+
, 百拇医药
3.200
9
-
-
-
0
+
+
-
0.010
+
+
+
2.500
, 百拇医药
10
-
-
-
0
+
+
-
0.100
+
+
-
0.500
11
, http://www.100md.com
-
-
-
0
+
-
-
0.010
+
+
-
0.100
12
-
, 百拇医药
-
-
0
+
-
-
0.001
+
-
-
0.010
13
-
-
, http://www.100md.com
-
0
+
-
-
0.001
-
-
-
0
14
-
-
-
, 百拇医药
0
-
-
-
0
-
-
-
0
15
-
-
-
0
, 百拇医药
-
-
-
0
-
-
-
0
表2 接种痘苗病毒后动物血象变化
Tab.2 The hemoram change of monkeys immunized with vaccinia virus Days
R.virus immunized monkey
, http://www.100md.com
V.virus immunized
Control monkey
Red blood cells
(1012)
White blood cells
(109)
Red bood cel l s
(1012)
White blood cells
(109)
, 百拇医药
Red blood cells
(10 12)
White blood cells
(109)
1
6.50
20.00
5.50
18.75
7.50
11.56
7
, http://www.100md.com
6.50
17.50
5.65
27.50
7.00
9.51
14
5.00
22.50
4.75
20.00
6.58
10.00
, http://www.100md.com
21
5.00
15.54
4.50
18.50
6.85
12.85
28
5.25
21.85
4.50
20.00
7.25
, http://www.100md.com
11.00
表3 攻虫后动物血象变化
Tab.3 The hemogram change of monkeys after challenge Days
R.virus immunized monkey
V.virus immunized
Control monkey
Red blood cells
(1012)
White blood
cells
, 百拇医药
(109)
Red blood
cells
(1012)
White blood cells
(109)
Red blood
cells
(10 12)
White blood cells
(109)
, 百拇医药
1
5.56
15.60
4.65
18.80
6.50
10.00
4
5.31
10.00
4.85
13.50
5.31
, http://www.100md.com
8.50
7
5.20
11.30
4.43
12.80
5.25
10.00
10
5.45
12.60
4.65
16.20
, 百拇医药
5.31
12.50
2.2 用痘苗病毒免疫后,每周静脉采血1次,检查动物红细胞及白细胞变化 。由表2可以看出,动 物在接种痘苗病毒后,红细胞和白细胞数无明显变化。攻虫后,重组痘苗病毒及非重组痘苗 病 毒免疫猴红细胞数无明显变化,白细胞数略有下降,空白对照猴红细胞和白细胞数均无明显 变化(表3)。
3 讨论
到目前为止,恶性疟原虫疫苗临床前保护性评价最理想的实验动物是夜猴(Aotus sp.) 和松 鼠猴(Simiry sp.),国外一些恶性疟原候选疫苗已经用夜猴进行了保护性试验[12] 。但 这两种产于中、南美洲的小型猴均为珍稀保护动物,野外数量少,人工饲养繁殖困难,而且 价格较为昂贵,特别在我国更加难以得到,这种情况在某种程度上对恶性疟原虫疫苗的研究 进程起到了一定的限制作用。目前国内常用的方法仍是体外实验评价,在体液免疫方面,主 要是测定免疫血清抗体及体外培养抑制试验,在细胞免疫方面也是测定一些体外实验指标。 然而,体外实验的结果往往与体内实验结果存在一定差异。
, 百拇医药
本试验所用多次部分换人血猕猴模,虽然只允许体外培养的恶性疟原虫在其体内“ 临时” 存活13 d左右,疟原虫也仍是寄生在换入的红细胞内,但却提供了一种模拟人体T、B 细胞免疫的综合“立体”环境,这一点是任何体外试验条件不可比拟之处。再者,猕猴的 很多生理指标与人体相近,来源较丰富,价格适宜,在缺乏夜猴和松鼠猴的情况下进行恶性 疟原虫候选疫苗的保护性评价,使用换人血猕猴模是一种比较经济、适用的选择。试验证实 ,在免疫后1个月攻虫,重组痘苗病毒免疫猴从第3天到第12天的采血检查中均未发现疟原 虫。 而非重组痘苗病毒免疫猴及空白对照猴从第3天后原虫感染率上升,第6~8天原虫感染率最 高 可达2.5%~6.0%(体外培养恶性疟原虫的最高红细胞感染率一般在5%左右),而后原虫感 染率 逐渐下降,原虫持续时间为12~13 d。值得指出的是,本次试验由于实验动物数较少,每组 仅 为一只动物,试验中非重组病毒免疫对照猴与空白对照猴攻虫后原虫感染率的差异,一方面 与猴体个体差异有关,这点在鼠疟原虫接种小鼠后其原虫感染率在不同鼠间不完全一致相符 ;另一方面还可能与疟原虫在体内的增殖特点有关,疟原虫在体内是以裂体增殖的方式繁殖 的,而不是二分裂方式,即下一代上一代与在数量关系上的差别是数倍至数十倍的关系,由 于在本试验所使用的猴模体内疟原虫只能生存13 d左右,因而这一差别应该属正常现象。尽 管本试验的结果只是初步的,但却为该候选疫苗株在实验动物体内的评价迈出了重要的 一步, 并使我们从中看到了一线希望。因为到目前为止,国内所进行的恶性疟原虫疫苗研究,基本 上是在体外评价水平。因此,本实验所用的疟疾候选疫苗株在换人血猕猴模上具有一定的抗 恶 性疟原虫红内期虫体攻击的能力这一初步结果,为下一步在夜猴及人体的抗攻击保护性评价 试验奠定了一定基础。
, 百拇医药
本课题受到UNDP/WHO Special Programme for Research and Training in Tropi cal Disease(TDR)的资助
作者简介:董文其,男,36岁,博士,副教授(硕士导师),主要研究疟疾基因工程 疫苗、基因工程抗体
4 参考文献
1,Quakyi I A,Taylor D W, Jonhson A H et al. Development of a malari a T-cell vaccine for blood stage immunity. Scand J Immunol, 1992;36(11):9
2,Lanar D E, Tine J A,De-Taisne C et al. Attenuated vaccinia virus-circu msporozo ite protein recombinant cofer protection against rodent malaria.Infect Immun, 19 96;65(5):1666
, http://www.100md.com
3,Tine J A, Conseil V,Delpace P et al. Immunogenicity of the Plasmodium f alciparum serinerepeat antigen(P126)expressed by vaccinia virus. Infect Imm un,1993;161(9):3633
4,Pye D, Edwards S J,Anders R F et al. Failure of recombinant vaccinia viru s exp ression Plasmodiun falciparum antigens to protect saimiri monkeys against ma laria.Infect Immun, 1991;59(7):2403
5,Yang S, Carroll M V, Torred-Duarte A P et al. Addition of the MSA-1 sig nal and anchor sequence to the malaria merozoite surface antigen 1 C-terminal region en hances immunogenicity when expressed by recombinant vaccinia virus. Vaccine,1997 ;15(12~13):1303
, 百拇医药
6,Tine J A,Lanar D E,Smith D M et al. NYVAC-pf7:a poxviurs-vectored,mul tiantige n, multistage vaccine candidate for Plasmodium falciparum malaria. Infect Im mun, 1996;64(9):3833
7,Satchidanandan V, Zavala F, Moss B. Studies using a recombinant vaccinia viru s expressing the circumsporozoitd protein of Plasmodium berghei. Mol Biochem Parasitol,1991;48:89
8,Moss B. Vaccinia virus:a tool for research and vaccine development. Science, 1991;252(5013):1662
, 百拇医药
9,李全贞,毕惠祥,李英杰 et al. 抗恶性疟重组复合抗原的免疫血清对恶性疟原虫 体外生长的抑制作用.中国寄生虫学与寄生虫病杂志,1995;13(3):209
10,董文其,李 明,毕惠祥 et al. 恶性疟原虫保护性抗原复合基因-痘苗病毒重组 活疫苗株的构建.寄生虫与医学昆虫学报,1998;5(2):72
11,金宁一,殷 震,舟桥真一 et al. 痘苗病毒高效表达载体的构建研究.中国兽医 学报,1994;14(1):5
12,Bundy D A P, Chan M S, Guyatt H L et al. The practicality and sustain ab ility of vaccination as an approach to parasite control. Parasitology,1995;110(supple ):S51
[收稿1998-10-10 修回1998-10-22], 百拇医药