APA微囊对免疫细胞和细胞因子隔离效应的研究
作者:李崇辉 薛毅珑 罗芸 李新建 李雁凌 刘成贵 潘长玉
单位:李崇辉(解放军总医院基础医学研究所,北京100853);薛毅珑(解放军总医院基础医学研究所,北京100853);罗芸(解放军总医院基础医学研究所,北京100853);李新建(解放军总医院基础医学研究所,北京100853)
关键词:微囊;免疫隔离;细胞因子
中国免疫学杂志000510 摘 要 目的:测定海藻酸钠-多聚赖氨酸-海藻酸钠(APA)微 囊对免疫细胞和细胞因 子的隔离效应。方法:将NK细胞和IL-2、TNF-α的活性测定方法用 于微囊免疫隔离效果的评价。结果:NK细胞对微囊化K562靶细胞的细胞 毒实验表明,微囊可有效地 保护囊内细胞不受NK细胞的杀伤作用;IL-2 (15.4 kD)和TNF-α (51 kD)可通过微囊 膜进 入囊内,并分别支持囊内IL-2依赖细胞的生存以及对微囊内的L929靶细胞发挥杀伤作用。 结 论:APA微囊可有效地隔离细胞免疫排斥反应,但某些细胞因子可通过微囊膜,成 为影响微囊化细胞在宿主体内生存的可能因素。
, 百拇医药
中国图书分类号 R392
Study of the isolating effects of APA microcapsules to immune cells and cytokines
LI Chong-Hui XUE Yi-Long LUO Yun
(Institute of Basic Medical Sciences, General Hospital of PLA, Beijing 100853)
Abstract Objective:The isolating effects of algi nate-polylysine-alginate ( APA) microcapsules to immune cells and cytokines were measured. Metho ds:The methods of measuring the activities of NK cells and IL-2,TNF -α were used to evaluate the isolating effects of APA microcapsules. Results:By performing the cytotoxicity test of NK cells on microencapsu lated K562 t arget cells,it was showed that the microcapsules could protect the encapsulated K562 cells from the cytotoxic effect of NK cells. By crossing the microcapsule m embrane IL-2 (15.4 kD) and TNF-α (51 kD) could diffuse into the microcapsule s, and then sustain the survival of IL-2 dependent cells and perform destructive e ffect on L929 target cells within the microcapsules, respectively. Co nclusion:A PA microcapsules were able to efficiently isolate the occurrence of cellular imm une rejection; but some cytokines were able to diffuse into the microcapsules, t his may be an possible factor in affecting the survival of microencapsulated cel ls in the recipients.
, 百拇医药
Key words Microcapsules Immunoisolation Cytokines
免疫隔离的细胞移植技术,为人类克服细胞移植中的免疫排斥反应和细胞来源缺乏问题 提供了一条有希望的途径。许多研究已表明由海藻酸钠-多聚赖氨酸-海藻酸钠(APA)构 成 的微囊,由于具有制作简便、体积小、生物相容性好等优点而成为应用前景较好的免疫隔离 工具之一[1,2]。我们实验室以APA微囊化异种细胞移植治疗糖尿病和 帕金森氏病的研 究结果也显示[3,4],我们制作的APA微囊可明显延长微囊化细胞在异种宿主体内存活和 发挥功能的时间。为了确切了解该微囊发挥免疫隔离作用并支持囊内细胞生存的原理和基础,本文选 择NK细胞、IL-2和TNF-α为代表,测定了APA微囊对免疫细 胞和细胞因子的隔离效应。
1 材料与方法
1.1 微囊化细胞的制备 将细胞悬浮于1.5%的海藻酸钠溶液中,用静电微囊制作仪(购自加拿大多伦多大学生理 系)喷入0.1 mol/L氯化钙溶液中;再依次用0.05%的多聚赖氨酸溶液和 0.15%的海藻酸钠溶液包裹,最后用55 mmol/L的柠檬酸钠溶液液化微珠核心,形成APA微囊 化细胞。
, 百拇医药
1.2 NK细胞对裸露和微囊化K562细胞的细胞毒作用的测定 参考常规NK细 胞活性测定方法[5],取新鲜献血员血制备效应细胞悬液。将100 μl含裸 露或微囊化K562细胞的悬液加入96孔板中,1×104细胞/孔,再按不同的效靶细胞比分别 加 入效应细胞悬液。37℃孵育18 h后,裸露靶细胞组以台盼蓝染色法计数每孔K562细胞死亡率 ,微囊化靶细胞组用培养液洗去淋巴细胞,吸取少量微囊置于载玻片上,滴加台盼蓝染液并 加盖盖玻片,轻压盖片使囊内细胞散出,计数K562细胞死亡率。结果按下式计算:自然杀伤率(%)= 实验组细胞死亡率—对照组细胞死亡率。
1.3 IL-2对裸露和微囊化CTLL-2细胞生长的影响 制备微囊化CTLL-2细 胞,计数平均每个微囊所含细胞数和细胞活率。将等量裸露或微囊 化的CTLL-2细胞用含不同浓度IL-2的1640培养液培养,分别于培养后第1、3和5天, 以台盼蓝染色法测定CTLL-2细胞的活率。
, 百拇医药
1.4 TNF-α对裸露和微囊化L929细胞杀伤作用的测定 将L929细胞制成2. 5×105ml-1的细胞悬液,接种96孔板,每孔100 μl,37℃培养18 h。弃 去培养液,加入含1 μg/ml放线菌素D和不同浓度TNF-α的1640培养液,继续培养20 h。弃 去 培养液,细胞用50 μl 0.2%的结晶紫乙醇-水溶液(2∶98,v/v)室温染色10 m in,蒸馏水漂洗,室温晾干,加100 μl 1%SDS,待紫色物质溶解后,酶标仪595 nm比色。制备微囊化L929细胞,将适量微囊转移入24孔板中,加入1 ml含放线菌素D和不同浓度T NF-α 的培养液,使细胞终浓度同裸露细胞终浓度,37℃培养20 h。吸取少量微囊置于载玻片上, 台盼蓝染色计数各孔微囊化L929细胞的死亡率。
2 结果
2.1 微囊对NK细胞介导的细胞毒作用的隔离效果 将人外周血NK细胞与其敏感靶细胞K562细胞共培养,从表1可看出,随着效靶细胞比的 增加,NK细胞对裸露靶细胞的自然杀伤率明显升高。但是将K562靶细胞用APA微囊包裹后, 则发现在各效靶细胞比例下,NK细胞对微囊化细胞均无明显杀伤作用,表明APA微囊可有效 地保护囊内细胞不受囊外细胞毒细胞的杀伤作用。
, 百拇医药
2.2 APA微囊对IL-2的通透性 将CTLL-2细胞用微囊包裹,包囊前后细胞活率 分别为98.4%和94.9%,平均294个细胞/囊。将裸露和微囊化细胞于含不同浓度IL-2的 培 养液中 培养不同时间后,其细 胞活率如图1所示,裸露和囊化细胞活率均随IL-2浓度的增加而提高 ,随培养时间的延长而降低,表明IL-2能够通过微囊膜进入囊内并支持囊内细胞的存 活。但 是,在24和48 h时的各IL-2浓度点,囊化细胞的活率均低于裸露细胞,提示扩散到微囊 内的IL-2浓度可能低于囊外培养液中IL-2浓度,故在一定程度上限制了囊内细胞的生 长。
表1 NK细胞对裸露和微囊化K562细胞的杀伤作用(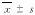 , n=3)[ WTHZ
, n=3)[ WTHZ
Tab.1 Cytotoxicity of NK cells on naked and microencapsulated K562 cells(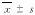 , n=3) Effect:target ratios
, n=3) Effect:target ratios
, 百拇医药
10:1
25:1
50:1
75:1
100:1
Cytotoxicity on naked cells (%)
9.30±2.20
34.10±1.30
51.20±3.30
70.30±1.40
89.40±1.70
Cytotoxicity on microencapsulated cells (%)
, 百拇医药
—
0.10±0.07
0.52±0.27
—
0.56±0.28 图1 IL-2对裸露和微囊化CTLL-2细胞生存的影响
图1 IL-2对裸露和微囊化CTLL-2细胞生存的影响
Fig.1 Effects of IL-2 on the survival
of naked and microencapsulated CT LL-2 cells
图2 TNF-α对裸露L929细胞的杀伤作用(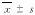 , n=3)
, n=3)
, http://www.100md.com
Fig.2 Cytotoxicity of TNF-α on naked L929 cells (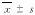 , n=3)
, n=3)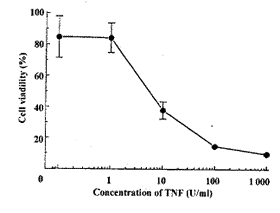
图3 TNF-α对微囊化L929细胞的杀伤作用(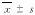 , n=3)[ WTHZ
, n=3)[ WTHZ
Fig.3 Cytotoxicity of TNF-α on microencapsulated L929 cells (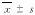 , n=3)
, n=3)
2.3 APA微囊对TNF-α的通透性 将不同浓度TNF-α与贴壁培养的L929细胞在放线菌素D存在下作用20~24 h,以结晶紫 法 进行细胞活性染色。结果如图2所示,随着TNF-α作用浓度的提高,代表细胞活性的A595 n m 值明显降低,即TNF-α对细胞的杀伤率明显增加,表明TNF-α可有效地杀伤裸露的L929细 胞。将L929细胞用APA微囊包裹,包囊前、后细胞活率分别为91%和85%,平均49个细 胞/囊。 TNF-α对微囊化L929细胞的杀伤作用如图3所示,无TNF-α组的囊化细胞活率仍维持在85% ,而 加入TNF-α的各组,随着TNF-α作用浓度的增加,微囊内细胞活率明显下降,即对细胞的 杀伤率增加,表明TNF-α可很好地扩散进微囊内,并对囊内靶细胞发挥杀伤作用。
, 百拇医药
3 讨论
3.1 APA微囊可满足微囊化细胞生存的基本营养需要 APA微囊 化细胞是以非血管化的形式、依赖于从组织液或培养液中扩散到微囊内的营养成分 而生存。文中确定分子量15.4 kD的IL-2可通过微囊膜并支持囊内IL-2依赖细胞的生长, 分 子量51 kD的TNF-α可进入微囊内并发挥生物效应,表明支持细胞生长的小分子营养物质 和生长因子可通过微囊膜,因此APA微囊可满足囊化细胞生存的基本营养需要。
3.2 APA微囊可有效地隔离大分子免疫活性物质 实验表明APA微 囊能够有效地阻挡NK细胞介导的细胞毒作用,由此可推测APA微囊亦能够阻挡其它与细胞毒 作用有关的细胞进入囊内,从而可有效地保护囊内细胞不受宿主细胞免疫排斥反应的作用。 我们过去的研究还表明,分子量大于71 kD的葡聚糖分子和免疫球蛋白IgG不能 通过APA 微囊膜[6]。而IgG是最小的免疫球蛋白分子,补体激活必需的C3成分为195 kD。因 此 APA微囊可以阻挡移植免疫排斥反应的细胞免疫和体液免疫两大效应机制对微囊内细胞发生 作用,从而起到有效的免疫隔离屏障作用。上述关于微囊通透性和免疫隔离效应的研究是通过体外实验证实的,在将微囊移植到体内后 可能会受体内多种因素的影响,特别是若微囊膜生物相容性不够好,则易发生囊外周细胞吸 附甚至纤维化,可影响微囊膜的通透性甚至使其不能通透。因此APA微囊的生物相容性亦是 影响微囊免疫隔离效果和囊内细胞存活的关键因素。
, http://www.100md.com
3.3 细胞因子与微囊化细胞移植 细胞因子是除免疫球蛋白和补体外的另一类非特异性免疫效应物质,多数细胞因子的分子量 <80 kD。 文中实验表明部分细胞因子可以进入APA微囊内并对囊内细胞产生生物效应。但是我们及他 人的微囊化细胞体内移植实验均表明微囊化细胞可较长期地在异种体内存活 并发挥功 能[1-4]。推测与以下因素有关:用于微囊化移植的细胞多为经过纯化的实质细 胞,去除了血管 和淋巴细胞,并对细胞包裹后进行移植,大大减少了诱导细胞因子产生的因素;生物相容 性较好的微囊移植不足以诱使机体产生细胞因子;即使可诱发细胞因子的产生,但其产生 的量可能不足以对微囊内细胞产生严重的损伤效应。微囊化细胞移植中小分子细胞因子 的可能作用有待于进一步研究。
本文受国家自然科学基金(39570725)和国家计委“九五”重点科技攻关项目基 金(96-120-50)的资助
作者简介:李崇辉,女,30岁,博士后,主要从事微囊化组织细胞的移植研究;
, 百拇医药
薛毅珑,女,46岁,副研究员,主要从事生物型人工器官的应用基础研究
李雁凌(解放军总医院基础医学研究所,北京100853)
刘成贵(解放军总医院基础医学研究所,北京100853)
潘长玉(解放军总医院内分泌科,北京100853)
4 参考文献
1,Sun A M. Microencapsulation as bioartificial organs: allograf ts and exnograft s. In: Lanza R P, Chick W L eds. Pancreatic islet transplantation (Vol Ⅲ): I mmunoisolation of pancreatic islets. New York:R G Landes Company, 1994:45-58
, http://www.100md.com
2,Chang P L. Microcapsules as bio-organs for somatic gene therapy. Ann N Y A cad Sci, 1997; 831:460
3,何立敏,薛毅珑,张 莉 et al.微囊化大鼠胰岛异种移植于糖尿病小鼠的实验 观察. 军医进修学院学报, 1999; 20(2):98
4,高军茂,薛毅珑,齐增飞 et al.微囊化牛嗜铬细胞移植于偏侧帕金森病样大鼠 脑内的实验研究(Ⅰ):行为和组织学. 中华器官移植杂志, 1999;20(1):10
5,严 杰. 现代微生物学实验技术及其应用. 北京:人民卫生出版社,1997:164
6,李崇辉,罗 芸,李新建 et al.利用激光共聚焦显微镜测定APA微囊通透性. 中国体视学与图像分析, 1999;4(1):16
[收稿1999-11-09 修回2000-01-30], 百拇医药
单位:李崇辉(解放军总医院基础医学研究所,北京100853);薛毅珑(解放军总医院基础医学研究所,北京100853);罗芸(解放军总医院基础医学研究所,北京100853);李新建(解放军总医院基础医学研究所,北京100853)
关键词:微囊;免疫隔离;细胞因子
中国免疫学杂志000510 摘 要 目的:测定海藻酸钠-多聚赖氨酸-海藻酸钠(APA)微 囊对免疫细胞和细胞因 子的隔离效应。方法:将NK细胞和IL-2、TNF-α的活性测定方法用 于微囊免疫隔离效果的评价。结果:NK细胞对微囊化K562靶细胞的细胞 毒实验表明,微囊可有效地 保护囊内细胞不受NK细胞的杀伤作用;IL-2 (15.4 kD)和TNF-α (51 kD)可通过微囊 膜进 入囊内,并分别支持囊内IL-2依赖细胞的生存以及对微囊内的L929靶细胞发挥杀伤作用。 结 论:APA微囊可有效地隔离细胞免疫排斥反应,但某些细胞因子可通过微囊膜,成 为影响微囊化细胞在宿主体内生存的可能因素。
, 百拇医药
中国图书分类号 R392
Study of the isolating effects of APA microcapsules to immune cells and cytokines
LI Chong-Hui XUE Yi-Long LUO Yun
(Institute of Basic Medical Sciences, General Hospital of PLA, Beijing 100853)
Abstract Objective:The isolating effects of algi nate-polylysine-alginate ( APA) microcapsules to immune cells and cytokines were measured. Metho ds:The methods of measuring the activities of NK cells and IL-2,TNF -α were used to evaluate the isolating effects of APA microcapsules. Results:By performing the cytotoxicity test of NK cells on microencapsu lated K562 t arget cells,it was showed that the microcapsules could protect the encapsulated K562 cells from the cytotoxic effect of NK cells. By crossing the microcapsule m embrane IL-2 (15.4 kD) and TNF-α (51 kD) could diffuse into the microcapsule s, and then sustain the survival of IL-2 dependent cells and perform destructive e ffect on L929 target cells within the microcapsules, respectively. Co nclusion:A PA microcapsules were able to efficiently isolate the occurrence of cellular imm une rejection; but some cytokines were able to diffuse into the microcapsules, t his may be an possible factor in affecting the survival of microencapsulated cel ls in the recipients.
, 百拇医药
Key words Microcapsules Immunoisolation Cytokines
免疫隔离的细胞移植技术,为人类克服细胞移植中的免疫排斥反应和细胞来源缺乏问题 提供了一条有希望的途径。许多研究已表明由海藻酸钠-多聚赖氨酸-海藻酸钠(APA)构 成 的微囊,由于具有制作简便、体积小、生物相容性好等优点而成为应用前景较好的免疫隔离 工具之一[1,2]。我们实验室以APA微囊化异种细胞移植治疗糖尿病和 帕金森氏病的研 究结果也显示[3,4],我们制作的APA微囊可明显延长微囊化细胞在异种宿主体内存活和 发挥功能的时间。为了确切了解该微囊发挥免疫隔离作用并支持囊内细胞生存的原理和基础,本文选 择NK细胞、IL-2和TNF-α为代表,测定了APA微囊对免疫细 胞和细胞因子的隔离效应。
1 材料与方法
1.1 微囊化细胞的制备 将细胞悬浮于1.5%的海藻酸钠溶液中,用静电微囊制作仪(购自加拿大多伦多大学生理 系)喷入0.1 mol/L氯化钙溶液中;再依次用0.05%的多聚赖氨酸溶液和 0.15%的海藻酸钠溶液包裹,最后用55 mmol/L的柠檬酸钠溶液液化微珠核心,形成APA微囊 化细胞。
, 百拇医药
1.2 NK细胞对裸露和微囊化K562细胞的细胞毒作用的测定 参考常规NK细 胞活性测定方法[5],取新鲜献血员血制备效应细胞悬液。将100 μl含裸 露或微囊化K562细胞的悬液加入96孔板中,1×104细胞/孔,再按不同的效靶细胞比分别 加 入效应细胞悬液。37℃孵育18 h后,裸露靶细胞组以台盼蓝染色法计数每孔K562细胞死亡率 ,微囊化靶细胞组用培养液洗去淋巴细胞,吸取少量微囊置于载玻片上,滴加台盼蓝染液并 加盖盖玻片,轻压盖片使囊内细胞散出,计数K562细胞死亡率。结果按下式计算:自然杀伤率(%)= 实验组细胞死亡率—对照组细胞死亡率。
1.3 IL-2对裸露和微囊化CTLL-2细胞生长的影响 制备微囊化CTLL-2细 胞,计数平均每个微囊所含细胞数和细胞活率。将等量裸露或微囊 化的CTLL-2细胞用含不同浓度IL-2的1640培养液培养,分别于培养后第1、3和5天, 以台盼蓝染色法测定CTLL-2细胞的活率。
, 百拇医药
1.4 TNF-α对裸露和微囊化L929细胞杀伤作用的测定 将L929细胞制成2. 5×105ml-1的细胞悬液,接种96孔板,每孔100 μl,37℃培养18 h。弃 去培养液,加入含1 μg/ml放线菌素D和不同浓度TNF-α的1640培养液,继续培养20 h。弃 去 培养液,细胞用50 μl 0.2%的结晶紫乙醇-水溶液(2∶98,v/v)室温染色10 m in,蒸馏水漂洗,室温晾干,加100 μl 1%SDS,待紫色物质溶解后,酶标仪595 nm比色。制备微囊化L929细胞,将适量微囊转移入24孔板中,加入1 ml含放线菌素D和不同浓度T NF-α 的培养液,使细胞终浓度同裸露细胞终浓度,37℃培养20 h。吸取少量微囊置于载玻片上, 台盼蓝染色计数各孔微囊化L929细胞的死亡率。
2 结果
2.1 微囊对NK细胞介导的细胞毒作用的隔离效果 将人外周血NK细胞与其敏感靶细胞K562细胞共培养,从表1可看出,随着效靶细胞比的 增加,NK细胞对裸露靶细胞的自然杀伤率明显升高。但是将K562靶细胞用APA微囊包裹后, 则发现在各效靶细胞比例下,NK细胞对微囊化细胞均无明显杀伤作用,表明APA微囊可有效 地保护囊内细胞不受囊外细胞毒细胞的杀伤作用。
, 百拇医药
2.2 APA微囊对IL-2的通透性 将CTLL-2细胞用微囊包裹,包囊前后细胞活率 分别为98.4%和94.9%,平均294个细胞/囊。将裸露和微囊化细胞于含不同浓度IL-2的 培 养液中 培养不同时间后,其细 胞活率如图1所示,裸露和囊化细胞活率均随IL-2浓度的增加而提高 ,随培养时间的延长而降低,表明IL-2能够通过微囊膜进入囊内并支持囊内细胞的存 活。但 是,在24和48 h时的各IL-2浓度点,囊化细胞的活率均低于裸露细胞,提示扩散到微囊 内的IL-2浓度可能低于囊外培养液中IL-2浓度,故在一定程度上限制了囊内细胞的生 长。
表1 NK细胞对裸露和微囊化K562细胞的杀伤作用(
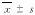 , n=3)[ WTHZ
, n=3)[ WTHZTab.1 Cytotoxicity of NK cells on naked and microencapsulated K562 cells(
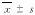 , n=3) Effect:target ratios
, n=3) Effect:target ratios, 百拇医药
10:1
25:1
50:1
75:1
100:1
Cytotoxicity on naked cells (%)
9.30±2.20
34.10±1.30
51.20±3.30
70.30±1.40
89.40±1.70
Cytotoxicity on microencapsulated cells (%)
, 百拇医药
—
0.10±0.07
0.52±0.27
—
0.56±0.28
 图1 IL-2对裸露和微囊化CTLL-2细胞生存的影响
图1 IL-2对裸露和微囊化CTLL-2细胞生存的影响Fig.1 Effects of IL-2 on the survival
of naked and microencapsulated CT LL-2 cells

图2 TNF-α对裸露L929细胞的杀伤作用(
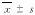 , n=3)
, n=3), http://www.100md.com
Fig.2 Cytotoxicity of TNF-α on naked L929 cells (
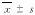 , n=3)
, n=3)
图3 TNF-α对微囊化L929细胞的杀伤作用(
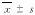 , n=3)[ WTHZ
, n=3)[ WTHZFig.3 Cytotoxicity of TNF-α on microencapsulated L929 cells (
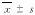 , n=3)
, n=3)2.3 APA微囊对TNF-α的通透性 将不同浓度TNF-α与贴壁培养的L929细胞在放线菌素D存在下作用20~24 h,以结晶紫 法 进行细胞活性染色。结果如图2所示,随着TNF-α作用浓度的提高,代表细胞活性的A595 n m 值明显降低,即TNF-α对细胞的杀伤率明显增加,表明TNF-α可有效地杀伤裸露的L929细 胞。将L929细胞用APA微囊包裹,包囊前、后细胞活率分别为91%和85%,平均49个细 胞/囊。 TNF-α对微囊化L929细胞的杀伤作用如图3所示,无TNF-α组的囊化细胞活率仍维持在85% ,而 加入TNF-α的各组,随着TNF-α作用浓度的增加,微囊内细胞活率明显下降,即对细胞的 杀伤率增加,表明TNF-α可很好地扩散进微囊内,并对囊内靶细胞发挥杀伤作用。
, 百拇医药
3 讨论
3.1 APA微囊可满足微囊化细胞生存的基本营养需要 APA微囊 化细胞是以非血管化的形式、依赖于从组织液或培养液中扩散到微囊内的营养成分 而生存。文中确定分子量15.4 kD的IL-2可通过微囊膜并支持囊内IL-2依赖细胞的生长, 分 子量51 kD的TNF-α可进入微囊内并发挥生物效应,表明支持细胞生长的小分子营养物质 和生长因子可通过微囊膜,因此APA微囊可满足囊化细胞生存的基本营养需要。
3.2 APA微囊可有效地隔离大分子免疫活性物质 实验表明APA微 囊能够有效地阻挡NK细胞介导的细胞毒作用,由此可推测APA微囊亦能够阻挡其它与细胞毒 作用有关的细胞进入囊内,从而可有效地保护囊内细胞不受宿主细胞免疫排斥反应的作用。 我们过去的研究还表明,分子量大于71 kD的葡聚糖分子和免疫球蛋白IgG不能 通过APA 微囊膜[6]。而IgG是最小的免疫球蛋白分子,补体激活必需的C3成分为195 kD。因 此 APA微囊可以阻挡移植免疫排斥反应的细胞免疫和体液免疫两大效应机制对微囊内细胞发生 作用,从而起到有效的免疫隔离屏障作用。上述关于微囊通透性和免疫隔离效应的研究是通过体外实验证实的,在将微囊移植到体内后 可能会受体内多种因素的影响,特别是若微囊膜生物相容性不够好,则易发生囊外周细胞吸 附甚至纤维化,可影响微囊膜的通透性甚至使其不能通透。因此APA微囊的生物相容性亦是 影响微囊免疫隔离效果和囊内细胞存活的关键因素。
, http://www.100md.com
3.3 细胞因子与微囊化细胞移植 细胞因子是除免疫球蛋白和补体外的另一类非特异性免疫效应物质,多数细胞因子的分子量 <80 kD。 文中实验表明部分细胞因子可以进入APA微囊内并对囊内细胞产生生物效应。但是我们及他 人的微囊化细胞体内移植实验均表明微囊化细胞可较长期地在异种体内存活 并发挥功 能[1-4]。推测与以下因素有关:用于微囊化移植的细胞多为经过纯化的实质细 胞,去除了血管 和淋巴细胞,并对细胞包裹后进行移植,大大减少了诱导细胞因子产生的因素;生物相容 性较好的微囊移植不足以诱使机体产生细胞因子;即使可诱发细胞因子的产生,但其产生 的量可能不足以对微囊内细胞产生严重的损伤效应。微囊化细胞移植中小分子细胞因子 的可能作用有待于进一步研究。
本文受国家自然科学基金(39570725)和国家计委“九五”重点科技攻关项目基 金(96-120-50)的资助
作者简介:李崇辉,女,30岁,博士后,主要从事微囊化组织细胞的移植研究;
, 百拇医药
薛毅珑,女,46岁,副研究员,主要从事生物型人工器官的应用基础研究
李雁凌(解放军总医院基础医学研究所,北京100853)
刘成贵(解放军总医院基础医学研究所,北京100853)
潘长玉(解放军总医院内分泌科,北京100853)
4 参考文献
1,Sun A M. Microencapsulation as bioartificial organs: allograf ts and exnograft s. In: Lanza R P, Chick W L eds. Pancreatic islet transplantation (Vol Ⅲ): I mmunoisolation of pancreatic islets. New York:R G Landes Company, 1994:45-58
, http://www.100md.com
2,Chang P L. Microcapsules as bio-organs for somatic gene therapy. Ann N Y A cad Sci, 1997; 831:460
3,何立敏,薛毅珑,张 莉 et al.微囊化大鼠胰岛异种移植于糖尿病小鼠的实验 观察. 军医进修学院学报, 1999; 20(2):98
4,高军茂,薛毅珑,齐增飞 et al.微囊化牛嗜铬细胞移植于偏侧帕金森病样大鼠 脑内的实验研究(Ⅰ):行为和组织学. 中华器官移植杂志, 1999;20(1):10
5,严 杰. 现代微生物学实验技术及其应用. 北京:人民卫生出版社,1997:164
6,李崇辉,罗 芸,李新建 et al.利用激光共聚焦显微镜测定APA微囊通透性. 中国体视学与图像分析, 1999;4(1):16
[收稿1999-11-09 修回2000-01-30], 百拇医药