噬菌体表面呈现抗人红细胞血型A抗原单链抗体的研究
作者:王长军 唐家琪 李先富 潘秀珍 操敏
单位:王长军(南京军区军事医学研究所 ,南京210002);李先富(南京军区军事医学研究所 ,南京210002);潘秀珍(南京军区军事医学研究所 ,南京210002);操敏(南京军区军事医学研究所 ,南京210002)
关键词:噬菌体表面呈现技术;单链抗体;ABO血型
中国免疫学杂志000505 摘 要 目的:构建表达抗人红细胞血型A抗原50A杂交瘤细胞的单链抗 体(ScFv)。方法:应用重组噬菌体抗体技术,从50A杂交瘤细胞中分离 、构建单链抗体基因,并将其克隆入噬粒pCANTAB5E中,转化E.coli XL-Blue,辅助噬菌体 援救构建50A噬菌体单链抗体库;采用完整红细胞亲和富集法淘选阳性重组噬菌体,鉴定重 组噬菌体并进行序列测定分析;免疫印迹试验检测重组单链抗体的特异性抗原活性。结果:用M13KO7援救XL-1 Blue转化菌中的pCANTAB5E重组噬菌体,得到滴度 为4×109 pfu/ml噬菌体单链抗体库;免疫印迹试验证实表达产物保留了亲本单抗对人红 细胞血型A抗原的特异性亲和力。结论:成功构建50A McAb单链噬菌体 抗体库,为进一步研制高特异性、高亲和力的基因工程原核血型检定抗体试剂奠定了基础。
, http://www.100md.com
中国图书分类号 R392.11
Expression of anti-RBC blood group A substance ScFv by using phage display tech nology
WANG Chang-Jun TANG Jia-Qi LI Xian-Fu
(Institute of Military Medicine, Nanjing Command,Nanjing 210002)
Abstract Objective:To construct a phage-displayed ScFv antibody of 50A hybridoma anti-blood group A substance.Methods:Based on recombinant phage display techniques,the construction,screening and expression of functional single-chain Fv fragment(ScFv) from murine hybrido ma 50A which secrets antibody specifity binding to human blood group A substa nce was performed. By RT-PCR for VH and VL genes assembly of ScFv genes and cl o ning into phagemid pCANTAB5E, transformation of E.coli XL-Blue cells and rescui n g with M13KO7 helper phage. The recombinant phages were panned by whole red bloo d cells over three rounds. Finally, the positive recombinant phages were sequenc ed and identified by immuno-blot assay. Results:A recombinant phage ScFv libra ry with titer of 4×109 pfu/ml was established. The result of immuno-blot in dicated that the phage-displayed 50A-ScFv retained the affinity and specificit y of the original intact antibody to blood group A substance.Conclusi on:Single chain antibody fragment 50A-ScFv displayed on the surface of filamentous phage was successfully produced,which would be potentially useful in constructing engineering antibody fragments as blood grouping reagents.
, 百拇医药
Key words Phage display technology Single-chain F v antibody Blood group ABO substance
噬菌体表面呈现技术(Phage display technology,PDT)是利用在改构的噬菌 体 外壳蛋白质基因PIII或PVIII区引入外源基因,以融合形式表达外源肽或蛋白,使其随着 噬 菌体的组装而呈现在噬菌体表面,保持特定的空间构象,并通过免疫亲和吸附法筛选特异性 肽或蛋白的一项新技术[1]。它的出现极大地推动了抗体工程的发展,为在体外 模拟免疫系统的抗原选择和抗体多样化过程,进而筛选高特异性、高亲和力的基因工程抗体 提 供了技术支持。本实验在已完成杂交瘤建株、分离抗体可变区基因等工作的基础上[2 ,3],采用噬菌体表面呈现技术,构建了抗人红细胞血型A抗原杂交瘤50A株噬 菌体单链抗体库,为研制第三代基因工程原核血型检定抗体试剂奠定了基础。
, http://www.100md.com
1 材料与方法
1.1 细胞和载体 小鼠杂交瘤细胞系50A由本室研制,分泌抗A单克隆抗体 ,为IgM类;E.coli HB2151、E.coli XL-Blue和含(Glu4Ser)3接头质粒pSTE-215为 德国Duble教授惠赠;测序用T-Vector easy Kit 购自Promega公司;噬菌体抗体表达载体p CANTAB5E和辅助噬菌体M13KO7购自Pharmacia公司。
1.2 工具酶和试剂 限制性核酸内切酶为Biolabs产品;T4 DNA连接酶、 IPTG、碱性磷酸酶为Promega公司产品;PCR Kit为上海Sangon生物工程公司产品;正常人分 离 红细胞由南京军区总医院提供;酶标抗E-tag抗体、鼠抗噬菌体衣壳蛋白抗体为Pharmacia 公 司产品;HRP标记兔抗鼠IgG抗体及DAB显色液为SABC产品。其余试剂均为分析纯级(A、R)或 分子生物学纯级。
, 百拇医药
1.3 PCR引物设计与合成 参考已知的小鼠抗体轻、重链可变区氨基酸序列 ,设计合成了抗体可变区5’端及3’端引物。用于扩增重链可变区的一对引物为VH Back 和VH For,用于扩增轻链可变区的一对引物为VL Back和VL For,引入连接肽编码基 因用于拼接PCR构建50A单链抗体基因的一对引物为Linker For和Linker Back,用于加端PCR 引入与pCANTAB5E克隆位点SfiI、NotI匹配的一对引物为VHO和VLO。引物序列如下: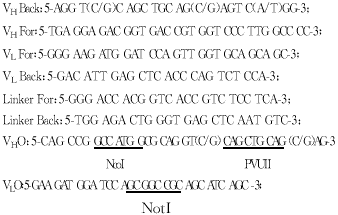
以上引物由上海Sangon生物工程公司帮助合成纯化。
1.4 50A单链抗体基因的构建[3] ①VH和VL基因克隆:收 集对数生长期杂交瘤细胞,异硫氰酸胍一步法[4]提取细胞总mRNA,逆转录合成cDN A第一链。用鼠源抗体引物(VH Back/VH For,VLBack/VLFor)从cDNA中分别PCR扩增 VH和VL基因,Microspin柱纯化扩增产物。②连接肽编码基因的克隆:以Linker Fo r和Linker Back为引物,含Linker质粒pSTE-215为模板,常规PCR克隆连接肽编码基因。③ 拼接PCR组装ScFv基因:在75 μl反应体系中,含纯化的VH、VL和十五肽接头基因各 20 ng,1.0 mmol/L dNTPs,2.0 mmol/L MgCl2,5 U Taq DNA多聚酶,混匀后进入拼接 循 环,条件为:95℃变性45 s,62℃退火2.5 min,72℃延伸1 min,共扩增8个循环;在反 应体系中加VHO和VLO引物各50 pmol, 5 U Taq DNA多聚酶的混合溶液25 μl,进入二 级 循环:94℃变性50 s,56℃退火1.5 min,72℃延伸1.5 min,共25个循环。拼接PCR反 应后,组装的ScFv基因5’、3’端分别加上与pCANTAB5E载体匹配的NcoI(NcoI与 SfiI具有 相匹配的粘性末端)及NotI酶切位点。
, http://www.100md.com
1.5 噬菌体单链抗体库的构建 将纯化的ScFv片段依次用NcoI/NotI酶切 ,M icrospin柱纯化,在T4 DNA连接酶作用下,定向插入pCANTAB5E表达载体(图1),常规CaCl 2法转化E.coli XL-1 Blue感受细胞,氨苄抗性丰富培养基培养转化细胞至OD600=0. 5,加入 总滴度约3×109pfu M13KO7辅助噬菌体援救,构建噬菌体抗体库,涂板测定抗体库滴度。
1.6 50A单链抗体的融合表达及纯化 转化体1/100转种20 ml含2%葡萄糖及 100 μg/ml氨苄青霉素(Amp)的LB培养液,于28℃~30℃振荡培养约4 h(OD600=0.5) , 加入总滴度为109 pfu的辅助噬菌体M13KO7,37℃水浴静置15 min。离心收集菌体,以等 体积L B液(无葡萄糖)洗涤2次,重悬于20 ml LBAK(含50 μg/ml卡那霉素及100 μg/ml Amp)液中 30℃培养过夜。培养液4℃ 10 000 r/min离心10 min,收集上清,按每ml上清加入150 μl PA溶液(16% PEG 6000,3.3 mol/L NaCl),4℃静置2 h,4℃ 10 000 r/min离心沉淀纯化噬 菌体。
, http://www.100md.com
1.7 噬菌体抗体库的亲和吸附及富集[5]
1.7.1 亲和吸附 取1012pfu纯化重组噬菌体重悬于2 ml PBS稀释的 正常人A型红细胞悬液(4×107 cell/ml)200 μl,轻柔混匀,4℃水浴30 min。离心去上清 ,红细胞沉淀用15 ml预冷的PBS 4℃洗涤4次,每次15 min。向洗涤红细胞沉淀中加预冷灭 菌去离子水30 μl,轻轻摇匀。此红细胞裂解液含有亲和富集的重组噬菌体。
1.7.2 转染和援救 将红细胞裂解液加入到3.0 ml新鲜培养的XL-1 Blue 菌液中(OD600=0.5),37℃静置水浴15 min。取1 μl测定菌斑形成单位(CFU),其余 菌液37℃振荡培养。同1.6进行援救和纯化,得到第一轮富集后的噬菌体抗 体库,重复1.7.1~1.7.2步骤3次。
, 百拇医药
图1 50A单链抗体表达载体pCANTAB5E构建示意图
Fig.1 The construction scheme of ScFv expression vector pCANTAB5E
1.8 重组噬菌体质粒的鉴定 挑取亲和富集后转化体,常规扩大培养,碱 裂解法提取质粒DNA,PEG法纯化质粒,用双酶切法和PCR扩增鉴定重组噬菌体[6]。
1.9 50A单链抗体的分泌表达 将滴度为1×109 pfu/ml阳性重组噬菌体 转染对数生长期HB2151细胞,铺板后挑单菌落于含1 mmol/L IPTG和100 μg/mg氨苄的2×YT 培养液中,25℃~30℃,培养20 h,离心收集上清。沉淀用PBS悬起,在液氮和37℃水浴中 反复冻融3次,离心收集上清,为细胞周质腔提取液。
, 百拇医药 1.10 表达产物的特异性鉴定 将包被有不同稀释度的A型和O型红细胞裂解 液及牛血清白蛋白(BSA)的硝酸纤维素条置入1∶10稀释的纯化噬菌体抗体液中,Dot-blot 实验[6]及红细胞血凝实验测定表达产物的免疫活性和特异性。将浓缩的分泌表达 上 清和周质腔提取液于12% SDS-PAGE电泳,电转移后,用抗E-tag抗体按文献 [6]方法进行免疫印迹试验,DAB显色。
2 结果
2.1 单链抗体基因PCR产物 用1.5%琼脂糖凝胶电泳检测PCR扩增产物,V H、VL扩增片段长度为350 bp左右,其中VH片段略长于VL片段;SOE PCR得到一长约75 0 bp特异性扩增片段,与实验设计单链抗体基因大小相符。ScFv基因前有一条约100 bp的非 特异性扩增条带,可能为引物多聚体(图2)。
, 百拇医药
2.2 噬菌体单链抗体库的构建及测定 将NcoI/NotI双酶切并纯化的50A ScFv基因克隆入噬菌体载体pCANTAB5E中,加入辅助噬菌体M13KO7超感染援救XL-1 Blue转 化菌中的pCANTAB5E重组噬菌体,构建成噬菌体单链抗体库。将抗体库培养上清稀释105倍 后,取1 μl加入1.0 ml E.coli XL-1 Blue菌液中涂板,得到噬菌斑42个,该抗体库滴度 约4×109 pfu/ml。
2.3 重组噬菌体质粒的酶切鉴定与DNA序列分析 从噬菌体抗体转染的XL- 1 Blue细胞中提取重组pCANTAB5E质粒,经PVUII/NotI双酶切,得到一长度为750 bp左右的 外源插入片段(图3)。对该质粒进行序列测定,结果与原构建ScFv抗体基因一致,50A-ScFv 全长747 bp。其中VH 366 bp,编码122个氨基酸;VL 336 bp,编码112个氨基酸,两者以连 接肽(Glu4Ser)3相连。50A ScFv末端接有检测肽E-tag基因。
, 百拇医药
图2 PCR产物凝胶电泳结果
Fig.2 PCR products of VH,VL and ScFv genes
Note:1.100 bp ladder;2.50 A-ScFv gene;3.VL gene;4.V H gene;5.DNA marker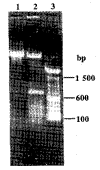
图3 重组噬粒pCANTAB5E酶切鉴定
Fig.3 Restriction endonuclease analysis of recombinant phagemid pCANTAB5 E
Note:1.pCANTAB5E control;2.recombinant pCANTAB5E;3.100 bp ladder
, 百拇医药
图4 HB2151转化菌表达产物Western-blot分析
Fig.4 The Western-blot analysis of ScFv product in transformed E.coli H B2151
Note:1.Untransformed HB2151 extract;2.Periplasm extract of transformed HB 2151;3.Concentrated supernatant of transformed HB2151
2.4 50A单链抗体的特异性鉴定免疫印迹检测E-tag,显示HB2151细胞周质腔提取液及培养上清均出现特异性显色条带,其中周质腔提取液显色较深,产物分子量约为28000 Mr,与理论计算值相符。Dot-blot测定显示,表达的噬菌体单链抗体50A-ScFv 可与A型红细胞裂解液反应,显色明显强于O型红细胞裂解液及BSA对照,但弱于亲本单抗阳性对照(图4)。用上述噬菌体抗体浓缩液与A型红细胞进行血凝试验,未能观察到肉眼可见的凝集现象。
, 百拇医药
3 讨论
噬菌体抗体技术已被广泛用于构建筛选特异性单链、单区或更小片段抗体,并成为不经过免疫筛选特异性人源抗体的重要手段[7]。它具有巨大的优越性:①可构建库容量 极大的免疫球蛋白随机联合文库;②具有强大的筛选功能,以特异性抗原筛选暴露于噬菌体 表面的多样性抗体片段,经过数轮淘选可将10-6~10-8水平的特异噬菌体抗体 筛选出来;③通过体外突变系统,在抗体可变区引入随机突变,可模拟抗原驱动下的体细胞突变抗体成熟过程,提高抗体的亲和力;④具有优越的表达性能,阳性噬粒感染琥珀非抑制型大肠杆菌时,抗体可分泌至细菌周质,经折叠后还可进一步分泌至细胞培养液中。可以预测 ,随着蛋白质三维结构预测和分子模拟技术与噬菌体抗体技术的融合,必将推动抗体改造及 抗原抗体作用的分子机制等多方面的研究进程。
利用单抗可变区基因构建的噬菌体单链抗体库库容物应是单一的,理论上可以直接挑取噬菌 体 阳性克隆,但由于建库过程中多次使用PCR技术,容易引入突变(尤其在抗原表位核心区的突 变),会增加噬菌体抗体库的无效(不具特异性抗体活性)表达的比率;同时某些无效突 变体 还可能具有更高的援救效率,从而在几轮转染援救后使噬菌体特异性表达丧失贻尽。因此, 为确保获得抗原特异性克隆,本研究在建立50A-ScFv抗体库时采用特异性抗原进行了三轮 亲和筛选。
, http://www.100md.com
本研究运用噬菌体表面呈现技术构建了50A噬菌体单链抗体库,并分别在琥珀抑制型大肠杆 菌和琥珀非抑制型大肠杆菌中实现了融合及分泌表达,产物经免疫杂交检测证实基本保留了 原亲本单抗的特异性和亲和力。但用表达的噬菌体单链抗体进行红细胞凝集试验未得到预期 的结果[5],分析原因主要有以下几点:噬菌体尾丝蛋白为低拷贝(4~5个),尾丝 蛋白融合表达单链抗体时在噬菌体表面以单价表达为主[8],双价或多价表达的比 例较少,单价抗体不能满足血凝的要求;重组噬菌体单链抗体的援救产率和亲和力较低;红 细胞之间的空间位阻效应及表面电荷排斥力也是血凝试验中不可忽视的因素[9]。 这些正是本实验需要进一步研究和改进之处,也是利用噬菌体表达可用于血型鉴定的基因工程抗体研究的关键问题。
本课题为“九五”全军招标课题(编号:96M025)
作者简介:王长军,男,28岁,主要从事分子免疫学研究;
, 百拇医药
唐家琪,男,54岁,博士生导师,主要从事病毒学、细胞分子免疫学研究
4 参考文献
1,Smith G P. Filamentous fusion phage:Novel expression vector t hat display cloned antigen on the viron. Science,1985;228:1315
2,唐家琪,陈竞芳,李先富 et al.可用于大量生产的抗A抗B杂交瘤的建立鉴定及应 用.中华血液学杂志,1991;12(2):137
3,王长军,唐家琪,潘秀珍 et al.抗人RBC A抗原50A株单抗可变区基因克隆及单链 抗体基因构建.中国输血杂志,1999;13(2):69
4,Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guani dium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987;162:156
, 百拇医药
5,Marks J D, Ouwehend W H, Bye J M et al. Human antibody fragment s s pecific for human blood group antigens from a phage display library. Bio/techno logy,1993;11:1145
6,Sambook J, Fritsch E F, Maniatis T.Molecular cloning:A laboratory m anual. 2nd ed. New York:Cold Spring Harbor Laboratory Press,1989:298
7,Winter G,Grriffiths A O.Making antibodies by phage display technology. Ann Rev Immunol,1994;12(2):433
8,Borrebaeck C A K, Marks J D. Antibody engineering. 2nd ed. New York:Oxford University Press,1995:53
9,赵侗茂编著.人类血型遗传学.北京:科学出版社,1986:14
[收稿1999-06-07], 百拇医药
单位:王长军(南京军区军事医学研究所 ,南京210002);李先富(南京军区军事医学研究所 ,南京210002);潘秀珍(南京军区军事医学研究所 ,南京210002);操敏(南京军区军事医学研究所 ,南京210002)
关键词:噬菌体表面呈现技术;单链抗体;ABO血型
中国免疫学杂志000505 摘 要 目的:构建表达抗人红细胞血型A抗原50A杂交瘤细胞的单链抗 体(ScFv)。方法:应用重组噬菌体抗体技术,从50A杂交瘤细胞中分离 、构建单链抗体基因,并将其克隆入噬粒pCANTAB5E中,转化E.coli XL-Blue,辅助噬菌体 援救构建50A噬菌体单链抗体库;采用完整红细胞亲和富集法淘选阳性重组噬菌体,鉴定重 组噬菌体并进行序列测定分析;免疫印迹试验检测重组单链抗体的特异性抗原活性。结果:用M13KO7援救XL-1 Blue转化菌中的pCANTAB5E重组噬菌体,得到滴度 为4×109 pfu/ml噬菌体单链抗体库;免疫印迹试验证实表达产物保留了亲本单抗对人红 细胞血型A抗原的特异性亲和力。结论:成功构建50A McAb单链噬菌体 抗体库,为进一步研制高特异性、高亲和力的基因工程原核血型检定抗体试剂奠定了基础。
, http://www.100md.com
中国图书分类号 R392.11
Expression of anti-RBC blood group A substance ScFv by using phage display tech nology
WANG Chang-Jun TANG Jia-Qi LI Xian-Fu
(Institute of Military Medicine, Nanjing Command,Nanjing 210002)
Abstract Objective:To construct a phage-displayed ScFv antibody of 50A hybridoma anti-blood group A substance.Methods:Based on recombinant phage display techniques,the construction,screening and expression of functional single-chain Fv fragment(ScFv) from murine hybrido ma 50A which secrets antibody specifity binding to human blood group A substa nce was performed. By RT-PCR for VH and VL genes assembly of ScFv genes and cl o ning into phagemid pCANTAB5E, transformation of E.coli XL-Blue cells and rescui n g with M13KO7 helper phage. The recombinant phages were panned by whole red bloo d cells over three rounds. Finally, the positive recombinant phages were sequenc ed and identified by immuno-blot assay. Results:A recombinant phage ScFv libra ry with titer of 4×109 pfu/ml was established. The result of immuno-blot in dicated that the phage-displayed 50A-ScFv retained the affinity and specificit y of the original intact antibody to blood group A substance.Conclusi on:Single chain antibody fragment 50A-ScFv displayed on the surface of filamentous phage was successfully produced,which would be potentially useful in constructing engineering antibody fragments as blood grouping reagents.
, 百拇医药
Key words Phage display technology Single-chain F v antibody Blood group ABO substance
噬菌体表面呈现技术(Phage display technology,PDT)是利用在改构的噬菌 体 外壳蛋白质基因PIII或PVIII区引入外源基因,以融合形式表达外源肽或蛋白,使其随着 噬 菌体的组装而呈现在噬菌体表面,保持特定的空间构象,并通过免疫亲和吸附法筛选特异性 肽或蛋白的一项新技术[1]。它的出现极大地推动了抗体工程的发展,为在体外 模拟免疫系统的抗原选择和抗体多样化过程,进而筛选高特异性、高亲和力的基因工程抗体 提 供了技术支持。本实验在已完成杂交瘤建株、分离抗体可变区基因等工作的基础上[2 ,3],采用噬菌体表面呈现技术,构建了抗人红细胞血型A抗原杂交瘤50A株噬 菌体单链抗体库,为研制第三代基因工程原核血型检定抗体试剂奠定了基础。
, http://www.100md.com
1 材料与方法
1.1 细胞和载体 小鼠杂交瘤细胞系50A由本室研制,分泌抗A单克隆抗体 ,为IgM类;E.coli HB2151、E.coli XL-Blue和含(Glu4Ser)3接头质粒pSTE-215为 德国Duble教授惠赠;测序用T-Vector easy Kit 购自Promega公司;噬菌体抗体表达载体p CANTAB5E和辅助噬菌体M13KO7购自Pharmacia公司。
1.2 工具酶和试剂 限制性核酸内切酶为Biolabs产品;T4 DNA连接酶、 IPTG、碱性磷酸酶为Promega公司产品;PCR Kit为上海Sangon生物工程公司产品;正常人分 离 红细胞由南京军区总医院提供;酶标抗E-tag抗体、鼠抗噬菌体衣壳蛋白抗体为Pharmacia 公 司产品;HRP标记兔抗鼠IgG抗体及DAB显色液为SABC产品。其余试剂均为分析纯级(A、R)或 分子生物学纯级。
, 百拇医药
1.3 PCR引物设计与合成 参考已知的小鼠抗体轻、重链可变区氨基酸序列 ,设计合成了抗体可变区5’端及3’端引物。用于扩增重链可变区的一对引物为VH Back 和VH For,用于扩增轻链可变区的一对引物为VL Back和VL For,引入连接肽编码基 因用于拼接PCR构建50A单链抗体基因的一对引物为Linker For和Linker Back,用于加端PCR 引入与pCANTAB5E克隆位点SfiI、NotI匹配的一对引物为VHO和VLO。引物序列如下:
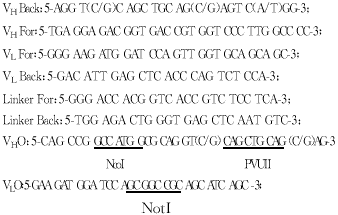
以上引物由上海Sangon生物工程公司帮助合成纯化。
1.4 50A单链抗体基因的构建[3] ①VH和VL基因克隆:收 集对数生长期杂交瘤细胞,异硫氰酸胍一步法[4]提取细胞总mRNA,逆转录合成cDN A第一链。用鼠源抗体引物(VH Back/VH For,VLBack/VLFor)从cDNA中分别PCR扩增 VH和VL基因,Microspin柱纯化扩增产物。②连接肽编码基因的克隆:以Linker Fo r和Linker Back为引物,含Linker质粒pSTE-215为模板,常规PCR克隆连接肽编码基因。③ 拼接PCR组装ScFv基因:在75 μl反应体系中,含纯化的VH、VL和十五肽接头基因各 20 ng,1.0 mmol/L dNTPs,2.0 mmol/L MgCl2,5 U Taq DNA多聚酶,混匀后进入拼接 循 环,条件为:95℃变性45 s,62℃退火2.5 min,72℃延伸1 min,共扩增8个循环;在反 应体系中加VHO和VLO引物各50 pmol, 5 U Taq DNA多聚酶的混合溶液25 μl,进入二 级 循环:94℃变性50 s,56℃退火1.5 min,72℃延伸1.5 min,共25个循环。拼接PCR反 应后,组装的ScFv基因5’、3’端分别加上与pCANTAB5E载体匹配的NcoI(NcoI与 SfiI具有 相匹配的粘性末端)及NotI酶切位点。
, http://www.100md.com
1.5 噬菌体单链抗体库的构建 将纯化的ScFv片段依次用NcoI/NotI酶切 ,M icrospin柱纯化,在T4 DNA连接酶作用下,定向插入pCANTAB5E表达载体(图1),常规CaCl 2法转化E.coli XL-1 Blue感受细胞,氨苄抗性丰富培养基培养转化细胞至OD600=0. 5,加入 总滴度约3×109pfu M13KO7辅助噬菌体援救,构建噬菌体抗体库,涂板测定抗体库滴度。
1.6 50A单链抗体的融合表达及纯化 转化体1/100转种20 ml含2%葡萄糖及 100 μg/ml氨苄青霉素(Amp)的LB培养液,于28℃~30℃振荡培养约4 h(OD600=0.5) , 加入总滴度为109 pfu的辅助噬菌体M13KO7,37℃水浴静置15 min。离心收集菌体,以等 体积L B液(无葡萄糖)洗涤2次,重悬于20 ml LBAK(含50 μg/ml卡那霉素及100 μg/ml Amp)液中 30℃培养过夜。培养液4℃ 10 000 r/min离心10 min,收集上清,按每ml上清加入150 μl PA溶液(16% PEG 6000,3.3 mol/L NaCl),4℃静置2 h,4℃ 10 000 r/min离心沉淀纯化噬 菌体。
, http://www.100md.com
1.7 噬菌体抗体库的亲和吸附及富集[5]
1.7.1 亲和吸附 取1012pfu纯化重组噬菌体重悬于2 ml PBS稀释的 正常人A型红细胞悬液(4×107 cell/ml)200 μl,轻柔混匀,4℃水浴30 min。离心去上清 ,红细胞沉淀用15 ml预冷的PBS 4℃洗涤4次,每次15 min。向洗涤红细胞沉淀中加预冷灭 菌去离子水30 μl,轻轻摇匀。此红细胞裂解液含有亲和富集的重组噬菌体。
1.7.2 转染和援救 将红细胞裂解液加入到3.0 ml新鲜培养的XL-1 Blue 菌液中(OD600=0.5),37℃静置水浴15 min。取1 μl测定菌斑形成单位(CFU),其余 菌液37℃振荡培养。同1.6进行援救和纯化,得到第一轮富集后的噬菌体抗 体库,重复1.7.1~1.7.2步骤3次。

, 百拇医药
图1 50A单链抗体表达载体pCANTAB5E构建示意图
Fig.1 The construction scheme of ScFv expression vector pCANTAB5E
1.8 重组噬菌体质粒的鉴定 挑取亲和富集后转化体,常规扩大培养,碱 裂解法提取质粒DNA,PEG法纯化质粒,用双酶切法和PCR扩增鉴定重组噬菌体[6]。
1.9 50A单链抗体的分泌表达 将滴度为1×109 pfu/ml阳性重组噬菌体 转染对数生长期HB2151细胞,铺板后挑单菌落于含1 mmol/L IPTG和100 μg/mg氨苄的2×YT 培养液中,25℃~30℃,培养20 h,离心收集上清。沉淀用PBS悬起,在液氮和37℃水浴中 反复冻融3次,离心收集上清,为细胞周质腔提取液。
, 百拇医药 1.10 表达产物的特异性鉴定 将包被有不同稀释度的A型和O型红细胞裂解 液及牛血清白蛋白(BSA)的硝酸纤维素条置入1∶10稀释的纯化噬菌体抗体液中,Dot-blot 实验[6]及红细胞血凝实验测定表达产物的免疫活性和特异性。将浓缩的分泌表达 上 清和周质腔提取液于12% SDS-PAGE电泳,电转移后,用抗E-tag抗体按文献 [6]方法进行免疫印迹试验,DAB显色。
2 结果
2.1 单链抗体基因PCR产物 用1.5%琼脂糖凝胶电泳检测PCR扩增产物,V H、VL扩增片段长度为350 bp左右,其中VH片段略长于VL片段;SOE PCR得到一长约75 0 bp特异性扩增片段,与实验设计单链抗体基因大小相符。ScFv基因前有一条约100 bp的非 特异性扩增条带,可能为引物多聚体(图2)。
, 百拇医药
2.2 噬菌体单链抗体库的构建及测定 将NcoI/NotI双酶切并纯化的50A ScFv基因克隆入噬菌体载体pCANTAB5E中,加入辅助噬菌体M13KO7超感染援救XL-1 Blue转 化菌中的pCANTAB5E重组噬菌体,构建成噬菌体单链抗体库。将抗体库培养上清稀释105倍 后,取1 μl加入1.0 ml E.coli XL-1 Blue菌液中涂板,得到噬菌斑42个,该抗体库滴度 约4×109 pfu/ml。
2.3 重组噬菌体质粒的酶切鉴定与DNA序列分析 从噬菌体抗体转染的XL- 1 Blue细胞中提取重组pCANTAB5E质粒,经PVUII/NotI双酶切,得到一长度为750 bp左右的 外源插入片段(图3)。对该质粒进行序列测定,结果与原构建ScFv抗体基因一致,50A-ScFv 全长747 bp。其中VH 366 bp,编码122个氨基酸;VL 336 bp,编码112个氨基酸,两者以连 接肽(Glu4Ser)3相连。50A ScFv末端接有检测肽E-tag基因。

, 百拇医药
图2 PCR产物凝胶电泳结果
Fig.2 PCR products of VH,VL and ScFv genes
Note:1.100 bp ladder;2.50 A-ScFv gene;3.VL gene;4.V H gene;5.DNA marker

图3 重组噬粒pCANTAB5E酶切鉴定
Fig.3 Restriction endonuclease analysis of recombinant phagemid pCANTAB5 E
Note:1.pCANTAB5E control;2.recombinant pCANTAB5E;3.100 bp ladder

, 百拇医药
图4 HB2151转化菌表达产物Western-blot分析
Fig.4 The Western-blot analysis of ScFv product in transformed E.coli H B2151
Note:1.Untransformed HB2151 extract;2.Periplasm extract of transformed HB 2151;3.Concentrated supernatant of transformed HB2151
2.4 50A单链抗体的特异性鉴定免疫印迹检测E-tag,显示HB2151细胞周质腔提取液及培养上清均出现特异性显色条带,其中周质腔提取液显色较深,产物分子量约为28000 Mr,与理论计算值相符。Dot-blot测定显示,表达的噬菌体单链抗体50A-ScFv 可与A型红细胞裂解液反应,显色明显强于O型红细胞裂解液及BSA对照,但弱于亲本单抗阳性对照(图4)。用上述噬菌体抗体浓缩液与A型红细胞进行血凝试验,未能观察到肉眼可见的凝集现象。
, 百拇医药
3 讨论
噬菌体抗体技术已被广泛用于构建筛选特异性单链、单区或更小片段抗体,并成为不经过免疫筛选特异性人源抗体的重要手段[7]。它具有巨大的优越性:①可构建库容量 极大的免疫球蛋白随机联合文库;②具有强大的筛选功能,以特异性抗原筛选暴露于噬菌体 表面的多样性抗体片段,经过数轮淘选可将10-6~10-8水平的特异噬菌体抗体 筛选出来;③通过体外突变系统,在抗体可变区引入随机突变,可模拟抗原驱动下的体细胞突变抗体成熟过程,提高抗体的亲和力;④具有优越的表达性能,阳性噬粒感染琥珀非抑制型大肠杆菌时,抗体可分泌至细菌周质,经折叠后还可进一步分泌至细胞培养液中。可以预测 ,随着蛋白质三维结构预测和分子模拟技术与噬菌体抗体技术的融合,必将推动抗体改造及 抗原抗体作用的分子机制等多方面的研究进程。
利用单抗可变区基因构建的噬菌体单链抗体库库容物应是单一的,理论上可以直接挑取噬菌 体 阳性克隆,但由于建库过程中多次使用PCR技术,容易引入突变(尤其在抗原表位核心区的突 变),会增加噬菌体抗体库的无效(不具特异性抗体活性)表达的比率;同时某些无效突 变体 还可能具有更高的援救效率,从而在几轮转染援救后使噬菌体特异性表达丧失贻尽。因此, 为确保获得抗原特异性克隆,本研究在建立50A-ScFv抗体库时采用特异性抗原进行了三轮 亲和筛选。
, http://www.100md.com
本研究运用噬菌体表面呈现技术构建了50A噬菌体单链抗体库,并分别在琥珀抑制型大肠杆 菌和琥珀非抑制型大肠杆菌中实现了融合及分泌表达,产物经免疫杂交检测证实基本保留了 原亲本单抗的特异性和亲和力。但用表达的噬菌体单链抗体进行红细胞凝集试验未得到预期 的结果[5],分析原因主要有以下几点:噬菌体尾丝蛋白为低拷贝(4~5个),尾丝 蛋白融合表达单链抗体时在噬菌体表面以单价表达为主[8],双价或多价表达的比 例较少,单价抗体不能满足血凝的要求;重组噬菌体单链抗体的援救产率和亲和力较低;红 细胞之间的空间位阻效应及表面电荷排斥力也是血凝试验中不可忽视的因素[9]。 这些正是本实验需要进一步研究和改进之处,也是利用噬菌体表达可用于血型鉴定的基因工程抗体研究的关键问题。
本课题为“九五”全军招标课题(编号:96M025)
作者简介:王长军,男,28岁,主要从事分子免疫学研究;
, 百拇医药
唐家琪,男,54岁,博士生导师,主要从事病毒学、细胞分子免疫学研究
4 参考文献
1,Smith G P. Filamentous fusion phage:Novel expression vector t hat display cloned antigen on the viron. Science,1985;228:1315
2,唐家琪,陈竞芳,李先富 et al.可用于大量生产的抗A抗B杂交瘤的建立鉴定及应 用.中华血液学杂志,1991;12(2):137
3,王长军,唐家琪,潘秀珍 et al.抗人RBC A抗原50A株单抗可变区基因克隆及单链 抗体基因构建.中国输血杂志,1999;13(2):69
4,Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guani dium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987;162:156
, 百拇医药
5,Marks J D, Ouwehend W H, Bye J M et al. Human antibody fragment s s pecific for human blood group antigens from a phage display library. Bio/techno logy,1993;11:1145
6,Sambook J, Fritsch E F, Maniatis T.Molecular cloning:A laboratory m anual. 2nd ed. New York:Cold Spring Harbor Laboratory Press,1989:298
7,Winter G,Grriffiths A O.Making antibodies by phage display technology. Ann Rev Immunol,1994;12(2):433
8,Borrebaeck C A K, Marks J D. Antibody engineering. 2nd ed. New York:Oxford University Press,1995:53
9,赵侗茂编著.人类血型遗传学.北京:科学出版社,1986:14
[收稿1999-06-07], 百拇医药