小鼠B7-1基因转染的黑色素瘤细胞免疫原性探讨
作者:刘然义 屈伸 过建莉m)yo%, 百拇医药
单位:刘然义(中山医科大学肿瘤防治中心,广东 广州 510060);屈伸(同济医科大学生化教研室,湖北 武汉 430030);过建莉(同济医科大学生化教研室,湖北 武汉 430030)m)yo%, 百拇医药
关键词:B7-1;黑色素瘤;免疫原性;肿瘤疫苗m)yo%, 百拇医药
免疫学杂志000307 [摘 要]目的 探讨B7-1分子对肿瘤细胞免疫原性的影响。方法 将小鼠B7-1基因转染的黑色素瘤细胞(B16-mB7.1)与野生型及空载体转染细胞(B16-wt和B16-neo)的免疫原性在体内外进行了比较。同源淋巴细胞肿瘤细胞混合培养(MTLCs)后测定淋巴细胞增殖指数和CTLs活性;将B16-neo和B16-mB7.1细胞接种于小鼠皮下,观察肿瘤生长速度。结果 B16-mB7.1在体外刺激淋巴细胞增殖和诱导CTLs的能力明显强于对照细胞(P<0.05);尽管B16-mB7.1与B16-neo细胞在体外增殖能力一致,但B16-B7.1细胞体内生长速度明显减慢(P<0.05)。结论 B16-B7.1分子在B16细胞中表达能增强其免疫原性。m)yo%, 百拇医药
[中图分类号]R739.5;R392.11 [文献标识码]Am)yo%, 百拇医药
[文章编号]1000-8861(2000)03-0186-03m)yo%, 百拇医药
Study on the immunogenicity of murine B7-1 cDNA transfected B16 melanoma cellsm)yo%, 百拇医药
LIU Ran-yim)yo%, 百拇医药
(Cancer Center,Sun Yet-sen University of Medical Sciences,Guangzhou 510060,China)m)yo%, 百拇医药
QU Shen,GUO Jian-lim)yo%, 百拇医药
(Department of Biochemistry,Tongji Medical University,Wuhan 430030,China)m)yo%, 百拇医药
[Abstract]Objective To investigate the effect of B7-1 molecule on increasing the immunogenicity of tumor cells.Methods Immunogenicity of murine B7-1 cDNA-transfected B16 melanoma cells(B16-mB7.1)was compared with that of parental and mock-transfected B16 cells(B16-wt,B16-neo).The lymphocytes were examined for both proliferation indices(PI) and specific lysis activity against B16-wt cells after syngeneic Mixed Lymphocyte Tumor Cultures(MLTCs) had been conducted for 6d.Injected subcutaneously into syngeneic mice,the growth rates of B16-neo and B16-mB7.1 cells were tested.Results B16-mB7.1 cells could induce more effective proliferation of effector lymphocytes and stronger specific lytic activity against B16-wt cells than control cells(P<0.05).In vivo,B16-mB7.1 cells grew slower than B16-neo cells(P<0.05),though they showed the same growth rate in vitro.Conclusion B7-1 expression can help poor immunogenic tumor cells to increase their immunogenicity.
[Key words]B7-1;melanoma;immunogenicity;tumor vaccineh0w[, http://www.100md.com
大多数肿瘤细胞表达MHC-Ⅰ类分子和肿瘤抗原,是潜在的抗原提呈细胞[1]。但其免疫原性较弱,不能有效地激活淋巴细胞,故能逃避机体免疫监视发展成为肿瘤[2]。经研究发现,B7-1分子的缺乏是重要原因之一[3]。为此,我们对mB7-1基因转染的小鼠黑色素瘤细胞B16-mB7.1的免疫原性和致瘤性进行了实验研究。h0w[, http://www.100md.com
1 材料与方法h0w[, http://www.100md.com
1.1 实验动物和细胞 C57BL/6小鼠,6~8周龄,雌性,购自上海西普尔-必凯实验动物有限公司。小鼠黑色素瘤细胞系B16(F0)(B16-wt,源于C57BL/6小鼠)购自武汉大学;B16-mB7.1和B16-neo系本室建立的分别转染小鼠B7-1基因和空载体的B16细胞系[4],用含10%小牛血清的DMEM(Gibco)培养;淋巴细胞来源于未免疫的同源小鼠脾脏,用含10%FCS的1640(Gibco)培养。培养条件为37°C、5%CO2。h0w[, http://www.100md.com
1.2 淋巴细胞增殖指数(Proliferation Indices,PI)的测定 将3种肿瘤细胞灭活(5×106/ml肿瘤细胞用80mg丝裂霉素C 37°C处理1h)后,与淋巴细胞混合培养(每孔0.2ml培养液,含105淋巴细胞和104肿瘤细胞,对照组只含淋巴细胞或者肿瘤细胞)。培养条件同淋巴细胞。6d后用MTT法测定淋巴细胞增殖指数(PI)。PI值=(实验孔A570nm—肿瘤细胞孔A570nm)/淋巴细胞孔A570nm。h0w[, http://www.100md.com
1.3 CTLs的诱导及其杀伤活性的检测 淋巴细胞与灭活的肿瘤细胞混合培养6d(每孔2ml,含6×106淋巴细胞和2×105肿瘤细胞)。收集淋巴细胞作为效应细胞,以B16-wt为靶细胞,用LDH释放改良法[5]测定其特异杀伤活性,效靶比为25∶1。杀伤活性按下列公式计算:杀伤活性=(实验孔A570nm—自然释放孔A570nm)/(最大释放孔A570nm—自然释放孔A570nm)×100%。
1.4 肿瘤细胞体内外生长增殖能力的观察 肿瘤细胞体外增殖能力以A570nm来衡量(MTT法)。体内实验分两组进行,分别在C57BL/6小鼠皮下接种B16-neo或B16-mB7.1细胞(5×104/0.1ml),观察肿瘤生长情况。肿瘤生长速度以成瘤潜伏期、荷瘤小鼠存活期和肿瘤结节大小来衡量。潜伏期和存活期分别为肿瘤结节直径达到2mm和荷瘤小鼠死亡所需的天数,而肿瘤结节大小用两垂直方向直径的平均值来表示。s, http://www.100md.com
1.5 统计学处理 本实验中数据均采用未配对资料的t检验进行统计分析。s, http://www.100md.com
2 结果s, http://www.100md.com
2.1 淋巴细胞增殖效应和CTLs杀伤活性 B16-mB7.1组淋巴细胞增殖指数(PI值)和CTL杀伤活性均显著高于B16-wt和B16-neo组(见图1,图2)。这说明表达B7-1分子有利于诱导T细胞活化。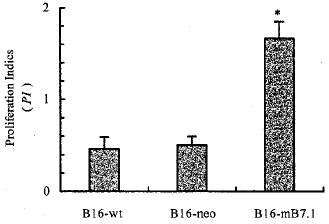 s, http://www.100md.com
s, http://www.100md.com
*P<0.05,compared with B16-wt and B16-neo cells(n=3)s, http://www.100md.com
图1 B16-mB7.1有效地刺激淋巴细胞增殖s, http://www.100md.com
Fig1 B16-mB7.1 cells stimulated effective lymphocyte proliferation s, http://www.100md.com
s, http://www.100md.com
图2 B16-mB7.1细胞诱导淋巴细胞产生特异杀伤活性s, http://www.100md.com
Fig2 B16-mB7.1 cells induced specific lysis activity against B16-wts, http://www.100md.com
2.2 体外培养肿瘤细胞的增殖能力 MTT法测得B16-mB7.1细胞与对照细胞(B16-wt、B16-neo)体外生长速度无显著差异(A570nm分别为1.140±0.202,0.893±0.135,1.170±0.122,P>0.05,n=3)。s, http://www.100md.com
2.3 肿瘤细胞体内生长速度 与B16-neo组相比,B16-mB7.1组小鼠成瘤潜伏期和荷瘤小鼠存活期都显著延长(见表1),肿瘤结节的生长速度明显减慢(见图3),这说明B16-mB7.1细胞体内生长能力明显低于B16-neo细胞。
表1 两种肿瘤细胞在小鼠皮下成瘤潜伏期及荷瘤小鼠存活期比较wtn*%6, 百拇医药
Tab1 The comparison of latency and survival times of C57BL/6 mice challenged subcutaneously two melanoma cell lines Celllinewtn*%6, 百拇医药
nwtn*%6, 百拇医药
Latency time(d)wtn*%6, 百拇医药
Survival time(d)wtn*%6, 百拇医药
B16-neowtn*%6, 百拇医药
6wtn*%6, 百拇医药
12.0±4.1 wtn*%6, 百拇医药
28.8±5.1 wtn*%6, 百拇医药
B16-mB7.1wtn*%6, 百拇医药
6wtn*%6, 百拇医药
20.0±5.3wtn*%6, 百拇医药
41.8±8.1wtn*%6, 百拇医药
*P<0.05,compared with B16-neo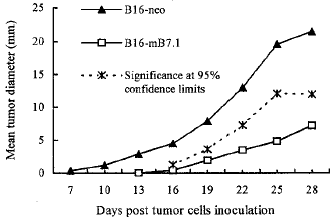 wtn*%6, 百拇医药
wtn*%6, 百拇医药
图3 皮下接种B16-B7.1细胞后C57BL/6小鼠体内肿瘤结节生长速度wtn*%6, 百拇医药
Fig3 Tumor growth rate in C57BL/6 mice injected subcutaneously with B16-mB7.1 cellswtn*%6, 百拇医药
3 讨论wtn*%6, 百拇医药
基因修饰瘤苗的主动、特异性免疫是提高抗肿瘤免疫效果的重要研究方向。由于肿瘤细胞抗原性弱,人们试图用各种免疫刺激分子基因修饰肿瘤细胞以增强其免疫原性,其中共刺激分子B7基因受到大家重视。有实验证实,将B7基因导入肿瘤细胞能增强其免疫原性[2,6],但其效应似乎与肿瘤细胞自身抗原性强弱有关[7,8]。在抗原性较强的肿瘤细胞(EL-4淋巴瘤细胞、黑色素瘤细胞株K1735-M2/E7C3等)中导入B7-1基因可在同源小鼠体内导致完全的免疫排斥;在弱/无免疫原性的肿瘤细胞中效果却不太理想[2,7,8]。
为了进一步探讨B7-1基因在弱免疫原性肿瘤细胞中表达对其免疫原性的影响及其与肿瘤细胞其它表面分子的关系,本文以免疫原性很弱的小鼠黑色素瘤细胞系B16(F0)为靶细胞进行了研究。结果发现将B7-1基因导入B16细胞能使其在同源小鼠体内生长速度减慢,这可能是由于机体对其产生了一定的免疫排斥反应所致。这一假设在体外实验中得到了证实:B16-B7.1细胞能较有效诱导T细胞活化。2, http://www.100md.com
B7-1基因的导入确实能在一定程度上增强B16细胞的免疫原性,但没能消除其致瘤性。这可能与B16细胞表面分子表达情况有关[7]。B16细胞不表达MHC-Ⅱ类分子,MHC-Ⅰ类分子表达水平较低,提呈抗原能力弱;B16细胞不表达细胞间粘附分子1(ICAM-1),而ICAM-1也是一种重要的共刺激分子—通过与T细胞表面LFA-1作用,促进T细胞活化[9],并与B7-1分子存在协同作用[10]。基于这些原因,有人用MHC-Ⅱ类基因[11]或ICAM-1基因[10]修饰B16黑色素瘤细胞以增强其免疫原性,且获得了一定的效果,但单基因修饰效果均不够理想。所以对于弱免疫原性肿瘤(如B16细胞)来说,多基因(B7分子、MHC分子、细胞因子和/或ICMA-1等)联合导入将是最佳的方案和途径。2, http://www.100md.com
[基金项目]国家教委基金资助项目(JW9307)2, http://www.100md.com
[作者简介]刘然义(1967-),男,湖北天门市人,助理研究员,硕士,主要从事肿瘤生物治疗研究。2, http://www.100md.com
[参考文献]2, http://www.100md.com
[1]LURQUIN C,VAN PEL A,MARIAME B,et al.Structure of the Gene of Tum-Transplantation Antigen P91A:The Mutated Exon Encodes a Peptide Re-cognized with Ld by Cytolytic T cells[J].Cell,1989,58:293~303.2, http://www.100md.com
[2]CHEN L,ASHE S,BRADY WA,et al.Costimula-tion of antitumor immunity by the B7 counterreceptor for the T lymphocyte molecules CD28 and CTLA-4[J].Cell,1992,71:1093~1102.
[3]GIMMI CD,FREEMAN GJ,GRIGGEN JG,et al.Human T-Cell Clonal Anergy is Induced by Antigen Presentation in the Absence of B7 Costimulation[J].Proc Natl Sci USA,1993,90:6586~6590.12epj, 百拇医药
[4]刘然义,屈伸.B7-1 cDNA的克隆、测序、表达及其抗瘤效应的初步探讨[J].武汉大学学报,1999,45(2):225~228.12epj, 百拇医药
[5]陈丙莺,尤丽芬.简易自然杀伤试验-LDH释放改良法[J].上海免疫学杂志,1989,9(4):218~219.12epj, 百拇医药
[6]杨世成,李树浓,刘芳,等.转染B7-1基因至鼻咽癌细胞株及其诱导的细胞免疫应答[J].免疫学杂志,1998,14(3):172~175.12epj, 百拇医药
[7]CHEN L,McGOWAN P,ASHE S,et al.Tumor immunogenicity determines the effect of B7 costimulation on T cell-mediated tumor immunity[J].J Exp Med,1994,179:523~532.12epj, 百拇医药
[8]马强中,吴易中,遇珑,等.共刺激信号B7-1表达对小鼠肿瘤细胞生长和转移的影响[J].中华医学杂志,1997,77(5):374~377.12epj, 百拇医药
[9]VAN SEVENTER GA,NEWMAN W,SHIMIZU Y,et al.Analysis of T cell stimulation by superantigen plus major histocompatibility complex class Ⅱ molecules or by CD3 monoclonal antibody:costimulation by purified adhesion ligands VCAM-1,ICAM-1,but not ELAM-1[J].J Exp Med,1991,174:901~913.12epj, 百拇医药
[10]AVALLO F,MARTIN-FONTECHA A,BELLONE M,et al.Co-expression of B7-l and ICAM-1 on tumors is required for rejection and the establishment of a memory response[J].Eur J Immunol,1995,25:1154~1162.12epj, 百拇医药
[11]BASKAR S,CLEMENTS VK,GLIMCHER LH,et al.Rejection of MHC Class Ⅱ-Transfected Tumor Cells Requires Induction of Tumor-Encoded B7-1 and/or B7-2 Costimulatory Molecules[J].J Immunol,1996,156:3821~3827.12epj, 百拇医药
[收稿日期]1999-03-10;[修回日期]1999-10-20(刘然义 屈伸 过建莉)
单位:刘然义(中山医科大学肿瘤防治中心,广东 广州 510060);屈伸(同济医科大学生化教研室,湖北 武汉 430030);过建莉(同济医科大学生化教研室,湖北 武汉 430030)m)yo%, 百拇医药
关键词:B7-1;黑色素瘤;免疫原性;肿瘤疫苗m)yo%, 百拇医药
免疫学杂志000307 [摘 要]目的 探讨B7-1分子对肿瘤细胞免疫原性的影响。方法 将小鼠B7-1基因转染的黑色素瘤细胞(B16-mB7.1)与野生型及空载体转染细胞(B16-wt和B16-neo)的免疫原性在体内外进行了比较。同源淋巴细胞肿瘤细胞混合培养(MTLCs)后测定淋巴细胞增殖指数和CTLs活性;将B16-neo和B16-mB7.1细胞接种于小鼠皮下,观察肿瘤生长速度。结果 B16-mB7.1在体外刺激淋巴细胞增殖和诱导CTLs的能力明显强于对照细胞(P<0.05);尽管B16-mB7.1与B16-neo细胞在体外增殖能力一致,但B16-B7.1细胞体内生长速度明显减慢(P<0.05)。结论 B16-B7.1分子在B16细胞中表达能增强其免疫原性。m)yo%, 百拇医药
[中图分类号]R739.5;R392.11 [文献标识码]Am)yo%, 百拇医药
[文章编号]1000-8861(2000)03-0186-03m)yo%, 百拇医药
Study on the immunogenicity of murine B7-1 cDNA transfected B16 melanoma cellsm)yo%, 百拇医药
LIU Ran-yim)yo%, 百拇医药
(Cancer Center,Sun Yet-sen University of Medical Sciences,Guangzhou 510060,China)m)yo%, 百拇医药
QU Shen,GUO Jian-lim)yo%, 百拇医药
(Department of Biochemistry,Tongji Medical University,Wuhan 430030,China)m)yo%, 百拇医药
[Abstract]Objective To investigate the effect of B7-1 molecule on increasing the immunogenicity of tumor cells.Methods Immunogenicity of murine B7-1 cDNA-transfected B16 melanoma cells(B16-mB7.1)was compared with that of parental and mock-transfected B16 cells(B16-wt,B16-neo).The lymphocytes were examined for both proliferation indices(PI) and specific lysis activity against B16-wt cells after syngeneic Mixed Lymphocyte Tumor Cultures(MLTCs) had been conducted for 6d.Injected subcutaneously into syngeneic mice,the growth rates of B16-neo and B16-mB7.1 cells were tested.Results B16-mB7.1 cells could induce more effective proliferation of effector lymphocytes and stronger specific lytic activity against B16-wt cells than control cells(P<0.05).In vivo,B16-mB7.1 cells grew slower than B16-neo cells(P<0.05),though they showed the same growth rate in vitro.Conclusion B7-1 expression can help poor immunogenic tumor cells to increase their immunogenicity.
[Key words]B7-1;melanoma;immunogenicity;tumor vaccineh0w[, http://www.100md.com
大多数肿瘤细胞表达MHC-Ⅰ类分子和肿瘤抗原,是潜在的抗原提呈细胞[1]。但其免疫原性较弱,不能有效地激活淋巴细胞,故能逃避机体免疫监视发展成为肿瘤[2]。经研究发现,B7-1分子的缺乏是重要原因之一[3]。为此,我们对mB7-1基因转染的小鼠黑色素瘤细胞B16-mB7.1的免疫原性和致瘤性进行了实验研究。h0w[, http://www.100md.com
1 材料与方法h0w[, http://www.100md.com
1.1 实验动物和细胞 C57BL/6小鼠,6~8周龄,雌性,购自上海西普尔-必凯实验动物有限公司。小鼠黑色素瘤细胞系B16(F0)(B16-wt,源于C57BL/6小鼠)购自武汉大学;B16-mB7.1和B16-neo系本室建立的分别转染小鼠B7-1基因和空载体的B16细胞系[4],用含10%小牛血清的DMEM(Gibco)培养;淋巴细胞来源于未免疫的同源小鼠脾脏,用含10%FCS的1640(Gibco)培养。培养条件为37°C、5%CO2。h0w[, http://www.100md.com
1.2 淋巴细胞增殖指数(Proliferation Indices,PI)的测定 将3种肿瘤细胞灭活(5×106/ml肿瘤细胞用80mg丝裂霉素C 37°C处理1h)后,与淋巴细胞混合培养(每孔0.2ml培养液,含105淋巴细胞和104肿瘤细胞,对照组只含淋巴细胞或者肿瘤细胞)。培养条件同淋巴细胞。6d后用MTT法测定淋巴细胞增殖指数(PI)。PI值=(实验孔A570nm—肿瘤细胞孔A570nm)/淋巴细胞孔A570nm。h0w[, http://www.100md.com
1.3 CTLs的诱导及其杀伤活性的检测 淋巴细胞与灭活的肿瘤细胞混合培养6d(每孔2ml,含6×106淋巴细胞和2×105肿瘤细胞)。收集淋巴细胞作为效应细胞,以B16-wt为靶细胞,用LDH释放改良法[5]测定其特异杀伤活性,效靶比为25∶1。杀伤活性按下列公式计算:杀伤活性=(实验孔A570nm—自然释放孔A570nm)/(最大释放孔A570nm—自然释放孔A570nm)×100%。
1.4 肿瘤细胞体内外生长增殖能力的观察 肿瘤细胞体外增殖能力以A570nm来衡量(MTT法)。体内实验分两组进行,分别在C57BL/6小鼠皮下接种B16-neo或B16-mB7.1细胞(5×104/0.1ml),观察肿瘤生长情况。肿瘤生长速度以成瘤潜伏期、荷瘤小鼠存活期和肿瘤结节大小来衡量。潜伏期和存活期分别为肿瘤结节直径达到2mm和荷瘤小鼠死亡所需的天数,而肿瘤结节大小用两垂直方向直径的平均值来表示。s, http://www.100md.com
1.5 统计学处理 本实验中数据均采用未配对资料的t检验进行统计分析。s, http://www.100md.com
2 结果s, http://www.100md.com
2.1 淋巴细胞增殖效应和CTLs杀伤活性 B16-mB7.1组淋巴细胞增殖指数(PI值)和CTL杀伤活性均显著高于B16-wt和B16-neo组(见图1,图2)。这说明表达B7-1分子有利于诱导T细胞活化。
 s, http://www.100md.com
s, http://www.100md.com*P<0.05,compared with B16-wt and B16-neo cells(n=3)s, http://www.100md.com
图1 B16-mB7.1有效地刺激淋巴细胞增殖s, http://www.100md.com
Fig1 B16-mB7.1 cells stimulated effective lymphocyte proliferation
 s, http://www.100md.com
s, http://www.100md.com图2 B16-mB7.1细胞诱导淋巴细胞产生特异杀伤活性s, http://www.100md.com
Fig2 B16-mB7.1 cells induced specific lysis activity against B16-wts, http://www.100md.com
2.2 体外培养肿瘤细胞的增殖能力 MTT法测得B16-mB7.1细胞与对照细胞(B16-wt、B16-neo)体外生长速度无显著差异(A570nm分别为1.140±0.202,0.893±0.135,1.170±0.122,P>0.05,n=3)。s, http://www.100md.com
2.3 肿瘤细胞体内生长速度 与B16-neo组相比,B16-mB7.1组小鼠成瘤潜伏期和荷瘤小鼠存活期都显著延长(见表1),肿瘤结节的生长速度明显减慢(见图3),这说明B16-mB7.1细胞体内生长能力明显低于B16-neo细胞。
表1 两种肿瘤细胞在小鼠皮下成瘤潜伏期及荷瘤小鼠存活期比较wtn*%6, 百拇医药
Tab1 The comparison of latency and survival times of C57BL/6 mice challenged subcutaneously two melanoma cell lines Celllinewtn*%6, 百拇医药
nwtn*%6, 百拇医药
Latency time(d)wtn*%6, 百拇医药
Survival time(d)wtn*%6, 百拇医药
B16-neowtn*%6, 百拇医药
6wtn*%6, 百拇医药
12.0±4.1 wtn*%6, 百拇医药
28.8±5.1 wtn*%6, 百拇医药
B16-mB7.1wtn*%6, 百拇医药
6wtn*%6, 百拇医药
20.0±5.3wtn*%6, 百拇医药
41.8±8.1wtn*%6, 百拇医药
*P<0.05,compared with B16-neo
 wtn*%6, 百拇医药
wtn*%6, 百拇医药图3 皮下接种B16-B7.1细胞后C57BL/6小鼠体内肿瘤结节生长速度wtn*%6, 百拇医药
Fig3 Tumor growth rate in C57BL/6 mice injected subcutaneously with B16-mB7.1 cellswtn*%6, 百拇医药
3 讨论wtn*%6, 百拇医药
基因修饰瘤苗的主动、特异性免疫是提高抗肿瘤免疫效果的重要研究方向。由于肿瘤细胞抗原性弱,人们试图用各种免疫刺激分子基因修饰肿瘤细胞以增强其免疫原性,其中共刺激分子B7基因受到大家重视。有实验证实,将B7基因导入肿瘤细胞能增强其免疫原性[2,6],但其效应似乎与肿瘤细胞自身抗原性强弱有关[7,8]。在抗原性较强的肿瘤细胞(EL-4淋巴瘤细胞、黑色素瘤细胞株K1735-M2/E7C3等)中导入B7-1基因可在同源小鼠体内导致完全的免疫排斥;在弱/无免疫原性的肿瘤细胞中效果却不太理想[2,7,8]。
为了进一步探讨B7-1基因在弱免疫原性肿瘤细胞中表达对其免疫原性的影响及其与肿瘤细胞其它表面分子的关系,本文以免疫原性很弱的小鼠黑色素瘤细胞系B16(F0)为靶细胞进行了研究。结果发现将B7-1基因导入B16细胞能使其在同源小鼠体内生长速度减慢,这可能是由于机体对其产生了一定的免疫排斥反应所致。这一假设在体外实验中得到了证实:B16-B7.1细胞能较有效诱导T细胞活化。2, http://www.100md.com
B7-1基因的导入确实能在一定程度上增强B16细胞的免疫原性,但没能消除其致瘤性。这可能与B16细胞表面分子表达情况有关[7]。B16细胞不表达MHC-Ⅱ类分子,MHC-Ⅰ类分子表达水平较低,提呈抗原能力弱;B16细胞不表达细胞间粘附分子1(ICAM-1),而ICAM-1也是一种重要的共刺激分子—通过与T细胞表面LFA-1作用,促进T细胞活化[9],并与B7-1分子存在协同作用[10]。基于这些原因,有人用MHC-Ⅱ类基因[11]或ICAM-1基因[10]修饰B16黑色素瘤细胞以增强其免疫原性,且获得了一定的效果,但单基因修饰效果均不够理想。所以对于弱免疫原性肿瘤(如B16细胞)来说,多基因(B7分子、MHC分子、细胞因子和/或ICMA-1等)联合导入将是最佳的方案和途径。2, http://www.100md.com
[基金项目]国家教委基金资助项目(JW9307)2, http://www.100md.com
[作者简介]刘然义(1967-),男,湖北天门市人,助理研究员,硕士,主要从事肿瘤生物治疗研究。2, http://www.100md.com
[参考文献]2, http://www.100md.com
[1]LURQUIN C,VAN PEL A,MARIAME B,et al.Structure of the Gene of Tum-Transplantation Antigen P91A:The Mutated Exon Encodes a Peptide Re-cognized with Ld by Cytolytic T cells[J].Cell,1989,58:293~303.2, http://www.100md.com
[2]CHEN L,ASHE S,BRADY WA,et al.Costimula-tion of antitumor immunity by the B7 counterreceptor for the T lymphocyte molecules CD28 and CTLA-4[J].Cell,1992,71:1093~1102.
[3]GIMMI CD,FREEMAN GJ,GRIGGEN JG,et al.Human T-Cell Clonal Anergy is Induced by Antigen Presentation in the Absence of B7 Costimulation[J].Proc Natl Sci USA,1993,90:6586~6590.12epj, 百拇医药
[4]刘然义,屈伸.B7-1 cDNA的克隆、测序、表达及其抗瘤效应的初步探讨[J].武汉大学学报,1999,45(2):225~228.12epj, 百拇医药
[5]陈丙莺,尤丽芬.简易自然杀伤试验-LDH释放改良法[J].上海免疫学杂志,1989,9(4):218~219.12epj, 百拇医药
[6]杨世成,李树浓,刘芳,等.转染B7-1基因至鼻咽癌细胞株及其诱导的细胞免疫应答[J].免疫学杂志,1998,14(3):172~175.12epj, 百拇医药
[7]CHEN L,McGOWAN P,ASHE S,et al.Tumor immunogenicity determines the effect of B7 costimulation on T cell-mediated tumor immunity[J].J Exp Med,1994,179:523~532.12epj, 百拇医药
[8]马强中,吴易中,遇珑,等.共刺激信号B7-1表达对小鼠肿瘤细胞生长和转移的影响[J].中华医学杂志,1997,77(5):374~377.12epj, 百拇医药
[9]VAN SEVENTER GA,NEWMAN W,SHIMIZU Y,et al.Analysis of T cell stimulation by superantigen plus major histocompatibility complex class Ⅱ molecules or by CD3 monoclonal antibody:costimulation by purified adhesion ligands VCAM-1,ICAM-1,but not ELAM-1[J].J Exp Med,1991,174:901~913.12epj, 百拇医药
[10]AVALLO F,MARTIN-FONTECHA A,BELLONE M,et al.Co-expression of B7-l and ICAM-1 on tumors is required for rejection and the establishment of a memory response[J].Eur J Immunol,1995,25:1154~1162.12epj, 百拇医药
[11]BASKAR S,CLEMENTS VK,GLIMCHER LH,et al.Rejection of MHC Class Ⅱ-Transfected Tumor Cells Requires Induction of Tumor-Encoded B7-1 and/or B7-2 Costimulatory Molecules[J].J Immunol,1996,156:3821~3827.12epj, 百拇医药
[收稿日期]1999-03-10;[修回日期]1999-10-20(刘然义 屈伸 过建莉)