应用循环逆转录PCR技术检测丙型肝炎病毒RNA
作者:陈燃 伍迪 唐榕 汪进 毛裕民
单位:复旦大学遗传学研究所遗传工程国家重点实验室 上海 200433
关键词:循环逆转录;RT-PCR;HCV;竞争定量PCR
病毒学报000316摘要:循环逆转录(circulatory reverse transcription,CRT)是线性增长逆转录cDNA产量的一种新技术。为了将该技术用于检测HCV RNA,通过改变CRT的循环次数,结合竞争PCR,作出标准曲线。采用16次CRT加34次循环PCR检测了136例HCV ELISA阳性、54例HCV ELISA阴性和108例临床可疑病人全血标本,并与逆转录PCR(RT-PCR)和巢式PCR(NT-PCR)的检测结果相比较,显示HCV RNA总检出率分别为:57.9%、35.6%、58.6%。结果提示,CRT-PCR是一种简便有效的提高RNA检测灵敏度的方法,并适合应用于定量分析
, 百拇医药
中图分类号:R373.2+1;Q522 文献标识码:A
文章编号:1000-8721(2000)03-0266-04
Detection of Hepatitis C Virus RNA by Circulatory Reverse Transcription-PCR
CHEN Ran,WU Di,TANG Rong,WANG Jin,MAO Yu-min
(State Key Laboratory of Genetic Engineering, Institute of Genetics, Fudan University, Shanghai 200433, China)
Abstract: Circulatory reverse transcription (CRT) reaction is a new technique which can linearly increase cDNA products of reverse transcription reaction and is applied to detect Hepatitis C virus (HCV) RNA. By varying the cycles of CRT, along with the competitive PCR method, we have produced a standard curve. 136 HCV-positive blood samples, 54 HCV-negative blood samples (detected by ELISA) and 108 clinical blood samples were detected with 16 cycles of CRT plus 34 cycles of PCR and a comparative analysis with RT-PCR and NT-PCR detection was conducted. The HCV RNA totally positive rates were 57.9%, 35.6% and 58.6% respectively. The result indicates that the CRT-PCR is a convenient device to enhance the sensitivity of RNA detection and can be applied in the quantification of RNA.
, 百拇医药
Key words: circulatory reverse transcription (CRT); RT -PCR; HCV; quantitative competitive PCR (QC-PCR)
FD-耐热逆转录酶(FD-thermostable reverse transcriptase,FD-TRT)是由本实验室发现并生产[1,2]。根据该酶能耐受使核酸变性的高温,并在较高温度下保持逆转录催化活性的特性,我们发明了循环逆转录(CRT)(已申请国家发明专利):在逆转录反应中引入高温变性和低温退火延伸的循环过程,通过控制温度变化,反复利用起始的RNA作为模板进行逆转录,可以得到拷贝数几十倍于模板RNA的cDNA,从而提高RNA检测和分析的灵敏度。
直接检测血样中HCV RNA是判断HCV感染及传染性的可靠指标,被感染者体内病毒的含量与临床发病情况、治疗的反应性及预后相关,因此,对HCV RNA的定量检测具有重要的临床意义。但HCV感染者血液中的病毒数量很少,所以一般应用巢式PCR(nested primers-PCR),采用二步PCR扩增,以提高检测的灵敏度,然而巢式PCR增加了引物设计的难度和实验的复杂性,而且操作技术要求高而繁琐,易导致PCR产物污染,定量分析很困难,成本较高等,因此不利于推广应用[3,7]。本实验中,应用CRT-PCR对血清HCV RNA进行了检测研究,并结合定量PCR技术,通过作出定量标准曲线,验证CRT是线性增长过程。结果提示,通过改变CRT的循环数,即可得到定量PCR所需的起始模板量的梯度变化。
, 百拇医药
材料与方法
1 样品来源 136例抗-HCV ELISA 阳性和54例抗-HCV ELISA阴性血清,来自于献血人群(检测采用上海科华实业生产的试剂盒),由上海第二医科大学免疫室提供。108例肝功能指标异常临床检验样品,由安徽省巢湖地区中心血站提供。
2 RNA模板 采用异硫氰酸胍-酚-氯仿一步法并略加改进[4]。RNA溶于DEPC处理过的无菌水中。
3 引物 引物位于HCV序列5'-NS区,由上海生工生物工程公司代为合成,其序列如下(OP1和IP1近3'端有变异,OP1 34和35位核苷酸、IP1 59位核苷酸有变异,但不影响扩增[3,6]):
OP1,位于正链18~38:5'-GGCGACACTCCACCATAGATC
, 百拇医药
OP2,位于负链446~426:5'-GTAAACTCCACCAACGATCTG
IP1,位于正链46~65:5'-CTGTGAGGAACTACTGTCTTC
IP2,位于负链341~321:5'-GGTGCACGGTCTACGAGACCT
4 RT反应 20μl体系中含:Tris-HCl(pH8.2,25℃)25mmol/L,(NH4)2SO4 15mmol/L,MnCl2, 2.0mmol/L,dNTP0.5mmol/L,DTT1.0mmol/L;明胶0.1mg/ml,逆转录引物(OP2)1.0μmol/L,FD-TRT0.5U,HCV RNA模板2μl。以液蜡封住液面,于65℃保温300s。
5 CRT及巢式PCR第一轮扩增 上述RT反应结束后,除一部分直接用于下面PCR外,另外的分别按下面2种步骤进行反应后再进行PCR:
, http://www.100md.com
(1)CRT:94℃ 40s,65℃ 200s,循环数设为1~33次。不同循环次数的CRT分别在各自预定的循环数完成后,以沸水浴300s终止反应。
(2)巢式PCR:补充OP1引物后,94℃ 40s,55℃ 40s,72℃ 60s;30次循环。
6 PCR扩增及电泳
20μl体系中含:Tris-HCl(pH8.2,25℃)10mmol/L,KCl 50mmol/L,MnCl2 2.5mmol/L,dNTP0.2mmol/L,DTT 1.0mmol/L;明胶0.1mg/ml,PCR引物IP1和IP2各1.0μmol/L,甲酰胺8%,Taq酶0.5U,逆转录产物2μl。以液蜡封住液面。特异扩增片段长度为297bp。对于定量PCR,另外加入采用随机扩增——克隆法构建的对照模板QC-DNA(具体方法将另文发表)3×10-9μg,对照扩增片段长度为454bp。
, 百拇医药
反应在Hybaid UK热循环仪上进行,程序为93℃ 40s,55℃ 40s,72℃ 60s,循环数设为32次,最后于72℃保温300s。
反应结束后,取出10μl扩增产物于1.5%的琼脂糖凝胶上(含EB 0.5μg/ml)电泳分离,电泳缓冲液为1×TAE,电压80V(5V/cm),电泳1h,用FR980生物电泳图像分析系统分析,拍照记录。定量分析方法参照Tsai和Wiltbank的方法进行[8]。扫描记录DNA条带光密度值,计算HCV DNA扩增带对QC-DNA扩增带的光密度比值,取对数,采用Microcal Origin5.0系统分析作图。
结 果
1 循环逆转录-PCR
采用相同的逆转录体系和温度时间参数,改变逆转录反应的循环数,然后用相同的PCR体系和程序进行扩增,通过比较PCR产物量的变化,研究CRT增加逆转录产物量的效果。为了避免PCR扩增平台效应的影响,将PCR循环数控制在29次。从电泳结果可以看出,CRT的PCR扩增量明显多于普通逆转录,而且随着CRT循环数的增加而增多(图1a)。采用竞争定量PCR(quantitative competitive PCR,QC-PCR),对CRT增长cDNA量进行定量分析(PCR循环采用34次)。通过改变HCV RNA CRT的循环数,然后与QC-DNA(3×10-9μg~100个拷贝)进行共扩增,根据电泳结果(图1b),作出lg(HCV-DNA/QC-DNA)-lg(CRT-Cycles)拟合标准曲线为一条直线(图1c),说明CRT是线性增长过程。
, 百拇医药
2 HCV RNA检测
采用16次循环的CRT,偶联34次PCR,检测从50μl血清(或血浆)样品中制备的HCV RNA,并同时进行巢式PCR和普通RT-PCR(采用34次循环) 检测对照。 从电泳结果(图2)可以看出, CRT-PCR的检测灵敏度接近巢式PCR,高于普通的RT-PCR,而且CRT-PCR放大倍数适中,不象巢式PCR那样因为原始模板浓度高,容易出现非特异结果。在136例抗-HCV阳性血清中,用CRT-PCR法检出124例,说明绝大多数HCV抗体阳性者存在病毒的复制。未能检出HCV-RNA的病例,可能为既往感染的免疫反应,也有可能是病毒株的序列变异,使引物难以互补结合或HCV RNA低于PCR法的检测极限所致。从实验设计来说,后两种情况的可能性较小。54例HCV阴性血清中,仍有4例检出HCV-RNA,提示ELISA法不能检出全部HCV感染者。因为在HCV感染早期,患者血清中没有可检出的抗病毒抗体,抗体出现较晚,一般要在感染1~4.5个月左右才能出现。而HCV的复制出现得早,在感染后数天即出现病毒血症,因而 PCR可较早地检出HCV病毒的感染[5,7]。在总共163例巢式PCR检测为HCV RNA阳性的样品中,CRT-PCR检出161例,灵敏度为98.8%,远高于RT-PCR的60.8%。(表1)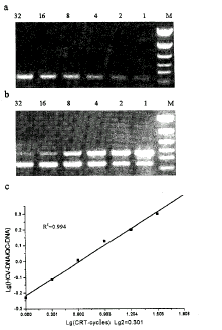
, 百拇医药
图1 CRT-PCR及QC-PCR结果
Figure 1 Results of CRT-PCR and QC-PCR
(a) Ethidium bromide stained CRT-PCR products. Lines 1, 2, 4, 8, 16, and 32 indicate the numbers of CRT cycles (as RT-PCR, the number=1); M=DNA size marker (PCR-Markers, Sino-American Biotechnology Co.): 1,543, 994, 695, 515, 377, 237bp. The size of HCV RNA PCR product is 297bp. (b) Ethidium bromide stained QC-PCR products. The size of HCV RNA PCR product is 297 bp, and the size of QC-DNA PCR product is 454bp. (c) Plot of standard curve.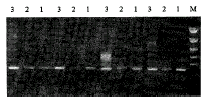
, http://www.100md.com
图2 HCV RNA PCR扩增结果对照
Figure 2 HCV RNA amplification by RT-PCR, CRT-PCR and nested-PCR
M=DNA size marker(PCR-Markers, Sino-American Biotechnology Co.): 1,543, 994, 695, 515, 377, 237 bp. The size of HCV RNA PCR product is 297 bp. 1. CRT-PCR; 2. RT-PCR; 3. nested-PCR.
表1 样品HCV RNA的检出率
Table 1 Detection of HCV RNA in the samples Kind of PCR
, 百拇医药
Detection of HCV RNA from 50μl of serum or plasma
HCV antibody ELISA positive
HCV antibody ELISA negative
Clinical samples*
HCV RNA
totally
positive rate
+
-
HCV RNA
, 百拇医药
positive rate
+
-
HCV RNA
positive rate
+
-
HCV RNA
positive rate
CRT-PCR
124
12
, 百拇医药 91.2
4
50
7.4
33
75
30.6
57.9%
RT-PCR
82
54
60.3
1
, 百拇医药 53
1.9
16
92
14.8
35.6%
NT-PCR
126
10
92.6
4
50
7.4
, 百拇医药 33
75
30.6
58.6%
* Results of liver function test were abnormal;+,-:Indicating HCV RNA positive and negative respectively.讨 论
ELISA法和RT-PCR法检测的对象是不同的,ELISA法主要检测血清中有无HCV抗体的存在,而RT-PCR法主要检测有无HCV-RNA的存在。HCV抗体的存在表明患者受到过HCV的感染;而HCV-RNA的存在表明HCV基本上处于复制期,这时的患者具有传染性[5,7]。
RT-PCR逆转录反应合成的RNA-cDNA杂合双链在被高温变性之后,只有cDNA单链被用做PCR模板,虽然原先的RNA模板在反应体系中继续存在,但已经不起作用。这样没有充分利用RNA,不利于低丰度的RNA的检测和分析。我们在基因表达芯片研究过程中发现,利用FD耐热逆转录酶对mRNA进行CRT,可以得到最高40~50倍量(与常规RT相比)的长度在200~500bp之间的cDNA,在15~20个循环之前,RNA模板没有明显降解(具体数据略)。虽然CRT-PCR理论上的灵敏度无法与巢式PCR相比,但我们的结果表明,CRT-PCR对HCV RNA检测的灵敏度达到巢式PCR的98.8%。检测中我们选用16个循环的CRT,原因是:①这时体系中RNA模板没有明显降解,结果比较稳定;②更多循环的CRT对HCV检测灵敏度提高不大,且耗时长对实际应用不利。与巢式PCR比较,CRT-PCR具有以下优点:(1)技术设计简单,成本低;(2)便于实行定量PCR;(3)操作简便,发生污染的机会低,结果易判断。
, http://www.100md.com
定量PCR作为高灵敏度的定量检测方法,具有重要的临床价值[6]。标准曲线法是一种新出现的定量PCR方法,相对简单准确,适用的PCR循环数可以多达34次,甚至更多,提高了灵敏度[8,9]。但这种方法要求对RNA的样品作梯度稀释,不适于低丰度的RNA的检测分析,并且因为加大了RNA的耗费及被降解或污染的可能,会导致实验误差增大,甚至失败。而将CRT应用于定量PCR,由于CRT是线性增长过程,通过改变RT的循环数,可以得到定量PCR所需的起始模板量的变化,在减少甚至避免对RNA样品进行稀释的同时,还提高了分析的灵敏度,特别适合于比较珍贵的、低丰度的RNA样品的定量分析,这是对标准曲线法很大的改进和补充。我们将在以后的工作中对此作进一步的研究。
基金项目:国家自然科学基金资助项目(批准号:39700082)
作者简介:陈燃(1970-),男,博士,讲师,现从事基因芯片技术及应用研究。
, http://www.100md.com
参考文献:
[1]郑佐华,周宗祥,朱蔚,等.FD耐热逆转录酶的部分酶学性质研究[J].中国生物化学和分子生物学学报,1998,14(2):170-174.
[2]殷长传,颜学恒,郑佐华,等.FD-RTR耐热逆转录酶的特性分析[J].复旦学报(自然科学版),1998,37(2):225-228.
[3]Garson J A, Tedder R S, Briggs M, et al. Detection of hepatitis C viral sequences in blood donations by "nested" polymerase chain reaction and prediction of infectivity [J]. Lancet, 1990, 355(8703): 1419-1422.
, http://www.100md.com [4]Schlauder G G, Leverenz G J, Mattsson L, et al. Detection of hepatitis C viral RNA by the polymerase chain reaction in serum of patients with post-transfusion non-A, non-B hepatitis [J]. J Virol Methods, 1992, 37(2): 189-99.
[5]Francois M, Dubois F, Brand D, et al. Prevalence and significance of hepatitis C virus (HCV) viremia in HCV antibody -positive subjects from various populations [J]. J Clin Microbiol, 1993, 31(5): 1189-1193.
, 百拇医药 [6]Berger A, Braner J, Doerr H W, et al. Quantification of viral load: clinical relevance for human immunodeficiency virus, hepatitis B virus and hepatitis C virus infection [J]. Intervirology, 1998, 41(1): 24-34.
[7]汪兴太,王佑春,孙德贵,等.首次及重复感染HCV后抗体及HCV RNA的动态观察[J].中华微生物学和免疫学杂志,1994,14(1):1-4.
[8]Tsai S-J, Wiltbank M C. Quantification of mRNA using competitive RT-PCR with standard-curve methodology. Bio Techbiques, 1996, 21(5): 862-866.
[9]Hayward A L, Oefner P J, Sabatini S, et al. Modeling and analysis of competitive RT-PCR [J]. Nucleic Acids Res, 1998, 26(11): 2511-2518.
收稿日期:1999-04-02;修回日期:1999-08-31, http://www.100md.com
单位:复旦大学遗传学研究所遗传工程国家重点实验室 上海 200433
关键词:循环逆转录;RT-PCR;HCV;竞争定量PCR
病毒学报000316摘要:循环逆转录(circulatory reverse transcription,CRT)是线性增长逆转录cDNA产量的一种新技术。为了将该技术用于检测HCV RNA,通过改变CRT的循环次数,结合竞争PCR,作出标准曲线。采用16次CRT加34次循环PCR检测了136例HCV ELISA阳性、54例HCV ELISA阴性和108例临床可疑病人全血标本,并与逆转录PCR(RT-PCR)和巢式PCR(NT-PCR)的检测结果相比较,显示HCV RNA总检出率分别为:57.9%、35.6%、58.6%。结果提示,CRT-PCR是一种简便有效的提高RNA检测灵敏度的方法,并适合应用于定量分析
, 百拇医药
中图分类号:R373.2+1;Q522 文献标识码:A
文章编号:1000-8721(2000)03-0266-04
Detection of Hepatitis C Virus RNA by Circulatory Reverse Transcription-PCR
CHEN Ran,WU Di,TANG Rong,WANG Jin,MAO Yu-min
(State Key Laboratory of Genetic Engineering, Institute of Genetics, Fudan University, Shanghai 200433, China)
Abstract: Circulatory reverse transcription (CRT) reaction is a new technique which can linearly increase cDNA products of reverse transcription reaction and is applied to detect Hepatitis C virus (HCV) RNA. By varying the cycles of CRT, along with the competitive PCR method, we have produced a standard curve. 136 HCV-positive blood samples, 54 HCV-negative blood samples (detected by ELISA) and 108 clinical blood samples were detected with 16 cycles of CRT plus 34 cycles of PCR and a comparative analysis with RT-PCR and NT-PCR detection was conducted. The HCV RNA totally positive rates were 57.9%, 35.6% and 58.6% respectively. The result indicates that the CRT-PCR is a convenient device to enhance the sensitivity of RNA detection and can be applied in the quantification of RNA.
, 百拇医药
Key words: circulatory reverse transcription (CRT); RT -PCR; HCV; quantitative competitive PCR (QC-PCR)
FD-耐热逆转录酶(FD-thermostable reverse transcriptase,FD-TRT)是由本实验室发现并生产[1,2]。根据该酶能耐受使核酸变性的高温,并在较高温度下保持逆转录催化活性的特性,我们发明了循环逆转录(CRT)(已申请国家发明专利):在逆转录反应中引入高温变性和低温退火延伸的循环过程,通过控制温度变化,反复利用起始的RNA作为模板进行逆转录,可以得到拷贝数几十倍于模板RNA的cDNA,从而提高RNA检测和分析的灵敏度。
直接检测血样中HCV RNA是判断HCV感染及传染性的可靠指标,被感染者体内病毒的含量与临床发病情况、治疗的反应性及预后相关,因此,对HCV RNA的定量检测具有重要的临床意义。但HCV感染者血液中的病毒数量很少,所以一般应用巢式PCR(nested primers-PCR),采用二步PCR扩增,以提高检测的灵敏度,然而巢式PCR增加了引物设计的难度和实验的复杂性,而且操作技术要求高而繁琐,易导致PCR产物污染,定量分析很困难,成本较高等,因此不利于推广应用[3,7]。本实验中,应用CRT-PCR对血清HCV RNA进行了检测研究,并结合定量PCR技术,通过作出定量标准曲线,验证CRT是线性增长过程。结果提示,通过改变CRT的循环数,即可得到定量PCR所需的起始模板量的梯度变化。
, 百拇医药
材料与方法
1 样品来源 136例抗-HCV ELISA 阳性和54例抗-HCV ELISA阴性血清,来自于献血人群(检测采用上海科华实业生产的试剂盒),由上海第二医科大学免疫室提供。108例肝功能指标异常临床检验样品,由安徽省巢湖地区中心血站提供。
2 RNA模板 采用异硫氰酸胍-酚-氯仿一步法并略加改进[4]。RNA溶于DEPC处理过的无菌水中。
3 引物 引物位于HCV序列5'-NS区,由上海生工生物工程公司代为合成,其序列如下(OP1和IP1近3'端有变异,OP1 34和35位核苷酸、IP1 59位核苷酸有变异,但不影响扩增[3,6]):
OP1,位于正链18~38:5'-GGCGACACTCCACCATAGATC
, 百拇医药
OP2,位于负链446~426:5'-GTAAACTCCACCAACGATCTG
IP1,位于正链46~65:5'-CTGTGAGGAACTACTGTCTTC
IP2,位于负链341~321:5'-GGTGCACGGTCTACGAGACCT
4 RT反应 20μl体系中含:Tris-HCl(pH8.2,25℃)25mmol/L,(NH4)2SO4 15mmol/L,MnCl2, 2.0mmol/L,dNTP0.5mmol/L,DTT1.0mmol/L;明胶0.1mg/ml,逆转录引物(OP2)1.0μmol/L,FD-TRT0.5U,HCV RNA模板2μl。以液蜡封住液面,于65℃保温300s。
5 CRT及巢式PCR第一轮扩增 上述RT反应结束后,除一部分直接用于下面PCR外,另外的分别按下面2种步骤进行反应后再进行PCR:
, http://www.100md.com
(1)CRT:94℃ 40s,65℃ 200s,循环数设为1~33次。不同循环次数的CRT分别在各自预定的循环数完成后,以沸水浴300s终止反应。
(2)巢式PCR:补充OP1引物后,94℃ 40s,55℃ 40s,72℃ 60s;30次循环。
6 PCR扩增及电泳
20μl体系中含:Tris-HCl(pH8.2,25℃)10mmol/L,KCl 50mmol/L,MnCl2 2.5mmol/L,dNTP0.2mmol/L,DTT 1.0mmol/L;明胶0.1mg/ml,PCR引物IP1和IP2各1.0μmol/L,甲酰胺8%,Taq酶0.5U,逆转录产物2μl。以液蜡封住液面。特异扩增片段长度为297bp。对于定量PCR,另外加入采用随机扩增——克隆法构建的对照模板QC-DNA(具体方法将另文发表)3×10-9μg,对照扩增片段长度为454bp。
, 百拇医药
反应在Hybaid UK热循环仪上进行,程序为93℃ 40s,55℃ 40s,72℃ 60s,循环数设为32次,最后于72℃保温300s。
反应结束后,取出10μl扩增产物于1.5%的琼脂糖凝胶上(含EB 0.5μg/ml)电泳分离,电泳缓冲液为1×TAE,电压80V(5V/cm),电泳1h,用FR980生物电泳图像分析系统分析,拍照记录。定量分析方法参照Tsai和Wiltbank的方法进行[8]。扫描记录DNA条带光密度值,计算HCV DNA扩增带对QC-DNA扩增带的光密度比值,取对数,采用Microcal Origin5.0系统分析作图。
结 果
1 循环逆转录-PCR
采用相同的逆转录体系和温度时间参数,改变逆转录反应的循环数,然后用相同的PCR体系和程序进行扩增,通过比较PCR产物量的变化,研究CRT增加逆转录产物量的效果。为了避免PCR扩增平台效应的影响,将PCR循环数控制在29次。从电泳结果可以看出,CRT的PCR扩增量明显多于普通逆转录,而且随着CRT循环数的增加而增多(图1a)。采用竞争定量PCR(quantitative competitive PCR,QC-PCR),对CRT增长cDNA量进行定量分析(PCR循环采用34次)。通过改变HCV RNA CRT的循环数,然后与QC-DNA(3×10-9μg~100个拷贝)进行共扩增,根据电泳结果(图1b),作出lg(HCV-DNA/QC-DNA)-lg(CRT-Cycles)拟合标准曲线为一条直线(图1c),说明CRT是线性增长过程。
, 百拇医药
2 HCV RNA检测
采用16次循环的CRT,偶联34次PCR,检测从50μl血清(或血浆)样品中制备的HCV RNA,并同时进行巢式PCR和普通RT-PCR(采用34次循环) 检测对照。 从电泳结果(图2)可以看出, CRT-PCR的检测灵敏度接近巢式PCR,高于普通的RT-PCR,而且CRT-PCR放大倍数适中,不象巢式PCR那样因为原始模板浓度高,容易出现非特异结果。在136例抗-HCV阳性血清中,用CRT-PCR法检出124例,说明绝大多数HCV抗体阳性者存在病毒的复制。未能检出HCV-RNA的病例,可能为既往感染的免疫反应,也有可能是病毒株的序列变异,使引物难以互补结合或HCV RNA低于PCR法的检测极限所致。从实验设计来说,后两种情况的可能性较小。54例HCV阴性血清中,仍有4例检出HCV-RNA,提示ELISA法不能检出全部HCV感染者。因为在HCV感染早期,患者血清中没有可检出的抗病毒抗体,抗体出现较晚,一般要在感染1~4.5个月左右才能出现。而HCV的复制出现得早,在感染后数天即出现病毒血症,因而 PCR可较早地检出HCV病毒的感染[5,7]。在总共163例巢式PCR检测为HCV RNA阳性的样品中,CRT-PCR检出161例,灵敏度为98.8%,远高于RT-PCR的60.8%。(表1)

, 百拇医药
图1 CRT-PCR及QC-PCR结果
Figure 1 Results of CRT-PCR and QC-PCR
(a) Ethidium bromide stained CRT-PCR products. Lines 1, 2, 4, 8, 16, and 32 indicate the numbers of CRT cycles (as RT-PCR, the number=1); M=DNA size marker (PCR-Markers, Sino-American Biotechnology Co.): 1,543, 994, 695, 515, 377, 237bp. The size of HCV RNA PCR product is 297bp. (b) Ethidium bromide stained QC-PCR products. The size of HCV RNA PCR product is 297 bp, and the size of QC-DNA PCR product is 454bp. (c) Plot of standard curve.

, http://www.100md.com
图2 HCV RNA PCR扩增结果对照
Figure 2 HCV RNA amplification by RT-PCR, CRT-PCR and nested-PCR
M=DNA size marker(PCR-Markers, Sino-American Biotechnology Co.): 1,543, 994, 695, 515, 377, 237 bp. The size of HCV RNA PCR product is 297 bp. 1. CRT-PCR; 2. RT-PCR; 3. nested-PCR.
表1 样品HCV RNA的检出率
Table 1 Detection of HCV RNA in the samples Kind of PCR
, 百拇医药
Detection of HCV RNA from 50μl of serum or plasma
HCV antibody ELISA positive
HCV antibody ELISA negative
Clinical samples*
HCV RNA
totally
positive rate
+
-
HCV RNA
, 百拇医药
positive rate
+
-
HCV RNA
positive rate
+
-
HCV RNA
positive rate
CRT-PCR
124
12
, 百拇医药 91.2
4
50
7.4
33
75
30.6
57.9%
RT-PCR
82
54
60.3
1
, 百拇医药 53
1.9
16
92
14.8
35.6%
NT-PCR
126
10
92.6
4
50
7.4
, 百拇医药 33
75
30.6
58.6%
* Results of liver function test were abnormal;+,-:Indicating HCV RNA positive and negative respectively.讨 论
ELISA法和RT-PCR法检测的对象是不同的,ELISA法主要检测血清中有无HCV抗体的存在,而RT-PCR法主要检测有无HCV-RNA的存在。HCV抗体的存在表明患者受到过HCV的感染;而HCV-RNA的存在表明HCV基本上处于复制期,这时的患者具有传染性[5,7]。
RT-PCR逆转录反应合成的RNA-cDNA杂合双链在被高温变性之后,只有cDNA单链被用做PCR模板,虽然原先的RNA模板在反应体系中继续存在,但已经不起作用。这样没有充分利用RNA,不利于低丰度的RNA的检测和分析。我们在基因表达芯片研究过程中发现,利用FD耐热逆转录酶对mRNA进行CRT,可以得到最高40~50倍量(与常规RT相比)的长度在200~500bp之间的cDNA,在15~20个循环之前,RNA模板没有明显降解(具体数据略)。虽然CRT-PCR理论上的灵敏度无法与巢式PCR相比,但我们的结果表明,CRT-PCR对HCV RNA检测的灵敏度达到巢式PCR的98.8%。检测中我们选用16个循环的CRT,原因是:①这时体系中RNA模板没有明显降解,结果比较稳定;②更多循环的CRT对HCV检测灵敏度提高不大,且耗时长对实际应用不利。与巢式PCR比较,CRT-PCR具有以下优点:(1)技术设计简单,成本低;(2)便于实行定量PCR;(3)操作简便,发生污染的机会低,结果易判断。
, http://www.100md.com
定量PCR作为高灵敏度的定量检测方法,具有重要的临床价值[6]。标准曲线法是一种新出现的定量PCR方法,相对简单准确,适用的PCR循环数可以多达34次,甚至更多,提高了灵敏度[8,9]。但这种方法要求对RNA的样品作梯度稀释,不适于低丰度的RNA的检测分析,并且因为加大了RNA的耗费及被降解或污染的可能,会导致实验误差增大,甚至失败。而将CRT应用于定量PCR,由于CRT是线性增长过程,通过改变RT的循环数,可以得到定量PCR所需的起始模板量的变化,在减少甚至避免对RNA样品进行稀释的同时,还提高了分析的灵敏度,特别适合于比较珍贵的、低丰度的RNA样品的定量分析,这是对标准曲线法很大的改进和补充。我们将在以后的工作中对此作进一步的研究。
基金项目:国家自然科学基金资助项目(批准号:39700082)
作者简介:陈燃(1970-),男,博士,讲师,现从事基因芯片技术及应用研究。
, http://www.100md.com
参考文献:
[1]郑佐华,周宗祥,朱蔚,等.FD耐热逆转录酶的部分酶学性质研究[J].中国生物化学和分子生物学学报,1998,14(2):170-174.
[2]殷长传,颜学恒,郑佐华,等.FD-RTR耐热逆转录酶的特性分析[J].复旦学报(自然科学版),1998,37(2):225-228.
[3]Garson J A, Tedder R S, Briggs M, et al. Detection of hepatitis C viral sequences in blood donations by "nested" polymerase chain reaction and prediction of infectivity [J]. Lancet, 1990, 355(8703): 1419-1422.
, http://www.100md.com [4]Schlauder G G, Leverenz G J, Mattsson L, et al. Detection of hepatitis C viral RNA by the polymerase chain reaction in serum of patients with post-transfusion non-A, non-B hepatitis [J]. J Virol Methods, 1992, 37(2): 189-99.
[5]Francois M, Dubois F, Brand D, et al. Prevalence and significance of hepatitis C virus (HCV) viremia in HCV antibody -positive subjects from various populations [J]. J Clin Microbiol, 1993, 31(5): 1189-1193.
, 百拇医药 [6]Berger A, Braner J, Doerr H W, et al. Quantification of viral load: clinical relevance for human immunodeficiency virus, hepatitis B virus and hepatitis C virus infection [J]. Intervirology, 1998, 41(1): 24-34.
[7]汪兴太,王佑春,孙德贵,等.首次及重复感染HCV后抗体及HCV RNA的动态观察[J].中华微生物学和免疫学杂志,1994,14(1):1-4.
[8]Tsai S-J, Wiltbank M C. Quantification of mRNA using competitive RT-PCR with standard-curve methodology. Bio Techbiques, 1996, 21(5): 862-866.
[9]Hayward A L, Oefner P J, Sabatini S, et al. Modeling and analysis of competitive RT-PCR [J]. Nucleic Acids Res, 1998, 26(11): 2511-2518.
收稿日期:1999-04-02;修回日期:1999-08-31, http://www.100md.com