神经营养素在小鼠脾的定位研究
作者:杨 宏 伯 音 周长满* 鞠 躬** 范 明
单位:军事医学科学院基础医学研究所,北京 100850,*解放军北京医学高等专科学校解剖学教研室,**第四军医大学神经科学研究所
关键词:神经营养素;脾;免疫组织化学;小鼠
解剖学报/980409 摘 要 为了解神经营养素与免疫系统的关系,用免疫组织化学方法对神经营养素包括神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养素3(NT-3)进行小鼠脾的定位研究。结果表明:3种神经营养素的免疫反应均存在于脾内,但分布特点各不相同。NGF主要分布于白髓动脉周围淋巴鞘(PALS)外层、边缘区(MZ)和红髓(RP)的巨噬细胞样和淋巴细胞样细胞;BDNF除具有与NGF相似的分布特点外,还见于脾淋巴小结生发中心的淋巴细胞样细胞;NT-3则存在于白、红髓的网状细胞样细胞。这一结果提示,脾的免疫和非免疫细胞均可能产生神经营养素,并提示不同类型的神经营养素对免疫系统有不同的作用。
, 百拇医药
神经系统的发育和存活依赖于神经营养性因子,即一类由神经元所支配的效应细胞或神经元自身所产生的蛋白质。先后发现的神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养素-3,4/5(NT-3,4/5)是一类在分子结构、受体类型、生物功能等方面相类似的因子,它们共同组成神经营养因子中的亚家族,合称神经营养素。
神经营养素除存在于神经系统之外,还广泛分布于全身其他器官并参与一些除神经营养之外的生理活动。有报道,NGF具有促进淋巴细胞增殖和分化[1,2]、调节T淋巴细胞白介素-2受体的表达等作用[3]。新近研究发现NGF、BDNF、NT-3/4等神经营养素mRNA存在于胸腺和脾[4]。因而,做为一种有可能在神经-免疫调节环路中起作用的因子,神经营养素正在引起人们的注意。但有关这些因子在免疫器官的定位尚不清楚。本研究应用免疫组织化学方法对以上3种神经营养素在脾内的定位进行初步研究,为揭示其在免疫系统的功能作用提供形态学基础。
, 百拇医药
材料和方法
1. 动物及组织处理
采用7~8周的雄性BALB/c小鼠15只,体重20~25g。动物以异戊巴比妥钠麻醉,经左心室灌注生理盐水10ml,继而灌注4℃的含4%多聚甲醛、0.01%戊二醛、0.2%苦味酸的磷酸缓冲液(0.1mol/L PB),pH7.4。10min后取出脾,以不含戊二醛的上述固定液于4℃再固定12~16h。以与脾长轴垂直的方向将脾分为4等份,取靠中线的一块自脾门向被膜方向做振动切片(厚30μm),收集所有切片于0.01mol/L的磷酸盐缓冲液(PBS)(pH7.4)中。
2. 免疫组织化学
特异性抗NGF、BDNF、NT-3多克隆抗体由美国Santa Cruz.公司提供(工作浓度1∶500)。染色中洗涤切片用0.01mol/L PBS(pH7.4)。切片先在0.01mol/L PBS中浸泡2~3h以去掉残留的固定剂,用甲醇+0.1%H2O2处理15min以消除内源性过氧化物酶活性,PBS洗(5min×3),用0.01mol/L Tris缓冲液(TBS)稀释的正常羊血清封闭1h,直接进入由抗体稀释液(含1%牛血清白蛋白、0.2%TritonX-100、0.08%叠氮钠的0.01mol/L Tris缓冲液,pH7.4)稀释的特异性抗体中孵育36~72h。PBS洗(5min×3),入羊抗兔生物素化IgG(丹麦Vector公司,1∶500)37℃孵育1~2h,PBS洗(5min×3),入ABC复合物(丹麦Vector公司,1∶500)37℃孵育1h,PBS洗(5min×3)。切片经短暂过蒸馏水后进入含0.05%DAB、2.5%硫酸镍铵、0.01%H2O2的0.1mol/L醋酸缓冲液(pH6.2)中呈色10~15min。蒸馏水洗(15s×2).PBS与1%明胶混合液中贴片,部分切片以1%中性红复染。室温晾干,100%酒精脱水、二甲苯透明,树胶封片。
, 百拇医药
3. 对照实验
分别以PBS或正常兔血清替代一抗,以及以PBS替代二抗同步进行染色。
结果
1. NGF免疫反应性细胞的分布
NGF免疫反应性细胞主要分布于脾边缘区(MZ)和红髓(RP),少数细胞散在于白髓动脉周围淋巴鞘(PALS)的外层或PALS与淋巴小结之间。而PALS内层和淋巴小结内几乎无阳性细胞(图1)。NGF免疫反应性细胞与血管关系密切,它们围绕在白髓中央动脉和红髓内小血管周围(图2)。NGF阳性细胞为大、小两种,分别属于巨噬细胞样和淋巴细胞样细胞。两种细胞胞浆均呈免疫染色,胞核呈阴性。较大的细胞形态不规则、边缘不整齐、胞浆丰富、胞核较小。较小的细胞为圆形、胞浆少、胞核相对较大,居中或偏向一侧(图3)。
, 百拇医药
图1 示边缘区(MZ)和红髓(RP)NGF免疫反应性细胞,少数细胞散在于白髓动脉周围淋巴鞘(PALS)内 ×100
图2 示白髓中央动脉周围(短箭头)和RP小血管周围(长箭头)NGF免疫反应性细胞 ×40
图3 示PALS内NGF免疫反应性巨噬细胞样细胞(长箭头)和淋巴细胞样细胞(短箭头) ×400
Fig.1 NGF immunoreactive(IR)cells distributed in marginal zone(MZ) and red pulp (RP) of spleen,with a small number of cells scattered within the periarterial lymphocyte sheath (PALS) of the white pulp.×100
Fig.2 NGF-IR cells around the central artery of white pulp(arrow head) and blood vessels of red pulp (arrows).×40
, 百拇医药
Fig.3 NGF-IR macrophages-like (arrow) and NGF-IR lymphocyte-like (arrow head) cells in the PALS.×400
2. BDNF免疫反应性细胞的分布
BDNF免疫反应细胞在MZ和RP的分布特点与NGF免疫反应细胞相似。即分布于PALS外层、MZ和脾索(图4)。另外,BDNF免疫反应性细胞还散在于脾淋巴小结生发中心(G)内。这些阳性细胞呈现淋巴细胞的特征。胞浆呈免疫反应性,胞核呈阴性(图5)。白髓内阳性细胞的免疫染色普遍较边缘区和红髓者浅,少部分淋巴小结内未见免疫反应性细胞。BDNF免疫反应性细胞与脾血管无明显关系。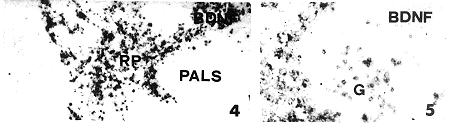
图4 示MZ和RP内BDNF免疫反应性细胞 ×100
, 百拇医药
图5 示脾淋巴小结生发中心(G)内BDNF免疫反应性淋巴细胞 ×200
Fig.4 BDNF-IR cells located in MZ and RP. ×100
Fig.5 BDNF-IR lymphocytes located in the germinal center (G) of splenic lymph node. ×200
3. NT-3免疫反应性细胞的分布
NT-3免疫反应性细胞广泛分布于白髓和红髓。(1)白髓:根据形态不同将免疫反应性细胞分为两种。一种细胞数量较多,于PALS内部均匀散在(图6),在PALS周边呈单层整齐排列(图8)。胞核、胞浆均呈免疫反应性,而且胞核的染色强于胞浆(图6)。油镜观察可见阳性胞核周围有染色稍淡的胞浆,胞浆多带有突起(图7)。另一种细胞数量较少,主要分布于脾淋巴小结内(图6),圆形或椭圆形,边缘整齐,胞浆丰富。(图9)。(2)红髓:阳性细胞常集中成群,胞浆呈免疫反应性(图10)。各级动、静脉分支和脾血窦的内皮细胞均呈阳性反应(图11)。另有一些大小不等的细胞成群分布于血管附近,或胞浆呈阳性或胞浆、胞核均呈免疫反应性(图11)。
, http://www.100md.com
图6 示PALS和脾淋巴小结的断面,两者之间界限不清,中央动脉偏于一侧,中央亮区为G。许多NT-3免疫反应性细胞散布于PALS和脾淋巴小结中,G内阳性细胞很少。中性红复染 ×200
图7 示PALS内NT-3免疫反应性细胞,胞核与胞浆免疫染色均呈阳性,箭头示NT-3免疫反应性细胞的胞浆突起 ×1 000(油镜)
图8 示PALS及其周边的NT-3免疫反应性细胞,MZ阳性细胞很少,中性红复染 ×400
图9 示G内NT-3免疫反应性细胞,圆或椭圆形,无胞浆突起 ×1 000(油镜)
图10 示红髓内聚集成群的NT-3免疫反应性细胞 ×400
图11 示NT-3免疫反应性内皮细胞,血管周围可见胞浆着色(箭头)和胞浆胞核均着色(三角)的两种细胞 ×400
, 百拇医药
Fig.6 A profile of PALS and splenic lymph node,the boundary between them is not clear.A central artery could be seen located in one side.The lighter area in the central was G.A lot of NT-3-IR cells scattered in PALS and splenic lymph node,while less NT-3-IR cells in G.Counterstained with neutral red.×200
Fig.7 NT-3-IR cells in the PALS which were immunohistochemically stained both in nuclear and cytoplasm,arrows show the cytoplasmic processes of NT-3-IR cells. ×1 000(oil)
, http://www.100md.com
Fig.8 NT-3-IR cells distributed in the PALS and its peripheral region.Only a few positively stained cells were found in MZ.Counterstained with neutral red. ×400
Fig.9 NT-3-IR cells in the germinal center which are round or ellipse in shape and have no cytoplasmic processes. ×1 000 (oil)
Fig.10 A cluster of NT-3-IR cells in red pulp. ×400
Fig.11 NT-3-IR endothelia.Two kinds of cells which were immunohistochemically stained in cytoplasm (arrow) and both in nuclear and cytoplasm (triangle) could be seen near the blood vessel. ×400
, http://www.100md.com
4. 对照实验结果
以PBS替代一抗和二抗的实验均未见到阳性染色。正常兔血清替代一抗的实验中切片有非常浅的非特异性着色。据Santa Cruz公司检测,NGF、BDNF、NT-3抗体之间无交叉反应。我们实验中也从未见到3种神经营养素之间有交叉染色。
讨论
本实验结果表明NGF、BDNF、NT-3样免疫反应均存在于小鼠脾内,但分布形式各不相同。NGF免疫反应性细胞主要存在于PALS外层、MZ和脾索,而PALS内层的T淋巴细胞分布区无免疫反应性。从分布和形态特点判断它们可能为巨噬细胞和淋巴细胞。已知边缘区和脾索是巨噬细胞主要存在部位,PALS外层、边缘区和脾索有许多B淋巴细胞存在。BDNF免疫反应性细胞的分布特点与NGF免疫反应性细胞相似,所不同的是脾小结生发中心内部分淋巴细胞呈免疫反应性,表明部分较幼稚的B淋巴细胞含有BDNF。NT-3免疫反应性细胞绝大部分位于PALS和髓索内,细胞形状不规则,有明显的胞浆突起。这种分布和形态上的特点高度提示它们为网状细胞。生发中心内的NT-3阳性细胞形状为圆或椭圆形,无胞浆突起,其性质有待确定。红髓内除血管内皮细胞外,其他NT-3阳性细胞的性质尚不清楚。本实验中NT-3免疫反应阳性细胞普遍存在着核着色深于浆的现象,这一现象也见于文献所报道的神经系统内CNTF免疫反应阳性神经细胞,其原因尚不清楚,我们推测该因子有可能在胞浆合成后又返回核内作为转录调节因子而存在[5]。
, http://www.100md.com
本实验结果与RNA酶保护实验结果吻合,后者证实神经营养素mRNA大量存在于脾基质(stroma)[4]。脾基质含网状细胞、巨噬细胞、抗原呈递细胞、成纤维细胞、内皮细胞等多种成分,共同构成淋巴细胞发育成熟的微环境[6]。淋巴细胞在这一微环境中游走、相互作用、相遇抗原、增殖分化以及进行有效的免疫应答。来自于局部成纤维细胞的网状细胞和来自于骨髓单核细胞前体的巨噬细胞是脾实质的主要成分。网状细胞与它们所产生的细胞外基质(ECM)不仅构成淋巴器官的基本框架,ECM中的多种整合素(integrins)家族分子还在免疫活性细胞间、淋巴细胞与抗原呈递细胞或内皮细胞间的相互作用中起重要作用[6]。边缘区的巨噬细胞分为两种,一种是具有强非特异性酯酶活性的边缘区嗜金属细胞,另一种是具有活跃的吞噬和抗原呈递能力的边缘区巨噬细胞[7]。本研究尚难以区分NGF免疫反应性细胞属于何种巨噬细胞。
脾是神经支配的靶器官,脾内神经营养素的存在符合神经营养素靶源性来源的特点。支配脾的神经主要是交感神经,而NGF和NT-3的主要作用对象之一正是交感神经元,故NGF和NT-3是维持脾神经正常形态和功能所必需的因子。我们以前的工作证实,免疫应答中脾交感神经纤维密度增加,并呈现自中央动脉向边缘区伸展的趋势[8],提示免疫功能活跃时神经系统的活动也同时增加,后者可能处于某种因素的驱使之下。边缘区巨噬细胞内NGF以及脾网状细胞内NT-3的发现,将有助于解释这种特殊功能状态下神经形态变化的机制。最近Kannan[9]等报道体外培养的淋巴组织能诱导交感神经生长,且这一作用可被抗NGF抗体所阻断,说明免疫器官产生的NGF具有神经诱生作用。已知脑内巨噬细胞和腹腔巨噬细胞具有产生NGF的功能[10,11],脾巨噬细胞是否具有这一功能还有待于证实。目前,有关NT-3与免疫系统之间的关系研究较少,但其在免疫器官的独特分布提示着它的广泛作用。网状细胞是支持营养神经成分的主要结构,有学者观察到脾单胺能神经深陷于网状细胞胞浆内、网状细胞以类似施万细胞的形式包裹神经纤维[12]。因此,通过维持正常和免疫应答时神经成分形态及功能状态的完整,神经营养素有可能间接起到调节免疫功能的作用,而免疫器官的交感神经具有重要的免疫调节功能早已得到证实。
, 百拇医药
另外,淋巴组织产生的神经营养因子还可能直接作用于免疫系统本身以调节免疫功能。已知免疫器官中诸如淋巴细胞、巨噬细胞和内皮细胞等多种细胞广泛存在神经营养素的受体[13,14],而且由受体介导的NGF促淋巴细胞增殖作用已得到证实。故神经营养素对免疫功能的多方面作用很值得进一步研究。
收稿1997-06 修回1998-04
参考文献
[1]Thorpe LW,Perez-Polo JR.The influence of nerve growth factor on in vivo proliferative response of rat spleen lymphocytes.J Neurosci Res,1987,18(1):134
[2]Otten U,Ehrhard P,Peck R.Nerve growth factor induces growth and differentiation of human B lymphocytes.Proc Natl Acad Sci USA,1989,86(24):10059
, 百拇医药
[3]Thorpe L,Werrbach-Perez W K,Perez-polo JR.Effects of nerve growth factor on the expression of interleukin-2 receptors on cultured human B lymphocytes.Ann NY Acad Sci USA,1987,496:310
[4]Laurenzi MA,Barbany G,Timmusk T,et al:Expression of mRNA encoding neurotrophins and neurotrophin receptors in rat thymus,spleen tissue and immunocompetent cells.Eur J Biochem,1994,223(3):733
[5]Henderson JT,Seniuk NA,Roder JC.Localization of CNTF immunoreactivity to neurons and astroglia in the CNS.Mol Brain Res,1994,22(1-4):151
, 百拇医药
[6]Weiss L,Sakai H.The hematopoietic stroma.Am J Anat,1984,170(3):447
[7]Matsuno K,Fujii H,Kotani M.Splenic marginal zone macrophages and marginal metallophils in rat and mice.Cell Tissue Res,1986,246(2):263
[8]Yang Hong,Wang Ling,Ju Gong.Plasticity of GAP-43 innervation of the spleen during immune response in the mouse-evidence for axonal sprouting and redistribution of the nerve fibers.Neuroimmunomodulation 1998 (in press)
, 百拇医药
[9]Kannan Y,Bienenstock J,Ohta M,et al.Nerve growth factor and cytokines mediate lymphoid tissueinduced neurite outgrowth from mouse superior cervical ganglia in vitro.J Immunol,1996,157(1):314
[10]Otten U,Weskamp G,Hardung M,et al.Synthesis and release of nerve growth factor by rat macrophages.Proc Soc Neurosci,1987,13:184
[11]Mallat M,Houlgatte R,Brachet P,et al.Lipopolysaccharide stimulated rat brain macrophages release NGF in vitro.Dev Biol,1989,133(1):309
, 百拇医药
[12]Blue J,Weiss L.Vascular pathway in non-sinusal red pulp:An electron microscope study of the cat spleen.Am J Anat,1981,161(2):135
[13]Shibayama E.Hirotaka K.Cellular localization of the trk neurotrophin receptor family in human non-neuronal tissues.Am J Path,1996,148(6):1807
[14]Hannestad J,Levanti MB,Vega JA.Distribution of neurotrophin receptors in human palatine tonsils:an immunohistochemical study.J neuroimmun,1995,58(2):131
, 百拇医药
STUDY ON THE LOCALIZATION OF NEUROTROPHINS IN THE
SPLEEN OF MOUSE
Yang HongΔ, Bo Yin, Zhou Changman*, Ju Gong**,Fan Ming
(Department of Neurobiology,Institute of Basic Medical Sciences,Beijing;
*Department of Anatomy,Beijing Medical College of PLA;
**Institute of Neurosciences,The Fourth Military Medical University,Xi'an)
, 百拇医药
In order to understand the relationship of neurotrophins and immune system,the present study investigated the localization of NGF,brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NT-3) in the spleen of BALB/c mouse using immunohistochemical method.The result showed that all three neurotrophins were present in the spleen with different distribution pattern.NGF was mainly distributed in macrophages-like and lymphocytes-like cells in the outer layer of periarterial lymphocyte sheath (PALS) of white pulp,marginal zone(MZ) and red pulp(RP).BDNF showed a similar distribution pattern with that of NGF,in addition,it was also identified in the lymphocytes of germinal center of splenic follicles.NT-3 was found widely in the reticular-like cells of white and red pulp.The present results indicated that both immune cells and non-immune cells of spleen might be capable of producing neurotrophins and different neurotrophins might exert different effects on immune system.
KEY WORDS Neurotrophin; Spleen; Immunohistochemistry; Mouse
△Department of Neurobiology,Institute of Basic Medical Sciences,Beijing 100850,China, 百拇医药(杨 宏 伯 音 周长满* 鞠 躬** 范 明)
单位:军事医学科学院基础医学研究所,北京 100850,*解放军北京医学高等专科学校解剖学教研室,**第四军医大学神经科学研究所
关键词:神经营养素;脾;免疫组织化学;小鼠
解剖学报/980409 摘 要 为了解神经营养素与免疫系统的关系,用免疫组织化学方法对神经营养素包括神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养素3(NT-3)进行小鼠脾的定位研究。结果表明:3种神经营养素的免疫反应均存在于脾内,但分布特点各不相同。NGF主要分布于白髓动脉周围淋巴鞘(PALS)外层、边缘区(MZ)和红髓(RP)的巨噬细胞样和淋巴细胞样细胞;BDNF除具有与NGF相似的分布特点外,还见于脾淋巴小结生发中心的淋巴细胞样细胞;NT-3则存在于白、红髓的网状细胞样细胞。这一结果提示,脾的免疫和非免疫细胞均可能产生神经营养素,并提示不同类型的神经营养素对免疫系统有不同的作用。
, 百拇医药
神经系统的发育和存活依赖于神经营养性因子,即一类由神经元所支配的效应细胞或神经元自身所产生的蛋白质。先后发现的神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养素-3,4/5(NT-3,4/5)是一类在分子结构、受体类型、生物功能等方面相类似的因子,它们共同组成神经营养因子中的亚家族,合称神经营养素。
神经营养素除存在于神经系统之外,还广泛分布于全身其他器官并参与一些除神经营养之外的生理活动。有报道,NGF具有促进淋巴细胞增殖和分化[1,2]、调节T淋巴细胞白介素-2受体的表达等作用[3]。新近研究发现NGF、BDNF、NT-3/4等神经营养素mRNA存在于胸腺和脾[4]。因而,做为一种有可能在神经-免疫调节环路中起作用的因子,神经营养素正在引起人们的注意。但有关这些因子在免疫器官的定位尚不清楚。本研究应用免疫组织化学方法对以上3种神经营养素在脾内的定位进行初步研究,为揭示其在免疫系统的功能作用提供形态学基础。
, 百拇医药
材料和方法
1. 动物及组织处理
采用7~8周的雄性BALB/c小鼠15只,体重20~25g。动物以异戊巴比妥钠麻醉,经左心室灌注生理盐水10ml,继而灌注4℃的含4%多聚甲醛、0.01%戊二醛、0.2%苦味酸的磷酸缓冲液(0.1mol/L PB),pH7.4。10min后取出脾,以不含戊二醛的上述固定液于4℃再固定12~16h。以与脾长轴垂直的方向将脾分为4等份,取靠中线的一块自脾门向被膜方向做振动切片(厚30μm),收集所有切片于0.01mol/L的磷酸盐缓冲液(PBS)(pH7.4)中。
2. 免疫组织化学
特异性抗NGF、BDNF、NT-3多克隆抗体由美国Santa Cruz.公司提供(工作浓度1∶500)。染色中洗涤切片用0.01mol/L PBS(pH7.4)。切片先在0.01mol/L PBS中浸泡2~3h以去掉残留的固定剂,用甲醇+0.1%H2O2处理15min以消除内源性过氧化物酶活性,PBS洗(5min×3),用0.01mol/L Tris缓冲液(TBS)稀释的正常羊血清封闭1h,直接进入由抗体稀释液(含1%牛血清白蛋白、0.2%TritonX-100、0.08%叠氮钠的0.01mol/L Tris缓冲液,pH7.4)稀释的特异性抗体中孵育36~72h。PBS洗(5min×3),入羊抗兔生物素化IgG(丹麦Vector公司,1∶500)37℃孵育1~2h,PBS洗(5min×3),入ABC复合物(丹麦Vector公司,1∶500)37℃孵育1h,PBS洗(5min×3)。切片经短暂过蒸馏水后进入含0.05%DAB、2.5%硫酸镍铵、0.01%H2O2的0.1mol/L醋酸缓冲液(pH6.2)中呈色10~15min。蒸馏水洗(15s×2).PBS与1%明胶混合液中贴片,部分切片以1%中性红复染。室温晾干,100%酒精脱水、二甲苯透明,树胶封片。
, 百拇医药
3. 对照实验
分别以PBS或正常兔血清替代一抗,以及以PBS替代二抗同步进行染色。
结果
1. NGF免疫反应性细胞的分布
NGF免疫反应性细胞主要分布于脾边缘区(MZ)和红髓(RP),少数细胞散在于白髓动脉周围淋巴鞘(PALS)的外层或PALS与淋巴小结之间。而PALS内层和淋巴小结内几乎无阳性细胞(图1)。NGF免疫反应性细胞与血管关系密切,它们围绕在白髓中央动脉和红髓内小血管周围(图2)。NGF阳性细胞为大、小两种,分别属于巨噬细胞样和淋巴细胞样细胞。两种细胞胞浆均呈免疫染色,胞核呈阴性。较大的细胞形态不规则、边缘不整齐、胞浆丰富、胞核较小。较小的细胞为圆形、胞浆少、胞核相对较大,居中或偏向一侧(图3)。

, 百拇医药
图1 示边缘区(MZ)和红髓(RP)NGF免疫反应性细胞,少数细胞散在于白髓动脉周围淋巴鞘(PALS)内 ×100
图2 示白髓中央动脉周围(短箭头)和RP小血管周围(长箭头)NGF免疫反应性细胞 ×40
图3 示PALS内NGF免疫反应性巨噬细胞样细胞(长箭头)和淋巴细胞样细胞(短箭头) ×400
Fig.1 NGF immunoreactive(IR)cells distributed in marginal zone(MZ) and red pulp (RP) of spleen,with a small number of cells scattered within the periarterial lymphocyte sheath (PALS) of the white pulp.×100
Fig.2 NGF-IR cells around the central artery of white pulp(arrow head) and blood vessels of red pulp (arrows).×40
, 百拇医药
Fig.3 NGF-IR macrophages-like (arrow) and NGF-IR lymphocyte-like (arrow head) cells in the PALS.×400
2. BDNF免疫反应性细胞的分布
BDNF免疫反应细胞在MZ和RP的分布特点与NGF免疫反应细胞相似。即分布于PALS外层、MZ和脾索(图4)。另外,BDNF免疫反应性细胞还散在于脾淋巴小结生发中心(G)内。这些阳性细胞呈现淋巴细胞的特征。胞浆呈免疫反应性,胞核呈阴性(图5)。白髓内阳性细胞的免疫染色普遍较边缘区和红髓者浅,少部分淋巴小结内未见免疫反应性细胞。BDNF免疫反应性细胞与脾血管无明显关系。

图4 示MZ和RP内BDNF免疫反应性细胞 ×100
, 百拇医药
图5 示脾淋巴小结生发中心(G)内BDNF免疫反应性淋巴细胞 ×200
Fig.4 BDNF-IR cells located in MZ and RP. ×100
Fig.5 BDNF-IR lymphocytes located in the germinal center (G) of splenic lymph node. ×200
3. NT-3免疫反应性细胞的分布
NT-3免疫反应性细胞广泛分布于白髓和红髓。(1)白髓:根据形态不同将免疫反应性细胞分为两种。一种细胞数量较多,于PALS内部均匀散在(图6),在PALS周边呈单层整齐排列(图8)。胞核、胞浆均呈免疫反应性,而且胞核的染色强于胞浆(图6)。油镜观察可见阳性胞核周围有染色稍淡的胞浆,胞浆多带有突起(图7)。另一种细胞数量较少,主要分布于脾淋巴小结内(图6),圆形或椭圆形,边缘整齐,胞浆丰富。(图9)。(2)红髓:阳性细胞常集中成群,胞浆呈免疫反应性(图10)。各级动、静脉分支和脾血窦的内皮细胞均呈阳性反应(图11)。另有一些大小不等的细胞成群分布于血管附近,或胞浆呈阳性或胞浆、胞核均呈免疫反应性(图11)。

, http://www.100md.com
图6 示PALS和脾淋巴小结的断面,两者之间界限不清,中央动脉偏于一侧,中央亮区为G。许多NT-3免疫反应性细胞散布于PALS和脾淋巴小结中,G内阳性细胞很少。中性红复染 ×200
图7 示PALS内NT-3免疫反应性细胞,胞核与胞浆免疫染色均呈阳性,箭头示NT-3免疫反应性细胞的胞浆突起 ×1 000(油镜)
图8 示PALS及其周边的NT-3免疫反应性细胞,MZ阳性细胞很少,中性红复染 ×400
图9 示G内NT-3免疫反应性细胞,圆或椭圆形,无胞浆突起 ×1 000(油镜)
图10 示红髓内聚集成群的NT-3免疫反应性细胞 ×400
图11 示NT-3免疫反应性内皮细胞,血管周围可见胞浆着色(箭头)和胞浆胞核均着色(三角)的两种细胞 ×400
, 百拇医药
Fig.6 A profile of PALS and splenic lymph node,the boundary between them is not clear.A central artery could be seen located in one side.The lighter area in the central was G.A lot of NT-3-IR cells scattered in PALS and splenic lymph node,while less NT-3-IR cells in G.Counterstained with neutral red.×200
Fig.7 NT-3-IR cells in the PALS which were immunohistochemically stained both in nuclear and cytoplasm,arrows show the cytoplasmic processes of NT-3-IR cells. ×1 000(oil)
, http://www.100md.com
Fig.8 NT-3-IR cells distributed in the PALS and its peripheral region.Only a few positively stained cells were found in MZ.Counterstained with neutral red. ×400
Fig.9 NT-3-IR cells in the germinal center which are round or ellipse in shape and have no cytoplasmic processes. ×1 000 (oil)
Fig.10 A cluster of NT-3-IR cells in red pulp. ×400
Fig.11 NT-3-IR endothelia.Two kinds of cells which were immunohistochemically stained in cytoplasm (arrow) and both in nuclear and cytoplasm (triangle) could be seen near the blood vessel. ×400
, http://www.100md.com
4. 对照实验结果
以PBS替代一抗和二抗的实验均未见到阳性染色。正常兔血清替代一抗的实验中切片有非常浅的非特异性着色。据Santa Cruz公司检测,NGF、BDNF、NT-3抗体之间无交叉反应。我们实验中也从未见到3种神经营养素之间有交叉染色。
讨论
本实验结果表明NGF、BDNF、NT-3样免疫反应均存在于小鼠脾内,但分布形式各不相同。NGF免疫反应性细胞主要存在于PALS外层、MZ和脾索,而PALS内层的T淋巴细胞分布区无免疫反应性。从分布和形态特点判断它们可能为巨噬细胞和淋巴细胞。已知边缘区和脾索是巨噬细胞主要存在部位,PALS外层、边缘区和脾索有许多B淋巴细胞存在。BDNF免疫反应性细胞的分布特点与NGF免疫反应性细胞相似,所不同的是脾小结生发中心内部分淋巴细胞呈免疫反应性,表明部分较幼稚的B淋巴细胞含有BDNF。NT-3免疫反应性细胞绝大部分位于PALS和髓索内,细胞形状不规则,有明显的胞浆突起。这种分布和形态上的特点高度提示它们为网状细胞。生发中心内的NT-3阳性细胞形状为圆或椭圆形,无胞浆突起,其性质有待确定。红髓内除血管内皮细胞外,其他NT-3阳性细胞的性质尚不清楚。本实验中NT-3免疫反应阳性细胞普遍存在着核着色深于浆的现象,这一现象也见于文献所报道的神经系统内CNTF免疫反应阳性神经细胞,其原因尚不清楚,我们推测该因子有可能在胞浆合成后又返回核内作为转录调节因子而存在[5]。
, http://www.100md.com
本实验结果与RNA酶保护实验结果吻合,后者证实神经营养素mRNA大量存在于脾基质(stroma)[4]。脾基质含网状细胞、巨噬细胞、抗原呈递细胞、成纤维细胞、内皮细胞等多种成分,共同构成淋巴细胞发育成熟的微环境[6]。淋巴细胞在这一微环境中游走、相互作用、相遇抗原、增殖分化以及进行有效的免疫应答。来自于局部成纤维细胞的网状细胞和来自于骨髓单核细胞前体的巨噬细胞是脾实质的主要成分。网状细胞与它们所产生的细胞外基质(ECM)不仅构成淋巴器官的基本框架,ECM中的多种整合素(integrins)家族分子还在免疫活性细胞间、淋巴细胞与抗原呈递细胞或内皮细胞间的相互作用中起重要作用[6]。边缘区的巨噬细胞分为两种,一种是具有强非特异性酯酶活性的边缘区嗜金属细胞,另一种是具有活跃的吞噬和抗原呈递能力的边缘区巨噬细胞[7]。本研究尚难以区分NGF免疫反应性细胞属于何种巨噬细胞。
脾是神经支配的靶器官,脾内神经营养素的存在符合神经营养素靶源性来源的特点。支配脾的神经主要是交感神经,而NGF和NT-3的主要作用对象之一正是交感神经元,故NGF和NT-3是维持脾神经正常形态和功能所必需的因子。我们以前的工作证实,免疫应答中脾交感神经纤维密度增加,并呈现自中央动脉向边缘区伸展的趋势[8],提示免疫功能活跃时神经系统的活动也同时增加,后者可能处于某种因素的驱使之下。边缘区巨噬细胞内NGF以及脾网状细胞内NT-3的发现,将有助于解释这种特殊功能状态下神经形态变化的机制。最近Kannan[9]等报道体外培养的淋巴组织能诱导交感神经生长,且这一作用可被抗NGF抗体所阻断,说明免疫器官产生的NGF具有神经诱生作用。已知脑内巨噬细胞和腹腔巨噬细胞具有产生NGF的功能[10,11],脾巨噬细胞是否具有这一功能还有待于证实。目前,有关NT-3与免疫系统之间的关系研究较少,但其在免疫器官的独特分布提示着它的广泛作用。网状细胞是支持营养神经成分的主要结构,有学者观察到脾单胺能神经深陷于网状细胞胞浆内、网状细胞以类似施万细胞的形式包裹神经纤维[12]。因此,通过维持正常和免疫应答时神经成分形态及功能状态的完整,神经营养素有可能间接起到调节免疫功能的作用,而免疫器官的交感神经具有重要的免疫调节功能早已得到证实。
, 百拇医药
另外,淋巴组织产生的神经营养因子还可能直接作用于免疫系统本身以调节免疫功能。已知免疫器官中诸如淋巴细胞、巨噬细胞和内皮细胞等多种细胞广泛存在神经营养素的受体[13,14],而且由受体介导的NGF促淋巴细胞增殖作用已得到证实。故神经营养素对免疫功能的多方面作用很值得进一步研究。
收稿1997-06 修回1998-04
参考文献
[1]Thorpe LW,Perez-Polo JR.The influence of nerve growth factor on in vivo proliferative response of rat spleen lymphocytes.J Neurosci Res,1987,18(1):134
[2]Otten U,Ehrhard P,Peck R.Nerve growth factor induces growth and differentiation of human B lymphocytes.Proc Natl Acad Sci USA,1989,86(24):10059
, 百拇医药
[3]Thorpe L,Werrbach-Perez W K,Perez-polo JR.Effects of nerve growth factor on the expression of interleukin-2 receptors on cultured human B lymphocytes.Ann NY Acad Sci USA,1987,496:310
[4]Laurenzi MA,Barbany G,Timmusk T,et al:Expression of mRNA encoding neurotrophins and neurotrophin receptors in rat thymus,spleen tissue and immunocompetent cells.Eur J Biochem,1994,223(3):733
[5]Henderson JT,Seniuk NA,Roder JC.Localization of CNTF immunoreactivity to neurons and astroglia in the CNS.Mol Brain Res,1994,22(1-4):151
, 百拇医药
[6]Weiss L,Sakai H.The hematopoietic stroma.Am J Anat,1984,170(3):447
[7]Matsuno K,Fujii H,Kotani M.Splenic marginal zone macrophages and marginal metallophils in rat and mice.Cell Tissue Res,1986,246(2):263
[8]Yang Hong,Wang Ling,Ju Gong.Plasticity of GAP-43 innervation of the spleen during immune response in the mouse-evidence for axonal sprouting and redistribution of the nerve fibers.Neuroimmunomodulation 1998 (in press)
, 百拇医药
[9]Kannan Y,Bienenstock J,Ohta M,et al.Nerve growth factor and cytokines mediate lymphoid tissueinduced neurite outgrowth from mouse superior cervical ganglia in vitro.J Immunol,1996,157(1):314
[10]Otten U,Weskamp G,Hardung M,et al.Synthesis and release of nerve growth factor by rat macrophages.Proc Soc Neurosci,1987,13:184
[11]Mallat M,Houlgatte R,Brachet P,et al.Lipopolysaccharide stimulated rat brain macrophages release NGF in vitro.Dev Biol,1989,133(1):309
, 百拇医药
[12]Blue J,Weiss L.Vascular pathway in non-sinusal red pulp:An electron microscope study of the cat spleen.Am J Anat,1981,161(2):135
[13]Shibayama E.Hirotaka K.Cellular localization of the trk neurotrophin receptor family in human non-neuronal tissues.Am J Path,1996,148(6):1807
[14]Hannestad J,Levanti MB,Vega JA.Distribution of neurotrophin receptors in human palatine tonsils:an immunohistochemical study.J neuroimmun,1995,58(2):131
, 百拇医药
STUDY ON THE LOCALIZATION OF NEUROTROPHINS IN THE
SPLEEN OF MOUSE
Yang HongΔ, Bo Yin, Zhou Changman*, Ju Gong**,Fan Ming
(Department of Neurobiology,Institute of Basic Medical Sciences,Beijing;
*Department of Anatomy,Beijing Medical College of PLA;
**Institute of Neurosciences,The Fourth Military Medical University,Xi'an)
, 百拇医药
In order to understand the relationship of neurotrophins and immune system,the present study investigated the localization of NGF,brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NT-3) in the spleen of BALB/c mouse using immunohistochemical method.The result showed that all three neurotrophins were present in the spleen with different distribution pattern.NGF was mainly distributed in macrophages-like and lymphocytes-like cells in the outer layer of periarterial lymphocyte sheath (PALS) of white pulp,marginal zone(MZ) and red pulp(RP).BDNF showed a similar distribution pattern with that of NGF,in addition,it was also identified in the lymphocytes of germinal center of splenic follicles.NT-3 was found widely in the reticular-like cells of white and red pulp.The present results indicated that both immune cells and non-immune cells of spleen might be capable of producing neurotrophins and different neurotrophins might exert different effects on immune system.
KEY WORDS Neurotrophin; Spleen; Immunohistochemistry; Mouse
△Department of Neurobiology,Institute of Basic Medical Sciences,Beijing 100850,China, 百拇医药(杨 宏 伯 音 周长满* 鞠 躬** 范 明)