人酪氨酸羟化酶基因在猴骨骼肌直接注射后的表达*
作者:王 珏 赵 澎 郑少鹏 赵春礼王 珂 刘玉军 田竟生 徐群渊
单位:首都医科大学神经科学研究所,北京 100054
关键词:肌细胞;基因导入;基因表达;人酪氨酸羟化酶基因;非人灵长类
解剖学报/980403 摘 要 为了对多途径治疗帕金森病(PD)提供研究依据,将带人酪氨酸羟化酶基因的质粒pRcTH与脂质体混合后直接注射至猴骨骼肌内,100d后取注射部位肌肉组织,以地高辛标记的hTHRNA探针进行Northern杂交,以检测该质粒在非人灵长类活体骨骼肌组织中表达的目的基因的mRNA水平。本研究结果表明,人酪氨酸羟化酶基因在猴体内有较高效率的表达。本研究提示,质粒可作为基因治疗的较理想的表达载体,而骨骼肌细胞则是一种能携带并表达外源基因的良好靶细胞。
近年来所进行的基因治疗研究是将某种遗传物质转入相应的细胞或组织中,以达到治疗目的。因此,进行基因治疗的关键是基因导入[1]。目前基因导入方法主要有两类:一类是间接法,即从体内取出靶细胞在体外转染遗传物质后再植入体内[2];另一类是直接法,即把遗传物质直接注入作用部位[1]。目前我们从事的帕金森病(Parkinson disease,PD)基因治疗的研究是以间接法为主,即将多巴胺合成限速酶——酪氨酸羟化酶(tyrosine hydroxylase,TH)的基因克隆于质粒或逆转录病毒表达载体以后转染靶细胞(如骨骼肌细胞),再移植至大脑纹状体[3,4]。对此,有人进行了采用直接注射法的探索性研究[5],但对其实用性尚有争议[1],如注射后表达产物的作用范围是否足够大,是否会经轴突到达非病变区等。由于研究显示骨骼肌细胞在长期存活方面优于成纤维细胞[4],是较为理想的靶细胞;其在携带外源性目的基因——TH基因方向的能力,也已被大量实验所证实。因此,本实验拟将携带人TH基因的质粒pRcTH直接注射至猴骨骼肌中并观察其表达情况,以期为多途径治疗PD提供研究基础。
, http://www.100md.com
材料和方法
1.实验动物
本研究使用成年恒河猴1只,雌性,5.37kg(购自中国医学科学院动物养殖场),60%水合氯醛麻醉,手术暴露左小腿三头肌,直视下注入带人TH基因的质粒pRcTH(由美国Somatix Therapy公司惠赠)20μg与脂质体(lipofectin)(GIBCO)20μg的混合物,注射100d后在麻醉下取注射部位肌肉组织约3g。
2.总RNA提取
用异硫氢酸胍法[6]提取猴肌肉组织总RNA,同时提取引产胎儿(孕6月)肾上腺组织的总RNA作为阳性对照。
3.探针制备
将带有人TH基因的质粒pRcTH(约6.5kb)用限制性内切酶BamHI(华美公司)消化1h(每μg DNA加1IU内切酶,以下同),得到4.3kb、1.97kb和0.27kb3个片段。用DNA快速纯化回收试剂盒(天象人公司)纯化回收其中的4.3kb片段。再用HindⅢ(华美公司)进行消化,得到2.5kb和1.8kb 2个片段。同样纯化回收1.8kb片段。质粒pGEM3zf(华美公司)(约3.2kb)用BamHI和HindⅢ同时消化,得到3.17kb和0.03kb2个片段,纯化回收3.17kb片段。将来自pRcTH的1.8kb片段与来自pGEM3zf的3.17kb片段混合,加入T4连接酶(Promega)和ATP在12℃下过夜(图1)。取上述混合物5μl与感受态大肠杆菌(DH5α)混合经冰浴45min、42℃45s、再冰浴2min后,加SOC 800μl,37℃振摇1h(120r/min),取出50μl铺板(Amp+)。筛选鉴定正确插入的克隆pGEMTH。
, 百拇医药
将新重组的质粒pGEMTH用XhoI完全消化,使之线性化,作为合成探针的模板。用DIG RNA标记盒(Boehringer Mannheim公司)中T7 RNA聚合酶合成地高辛标记的RNA探针(约1.4kb)。标记后与试剂盒中的标准标记RNA(1g/L)同时直接显色,检测hTH RNA探针的浓度及灵敏度。
4.Northern Blot
取猴肌及人胎肾上腺的总RNA各3μl,进行含甲醛凝胶电泳,用真空印迹仪将RNA转运至尼龙膜上,120℃下干烤30min。加杂交液(50%甲酰胺,5×SSC,2%阻滞试剂,0.1%十二烷基肌氨酸,0.02%SDS 20ml/100cm2),68℃下1h。再加入含RNA探针100ng的杂交液(2.5ml/100cm2),68℃下过夜。洗膜:(1)2×SSC,0.5%SDS,5min 2次;(2)0.1×SSC,0.5%SDS 15min 2次,68℃;(3)Washing buffer 1min,(4)bufferⅡ 30min。加碱性磷酸酶标记的羊抗地高辛抗体(用bufferⅡ1∶5 000稀释)振摇30min。buffer Ⅰ 15min 2次,bufferⅢ 15min。加显色底物氯化硝基因氮唑蓝(45μl)和5-嗅-4-氯-3-吲哚基磷酸二钠盐(35μl)(用10ml bufferⅢ稀释),避光静置3~4h。buffer Ⅳ 5min后终止呈色反应。
, http://www.100md.com
图1 hTH RNA 探针合成线路图
Fig.1 The route of hTHRNA probe laleling.
结 果
1.pRcTH酶切后纯化得到4.3kb、1.8kb片段(图2,第2、3泳道)。pGEM 3zf酶切后纯化得到3.17kb片段(图2,第1泳道)。1.8kb及3.17kb片段连接后得到重组质粒pGEMTH,合成线路见图1,经BamHI/HindⅢ,KpnⅠ/XbaⅠ及XhoⅠ分别酶切,确定为正确插入(图3)。
2.地高辛标记hTH RNA探针经直接检测,与试剂盒中标准标记的RNA浓度基本相当(约1g/L),灵敏度达0.1μg/L(图4)。
3.猴肌及胎儿肾上腺组织的总RNA之OD260/OD280=1.99,根据OD260计算总RNA浓度:猴肌0.15g/L,胎儿肾上腺0.1g/L。各取3μl于1%甲醛凝胶电脉(30V,1.5h),结果如图5。
, 百拇医药
4.Northern blot结果,猴肌及肾上腺均为阳性,说明在猴肌中有人TH基因的mRNA表达,且与肾上腺中的表达量基本相当(图6)。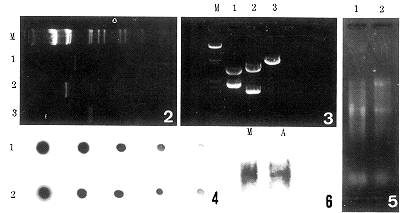
图2 质粒pRcTH及pGEM酶切、纯化片段(1%凝胶电脉,50V,1.5h) M.λDNA/EcoRI,Hind Ⅲ 泳道1.pGEM经BamHI及Hind Ⅲ双酶切后纯化得到的3.17kb片段 泳道2.pRcTH经BamHI酶切后纯化得到4.3kb片段 泳道3. 4.3kb片段经HindⅢ酶切后纯化得到的1.8kb片段
图3 重组质粒pGEMTH酶切鉴定(1%凝胶电泳,50V,1h) M.λDNA/EcoRI,Hind Ⅲ 泳道1.pGEMTH/BamHI 泳道2.pGEMTH/KpnⅠ 泳道3.pGEMTH/XhoⅠ
图4 地高辛标记hTH RNA探针的直接检测 1.hTH RNA探针 2.control RNA探针(从左至右为1mg/L、100μg/L、10μg/L、1μg/L、0.1μg/L)
, 百拇医药
图5 猴肌及胎肾上腺组织总RNA电泳.泳道1.猴肌总RNA 泳道2.胎肾上腺总RNA
图6 Northern blot结果 M.猴肌 A.胎肾上腺
Fig.2 Purified fragment from pRcTH and pGEM after digestion (1% Agarose,50V,1.5h) M:λ DNA/EcoRI,HindⅢ;Lane 1:pGEM(3.17kb) digested by BamHI and HindⅢ;Lane 2: 4.3kb fragment from pRcTH digested by BamHI;Lane 3: 1.8kb fragment from 4.3kb fragment digested by HindⅢ.
Fig.3 Recombined plasmid pGEMTH. M:λDNA/EcoRI,HindⅢ;Lane 1:pGEM/BamHI;Lane 2:pGEMTH/KpnI;Lane 3:pGEMTH/XhoⅠ.
, http://www.100md.com
Fig.4 Direct detection of digoxigenin-labeled hTH RNA probe.1.hTH RNA probe;2.control RNA probe(From the left side:1mg/L,100μg/L,10μg/L,1μg/L,0.1μg/L respectively)
Fig.5 Electrophoresis of total RNA extracted from the muscle of the monkey and the fetal adrenal tissue.Lanel:Monkey muscle;Lane 2:Fetal adrenal tissue
Fig.6 Northern blot M:Monkey muscle;A:Fetal adrenal tissue
讨 论
, http://www.100md.com
如何将目的基因导入机体并长期高效表达,一直是基因治疗中的一个难题。已有一些研究将目的基因克隆于腺病毒载体[7,8]或质粒载体[9~11]后,再注射至大鼠肌肉内,目的基因有较高水平的表达。另有一些研究将带目的基因的重组体与脂质体混合[5]、或与磷酸钙共沉淀[12]、或与多聚赖氨酸——糖蛋白复合物混合[13],然后注射于肌肉中,也取得了肯定结果。在对其他组织的类似研究中发现,向大鼠其他组织中注射质粒,仅心肌组织能吸收并表达外源基因[14],而脾、肾、肝、皮肤、肺、脑等组织则均无表达或表达量极低[10,15]。本实验将带有人TH基因的质粒pRcTH与脂质体混合后,直接注射至猴骨骼肌中,100d后证实在肌肉组织中有TH基因表达。这说明活体骨骼肌组织能接受并表达外源性基因,并可用于基因治疗。有研究认为,直接注射目的基因到猴骨骼肌中的表达效率低于大鼠骨骼肌的[15],可能提示灵长类动物的骨骼肌可能在表达外源性基因方面比啮齿类要更困难些,这也说明进一步研究人骨骼肌表达目的基因的能力是必要的。
, http://www.100md.com
骨骼肌直接吸收表达外源基因的机制尚不清楚,推测可能与其特殊结构即多核、粗面内质网丰富等有关;也可能是由于肌细胞受损后外源基因得以进入[10]。此外,由于DNA和细胞表面都带负电荷,DNA在带正电荷的脂质体包裹下,容易与细胞接近,或脂质体与细胞膜融合,或整个被细胞所吞噬,使目的基因通过细胞本身的机制整合到核内[5]。
骨骼肌细胞能吸收直接注射的靶DNA这一特性,使直接肌肉注射可能作为基因治疗肌肉疾病的给药途径[8,9],达到简便、安全及给药间隔期相对较长的目的。此外,由于骨骼肌供血丰富,可将某些作用于全身的激素或酶的基因导入骨骼肌细胞,使它们作为“生产基地”并通过血流运输至全身,以治疗相应疾病。这些都有待于对骨骼肌细胞更深入更广泛的研究。
在基因治疗的载体选择上,许多学者倾向于采用病毒载体。病毒载体确有表达效率高、持续时间长的优越性,但使用病毒具有直接毒性、抗原性及潜在致癌的风险[1]。而质粒载体则有较高的安全性[4],根据本研究结果也具有相当高的表达效率并持续3个月以上,因而可能较病毒载体具有更好的应用前景。
, http://www.100md.com
收稿1997-7 修回1997-11
参考文献
[1]Karpati G.Lochmuller H,Nalbantoglu J,et al.The principles of gene therapy for the nervous system.Trends Neurosci,1996,19(2):49
[2]Anton R,Kordower JH,Maidment NT,et al.Neural-targeted gene therapy for rodent and primate hemiparkisonism.Exp Neurol,1994,127(1):207
[3]佟宏霞,张进禄,徐群渊等.帕金林病大鼠基因治疗后脑内多巴胺含量的变化.中华医学杂志,1996,76(7):13
, http://www.100md.com
[4]徐群渊,田竟生,张进禄等.体外转基因细胞植入帕金森病模型大鼠脑内的研究.中华外科杂志,1997,35(1):5
[5]曹 蕾,郑仲承,刘新恒等.帕金森病裸DNA法基因治疗的实验研究.生物化学与生物物理进展,1994,21(4)289,369
[6]萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯T等著,金冬雁等译.分子克降实验指南.第2版,北京:科学出版社,1992:352~355
[7]Stratford-Perricaudet LD,Makeh I,Perricaudet M,et al.Wide spread long-term gene transfer to mouse skeletal muscles and heart.J Clin Invest,1992,90(8):626
[8]Quantin B,Perricaudet LD,Tajbakhsh S,et al.Adenovirus as expression vector in muscle cells in vivo.Proc Nat1 Acad Sci USA,1992,89(4):2581
, 百拇医药
[9]Acsadi G,Dickson G,Love DR,et al.Human dystrophin expression in mdx mice after intramuscular infection of DNA constracts.Nature,1991,352(6338):815
[10]Wollf JA,Malone RW,Williams P,et al.Direct gene transfer into mouse muscle in vivo.Science,1990,247(4949):1465
[11]郑少鹏,田竟生,徐群渊.LacZ基因在体内骨骼肌中的表达.首都医科大学学报,1995,16(2):85
[12]Benvenisty N,Reshef L.Direct introduction of genes into rats and exprssion of the gene.Proc Natl Acad Sci USA,1986,83(24):9551
, 百拇医药
[13]Wu GY,Wu CH.Receptor-mediated gene delivery and expression in vivo.J Bio Chem,1988,263(29):14621
[14]Jiao SS,Williams P,Berg RK,et al.Direct gene transfer into nonhuman primate myofibers in vivo.Hum Gene Ther,1992,3(1):21
[15]Lin H,Pamacek MS,Morle GM,et al.Expression of recombinant genes in myocardium in vivo after direct injection of DNA.Circulation,1990,82(6):2217
DIRECT INTRODUCTION INTO AND EXPRESSION OF HUMAN
, http://www.100md.com
TYROSINE HYDROXYLASE GENE IN NONHUMAN
PRIMATE MYOFIBERS IN VIVO
Wang Jue,Zhao Peng,Zheng Shaopeng,Zhao Chunli,Wang Ke,Liu Yujun,Tian Jingsheng,Xu QunyuanΔ
(Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing)
A plasmid (pRcTH) carrying human tyrosine hydroxylase(hTH) gene was intramuscularly coinjected with lipofectin to the monkey muscles.Northern blot showed steady expression of hTH gene in vivo for up to 100 days.The results indicate that the plasmid would be a good expression vector for gene therapy and the myofibers be good target cells for carrying foreign gene.
KEY WORDS Muscle cells;Geng transfer;Geng expression;Human tyrosine hydroxylase(hTH)gene;Nonhuman Primate
△Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing 100054,China, 百拇医药
单位:首都医科大学神经科学研究所,北京 100054
关键词:肌细胞;基因导入;基因表达;人酪氨酸羟化酶基因;非人灵长类
解剖学报/980403 摘 要 为了对多途径治疗帕金森病(PD)提供研究依据,将带人酪氨酸羟化酶基因的质粒pRcTH与脂质体混合后直接注射至猴骨骼肌内,100d后取注射部位肌肉组织,以地高辛标记的hTHRNA探针进行Northern杂交,以检测该质粒在非人灵长类活体骨骼肌组织中表达的目的基因的mRNA水平。本研究结果表明,人酪氨酸羟化酶基因在猴体内有较高效率的表达。本研究提示,质粒可作为基因治疗的较理想的表达载体,而骨骼肌细胞则是一种能携带并表达外源基因的良好靶细胞。
近年来所进行的基因治疗研究是将某种遗传物质转入相应的细胞或组织中,以达到治疗目的。因此,进行基因治疗的关键是基因导入[1]。目前基因导入方法主要有两类:一类是间接法,即从体内取出靶细胞在体外转染遗传物质后再植入体内[2];另一类是直接法,即把遗传物质直接注入作用部位[1]。目前我们从事的帕金森病(Parkinson disease,PD)基因治疗的研究是以间接法为主,即将多巴胺合成限速酶——酪氨酸羟化酶(tyrosine hydroxylase,TH)的基因克隆于质粒或逆转录病毒表达载体以后转染靶细胞(如骨骼肌细胞),再移植至大脑纹状体[3,4]。对此,有人进行了采用直接注射法的探索性研究[5],但对其实用性尚有争议[1],如注射后表达产物的作用范围是否足够大,是否会经轴突到达非病变区等。由于研究显示骨骼肌细胞在长期存活方面优于成纤维细胞[4],是较为理想的靶细胞;其在携带外源性目的基因——TH基因方向的能力,也已被大量实验所证实。因此,本实验拟将携带人TH基因的质粒pRcTH直接注射至猴骨骼肌中并观察其表达情况,以期为多途径治疗PD提供研究基础。
, http://www.100md.com
材料和方法
1.实验动物
本研究使用成年恒河猴1只,雌性,5.37kg(购自中国医学科学院动物养殖场),60%水合氯醛麻醉,手术暴露左小腿三头肌,直视下注入带人TH基因的质粒pRcTH(由美国Somatix Therapy公司惠赠)20μg与脂质体(lipofectin)(GIBCO)20μg的混合物,注射100d后在麻醉下取注射部位肌肉组织约3g。
2.总RNA提取
用异硫氢酸胍法[6]提取猴肌肉组织总RNA,同时提取引产胎儿(孕6月)肾上腺组织的总RNA作为阳性对照。
3.探针制备
将带有人TH基因的质粒pRcTH(约6.5kb)用限制性内切酶BamHI(华美公司)消化1h(每μg DNA加1IU内切酶,以下同),得到4.3kb、1.97kb和0.27kb3个片段。用DNA快速纯化回收试剂盒(天象人公司)纯化回收其中的4.3kb片段。再用HindⅢ(华美公司)进行消化,得到2.5kb和1.8kb 2个片段。同样纯化回收1.8kb片段。质粒pGEM3zf(华美公司)(约3.2kb)用BamHI和HindⅢ同时消化,得到3.17kb和0.03kb2个片段,纯化回收3.17kb片段。将来自pRcTH的1.8kb片段与来自pGEM3zf的3.17kb片段混合,加入T4连接酶(Promega)和ATP在12℃下过夜(图1)。取上述混合物5μl与感受态大肠杆菌(DH5α)混合经冰浴45min、42℃45s、再冰浴2min后,加SOC 800μl,37℃振摇1h(120r/min),取出50μl铺板(Amp+)。筛选鉴定正确插入的克隆pGEMTH。
, 百拇医药
将新重组的质粒pGEMTH用XhoI完全消化,使之线性化,作为合成探针的模板。用DIG RNA标记盒(Boehringer Mannheim公司)中T7 RNA聚合酶合成地高辛标记的RNA探针(约1.4kb)。标记后与试剂盒中的标准标记RNA(1g/L)同时直接显色,检测hTH RNA探针的浓度及灵敏度。
4.Northern Blot
取猴肌及人胎肾上腺的总RNA各3μl,进行含甲醛凝胶电泳,用真空印迹仪将RNA转运至尼龙膜上,120℃下干烤30min。加杂交液(50%甲酰胺,5×SSC,2%阻滞试剂,0.1%十二烷基肌氨酸,0.02%SDS 20ml/100cm2),68℃下1h。再加入含RNA探针100ng的杂交液(2.5ml/100cm2),68℃下过夜。洗膜:(1)2×SSC,0.5%SDS,5min 2次;(2)0.1×SSC,0.5%SDS 15min 2次,68℃;(3)Washing buffer 1min,(4)bufferⅡ 30min。加碱性磷酸酶标记的羊抗地高辛抗体(用bufferⅡ1∶5 000稀释)振摇30min。buffer Ⅰ 15min 2次,bufferⅢ 15min。加显色底物氯化硝基因氮唑蓝(45μl)和5-嗅-4-氯-3-吲哚基磷酸二钠盐(35μl)(用10ml bufferⅢ稀释),避光静置3~4h。buffer Ⅳ 5min后终止呈色反应。

, http://www.100md.com
图1 hTH RNA 探针合成线路图
Fig.1 The route of hTHRNA probe laleling.
结 果
1.pRcTH酶切后纯化得到4.3kb、1.8kb片段(图2,第2、3泳道)。pGEM 3zf酶切后纯化得到3.17kb片段(图2,第1泳道)。1.8kb及3.17kb片段连接后得到重组质粒pGEMTH,合成线路见图1,经BamHI/HindⅢ,KpnⅠ/XbaⅠ及XhoⅠ分别酶切,确定为正确插入(图3)。
2.地高辛标记hTH RNA探针经直接检测,与试剂盒中标准标记的RNA浓度基本相当(约1g/L),灵敏度达0.1μg/L(图4)。
3.猴肌及胎儿肾上腺组织的总RNA之OD260/OD280=1.99,根据OD260计算总RNA浓度:猴肌0.15g/L,胎儿肾上腺0.1g/L。各取3μl于1%甲醛凝胶电脉(30V,1.5h),结果如图5。
, 百拇医药
4.Northern blot结果,猴肌及肾上腺均为阳性,说明在猴肌中有人TH基因的mRNA表达,且与肾上腺中的表达量基本相当(图6)。

图2 质粒pRcTH及pGEM酶切、纯化片段(1%凝胶电脉,50V,1.5h) M.λDNA/EcoRI,Hind Ⅲ 泳道1.pGEM经BamHI及Hind Ⅲ双酶切后纯化得到的3.17kb片段 泳道2.pRcTH经BamHI酶切后纯化得到4.3kb片段 泳道3. 4.3kb片段经HindⅢ酶切后纯化得到的1.8kb片段
图3 重组质粒pGEMTH酶切鉴定(1%凝胶电泳,50V,1h) M.λDNA/EcoRI,Hind Ⅲ 泳道1.pGEMTH/BamHI 泳道2.pGEMTH/KpnⅠ 泳道3.pGEMTH/XhoⅠ
图4 地高辛标记hTH RNA探针的直接检测 1.hTH RNA探针 2.control RNA探针(从左至右为1mg/L、100μg/L、10μg/L、1μg/L、0.1μg/L)
, 百拇医药
图5 猴肌及胎肾上腺组织总RNA电泳.泳道1.猴肌总RNA 泳道2.胎肾上腺总RNA
图6 Northern blot结果 M.猴肌 A.胎肾上腺
Fig.2 Purified fragment from pRcTH and pGEM after digestion (1% Agarose,50V,1.5h) M:λ DNA/EcoRI,HindⅢ;Lane 1:pGEM(3.17kb) digested by BamHI and HindⅢ;Lane 2: 4.3kb fragment from pRcTH digested by BamHI;Lane 3: 1.8kb fragment from 4.3kb fragment digested by HindⅢ.
Fig.3 Recombined plasmid pGEMTH. M:λDNA/EcoRI,HindⅢ;Lane 1:pGEM/BamHI;Lane 2:pGEMTH/KpnI;Lane 3:pGEMTH/XhoⅠ.
, http://www.100md.com
Fig.4 Direct detection of digoxigenin-labeled hTH RNA probe.1.hTH RNA probe;2.control RNA probe(From the left side:1mg/L,100μg/L,10μg/L,1μg/L,0.1μg/L respectively)
Fig.5 Electrophoresis of total RNA extracted from the muscle of the monkey and the fetal adrenal tissue.Lanel:Monkey muscle;Lane 2:Fetal adrenal tissue
Fig.6 Northern blot M:Monkey muscle;A:Fetal adrenal tissue
讨 论
, http://www.100md.com
如何将目的基因导入机体并长期高效表达,一直是基因治疗中的一个难题。已有一些研究将目的基因克隆于腺病毒载体[7,8]或质粒载体[9~11]后,再注射至大鼠肌肉内,目的基因有较高水平的表达。另有一些研究将带目的基因的重组体与脂质体混合[5]、或与磷酸钙共沉淀[12]、或与多聚赖氨酸——糖蛋白复合物混合[13],然后注射于肌肉中,也取得了肯定结果。在对其他组织的类似研究中发现,向大鼠其他组织中注射质粒,仅心肌组织能吸收并表达外源基因[14],而脾、肾、肝、皮肤、肺、脑等组织则均无表达或表达量极低[10,15]。本实验将带有人TH基因的质粒pRcTH与脂质体混合后,直接注射至猴骨骼肌中,100d后证实在肌肉组织中有TH基因表达。这说明活体骨骼肌组织能接受并表达外源性基因,并可用于基因治疗。有研究认为,直接注射目的基因到猴骨骼肌中的表达效率低于大鼠骨骼肌的[15],可能提示灵长类动物的骨骼肌可能在表达外源性基因方面比啮齿类要更困难些,这也说明进一步研究人骨骼肌表达目的基因的能力是必要的。
, http://www.100md.com
骨骼肌直接吸收表达外源基因的机制尚不清楚,推测可能与其特殊结构即多核、粗面内质网丰富等有关;也可能是由于肌细胞受损后外源基因得以进入[10]。此外,由于DNA和细胞表面都带负电荷,DNA在带正电荷的脂质体包裹下,容易与细胞接近,或脂质体与细胞膜融合,或整个被细胞所吞噬,使目的基因通过细胞本身的机制整合到核内[5]。
骨骼肌细胞能吸收直接注射的靶DNA这一特性,使直接肌肉注射可能作为基因治疗肌肉疾病的给药途径[8,9],达到简便、安全及给药间隔期相对较长的目的。此外,由于骨骼肌供血丰富,可将某些作用于全身的激素或酶的基因导入骨骼肌细胞,使它们作为“生产基地”并通过血流运输至全身,以治疗相应疾病。这些都有待于对骨骼肌细胞更深入更广泛的研究。
在基因治疗的载体选择上,许多学者倾向于采用病毒载体。病毒载体确有表达效率高、持续时间长的优越性,但使用病毒具有直接毒性、抗原性及潜在致癌的风险[1]。而质粒载体则有较高的安全性[4],根据本研究结果也具有相当高的表达效率并持续3个月以上,因而可能较病毒载体具有更好的应用前景。
, http://www.100md.com
收稿1997-7 修回1997-11
参考文献
[1]Karpati G.Lochmuller H,Nalbantoglu J,et al.The principles of gene therapy for the nervous system.Trends Neurosci,1996,19(2):49
[2]Anton R,Kordower JH,Maidment NT,et al.Neural-targeted gene therapy for rodent and primate hemiparkisonism.Exp Neurol,1994,127(1):207
[3]佟宏霞,张进禄,徐群渊等.帕金林病大鼠基因治疗后脑内多巴胺含量的变化.中华医学杂志,1996,76(7):13
, http://www.100md.com
[4]徐群渊,田竟生,张进禄等.体外转基因细胞植入帕金森病模型大鼠脑内的研究.中华外科杂志,1997,35(1):5
[5]曹 蕾,郑仲承,刘新恒等.帕金森病裸DNA法基因治疗的实验研究.生物化学与生物物理进展,1994,21(4)289,369
[6]萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯T等著,金冬雁等译.分子克降实验指南.第2版,北京:科学出版社,1992:352~355
[7]Stratford-Perricaudet LD,Makeh I,Perricaudet M,et al.Wide spread long-term gene transfer to mouse skeletal muscles and heart.J Clin Invest,1992,90(8):626
[8]Quantin B,Perricaudet LD,Tajbakhsh S,et al.Adenovirus as expression vector in muscle cells in vivo.Proc Nat1 Acad Sci USA,1992,89(4):2581
, 百拇医药
[9]Acsadi G,Dickson G,Love DR,et al.Human dystrophin expression in mdx mice after intramuscular infection of DNA constracts.Nature,1991,352(6338):815
[10]Wollf JA,Malone RW,Williams P,et al.Direct gene transfer into mouse muscle in vivo.Science,1990,247(4949):1465
[11]郑少鹏,田竟生,徐群渊.LacZ基因在体内骨骼肌中的表达.首都医科大学学报,1995,16(2):85
[12]Benvenisty N,Reshef L.Direct introduction of genes into rats and exprssion of the gene.Proc Natl Acad Sci USA,1986,83(24):9551
, 百拇医药
[13]Wu GY,Wu CH.Receptor-mediated gene delivery and expression in vivo.J Bio Chem,1988,263(29):14621
[14]Jiao SS,Williams P,Berg RK,et al.Direct gene transfer into nonhuman primate myofibers in vivo.Hum Gene Ther,1992,3(1):21
[15]Lin H,Pamacek MS,Morle GM,et al.Expression of recombinant genes in myocardium in vivo after direct injection of DNA.Circulation,1990,82(6):2217
DIRECT INTRODUCTION INTO AND EXPRESSION OF HUMAN
, http://www.100md.com
TYROSINE HYDROXYLASE GENE IN NONHUMAN
PRIMATE MYOFIBERS IN VIVO
Wang Jue,Zhao Peng,Zheng Shaopeng,Zhao Chunli,Wang Ke,Liu Yujun,Tian Jingsheng,Xu QunyuanΔ
(Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing)
A plasmid (pRcTH) carrying human tyrosine hydroxylase(hTH) gene was intramuscularly coinjected with lipofectin to the monkey muscles.Northern blot showed steady expression of hTH gene in vivo for up to 100 days.The results indicate that the plasmid would be a good expression vector for gene therapy and the myofibers be good target cells for carrying foreign gene.
KEY WORDS Muscle cells;Geng transfer;Geng expression;Human tyrosine hydroxylase(hTH)gene;Nonhuman Primate
△Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing 100054,China, 百拇医药