UV-C诱导的体外凋亡SMC内Bcl-2蛋白表达的研究
作者:李晓丹 李进
单位:李晓丹(广州军区医学高等专科学校内科教研室,广州 510315);李进(广州第一军医大学组织学胚胎学教研室)
关键词:平滑肌细胞;凋亡;紫外线;Bcl-2
解剖学报990118
【摘要】 目的 观察经UV-C照射后的凋亡SMC内Bcl-2蛋白表达的情况。 方法 应用组织贴块法进行体外SMC培养,SP免疫组织化学技术和图像分析技术检测经UV-C照射后的SMC内Bcl-2蛋白的表达。 结果 UV-C照射体外SMC后,细胞出现典型的凋亡形态学和生化指标的改变;凋亡SMC胞浆内Bcl-2表达下降和出现胞浆内Bcl-2的迁移和再分布入核。 结论 UV-C照射可引起体外SMC凋亡,且Bcl-2可能参与了UV-C诱导的SMC凋亡的基因调控过程。
, http://www.100md.com
STUDY ON EXPRESSION OF Bcl-2 PROTEIN IN APOPTOTIC
SMCS INDUCED BY ULTRAVIOLET-C IN VITRO
Li Xiaodan,Li Jin△
(Department of Internal Medicine of Guangzhou Medical College PLA, Guangzhou)
【Abstract】 Objective To study expression of Bcl-2 protein in apoptotic SMCs induced by Ultraviolet-C. Methods SMCs were obtained utilizing traditional SMCs culture methods. Expression of Bcl-2 protein in apoptotic SMCs induced by UV-C were observed by means of immunohistochemical and image analysis. Results SMCs were found to undergo apoptosis which was characterized by morphological changes and DNA fragmentation after exposure to UV-C. This exposure led to a decline in expression of Bcl-2 in cytoplasm and a migration and redistribution from cytoplasm into the nucleus. Conclusion UV-C can induce apoptosis of SMCs in vitro and Bcl-2 gene perhaps is one important regulative gene in this apoptotic process.
, 百拇医药
【Key words】 smooth muscle cells; Apoptosis; Ultraviolet; Bcl-2
材料和方法
1. 体外血管平滑肌细胞(smooth muscle cell, SMC)培养及鉴定[1]
选取重约150~200g的成年SD大鼠,无菌条件下取出胸主动脉,剥离中膜,应用组织贴块法进行原代及传代培养,应用SP免疫组织化学方法检测细胞内α-SM Actin蛋白的表达。
2. UV-C诱导体外SMC凋亡模型的建立及其检测
取第4~7代生长良好的SMC,胰蛋白酶消化,以105/ml浓度接种于D100mm平皿中的盖玻片上,应用细胞培养超净台紫外消毒灯(20W、220V、50Hz)发射的UV-C波段光源(254nm)垂直照射距离其10cm处的SMC 10 min(照射时去盖,0.5mlD-Hank液湿润)后,继续培养,观察细胞形态变化,并分别取照射后24h、48h、72h的细胞,HE染色;于24h、48h提取细胞总DNA,进行琼脂糖凝胶电泳,观察其图谱。
, http://www.100md.com
3. UV-C诱导的凋亡SMC内Bcl-2蛋白表达的研究
3.1 免疫组织化学方法:参照SP试剂盒(福州迈新公司)提供的方法,并以PBS缓冲液代替一抗,设立相应的阴性对照片。以超净工作台紫外光源UV-C照射接种于平皿中的盖玻片上的大鼠主动脉SMC 10min,方法同上,继续培养,分别取照射后24h、48h细胞及相应的正常细胞,D-Hank液中洗1~2次,0.01mol/L PBS冲洗2~3次,纯丙酮固定10min,自然干燥,PBS冲洗3次,每次3~5min ×3次,3%过氧化氢溶液室温下孵育10min,PBS冲洗,5min×3次,加50μl 10%非免疫性动物血清,室温下孵育10min,吸去多余液体,加入50μl一抗(抗Bcl-2多克隆抗体,北京中山公司)4℃过液,一抗稀释度为1:20,PBS冲洗,5min×3次,加入50μl生物素标记的二抗,室温下孵育10min,PBS冲洗,5min×3次,加入50μl链亲和素-过氧化物酶溶液,室温下孵育10min,PBS冲洗5min×3次,100μl新鲜配制的DAB-H2O2溶液,显色3~10min,显微镜观察,待显色完成后用自来水冲洗3min,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。
, 百拇医药
3.2 形态计量学方法:每组标本测定3张切片,每张切片测定多个视野,以视野数为单位(n值),分别为:24h实验组n=12,对照组n=9;48h实验组n=10,对照组n=10;每张切片的多个视野共测50个细胞,3张切片总计150个细胞,用Quantimet 520+图像分析仪(德国)进行测量,选择OD值(平均光密度值)为定量参数。
3.3 统计学处理:检测结果以 表示,采用两均数间比较的t检验。
表示,采用两均数间比较的t检验。
实验分组:正常对照组(control)
UV-C照射组(UV-C)
结 果
1.体外SMC培养
, 百拇医药
参照传统的组织贴块法进行体外SMC培养,所得细胞生长状态具典型“峰与谷”结构,SP免疫组织化学方法观察细胞内α-SM Actin表达阳性,证明所得细胞为SMC。
2.UV-C诱导体外SMC凋亡及其检测
2.1 形态学变化:应用常规细胞培养超净台紫外消毒灯(20W、220V、50Hz)所发射的紫外光源UV-C(254nm)垂直照射距离其10cm处的SMC10min后,约3h细胞体积开始缩小,12h部分细胞变圆、上浮,随时间推移上浮细胞渐增多,24h将爬片生长的细胞经HE染色,光镜下观察可见:细胞体积变小、胞质收缩、深染,核染色质浓缩,聚集于核膜下呈镜界分明的颗粒块状小体,细胞形态完整;48h可见多数细胞表现同24h,亦可见部分细胞膜出泡;72h时可见细胞膜包裹碎裂的核成为凋亡小体。(图2~5)。
上述形态学变化发生之后,进一步检测其生化指标。
, http://www.100md.com
2.2 生化指标检测:于UV-C照射后24h、48h分别提取细胞总DNA进行琼脂糖凝胶电泳,结果见图1。可见经UV-C照射后24h、48h的细胞DNA图谱为180~200bp的亚单位片断及其倍数的片断,呈梯状(ladder),未经处理的正常细胞其DNA图谱不呈现梯状带。说明经UV-C照射后SMC DNA在核小体联接部发生了断裂。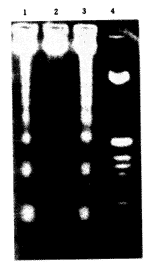
图1 SMC DNA图谱
1.UV-C照射后24h 2.正常对照组 3.UV-C照射后48h 4.分子量Mark
(Hinf 切割 pBR322,1,632;517;506;396;344;298;221;220;154bp)
Fig.1 SMC DNA Ladder
, 百拇医药
3.UV-C诱导的凋亡SMC内Bcl-2蛋白表达的研究
3.1 免疫组织化学染色观察:光镜下,正常SMC Bcl-2在胞浆中成片均匀表达,核周表达增强,可呈环状或块状围绕胞核,核内表达阴性;照后24h、48h凋亡SMC胞浆中Bcl-2均匀弱表达,核内阳性表达,呈块状或半月状增强。说明UV-C可导致SMC胞浆内Bcl-2表达下降和胞浆内Bcl-2的迁移和再分布入核。(图6,7)
3.2 形态计量学观察:正常、经UV-C照射10min后24h、48h大鼠主动脉SMC内bcl-2基因表达的平均光密度值变化见附表。
附表 UV-C照射后24h、48hSMC内Bcl-2蛋白的平均光密度值
Table OD Value of Bcl-2 in SMC at 24h and 48h after exposure to UV-C
, http://www.100md.com
UV-C照射后时间(time after exporsure to UV-C)
24h
48h
对照组
control
0.053±0.001
0.052±0.002
UV-C照射组
UV-C
0.047±0.002**
0.046±0.002**
, 百拇医药
**P<0.01 与正常对照组相比
**P<0.01 as compared with Control
与正常对照组相比,UV-C照射后24h实验组、48h实验组大鼠SMC Bcl-2表达量显著降低(P<0.01),24h、48h实验组之间无明显差异(P>0.2)。
讨 论
紫外线根据波长可分为3种:UV-A 320~390nm; UV-B 280~320nm;UV-C <280nm。UV-C光子能量高,可迅速产生大量损伤,因此,许多研究对象是UV-C辐射对多种生物体组织和细胞的损伤的影响。UV可诱导多种细胞发生凋亡,如人表皮Langerhans细胞、角化细胞、人白血病细胞、U937细胞等,其机制尚不明确,可能与DNA的直接、间接损伤[2]和在分子水平上激活多种凋亡相关基因如Clusterin基因、fos/jun基因家族、Bcl-2基因、P53基因等有关[3~5]。
, 百拇医药
Bcl-2是目前较为公认的与凋亡有密切关系的基因,越来越多的研究证明,对相当广泛的致凋亡因素如去除血清、γ-射线、糖皮质激素、myc基因过量表达等作用后引发的凋亡,Bcl-2均具有抑制作用,具有非常普遍的意义,似乎代表着一类哺乳动物细胞死亡的解毒剂[6]。但Bcl-2对某些细胞的凋亡却并无保护作用,提示凋亡的基因调控至少存在着两条或以上的激活途径。目前,Bcl-2调控凋亡的确切机制尚不十分清楚,研究发现Bcl-2与线虫(C elegans)中的抑凋亡基因ced-9有部分同源性,后者是通过抑制两个死亡基因ced-3、ced-4而起到抗凋亡作用的,将哺乳动物的Bcl-2基因转入线虫中可起到同样作用[7];最新研究表明,Bcl-2蛋白能与细胞中另一被称作bax的蛋白质结合,两者的比率可能决定了细胞接受信号后的存活或死亡[8];另外有学者认为Bcl-2对凋亡的抑制可能缘于抗氧自由基和抗脂质过氧化作用[9]。
在UV导致的表皮细胞凋亡中,凋亡细胞内的Bcl-2基因转录活性降低,但Bax基因的表达未见增高[4]。Zhang等[10]则发现,皮肤中黑素细胞可产生神经生长因子(nerve growth factor,NGF),后者使得黑素细胞内Bcl-2蛋白表达增高,从而保护了细胞,避免了UV引发的凋亡。
, 百拇医药
在SMC凋亡研究领域,Bennett等[11]发现,应用逆转录病毒载体转染Bcl-2,可抑制SMC凋亡,有力地证明了Bcl-2极可能参与了SMC凋亡的调控过程;Leszczynski等[12]研究了蛋白激酶C抑制剂Calohostin C诱导的SMC凋亡过程中的Bcl-2基因表达,发现了凋亡SMC内Bcl-2表达下降和胞浆内Bcl-2的迁移入核。本研究发现UV-C诱导后的凋亡SMC胞浆内Bcl-2表达较正常SMC明显减弱,但在核内有阳性表达,提示UV-C诱导SMC凋亡不仅仅与Bcl-2蛋白表达下降有关,且也可能与胞浆内Bcl-2再分布入核有关,Bcl-2可能参与了UV-C诱导的SMC凋亡的基因调控过程。这一结论也支持Leszcynski的观点,此两种不同的诱因引起了凋亡SMC内Bcl-2基因表达的相似变化,可能Bcl-2是处于多因素诱导SMC凋亡共同通路上的一个中心环节。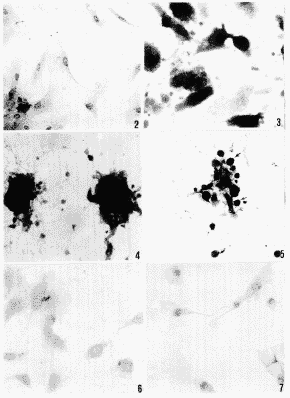
图版说明
, http://www.100md.com
图2 正常大鼠 SMCs“峰和谷”生长结构
图3 UV-C照射后24h SMCs 细胞皱缩,细胞浓染,染色质分裂为颗粒块状小体
图4 UV-C照射后48h SMCs膜出泡
图5 UV-C照射后72h SMCs(↑)凋亡小体
图6 正常SMCs Bcl-2表达 Bcl-2在胞浆内均匀表达,核内阴性
图7 经UV-C照射后24h SMCs内Bcl-2表达,经UV-C照射后,SMC胞浆内Bcl-2表达减弱,核内阳性表达
Ecplanation of figures
Fig 2. Normal rat SMCs hill-and-valley growth pattern HE×20
, 百拇医药
Fig 3. SMCs at 24h after exposure to UV-C for 24h cell shrinkage, dense cytoplasm and chromatin condensation HE ×40
Fig 4. SMCs at 48h after exposure to UV-C for 48h membrane blebbing HE ×100
Fig 5. SMCs at 72h after exposure to UV-C for 72h ↑: apoptotic body HE ×20
Fig 6. Bcl-2 expression in normal SMCs Bcl-2 expressed in cytoplasm yet the nuclei did not stain for Bcl-2 SP×20
, 百拇医药
Fig 7. Bcl-2 expression in SMCs at 24h after exposure to UV-C exposure of SMC to UV-C led to a decline in expression of Bcl-2 n cytoplasm but a positive staining in the nucleus. SP ×20
△Department of Histology and Embryology of the First Military Medical University ,Guangzhou 510510,China
参考文献
[1]邓仲端,陈钦才.SMC培养及其在AS研究中的意义.病理学进展.北京:人民卫生出版社,1987: 192
, 百拇医药 [2]Gudar DE,Lucas AD. Spectral dependence of UV-induced immediate and delayed apoptosis: the role of membrane and DNA damage. Photochem Photobiol, 1995,62(1):108
[3]French LE, Wohlwend A, Sappino AP, et al. Human clusterin gene expression is confined to surviving cells during in vitro programmed cell death. J Clin Invest, 1994,93(2):877
[4]Gillardon F, Eschenfelder C, Uhlmann E, et al. Differential regulation of c-fos, fosB, c-jun, junB, Bcl-2 and bax expression in rat skin following single or chronic ultaviolet irradiation and in vivo modulation by antisens oligodeoxy-nucleotide superfusion. Oncogene, 1994, 9(11):3219
, 百拇医药
[5]Jiang MC, Yang HF, Lin JK, et al. Differential regulation of p53, c-Myc, Bcl-2 and Bax protein expression during apoptosis induced by widely divergent stimuli in human hepatoblastoma cells. Oncogene, 1996,13(3):609
[6]Reed JC. Bcl-2 and the regulation of programmed cell death. J Cell Biol, 1994,124(1,2):1
[7]Marks J. Cell death studies yield cancer clues. Science, 1993, 259(5096):760
[8]Oltvai ZN, Milliman CL, Korsmeyer SJ, et al. Bcl-2 hete redimerizes in vivo with a conserved homology, Bax, that accelerate programmed cell death. Cell,1993,74(4):609
, 百拇医药
[9]Hockenber DMZN, Oltvai XM, Yin CL, et al. Bcl-2 functions in an antioxidant pathway to prevent apoptosis. Cell, 1993, 75(2):241
[10]Zhang S, Yaar M, Doyle SM, et al. Nerve growth factor rescues pigment cells from ultraviolet induced apoptosis by upregulating Bcl-2 levels. Exp Cell Res, 1996,224(2):335
[11]Bennett MR, Evan GI, Schwartz SW. Apoptosis of human vascular smooth muscle cells derived from normal vessels and coronary atherosclerotic plaques. J Clin Invest,1995,95(5):2266
[12]Leszcynski D, Zhao Y, Luokkamaki M, et al. Protein kinase C and oncoprotein Bcl-2 are involed in regulation of apoptosis in non-transformed rat vascular smooth muscle cells. Am J Pathol, 1994, 145(6):1265, 百拇医药
单位:李晓丹(广州军区医学高等专科学校内科教研室,广州 510315);李进(广州第一军医大学组织学胚胎学教研室)
关键词:平滑肌细胞;凋亡;紫外线;Bcl-2
解剖学报990118
【摘要】 目的 观察经UV-C照射后的凋亡SMC内Bcl-2蛋白表达的情况。 方法 应用组织贴块法进行体外SMC培养,SP免疫组织化学技术和图像分析技术检测经UV-C照射后的SMC内Bcl-2蛋白的表达。 结果 UV-C照射体外SMC后,细胞出现典型的凋亡形态学和生化指标的改变;凋亡SMC胞浆内Bcl-2表达下降和出现胞浆内Bcl-2的迁移和再分布入核。 结论 UV-C照射可引起体外SMC凋亡,且Bcl-2可能参与了UV-C诱导的SMC凋亡的基因调控过程。
, http://www.100md.com
STUDY ON EXPRESSION OF Bcl-2 PROTEIN IN APOPTOTIC
SMCS INDUCED BY ULTRAVIOLET-C IN VITRO
Li Xiaodan,Li Jin△
(Department of Internal Medicine of Guangzhou Medical College PLA, Guangzhou)
【Abstract】 Objective To study expression of Bcl-2 protein in apoptotic SMCs induced by Ultraviolet-C. Methods SMCs were obtained utilizing traditional SMCs culture methods. Expression of Bcl-2 protein in apoptotic SMCs induced by UV-C were observed by means of immunohistochemical and image analysis. Results SMCs were found to undergo apoptosis which was characterized by morphological changes and DNA fragmentation after exposure to UV-C. This exposure led to a decline in expression of Bcl-2 in cytoplasm and a migration and redistribution from cytoplasm into the nucleus. Conclusion UV-C can induce apoptosis of SMCs in vitro and Bcl-2 gene perhaps is one important regulative gene in this apoptotic process.
, 百拇医药
【Key words】 smooth muscle cells; Apoptosis; Ultraviolet; Bcl-2
材料和方法
1. 体外血管平滑肌细胞(smooth muscle cell, SMC)培养及鉴定[1]
选取重约150~200g的成年SD大鼠,无菌条件下取出胸主动脉,剥离中膜,应用组织贴块法进行原代及传代培养,应用SP免疫组织化学方法检测细胞内α-SM Actin蛋白的表达。
2. UV-C诱导体外SMC凋亡模型的建立及其检测
取第4~7代生长良好的SMC,胰蛋白酶消化,以105/ml浓度接种于D100mm平皿中的盖玻片上,应用细胞培养超净台紫外消毒灯(20W、220V、50Hz)发射的UV-C波段光源(254nm)垂直照射距离其10cm处的SMC 10 min(照射时去盖,0.5mlD-Hank液湿润)后,继续培养,观察细胞形态变化,并分别取照射后24h、48h、72h的细胞,HE染色;于24h、48h提取细胞总DNA,进行琼脂糖凝胶电泳,观察其图谱。
, http://www.100md.com
3. UV-C诱导的凋亡SMC内Bcl-2蛋白表达的研究
3.1 免疫组织化学方法:参照SP试剂盒(福州迈新公司)提供的方法,并以PBS缓冲液代替一抗,设立相应的阴性对照片。以超净工作台紫外光源UV-C照射接种于平皿中的盖玻片上的大鼠主动脉SMC 10min,方法同上,继续培养,分别取照射后24h、48h细胞及相应的正常细胞,D-Hank液中洗1~2次,0.01mol/L PBS冲洗2~3次,纯丙酮固定10min,自然干燥,PBS冲洗3次,每次3~5min ×3次,3%过氧化氢溶液室温下孵育10min,PBS冲洗,5min×3次,加50μl 10%非免疫性动物血清,室温下孵育10min,吸去多余液体,加入50μl一抗(抗Bcl-2多克隆抗体,北京中山公司)4℃过液,一抗稀释度为1:20,PBS冲洗,5min×3次,加入50μl生物素标记的二抗,室温下孵育10min,PBS冲洗,5min×3次,加入50μl链亲和素-过氧化物酶溶液,室温下孵育10min,PBS冲洗5min×3次,100μl新鲜配制的DAB-H2O2溶液,显色3~10min,显微镜观察,待显色完成后用自来水冲洗3min,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。
, 百拇医药
3.2 形态计量学方法:每组标本测定3张切片,每张切片测定多个视野,以视野数为单位(n值),分别为:24h实验组n=12,对照组n=9;48h实验组n=10,对照组n=10;每张切片的多个视野共测50个细胞,3张切片总计150个细胞,用Quantimet 520+图像分析仪(德国)进行测量,选择OD值(平均光密度值)为定量参数。
3.3 统计学处理:检测结果以
 表示,采用两均数间比较的t检验。
表示,采用两均数间比较的t检验。实验分组:正常对照组(control)
UV-C照射组(UV-C)
结 果
1.体外SMC培养
, 百拇医药
参照传统的组织贴块法进行体外SMC培养,所得细胞生长状态具典型“峰与谷”结构,SP免疫组织化学方法观察细胞内α-SM Actin表达阳性,证明所得细胞为SMC。
2.UV-C诱导体外SMC凋亡及其检测
2.1 形态学变化:应用常规细胞培养超净台紫外消毒灯(20W、220V、50Hz)所发射的紫外光源UV-C(254nm)垂直照射距离其10cm处的SMC10min后,约3h细胞体积开始缩小,12h部分细胞变圆、上浮,随时间推移上浮细胞渐增多,24h将爬片生长的细胞经HE染色,光镜下观察可见:细胞体积变小、胞质收缩、深染,核染色质浓缩,聚集于核膜下呈镜界分明的颗粒块状小体,细胞形态完整;48h可见多数细胞表现同24h,亦可见部分细胞膜出泡;72h时可见细胞膜包裹碎裂的核成为凋亡小体。(图2~5)。
上述形态学变化发生之后,进一步检测其生化指标。
, http://www.100md.com
2.2 生化指标检测:于UV-C照射后24h、48h分别提取细胞总DNA进行琼脂糖凝胶电泳,结果见图1。可见经UV-C照射后24h、48h的细胞DNA图谱为180~200bp的亚单位片断及其倍数的片断,呈梯状(ladder),未经处理的正常细胞其DNA图谱不呈现梯状带。说明经UV-C照射后SMC DNA在核小体联接部发生了断裂。

图1 SMC DNA图谱
1.UV-C照射后24h 2.正常对照组 3.UV-C照射后48h 4.分子量Mark
(Hinf 切割 pBR322,1,632;517;506;396;344;298;221;220;154bp)
Fig.1 SMC DNA Ladder
, 百拇医药
3.UV-C诱导的凋亡SMC内Bcl-2蛋白表达的研究
3.1 免疫组织化学染色观察:光镜下,正常SMC Bcl-2在胞浆中成片均匀表达,核周表达增强,可呈环状或块状围绕胞核,核内表达阴性;照后24h、48h凋亡SMC胞浆中Bcl-2均匀弱表达,核内阳性表达,呈块状或半月状增强。说明UV-C可导致SMC胞浆内Bcl-2表达下降和胞浆内Bcl-2的迁移和再分布入核。(图6,7)
3.2 形态计量学观察:正常、经UV-C照射10min后24h、48h大鼠主动脉SMC内bcl-2基因表达的平均光密度值变化见附表。
附表 UV-C照射后24h、48hSMC内Bcl-2蛋白的平均光密度值
Table OD Value of Bcl-2 in SMC at 24h and 48h after exposure to UV-C
, http://www.100md.com
UV-C照射后时间(time after exporsure to UV-C)
24h
48h
对照组
control
0.053±0.001
0.052±0.002
UV-C照射组
UV-C
0.047±0.002**
0.046±0.002**
, 百拇医药
**P<0.01 与正常对照组相比
**P<0.01 as compared with Control
与正常对照组相比,UV-C照射后24h实验组、48h实验组大鼠SMC Bcl-2表达量显著降低(P<0.01),24h、48h实验组之间无明显差异(P>0.2)。
讨 论
紫外线根据波长可分为3种:UV-A 320~390nm; UV-B 280~320nm;UV-C <280nm。UV-C光子能量高,可迅速产生大量损伤,因此,许多研究对象是UV-C辐射对多种生物体组织和细胞的损伤的影响。UV可诱导多种细胞发生凋亡,如人表皮Langerhans细胞、角化细胞、人白血病细胞、U937细胞等,其机制尚不明确,可能与DNA的直接、间接损伤[2]和在分子水平上激活多种凋亡相关基因如Clusterin基因、fos/jun基因家族、Bcl-2基因、P53基因等有关[3~5]。
, 百拇医药
Bcl-2是目前较为公认的与凋亡有密切关系的基因,越来越多的研究证明,对相当广泛的致凋亡因素如去除血清、γ-射线、糖皮质激素、myc基因过量表达等作用后引发的凋亡,Bcl-2均具有抑制作用,具有非常普遍的意义,似乎代表着一类哺乳动物细胞死亡的解毒剂[6]。但Bcl-2对某些细胞的凋亡却并无保护作用,提示凋亡的基因调控至少存在着两条或以上的激活途径。目前,Bcl-2调控凋亡的确切机制尚不十分清楚,研究发现Bcl-2与线虫(C elegans)中的抑凋亡基因ced-9有部分同源性,后者是通过抑制两个死亡基因ced-3、ced-4而起到抗凋亡作用的,将哺乳动物的Bcl-2基因转入线虫中可起到同样作用[7];最新研究表明,Bcl-2蛋白能与细胞中另一被称作bax的蛋白质结合,两者的比率可能决定了细胞接受信号后的存活或死亡[8];另外有学者认为Bcl-2对凋亡的抑制可能缘于抗氧自由基和抗脂质过氧化作用[9]。
在UV导致的表皮细胞凋亡中,凋亡细胞内的Bcl-2基因转录活性降低,但Bax基因的表达未见增高[4]。Zhang等[10]则发现,皮肤中黑素细胞可产生神经生长因子(nerve growth factor,NGF),后者使得黑素细胞内Bcl-2蛋白表达增高,从而保护了细胞,避免了UV引发的凋亡。
, 百拇医药
在SMC凋亡研究领域,Bennett等[11]发现,应用逆转录病毒载体转染Bcl-2,可抑制SMC凋亡,有力地证明了Bcl-2极可能参与了SMC凋亡的调控过程;Leszczynski等[12]研究了蛋白激酶C抑制剂Calohostin C诱导的SMC凋亡过程中的Bcl-2基因表达,发现了凋亡SMC内Bcl-2表达下降和胞浆内Bcl-2的迁移入核。本研究发现UV-C诱导后的凋亡SMC胞浆内Bcl-2表达较正常SMC明显减弱,但在核内有阳性表达,提示UV-C诱导SMC凋亡不仅仅与Bcl-2蛋白表达下降有关,且也可能与胞浆内Bcl-2再分布入核有关,Bcl-2可能参与了UV-C诱导的SMC凋亡的基因调控过程。这一结论也支持Leszcynski的观点,此两种不同的诱因引起了凋亡SMC内Bcl-2基因表达的相似变化,可能Bcl-2是处于多因素诱导SMC凋亡共同通路上的一个中心环节。

图版说明
, http://www.100md.com
图2 正常大鼠 SMCs“峰和谷”生长结构
图3 UV-C照射后24h SMCs 细胞皱缩,细胞浓染,染色质分裂为颗粒块状小体
图4 UV-C照射后48h SMCs膜出泡
图5 UV-C照射后72h SMCs(↑)凋亡小体
图6 正常SMCs Bcl-2表达 Bcl-2在胞浆内均匀表达,核内阴性
图7 经UV-C照射后24h SMCs内Bcl-2表达,经UV-C照射后,SMC胞浆内Bcl-2表达减弱,核内阳性表达
Ecplanation of figures
Fig 2. Normal rat SMCs hill-and-valley growth pattern HE×20
, 百拇医药
Fig 3. SMCs at 24h after exposure to UV-C for 24h cell shrinkage, dense cytoplasm and chromatin condensation HE ×40
Fig 4. SMCs at 48h after exposure to UV-C for 48h membrane blebbing HE ×100
Fig 5. SMCs at 72h after exposure to UV-C for 72h ↑: apoptotic body HE ×20
Fig 6. Bcl-2 expression in normal SMCs Bcl-2 expressed in cytoplasm yet the nuclei did not stain for Bcl-2 SP×20
, 百拇医药
Fig 7. Bcl-2 expression in SMCs at 24h after exposure to UV-C exposure of SMC to UV-C led to a decline in expression of Bcl-2 n cytoplasm but a positive staining in the nucleus. SP ×20
△Department of Histology and Embryology of the First Military Medical University ,Guangzhou 510510,China
参考文献
[1]邓仲端,陈钦才.SMC培养及其在AS研究中的意义.病理学进展.北京:人民卫生出版社,1987: 192
, 百拇医药 [2]Gudar DE,Lucas AD. Spectral dependence of UV-induced immediate and delayed apoptosis: the role of membrane and DNA damage. Photochem Photobiol, 1995,62(1):108
[3]French LE, Wohlwend A, Sappino AP, et al. Human clusterin gene expression is confined to surviving cells during in vitro programmed cell death. J Clin Invest, 1994,93(2):877
[4]Gillardon F, Eschenfelder C, Uhlmann E, et al. Differential regulation of c-fos, fosB, c-jun, junB, Bcl-2 and bax expression in rat skin following single or chronic ultaviolet irradiation and in vivo modulation by antisens oligodeoxy-nucleotide superfusion. Oncogene, 1994, 9(11):3219
, 百拇医药
[5]Jiang MC, Yang HF, Lin JK, et al. Differential regulation of p53, c-Myc, Bcl-2 and Bax protein expression during apoptosis induced by widely divergent stimuli in human hepatoblastoma cells. Oncogene, 1996,13(3):609
[6]Reed JC. Bcl-2 and the regulation of programmed cell death. J Cell Biol, 1994,124(1,2):1
[7]Marks J. Cell death studies yield cancer clues. Science, 1993, 259(5096):760
[8]Oltvai ZN, Milliman CL, Korsmeyer SJ, et al. Bcl-2 hete redimerizes in vivo with a conserved homology, Bax, that accelerate programmed cell death. Cell,1993,74(4):609
, 百拇医药
[9]Hockenber DMZN, Oltvai XM, Yin CL, et al. Bcl-2 functions in an antioxidant pathway to prevent apoptosis. Cell, 1993, 75(2):241
[10]Zhang S, Yaar M, Doyle SM, et al. Nerve growth factor rescues pigment cells from ultraviolet induced apoptosis by upregulating Bcl-2 levels. Exp Cell Res, 1996,224(2):335
[11]Bennett MR, Evan GI, Schwartz SW. Apoptosis of human vascular smooth muscle cells derived from normal vessels and coronary atherosclerotic plaques. J Clin Invest,1995,95(5):2266
[12]Leszcynski D, Zhao Y, Luokkamaki M, et al. Protein kinase C and oncoprotein Bcl-2 are involed in regulation of apoptosis in non-transformed rat vascular smooth muscle cells. Am J Pathol, 1994, 145(6):1265, 百拇医药