大鼠实验性胃溃疡自愈期间胰岛A细胞的结构和功能变化
作者:黄 岩 梁文妹 石爱荣
单位:黄岩(潍坊医学院组织学胚胎学教研室 潍坊 261041);梁文妹(贵阳医学组织学胚胎学教研室 贵阳 550004);石爱荣 (北京医科大学组织学胚胎学系 北京 100083)
关键词:胰岛A细胞;形态计量学;超微结构;胰高血糖素;实验性胃溃疡;大鼠
解剖学报990418 【摘要】 目的 探讨胰岛A细胞参与溃疡自愈调节的可能途径。 方法 应用形态计量、放射免疫测定及透射电镜方法,研究大鼠实验性胃溃疡自愈期间胰岛A细胞的面数密度、超微结构及血清胰高血糖素的变化。 结果 与正常组及盐水组比较,A细胞面数密度于溃疡后6d、10d明显增加(P<0.01)。溃疡后14d开始呈减小趋势,28d基本恢复正常。A细胞超微结构变化在溃疡后第6~14d较明显,主要表现为:(1)细胞核增大,异染色质减少,核周隙扩张;(2)部分A细胞粗面内质网增多,有的呈板层状排列,有的扩张成囊泡;(3)部分A细胞内分泌颗粒增多,大小不等,密度不一。血浆胰高血糖素水平从溃疡后14d到21d呈增高趋势(P<0.01),28d时接近正常。 结论 胰岛A细胞的形态和功能变化表明,它通过增加其细胞数目及增强其合成与分泌胰高血糖素的功能,积极参与了胃溃疡自愈的调节过程。
, 百拇医药
THE CHANGES OF STRUCTURE AND FUNCTION OF
ISLET A CELLS DURING THE HEALING PROCESS
OF GASTRIC ULCER IN RATS
Huang YanΔ Liang Wenmei* Shi Airong**
(Department of Histology and Embryology,Weifang Medical College,Weifang ;
*Guiyang Medical College,Guiyang; **Beijing Medical University,Beijing 100083)
, 百拇医药
【Abstract】 Objective To explore the possible way by which the islet A cells take part in the regulation of the healing process of gastric ulcer in rats. Methods Using morphometry,electron microscopy and radioimmunoassay to study the changes the numerical density on area(NA) and ultrastructure of islet A cells and the level of glucagon during the healing process of gastric ulcer in rats. Results As compared with normal control group(NCG) and saline control group(SCG),the NA of A cells markedly increased(P<0.01) during 6-10 days in experimental gastric ulcer group(EUG),then declined on the 14th day and recovered on the 28th day;the obvious ultrastructure changes occurred in A cells during 6-14 days after inducing gastric ulcer .The changes include that the nucleus was larger and rounder with the more euchromatin and dilated perinuclear space, the rough endoplasmic reticulum increased in the number or dilated into vacuole in some A cells; the number of secrete granules increased with different size and density.The level of plasma glucagon elevated remarkedbly(P<0.01)during 14-21 days,and recovered on the 28th day. Conclusion The above mentioned findings proved that the islet A cells were involved in the regulation of ulcer healing process by increasing their number and enhancing their functions of synthesizing and secreting glucagon.
, http://www.100md.com
【Key words】 Islet A cell; Morphometry; Ultrastructure; Glucagon; Experimental gastric ulcer; Rat
胰高血糖素能预防阿司匹林等引起的胃粘膜损伤早已有实验证明[1]。在大鼠实验性胃溃疡自愈过程中,胰岛A细胞多种酶活性增强,说明A细胞代谢活跃,可能与溃疡的修复愈合有关[2]。本实验在已有工作的基础上,对大鼠实验性胃溃疡自愈期间胰岛A细胞进行了形态计量、超微结构观察及胰高血糖素放射免疫测定,以期将形态与功能结合,进一步探讨胰岛A细胞参与溃疡自愈调节的可能途径。
材料和方法
成年雄性Wistar大鼠120只,体重180~210g,随机分为实验性胃溃疡组(溃疡组,60只)、盐水对照组(盐水组,48只)和正常对照组(正常组,12只)。大鼠实验性胃溃疡模型按本室已建立的方法[3]制作。盐水组为模拟手术,注射等量生理盐水代替冰醋酸。正常组不作任何处理。分别进行以下实验:
, 百拇医药
1. 胰岛A细胞的形态计量
1.1 免疫组织化学PAP法:分别于胃溃疡模型术后第6、10、14、21和28d取大鼠胰尾,Bouin液固定,常规石蜡包埋,制成6μm厚的连续切片,将同一时间点溃疡组、盐水组及正常组各6只大鼠胰尾相同序号的切片裱于同一张载片上。从溃疡组及盐水组各时间点和正常组胰腺切片中每例取片,隔20片取1片,按Sternberger PAP法进行免疫组织化学染色。主要步骤为:切片常规脱蜡到水,甲醇-H2O2封闭,依次滴加兔抗胰高血糖素抗血清(1∶2000 Watpa公司,新西兰),羊抗兔IgG(1∶50)及PAP(1∶100),DAB-H2O2液显色,Mayer苏木精复染。PBS代替胰高血糖素抗血清作为方法对照。
1.2 细胞计数方法:按体视学要求取样,从每个动物的胰腺切片中选直径100μm以上的胰岛9个,每张切片取3个在×400的放大倍数下用点测量法计数目镜测试方格内胰岛落点数(PI)及所测胰岛内胰高血糖素免疫染色细胞(A细胞)数(NX)。用下列公式计算A细胞面数密度(NA),所得数据经t检验处理。
, 百拇医药
a,为一个测试点所代表的测试格面积。
2. A细胞超微结构观察
从溃疡组和盐水组术后第6、10、14、21和28d各时间点和正常组分别取3个大鼠的胰腺,按常规制备电镜标本和观察。
3. 胰高血糖素放射免疫测定
溃疡组和盐水组术后第4、6、10、14、21和28d大鼠(溃疡组10只/时间点,盐水组8只/时间点)和正常组大鼠(12只)禁食24h后,用3%戊巴比妥钠经腹腔注射麻醉并经心脏取血。用北京海科锐生物技术中心研制的胰高血糖素放射免疫测定盒并按其说明书对血浆胰高血糖素进行放射免疫测定。取血2ml,加入盛有100μl抑肽酶1 000kIU和0.5mol/L EDTA-Na的试管内,轻轻摇匀,离心分离血浆。然后依次向放射免疫测定管中加入血浆100μl,抑肽酶50μl,胰高血糖素抗血清100μl,125I-胰高血糖素100μl,震荡混匀,4℃保温24h。之后加入免疫沉淀剂500μl,震荡混匀静置15min,2 000g离心15min,弃上清,用1470WIZARDTM自动γ计数仪得出样品的胰高血糖素浓度ng/L,所得数据用t检验处理。
, http://www.100md.com
结果
1. A细胞的形态及形态计量
A细胞位于胰岛周边,胞质呈棕黄色,形状不规则,呈三角形、多边形及梭形并常有突起(图1)。外分泌部亦有分布于腺泡上皮和导管上皮细胞之间的免疫染色细胞,但数目较少。在溃疡自愈期间,胰岛A细胞自溃疡后6d始明显增加,持续至溃疡后21d(图2,3)。溃疡后10d及14d,外分泌部可见散在于腺泡之间及导管周围的胰高血糖素免疫染色细胞团,尤以溃疡后14d最明显(图4)。其他时间点及正常组则未发现。
方法对照片均为阴性反应。
在溃疡自愈过程中,A细胞NA变化见图5。溃疡后6d和10d A细胞NA明显增高,与正常组及盐水组比较有显著性差异(P<0.01),溃疡后14d呈减小趋势,28d时基本恢复正常。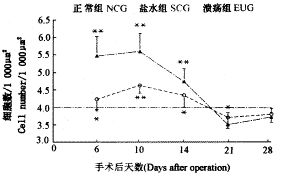
, 百拇医药
图5 A细胞面数密度的变化与正常组比较,P<0.05,P<0.01
Fig.5 The Changes of numerical density on area of islet A cells. *P<0.05, **P<0.01,as compared with NCG
2. A细胞的超微结构变化
溃疡组在溃疡第6d,部分A细胞胞核增大,异染色质减少,核仁明显、边集,核周隙扩张。胞质内出现较多的圆形及不规则形囊泡,囊泡有明显的膜,膜的表面有核糖体附着,囊泡内可见致密物。分泌颗粒较少,线粒体轻微肿胀,高尔基复合体未见明显变化(图6、7)。部分A细胞上述变化程度较轻,但核周隙扩张较明显,细胞基质密度较高(图8),粗面内质网、线粒体增多并呈区域性分布,高尔基复合体较发达,分泌颗粒较多,部分分泌颗粒的致密芯电子密度较低。溃汤第10d,A细胞的超微结构变化与第6d相似,但未见明显的核周隙扩张及囊泡(图6)。溃疡第14d,A细胞的超微结构变化多样,有的A细胞分泌颗粒明显增多,细胞器未见明显变化;有的A细胞高尔基复合体发达,由多层扁平囊及大小泡组成,丰富的粗面内质网在胞核的一侧呈板层状排列,分泌颗粒大小不等(图9);还有的A细胞核质比增大,染色质呈细粒状散在于胞核内,分泌颗粒较少,粗面内质网较丰富(图9)。溃疡第28d,A细胞的超微结构基本恢复正常。
, 百拇医药
3. 胰高血糖素放射免疫测定
如图10所示,溃疡组胰高血糖素水平从溃疡后6d到21d呈增高趋势,各时间点与正常组及盐水组比较均有极显著性差异(P<0.01),28d时接近正常。 图10 血浆胰高血糖素浓度的变化**与正常组比较,P<0.01
图10 血浆胰高血糖素浓度的变化**与正常组比较,P<0.01
Fig.10 The Changes of concentration of plasma glucagon.**P<0.01,as compared with NCG
讨论
在实验性胃溃疡自愈期间胰岛A细胞多种酶活性增强[2],提示A细胞参与了溃疡自愈调节。本实验用免疫组织化学、形态计量及胰高血糖素放射免疫测定方法可更直接地反映A细胞在溃疡自愈过程中的动态变化,从而深入探讨A细胞参与溃疡自愈调节的途径。形态学观察发现,在溃疡自愈期间最明显的改变是胰岛A细胞增加,溃疡后14d,外分泌部出现散在的胰高血糖素免疫染色细胞团。形态计量结果表明,A细胞面数密度高峰是在溃疡后10d,之后趋于降低,放射免疫测定结果表明,溃疡组血浆胰高血糖素高峰出现在溃疡后21d。综合上述结果分析,在溃疡愈合初期(6~10d),胰岛A细胞面数密度及血浆胰高血糖素浓度的增高可能主要是部分处于功能静止状态的A细胞转入功能活跃状态,合成分泌胰高血糖素增多的结果。本研究电镜下所观察到的溃疡后6d A细胞粗面内质网增多,高尔基复合体较发达,分泌颗粒增多及核周隙明显扩张为上述结论提供了证据,光镜下未发现胰岛内有分裂相的事实也为此提供了旁证。溃疡愈合中期(溃疡后14~21d),胰岛A细胞面数密度逐渐减小,而外分泌部出现散在的胰高血糖素免疫染色细胞团,从而使血浆胰高血糖素直至溃疡后21d始终维持在较高水平。因为这些散在的胰高血糖素免疫染色细胞团多位于小导管附近,故推测溃疡病灶可能通过肠胰岛轴影响到导管上皮细胞向胰腺内分泌细胞的分化、增生,其机制尚待探讨。
, http://www.100md.com
根据正常A细胞细胞器及分泌颗粒的形态和数量推测,正常A细胞可以处于静止和活动两种不同的功能状态。溃疡自愈过程中,尤其是溃疡第6~14d,A细胞的超微结构发生了较明显的变化。主要有以下几个方面:
细胞核的变化:溃疡第6~14d,有的A细胞胞核大而圆,异染色质很少;溃疡第6d时,部分A细胞还出现明显的核仁边集及核周隙扩张。细胞核的形态反映了细胞的功能状态,核内常染色质增多,说明细胞的转录功能相对活跃。核仁边集、核周隙扩张都是蛋白质合成功能旺盛的表现[4],这可能有利于转录的RNA自胞核快速输送至胞质。
粗面内质网的变化:溃疡自愈过程中,粗面内质网的变化最显著,正常大鼠胰岛A细胞内粗面内质网或散在分布,或沿核膜及细胞质膜平行排列。溃疡第6d,部分A细胞粗面内质网增多;第14d,A细胞内粗面内质网增多更明显,并平行排列于细胞核的一侧。同时,其附近有发达的高尔基复合体和较多的线粒体。已有研究证明,胰高血糖素在A细胞内的合成途径与胰岛素在B细胞内的合成途径相似[5]。首先,前胰高血糖素原在核糖体上合成,进入粗面内质网,然后经过高尔基复合体加工,最终以具有生物活性的胰高血糖素出现于分泌颗粒内[6]。上述超微结构变化反映了A细胞在溃疡自愈过程中合成胰高血糖素的功能活跃。
, http://www.100md.com
分泌颗粒的变化:溃疡第6~14d,部分A细胞内分泌颗粒增多,大小不等,密度不一。上述变化以第14d更为明显。Orci等[7]对胰岛素在B细胞内合成过程的示踪研究发现,分泌颗粒大小和密度与分泌颗粒的成熟程度有关。由此推测,上述变化可能是由于A细胞合成功能活跃,成熟程度不同的分泌颗粒均增多的结果。
细胞内空泡的形成:溃疡第6d,一些A细胞胞质内出现许多圆形或不规则形空泡,这些细胞与其周围不含空泡的细胞相邻,说明空泡的形成并非人工假象。在溃疡自愈的同一时间点,苏宇华等[8]于垂体的ACTH细胞、苑普庆等[9]于睾丸间质细胞观察到相同的变化,提示这是许多内分泌细胞对溃疡的一种反应。在空泡的表面有核糖体附着,说明这些空泡是扩张的粗面内质网。粗面内质网扩张反映细胞合成功能活跃。但我们在观察中不但未发现此种细胞内与分泌颗粒合成有关的其他细胞器增多,反而分泌颗粒较少。根据内质网快速增多时,所需的结构蛋白是原位来自内质网腔内[4],在溃疡第6d出现粗面内质网扩张的同时,伴有细胞核增大,核仁明显、边集等功能活跃的形态学特征,故推测这是结构蛋白合成活跃的表现,可能与溃疡第14d多数A细胞内粗面内质网的明显增多有关。
, http://www.100md.com
胰高血糖素是血糖的重要调节者之一,它通过分解糖原和糖异生作用使血糖升高。已有研究表明,胰高血糖素还能扩张肠系膜血管,增加粘膜及粘膜下层血流[1],抑制胃酸分泌[10],使胃未分化细胞和粘液细胞内葡萄糖-6-磷酸酶活性增强,表面上皮细胞粘液分泌增多[11],对阿斯匹林引起的胃粘膜损伤具有保护作用[1]。Chiba等[12]已报道胰高血糖素促进胃粘膜分泌生长抑素,而且发现胃内含有生长抑素的细胞与壁细胞密切接触[13]。结合前人及本研究工作可以推测,胰岛A细胞在溃疡自愈期间通过分泌高水平的胰高血糖素作用于胃粘膜,使局部血流增加,胃粘液分泌增加,同时通过促进胃粘膜内D细胞分泌生长抑素抑制胃酸分泌,从而改善胃内微环境,利于溃疡愈合。还有研究表明,胰高血糖素使禁食大鼠血糖水平升高能避免阿斯匹林引起的胃粘膜损伤[1]。上述研究均支持胰岛A细胞参与胃溃疡自愈调节的观点。
综上所述,在溃疡自愈期间,胰岛A细胞通过增加其数目,增强其合成与释放胰高血糖素功能积极参与了溃疡自愈的调节过程。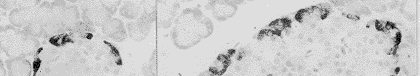







, 百拇医药
图版说明
图1~4 免疫组织化学PAP法,Ehrlich苏木精复染
图1 正常大鼠胰岛A细胞 ×400
图2~3 溃疡后10d、14d大鼠胰岛,A细胞明显增多 ×400
图4 溃疡后14d大鼠胰腺小叶间、小导管周围散在的胰高血糖素免疫反应性细胞及小胰岛 ×200
图6 溃疡后6d大鼠胰岛A细胞,核大而圆,核仁边集,胞质内出现大量空泡 ×7200
图7 溃疡后6d大鼠胰岛A细胞,空泡表面有核糖体附着 ×14000
图8 溃疡后6d大鼠胰岛A细胞,核周隙扩张,细胞内出现少量空泡 ×29000
, 百拇医药
图9 溃疡后14d大鼠胰岛A细胞,示丰富的粗面内质网和发达的高尔基复合体 ×7200
Explanation of figures
Fig.1-4 Immunohistochemiscal PAP method,Ehrlich hematoxylin countertain
Fig.1 The rat islet A cells in NCG. ×400
Fig.2-3 The number of A cells increased remarkedbly on 10 and 14 days in EUG. ×400
Fig.4 The sparse Glu-IR cells and small islets among pancreatic lobules and around small ductus on the 14th day in EUG. ×200
, 百拇医药
Fig.6 The islet A cell on the 6th day in EUG,showing the larger and rounder nucleus with the obvious nucleolus and many vacuoles in the cytoplasm. ×7200
Fig.7 The islet A cell on the 6th day in EUG,showing ribosome attached to vacuoles. ×14000
Fig.8 The islet A cell on the 6th day in EUG,showing the dilated perinuclear gaps. ×29000
Fig.9 The islet A cell on the 14th day in EUG,showing the rich rER and the developed Golgi complex. ×7200
, 百拇医药
△ Department of Histology and Embryology,Weifang Medical College,Weifang Shandong 261041,China
参考文献
1 Tarnawski A,Krause WJ,Ivey KJ.Effect of glucagon on aspirin-induced gastric mucosal damage in man.Gastroenterology,1978,74(2 Pt 1):240
2 陈玲,石爱荣.大鼠实验性胃溃疡期间A,B细胞酶组织化学研究.解剖学报,1987,18(2):208
3 张叔行,陈玲,陈东明,等.大鼠胃溃疡模型的制作方法.解剖学杂志,1987,10(2):158
, 百拇医药
4 成令忠主编.组织学.第2版,北京:人民卫生出版社,1993:51~162
5 Lefebvre PJ.Biosynthesis,Secretion and action of glucagon.In:Alberti KGMM,DeFronxo RA,Keen Ⅱ,et al.(eds):International Textbook of Diabetes Mellitus.John Wiley and Sons Ltd;1992:333-339
6 Unger RH,Orci L.Glucagon and the A cell.Physiology and patho-physiology.New Eng J Med,1981,304(26):1518
7 Orci L,Vassalli JD,Porrelet A.The insulin factory.Scientific American,1988,259(3):85
, http://www.100md.com
8 苏宇华,石爱荣.大鼠实验性胃溃疡自愈期间垂体远侧部ACTH细胞的免疫电镜研究.解剖学报,1994,25(4):403
9 苑普庆,李肇特.大鼠实验性胃溃疡自愈过程中睾丸间质细胞3β-羟基类固醇脱氢酶组织化学及睾酮免疫细胞化学研究.解剖学报,1993,24(1):72
10 Christiansen J,Holst JJ,Kalaja E.Inhibition of gastric acid secretion in man by exogenous and endogenous pancreatic glucagon.Gastroenterology,1976,70(5PT1):688
11 Stachura J,Tarnawski A,Bogdal J,et al.Effect of glucagon on human gastric mucosa:histochemical studies.Gastroenterology,1981,80(3):474
, http://www.100md.com
12 Chiba T,Taminato T,Kadowaki S,et al.Effects of glucagon,secretin,and vasoactive intestinal polypeptide on gastric somatostatin and gastrin release from isolated perfused rat stomach.Gastroenterology,1980,79(1):67
13 卢十一,石爱荣.大鼠实验性胃溃疡自愈期间胃窦粘膜G,D细胞免疫组织化学研究.解剖学报,1990,21(3):302
收稿1998-04 修回1999-02, 百拇医药
单位:黄岩(潍坊医学院组织学胚胎学教研室 潍坊 261041);梁文妹(贵阳医学组织学胚胎学教研室 贵阳 550004);石爱荣 (北京医科大学组织学胚胎学系 北京 100083)
关键词:胰岛A细胞;形态计量学;超微结构;胰高血糖素;实验性胃溃疡;大鼠
解剖学报990418 【摘要】 目的 探讨胰岛A细胞参与溃疡自愈调节的可能途径。 方法 应用形态计量、放射免疫测定及透射电镜方法,研究大鼠实验性胃溃疡自愈期间胰岛A细胞的面数密度、超微结构及血清胰高血糖素的变化。 结果 与正常组及盐水组比较,A细胞面数密度于溃疡后6d、10d明显增加(P<0.01)。溃疡后14d开始呈减小趋势,28d基本恢复正常。A细胞超微结构变化在溃疡后第6~14d较明显,主要表现为:(1)细胞核增大,异染色质减少,核周隙扩张;(2)部分A细胞粗面内质网增多,有的呈板层状排列,有的扩张成囊泡;(3)部分A细胞内分泌颗粒增多,大小不等,密度不一。血浆胰高血糖素水平从溃疡后14d到21d呈增高趋势(P<0.01),28d时接近正常。 结论 胰岛A细胞的形态和功能变化表明,它通过增加其细胞数目及增强其合成与分泌胰高血糖素的功能,积极参与了胃溃疡自愈的调节过程。
, 百拇医药
THE CHANGES OF STRUCTURE AND FUNCTION OF
ISLET A CELLS DURING THE HEALING PROCESS
OF GASTRIC ULCER IN RATS
Huang YanΔ Liang Wenmei* Shi Airong**
(Department of Histology and Embryology,Weifang Medical College,Weifang ;
*Guiyang Medical College,Guiyang; **Beijing Medical University,Beijing 100083)
, 百拇医药
【Abstract】 Objective To explore the possible way by which the islet A cells take part in the regulation of the healing process of gastric ulcer in rats. Methods Using morphometry,electron microscopy and radioimmunoassay to study the changes the numerical density on area(NA) and ultrastructure of islet A cells and the level of glucagon during the healing process of gastric ulcer in rats. Results As compared with normal control group(NCG) and saline control group(SCG),the NA of A cells markedly increased(P<0.01) during 6-10 days in experimental gastric ulcer group(EUG),then declined on the 14th day and recovered on the 28th day;the obvious ultrastructure changes occurred in A cells during 6-14 days after inducing gastric ulcer .The changes include that the nucleus was larger and rounder with the more euchromatin and dilated perinuclear space, the rough endoplasmic reticulum increased in the number or dilated into vacuole in some A cells; the number of secrete granules increased with different size and density.The level of plasma glucagon elevated remarkedbly(P<0.01)during 14-21 days,and recovered on the 28th day. Conclusion The above mentioned findings proved that the islet A cells were involved in the regulation of ulcer healing process by increasing their number and enhancing their functions of synthesizing and secreting glucagon.
, http://www.100md.com
【Key words】 Islet A cell; Morphometry; Ultrastructure; Glucagon; Experimental gastric ulcer; Rat
胰高血糖素能预防阿司匹林等引起的胃粘膜损伤早已有实验证明[1]。在大鼠实验性胃溃疡自愈过程中,胰岛A细胞多种酶活性增强,说明A细胞代谢活跃,可能与溃疡的修复愈合有关[2]。本实验在已有工作的基础上,对大鼠实验性胃溃疡自愈期间胰岛A细胞进行了形态计量、超微结构观察及胰高血糖素放射免疫测定,以期将形态与功能结合,进一步探讨胰岛A细胞参与溃疡自愈调节的可能途径。
材料和方法
成年雄性Wistar大鼠120只,体重180~210g,随机分为实验性胃溃疡组(溃疡组,60只)、盐水对照组(盐水组,48只)和正常对照组(正常组,12只)。大鼠实验性胃溃疡模型按本室已建立的方法[3]制作。盐水组为模拟手术,注射等量生理盐水代替冰醋酸。正常组不作任何处理。分别进行以下实验:
, 百拇医药
1. 胰岛A细胞的形态计量
1.1 免疫组织化学PAP法:分别于胃溃疡模型术后第6、10、14、21和28d取大鼠胰尾,Bouin液固定,常规石蜡包埋,制成6μm厚的连续切片,将同一时间点溃疡组、盐水组及正常组各6只大鼠胰尾相同序号的切片裱于同一张载片上。从溃疡组及盐水组各时间点和正常组胰腺切片中每例取片,隔20片取1片,按Sternberger PAP法进行免疫组织化学染色。主要步骤为:切片常规脱蜡到水,甲醇-H2O2封闭,依次滴加兔抗胰高血糖素抗血清(1∶2000 Watpa公司,新西兰),羊抗兔IgG(1∶50)及PAP(1∶100),DAB-H2O2液显色,Mayer苏木精复染。PBS代替胰高血糖素抗血清作为方法对照。
1.2 细胞计数方法:按体视学要求取样,从每个动物的胰腺切片中选直径100μm以上的胰岛9个,每张切片取3个在×400的放大倍数下用点测量法计数目镜测试方格内胰岛落点数(PI)及所测胰岛内胰高血糖素免疫染色细胞(A细胞)数(NX)。用下列公式计算A细胞面数密度(NA),所得数据经t检验处理。

, 百拇医药
a,为一个测试点所代表的测试格面积。
2. A细胞超微结构观察
从溃疡组和盐水组术后第6、10、14、21和28d各时间点和正常组分别取3个大鼠的胰腺,按常规制备电镜标本和观察。
3. 胰高血糖素放射免疫测定
溃疡组和盐水组术后第4、6、10、14、21和28d大鼠(溃疡组10只/时间点,盐水组8只/时间点)和正常组大鼠(12只)禁食24h后,用3%戊巴比妥钠经腹腔注射麻醉并经心脏取血。用北京海科锐生物技术中心研制的胰高血糖素放射免疫测定盒并按其说明书对血浆胰高血糖素进行放射免疫测定。取血2ml,加入盛有100μl抑肽酶1 000kIU和0.5mol/L EDTA-Na的试管内,轻轻摇匀,离心分离血浆。然后依次向放射免疫测定管中加入血浆100μl,抑肽酶50μl,胰高血糖素抗血清100μl,125I-胰高血糖素100μl,震荡混匀,4℃保温24h。之后加入免疫沉淀剂500μl,震荡混匀静置15min,2 000g离心15min,弃上清,用1470WIZARDTM自动γ计数仪得出样品的胰高血糖素浓度ng/L,所得数据用t检验处理。
, http://www.100md.com
结果
1. A细胞的形态及形态计量
A细胞位于胰岛周边,胞质呈棕黄色,形状不规则,呈三角形、多边形及梭形并常有突起(图1)。外分泌部亦有分布于腺泡上皮和导管上皮细胞之间的免疫染色细胞,但数目较少。在溃疡自愈期间,胰岛A细胞自溃疡后6d始明显增加,持续至溃疡后21d(图2,3)。溃疡后10d及14d,外分泌部可见散在于腺泡之间及导管周围的胰高血糖素免疫染色细胞团,尤以溃疡后14d最明显(图4)。其他时间点及正常组则未发现。
方法对照片均为阴性反应。
在溃疡自愈过程中,A细胞NA变化见图5。溃疡后6d和10d A细胞NA明显增高,与正常组及盐水组比较有显著性差异(P<0.01),溃疡后14d呈减小趋势,28d时基本恢复正常。

, 百拇医药
图5 A细胞面数密度的变化与正常组比较,P<0.05,P<0.01
Fig.5 The Changes of numerical density on area of islet A cells. *P<0.05, **P<0.01,as compared with NCG
2. A细胞的超微结构变化
溃疡组在溃疡第6d,部分A细胞胞核增大,异染色质减少,核仁明显、边集,核周隙扩张。胞质内出现较多的圆形及不规则形囊泡,囊泡有明显的膜,膜的表面有核糖体附着,囊泡内可见致密物。分泌颗粒较少,线粒体轻微肿胀,高尔基复合体未见明显变化(图6、7)。部分A细胞上述变化程度较轻,但核周隙扩张较明显,细胞基质密度较高(图8),粗面内质网、线粒体增多并呈区域性分布,高尔基复合体较发达,分泌颗粒较多,部分分泌颗粒的致密芯电子密度较低。溃汤第10d,A细胞的超微结构变化与第6d相似,但未见明显的核周隙扩张及囊泡(图6)。溃疡第14d,A细胞的超微结构变化多样,有的A细胞分泌颗粒明显增多,细胞器未见明显变化;有的A细胞高尔基复合体发达,由多层扁平囊及大小泡组成,丰富的粗面内质网在胞核的一侧呈板层状排列,分泌颗粒大小不等(图9);还有的A细胞核质比增大,染色质呈细粒状散在于胞核内,分泌颗粒较少,粗面内质网较丰富(图9)。溃疡第28d,A细胞的超微结构基本恢复正常。
, 百拇医药
3. 胰高血糖素放射免疫测定
如图10所示,溃疡组胰高血糖素水平从溃疡后6d到21d呈增高趋势,各时间点与正常组及盐水组比较均有极显著性差异(P<0.01),28d时接近正常。
 图10 血浆胰高血糖素浓度的变化**与正常组比较,P<0.01
图10 血浆胰高血糖素浓度的变化**与正常组比较,P<0.01Fig.10 The Changes of concentration of plasma glucagon.**P<0.01,as compared with NCG
讨论
在实验性胃溃疡自愈期间胰岛A细胞多种酶活性增强[2],提示A细胞参与了溃疡自愈调节。本实验用免疫组织化学、形态计量及胰高血糖素放射免疫测定方法可更直接地反映A细胞在溃疡自愈过程中的动态变化,从而深入探讨A细胞参与溃疡自愈调节的途径。形态学观察发现,在溃疡自愈期间最明显的改变是胰岛A细胞增加,溃疡后14d,外分泌部出现散在的胰高血糖素免疫染色细胞团。形态计量结果表明,A细胞面数密度高峰是在溃疡后10d,之后趋于降低,放射免疫测定结果表明,溃疡组血浆胰高血糖素高峰出现在溃疡后21d。综合上述结果分析,在溃疡愈合初期(6~10d),胰岛A细胞面数密度及血浆胰高血糖素浓度的增高可能主要是部分处于功能静止状态的A细胞转入功能活跃状态,合成分泌胰高血糖素增多的结果。本研究电镜下所观察到的溃疡后6d A细胞粗面内质网增多,高尔基复合体较发达,分泌颗粒增多及核周隙明显扩张为上述结论提供了证据,光镜下未发现胰岛内有分裂相的事实也为此提供了旁证。溃疡愈合中期(溃疡后14~21d),胰岛A细胞面数密度逐渐减小,而外分泌部出现散在的胰高血糖素免疫染色细胞团,从而使血浆胰高血糖素直至溃疡后21d始终维持在较高水平。因为这些散在的胰高血糖素免疫染色细胞团多位于小导管附近,故推测溃疡病灶可能通过肠胰岛轴影响到导管上皮细胞向胰腺内分泌细胞的分化、增生,其机制尚待探讨。
, http://www.100md.com
根据正常A细胞细胞器及分泌颗粒的形态和数量推测,正常A细胞可以处于静止和活动两种不同的功能状态。溃疡自愈过程中,尤其是溃疡第6~14d,A细胞的超微结构发生了较明显的变化。主要有以下几个方面:
细胞核的变化:溃疡第6~14d,有的A细胞胞核大而圆,异染色质很少;溃疡第6d时,部分A细胞还出现明显的核仁边集及核周隙扩张。细胞核的形态反映了细胞的功能状态,核内常染色质增多,说明细胞的转录功能相对活跃。核仁边集、核周隙扩张都是蛋白质合成功能旺盛的表现[4],这可能有利于转录的RNA自胞核快速输送至胞质。
粗面内质网的变化:溃疡自愈过程中,粗面内质网的变化最显著,正常大鼠胰岛A细胞内粗面内质网或散在分布,或沿核膜及细胞质膜平行排列。溃疡第6d,部分A细胞粗面内质网增多;第14d,A细胞内粗面内质网增多更明显,并平行排列于细胞核的一侧。同时,其附近有发达的高尔基复合体和较多的线粒体。已有研究证明,胰高血糖素在A细胞内的合成途径与胰岛素在B细胞内的合成途径相似[5]。首先,前胰高血糖素原在核糖体上合成,进入粗面内质网,然后经过高尔基复合体加工,最终以具有生物活性的胰高血糖素出现于分泌颗粒内[6]。上述超微结构变化反映了A细胞在溃疡自愈过程中合成胰高血糖素的功能活跃。
, http://www.100md.com
分泌颗粒的变化:溃疡第6~14d,部分A细胞内分泌颗粒增多,大小不等,密度不一。上述变化以第14d更为明显。Orci等[7]对胰岛素在B细胞内合成过程的示踪研究发现,分泌颗粒大小和密度与分泌颗粒的成熟程度有关。由此推测,上述变化可能是由于A细胞合成功能活跃,成熟程度不同的分泌颗粒均增多的结果。
细胞内空泡的形成:溃疡第6d,一些A细胞胞质内出现许多圆形或不规则形空泡,这些细胞与其周围不含空泡的细胞相邻,说明空泡的形成并非人工假象。在溃疡自愈的同一时间点,苏宇华等[8]于垂体的ACTH细胞、苑普庆等[9]于睾丸间质细胞观察到相同的变化,提示这是许多内分泌细胞对溃疡的一种反应。在空泡的表面有核糖体附着,说明这些空泡是扩张的粗面内质网。粗面内质网扩张反映细胞合成功能活跃。但我们在观察中不但未发现此种细胞内与分泌颗粒合成有关的其他细胞器增多,反而分泌颗粒较少。根据内质网快速增多时,所需的结构蛋白是原位来自内质网腔内[4],在溃疡第6d出现粗面内质网扩张的同时,伴有细胞核增大,核仁明显、边集等功能活跃的形态学特征,故推测这是结构蛋白合成活跃的表现,可能与溃疡第14d多数A细胞内粗面内质网的明显增多有关。
, http://www.100md.com
胰高血糖素是血糖的重要调节者之一,它通过分解糖原和糖异生作用使血糖升高。已有研究表明,胰高血糖素还能扩张肠系膜血管,增加粘膜及粘膜下层血流[1],抑制胃酸分泌[10],使胃未分化细胞和粘液细胞内葡萄糖-6-磷酸酶活性增强,表面上皮细胞粘液分泌增多[11],对阿斯匹林引起的胃粘膜损伤具有保护作用[1]。Chiba等[12]已报道胰高血糖素促进胃粘膜分泌生长抑素,而且发现胃内含有生长抑素的细胞与壁细胞密切接触[13]。结合前人及本研究工作可以推测,胰岛A细胞在溃疡自愈期间通过分泌高水平的胰高血糖素作用于胃粘膜,使局部血流增加,胃粘液分泌增加,同时通过促进胃粘膜内D细胞分泌生长抑素抑制胃酸分泌,从而改善胃内微环境,利于溃疡愈合。还有研究表明,胰高血糖素使禁食大鼠血糖水平升高能避免阿斯匹林引起的胃粘膜损伤[1]。上述研究均支持胰岛A细胞参与胃溃疡自愈调节的观点。
综上所述,在溃疡自愈期间,胰岛A细胞通过增加其数目,增强其合成与释放胰高血糖素功能积极参与了溃疡自愈的调节过程。








, 百拇医药
图版说明
图1~4 免疫组织化学PAP法,Ehrlich苏木精复染
图1 正常大鼠胰岛A细胞 ×400
图2~3 溃疡后10d、14d大鼠胰岛,A细胞明显增多 ×400
图4 溃疡后14d大鼠胰腺小叶间、小导管周围散在的胰高血糖素免疫反应性细胞及小胰岛 ×200
图6 溃疡后6d大鼠胰岛A细胞,核大而圆,核仁边集,胞质内出现大量空泡 ×7200
图7 溃疡后6d大鼠胰岛A细胞,空泡表面有核糖体附着 ×14000
图8 溃疡后6d大鼠胰岛A细胞,核周隙扩张,细胞内出现少量空泡 ×29000
, 百拇医药
图9 溃疡后14d大鼠胰岛A细胞,示丰富的粗面内质网和发达的高尔基复合体 ×7200
Explanation of figures
Fig.1-4 Immunohistochemiscal PAP method,Ehrlich hematoxylin countertain
Fig.1 The rat islet A cells in NCG. ×400
Fig.2-3 The number of A cells increased remarkedbly on 10 and 14 days in EUG. ×400
Fig.4 The sparse Glu-IR cells and small islets among pancreatic lobules and around small ductus on the 14th day in EUG. ×200
, 百拇医药
Fig.6 The islet A cell on the 6th day in EUG,showing the larger and rounder nucleus with the obvious nucleolus and many vacuoles in the cytoplasm. ×7200
Fig.7 The islet A cell on the 6th day in EUG,showing ribosome attached to vacuoles. ×14000
Fig.8 The islet A cell on the 6th day in EUG,showing the dilated perinuclear gaps. ×29000
Fig.9 The islet A cell on the 14th day in EUG,showing the rich rER and the developed Golgi complex. ×7200
, 百拇医药
△ Department of Histology and Embryology,Weifang Medical College,Weifang Shandong 261041,China
参考文献
1 Tarnawski A,Krause WJ,Ivey KJ.Effect of glucagon on aspirin-induced gastric mucosal damage in man.Gastroenterology,1978,74(2 Pt 1):240
2 陈玲,石爱荣.大鼠实验性胃溃疡期间A,B细胞酶组织化学研究.解剖学报,1987,18(2):208
3 张叔行,陈玲,陈东明,等.大鼠胃溃疡模型的制作方法.解剖学杂志,1987,10(2):158
, 百拇医药
4 成令忠主编.组织学.第2版,北京:人民卫生出版社,1993:51~162
5 Lefebvre PJ.Biosynthesis,Secretion and action of glucagon.In:Alberti KGMM,DeFronxo RA,Keen Ⅱ,et al.(eds):International Textbook of Diabetes Mellitus.John Wiley and Sons Ltd;1992:333-339
6 Unger RH,Orci L.Glucagon and the A cell.Physiology and patho-physiology.New Eng J Med,1981,304(26):1518
7 Orci L,Vassalli JD,Porrelet A.The insulin factory.Scientific American,1988,259(3):85
, http://www.100md.com
8 苏宇华,石爱荣.大鼠实验性胃溃疡自愈期间垂体远侧部ACTH细胞的免疫电镜研究.解剖学报,1994,25(4):403
9 苑普庆,李肇特.大鼠实验性胃溃疡自愈过程中睾丸间质细胞3β-羟基类固醇脱氢酶组织化学及睾酮免疫细胞化学研究.解剖学报,1993,24(1):72
10 Christiansen J,Holst JJ,Kalaja E.Inhibition of gastric acid secretion in man by exogenous and endogenous pancreatic glucagon.Gastroenterology,1976,70(5PT1):688
11 Stachura J,Tarnawski A,Bogdal J,et al.Effect of glucagon on human gastric mucosa:histochemical studies.Gastroenterology,1981,80(3):474
, http://www.100md.com
12 Chiba T,Taminato T,Kadowaki S,et al.Effects of glucagon,secretin,and vasoactive intestinal polypeptide on gastric somatostatin and gastrin release from isolated perfused rat stomach.Gastroenterology,1980,79(1):67
13 卢十一,石爱荣.大鼠实验性胃溃疡自愈期间胃窦粘膜G,D细胞免疫组织化学研究.解剖学报,1990,21(3):302
收稿1998-04 修回1999-02, 百拇医药