SA-30抗原在小鼠睾丸、附睾、精子及早期胚的定位
作者:孙秉贵 周占祥邓泽沛
单位:孙秉贵 周占祥 邓泽沛(中国农业大学动物医学院组织学胚胎学教研室,北京 100094)
关键词:SA-30(sperm;antigen-30)抗原;免疫组织化学;小鼠
解剖学报000218 【摘要】 目的 检测SA-30(sperm antigen-30)抗原在小鼠精子发生、成熟、获能及受精后的分布变化。 方法 免疫组织化学LSAB法。 结果 SA-30在小鼠睾丸内的各级生精上皮均有分布,尤其是靠近管腔的精子细胞染色最深;附睾各段的上皮细胞也有SA-30存在,而且主要集中在核上区;在附睾头和附睾尾的精子,SA-30主要分布在顶体区,两者无明显区别,获能后的精子除在顶体区有阳性染色外,尾部和顶体后区也出现了阳性反应。妊娠d3的小鼠胚泡表面有SA-30存在,而妊娠d6的胚胎上则未检测到SA-30。 结论 SA-30出现在小鼠精子发生的早期,附睾内精子成熟过程中,其表面SA-30的分布没有明显变化,而且在获能后仍然存在,早期小鼠胚上也有SA-30的分布,从而提示SA-30可能参与受精过程及早期胚胎的发育。
, http://www.100md.com
【中图分类号】 Q954.4 【文献标识码】 A
【文章编号】 0529-1356(2000)02-167
LOCALIZATION OF SA-30,A CON A-BINDING GLYCOPROTEIN,ON MOUSE TESTIS,EPIDIDYMIS,SPERMS AND EARLY EMBRYOS
SUN Bing-gui, ZHOU Zhan-xiang, DENG Ze-pei
(College of Veterinary Medicine,China Agricultural University,Beijing 100094,China)
【Abstract】 Objective Understanding the distribution and changes of SA-30 during mouse spermatogenesis,maturation,capacitation and fertilization. Methods Immunohistochemistry was used. Results In testis,positive staining was found in the spermatogenic cells with a higher reactivity in the spermatids.In epididymis,the epithelia of caput,corpus and cauda epididymis were all stained,and the positive sites were mainly restricted to the superanuclear areas.On the smears of caput and cauda sperms,the acrosomal region was strongly stained,while the stainig on postacrosomal region was negative.After capacitation,however,the sperm tail and postacrosomal region were also stained.SA-30 was also found on early embryos on day 3 of pregnancy, but not on day 6 of pregnancy. Conclusions SA-30 begins to appear in the early stage of mouse spermatogenesis;SA-30 on sperm surface does not show apparent changes during epididymal maturation and does not loss during capacitation; SA-30 also occurs on early mouse embryos;SA-30 may be involved in fertilization and the development of early embryos.
, 百拇医药
【Key words】 Speim antigen-30; Immunohistochemistry; Mouse
在精子成熟、获能、顶体反应及精卵结合的过程中,精子表面的糖复合物起着重要作用[1,2]。亲合细胞化学的结果表明,睾丸内精子生成过程中,精子表面有糖蛋白存在[3],在附睾内成熟及以后的获能过程中,精子表面糖蛋白的数量及分布均发生了改变[4,5]。许多证据表明,多种动物精子表面有Con A结合糖蛋白的分布,但对其在精子成熟和获能时被修饰的认识还不尽一致[4,6]。
在以前的研究中,我们发现小鼠及羊精子表面有多种糖复合物[7,8]。另外,利用Con A-Sepharose 4B亲合层析结合Sephadex G-100的方法,从牛精子膜上分离了一种能和Con A结合的糖蛋白,因该糖蛋白的分子量为30kD,故称之为SA-30(sperm antigen-30)。用SA-30免疫新西兰雌兔,制备兔抗SA-30抗血清,利用该抗血清对SA-30在牛精子上的定位及其在获能与顶体反应过程中的变化进行了检测[9]。最近的体外试验发现,兔抗SA-30抗血清能阻止小鼠精子与卵透明带的结合,而且对小鼠精子有制动作用(待发表),提示SA-30在受精过程中起重要作用。本实验利用免疫组织化学的方法,对SA-30在小鼠睾丸、附睾、精子及早期胚胎上的分布进行了检测,以了解SA-30在精子发生、附睾内成熟、获能及受精后的变化,从而进一步认识SA-30的生物学意义。
, http://www.100md.com
材料和方法
1. 睾丸与附睾切片
成年雄性昆明系小鼠(购自中国科学院遗传所)5只,颈椎脱臼致死后迅速取睾丸和附睾,于改良的Bouin液(不加冰醋酸)中固定,Paraplast包埋剂包埋,制备5μm厚切片。
2. 精子样品
2.1 附睾内的精子:成年雄性昆明系小鼠5只,颈椎脱臼致死后迅速摘除附睾,剪下附睾头和附睾尾,分别放入盛有0.01mol/L PBS(pH7.4)的培养皿中剪碎,于37℃静置10min,使精子游离出来,4层镜头纸过滤后,制备精子涂片。
2.2 获能精子:同上操作取出附睾尾,于盛有PBS的培养皿中剪碎过滤后(PBS及所用器皿均在37℃预温后使用),镜下调节精子密度为5×107个/ml,用灭菌滴管吸取精子悬液,向发情期小鼠阴道注入(0.5ml/只),进行人工授精,1.5h后处死小鼠,用PBS从子宫角冲洗获得子宫内的精子,精子悬液经4层镜头纸过滤后,制成精子涂片。
, 百拇医药
3. 早期鼠胚切片
成年昆明系小鼠按雌、雄3∶1的比例合笼,第2天清晨检查有阴栓者定为妊娠d0,于妊娠d3和d6各取5只,颈椎脱臼致死后迅速取出整个子宫,于改良的Bouin液中固定,Paraplast包埋剂包埋,制备5μm厚切片。
4. 免疫组织化学染色
切片经二甲苯脱蜡及系列酒精入水(精子涂片此步省略),0.5%H2O2(无水甲醇配制)封闭内源性过氧化物酶,PBS洗5min,10%正常羊血清封闭后,加兔抗SA-30抗血清(自制,1∶20稀释)孵育(4℃过夜),PBS洗涤后加生物素标记羊抗兔IgG(华美公司,1∶20)37℃温育30min,PBS冲洗,加链霉亲合素-HRP(Gibco,1∶200)37℃温育30min,PBS冲洗后用H2O2-DAB(Sigma)显色,常规封片。
, 百拇医药
阴性对照用正常兔血清代替兔抗SA-30抗血清。
结果
1. SA-30在小鼠睾丸及附睾的定位
1.1 曲细精管:曲细精管内各级生精上皮均有抗SA-30抗血清的阳性染色,精原细胞和精母细胞的外周部分有抗SA-30抗血清的强阳性反应,胞核区阴性,但SA-30究竟是仅在膜上还是胞质中也有尚不能确定,需要超微水平的检测。靠近管腔的精子细胞,整个细胞均为强阳性染色(图1)。
图1 抗SA-30抗体在小鼠睾丸的标记。曲精小管内各级生精上皮均有阳性标记,尤其在精子细胞(↑)标记最强 ×100
Fig.1 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse testis. ×100
, http://www.100md.com
1.2 附睾:(1)附睾头 睾丸输出管及附睾管上皮细胞的核上区有强阳性染色,基部稍弱,上皮细胞游离缘的静纤毛及管腔内的精子团也有阳性染色,精子头部较强(图2)。(2)附睾体 附睾管上皮细胞变矮,阳性反应部位基本与附睾头相同,反应强度稍有减弱(图3)。(3)附睾尾 附睾管上皮细胞变得更矮,阳性反应强度和阳性区域基本与附睾体相同(图4)。

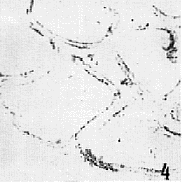
图2 抗SA-30抗体在小鼠附睾头的标记 ×100
图3 抗SA-30抗体在小鼠附睾体的标记 ×100
图4 抗SA-30抗体在小鼠附睾尾的标记 ×100
, http://www.100md.com
Fig.2 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse caput epididymis. ×100
Fig.3 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse corpus epididymis. ×100
Fig.4 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse capuda epididymis. ×100
2. SA-30在小鼠精子的定位
2.1 附睾头精子:精子顶体区呈强阳性染色,尾部的胞质小体也有阳性染色,而顶体后区和尾部为阴性(图5)。
, http://www.100md.com
图5 抗SA-30抗体在小鼠附睾头精子上的标记 ×500
Fig.5 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of caput. ×500
2.2 附睾尾精子:阳性部位及阳性反应强度基本与附睾头精子相同(图6)。
图6 抗SA-30抗体在小鼠附睾尾精子上的标记,(↑)示胞质小体 ×500
Fig.6 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of cauda.↑ droplet ×500
, http://www.100md.com
2.3 获能精子:顶体区及尾部为强阳性染色,顶体后区出现中等阳性反应(图7)。
图7 抗SA-30抗体在小鼠获能精子上的标记 ×500
Fig.7 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of capacitation. ×500
3. SA-30在小鼠早期胚上的定位
妊娠d3的小鼠胚泡游离在子宫腔中,其上有SA-30抗血清的强阳性染色(图8),在胚泡腔的切片,胚泡滋养层及内细胞团均有抗SA-30抗血清的阳性反应。妊娠d6的小鼠胚已经植入子宫壁中,未检测到SA-30的存在(图9)。
, http://www.100md.com
图8 抗SA-30抗体在妊娠d3小鼠胚泡上的标记。E.子宫内膜 ×100
Fig.8 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse embryos(3 day of pregnancy).E,endometrium ×100
图9 抗SA-30抗体在妊娠d6小鼠胚胎上的标记,结果为阴性。D.子宫蜕膜 em.胚胎 ×100
Fig.9 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse embryos(6 day of pregnancy).D,decidua,em,embryo ×100
, 百拇医药
4. 阴性对照
睾丸切片上没发现抗SA-30抗血清的阳性反应(图10)。
图10 阴性对照,睾丸切片上未出现阳性标记 ×100
Fig.10 Negative control. ×100
讨论
SA-30是首先从牛精子上分离到的一种可与Con A结合的糖蛋白[9]。本实验中,抗SA-30的抗血清在小鼠精子表面的成功标记,提示SA-30具有物种间交叉性。此外,抗SA-30抗血清还能与睾丸、附睾及早期胚结合,表明在这些组织上有和牛精子SA-30类似的抗原或抗原决定簇。
, 百拇医药
小鼠睾丸内的各级生精上皮均有抗SA-30抗血清的阳性反应,提示SA-30出现于精子发生的早期。阳性部位在精原细胞和精母细胞仅限于细胞外周部分,核区为阴性,这与Con A亲合细胞化学的实验结果一致[8],靠近管腔的精子细胞,整个细胞均为强阳性染色。研究认为,细胞中蛋白质的糖基化开始于内质网,经高尔基体进一步修饰后,分布到其他膜系统或分泌到胞外[10]。本实验中抗SA-30抗体在各级生精细胞的标记情况可能就反应了SA-30在细胞内的合成过程。附睾是精子成熟的场所,精子在附睾穿行过程中,附睾上皮分泌物对精子表面的组成有很大影响。一方面,这些分泌物可覆盖于精子的表面;另一方面,分泌物中的一些糖苷酶或糖基转移酶对精子表面的糖残基有修饰作用[11,12]。本实验中,附睾各段上皮内均有SA-30抗体的阳性标记,且主要集中在上皮的核上区,这与亲合细胞化学的结果一致[8],提示附睾上皮细胞可能向管腔内分泌SA-30。然而,附睾头精子和附睾尾精子上SA-30的分布区域及强度没有明显差别,另外,精子尾部胞质小体上有SA-30抗体的标记。这就提示,附睾上皮内的SA-30可能是上皮细胞内吞噬从精子上脱落的SA-30的结果,而不是附睾上皮本身有分泌SA-30的能力。
, http://www.100md.com
虽然有人认为附睾分泌物影响精子表面糖复合物的分布及组成,但目前的认识还不尽相同。对羊精子的研究表明,Con A在整个头部均有标记,而且在精子穿越附睾的过程中,Con A结合位点没有变化[4]。利用同样的方法,Sarkar等[6]却认为羊精子在穿越附睾的过程中,其表面的Con A受体明显增多,分布也发生了改变。应用胶体金技术对牛精子进行的标记表明,其表面Con A受体在穿越附睾时没有明显改变[13],对小鼠的实验也得到了相似的结果[8]。Con A受体在精子上分布的不同结果,可能是由于动物种类的不同而引起的,也可能是因为所用方法不同的缘故。我们的实验结果表明,SA-30在附睾头和附睾尾精子上的分布及数量没有明显区别。Runnebaum等[14]从猪精子上分离了一种Con A结合糖蛋白,并制备了其单克隆抗体(MAB436/10),免疫组织化学结果表明,该蛋白分布在精子的顶体区,并且在附睾内的运行过程中没有明显变化。由此我们认为,附睾分泌物对精子表面的Con A结合糖蛋白没有明显影响。
, 百拇医药
Lee等[5]对小鼠精子在获能前后,其Con A结合糖复合物的分布及标记强度进行了比较,未发现明显差异。本实验对小鼠精子进行了体内获能,免疫组织化学结果表明SA-30在获能前后发生了变化。获能前只分布在顶体区,获能后则除顶体区外,顶体后区及尾部也出现了SA-30。我们认为,顶体后区SA-30的出现,可能是获能完成的标志,另外,获能过程中SA-30不丢失,提示它可能在受精过程中起作用。
虽然有许多精子抗原被认为在受精过程中发挥作用[4],但这些抗原是否存在于受精卵质膜或早期胚胎表面尚不清楚。Naz等[15]从兔精子上分离到一种糖蛋白GA-1,用GA-1主动免疫兔及小鼠可引起胚胎死亡。同时他们还证实,精子表面另外一种蛋白(CS-1)的抗体能抑制原核期受精卵的首次分裂,从而导致妊娠失败。以上结果表明,受精卵及早期胚胎上可能具有与精子表面的某些抗原相似或相同的抗原特性。本实验首次证实小鼠早期胚(妊娠d3)上有类SA-30抗原。从以上分析我们推测,当雌性生殖道内有抗SA-30抗体存在时,这些抗体可能对早期胚胎有攻击作用,另外,如果用该精子抗原制备免疫避孕疫苗,即可作用于精子,也可作用于早期胚胎。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39770543)
作者简介:孙秉贵(1971-),男(汉族),河北阜平人,硕士,助教
参考文献
[1]Shalgi R,Raz T.The role of carbohydrate residues in mammalian fertilization[J].Histochem Histopathol,1997,12(4):812-822.
[2]McLeskey SB,Dowds C,Carballada R,et al.Molecules involved in mammallian sperm-egg interaction[J].Int Rev Cytol,1998,177(1):57-113.
, 百拇医药 [3]Arga M,Vanna-Perttula T.Comparision of lectin-staining pattern in testis and epididymis of gerbil,guinea pig,mouse and nutria[J].Am J Anat,1986,175(4):449-469.
[4]Magargee SF,Kunze E,Hammerstedt RH.Changes in lectin-binding features of ram sperm associated with epididymal maturation and ejaculation[J].Biol Reprod,1988,38(3):667-685.
[5]Lee SH,Ahuja KK.An investigation using lectins of glycomponents of mouse spermatoza during capacitation and spermatozona binding[J].J Reprod Fertil,1987,80(1):65-74.
, 百拇医药
[6]Sarkar M,Majumder GC,Chatterjee.Goat sperm membrane:lectin-binding sites of sperm surface and lectin affinity chromatography of the mature sperm membrane antigens[J].Bioch Bioph Acta,1991,1070(1):198-204.
[7]周占祥,邓泽沛.羊精子在成熟和获能过程中表面凝集素标记变化[J].解剖学报,1994,25(3):277~280.
[8]王家鑫,孙秀华,周占祥,等.小鼠精子表面Con A结合糖复合物的形成与变化[J].中国组织化学与细胞化学杂志,1996,5(2):259~263.
[9]周占祥,孙秉贵,邓泽沛.牛精子膜SA-30在获能与顶体反应后的定位变化[J].解剖学报,1998,29(2):178~183.
, http://www.100md.com
[10]Stryer L.Protein targeting.In Stryer L(ed).Biochemistry.4th ed. New York:WH Freeman and Company,1994:911-948.
[11]Olson GE,Danzo BJ.Surface changes in rat spermatozoa during epididymal transit[J].Biol Reprod,1981,24(2):431-433.
[12]Tulsiani DRP,Skudlarek MD,Holand MK,et al.Glycosylation of rat sperm plasma membrane during epididymal maturation[J].Biol Reprod,1993,48(2):417-428.
[13]Sinouatz F,Friess AE.Localization of lectin receptors on bovine epididymal spermatozoa using a colloidal gold technique[J].Histoch,1983,79(4):335-344.
, 百拇医药
[14]Runnebaum IB,Schill WB,Topfer-Peterson.Con A-binding proteins of the sperm surface are conserved through evolution and in sperm maturation[J].Androl,1995,27(1):81-90.
[15]Naz RK.Sperm antigens relevant to fertilization and early embryonic development.In Naz RK(ed).Immunology of Reproduction[M].Boca Raton:CRC,1993:37-55.
【收稿日期】1999-04-30
【修稿日期】1999-07-05, 百拇医药
单位:孙秉贵 周占祥 邓泽沛(中国农业大学动物医学院组织学胚胎学教研室,北京 100094)
关键词:SA-30(sperm;antigen-30)抗原;免疫组织化学;小鼠
解剖学报000218 【摘要】 目的 检测SA-30(sperm antigen-30)抗原在小鼠精子发生、成熟、获能及受精后的分布变化。 方法 免疫组织化学LSAB法。 结果 SA-30在小鼠睾丸内的各级生精上皮均有分布,尤其是靠近管腔的精子细胞染色最深;附睾各段的上皮细胞也有SA-30存在,而且主要集中在核上区;在附睾头和附睾尾的精子,SA-30主要分布在顶体区,两者无明显区别,获能后的精子除在顶体区有阳性染色外,尾部和顶体后区也出现了阳性反应。妊娠d3的小鼠胚泡表面有SA-30存在,而妊娠d6的胚胎上则未检测到SA-30。 结论 SA-30出现在小鼠精子发生的早期,附睾内精子成熟过程中,其表面SA-30的分布没有明显变化,而且在获能后仍然存在,早期小鼠胚上也有SA-30的分布,从而提示SA-30可能参与受精过程及早期胚胎的发育。
, http://www.100md.com
【中图分类号】 Q954.4 【文献标识码】 A
【文章编号】 0529-1356(2000)02-167
LOCALIZATION OF SA-30,A CON A-BINDING GLYCOPROTEIN,ON MOUSE TESTIS,EPIDIDYMIS,SPERMS AND EARLY EMBRYOS
SUN Bing-gui, ZHOU Zhan-xiang, DENG Ze-pei
(College of Veterinary Medicine,China Agricultural University,Beijing 100094,China)
【Abstract】 Objective Understanding the distribution and changes of SA-30 during mouse spermatogenesis,maturation,capacitation and fertilization. Methods Immunohistochemistry was used. Results In testis,positive staining was found in the spermatogenic cells with a higher reactivity in the spermatids.In epididymis,the epithelia of caput,corpus and cauda epididymis were all stained,and the positive sites were mainly restricted to the superanuclear areas.On the smears of caput and cauda sperms,the acrosomal region was strongly stained,while the stainig on postacrosomal region was negative.After capacitation,however,the sperm tail and postacrosomal region were also stained.SA-30 was also found on early embryos on day 3 of pregnancy, but not on day 6 of pregnancy. Conclusions SA-30 begins to appear in the early stage of mouse spermatogenesis;SA-30 on sperm surface does not show apparent changes during epididymal maturation and does not loss during capacitation; SA-30 also occurs on early mouse embryos;SA-30 may be involved in fertilization and the development of early embryos.
, 百拇医药
【Key words】 Speim antigen-30; Immunohistochemistry; Mouse
在精子成熟、获能、顶体反应及精卵结合的过程中,精子表面的糖复合物起着重要作用[1,2]。亲合细胞化学的结果表明,睾丸内精子生成过程中,精子表面有糖蛋白存在[3],在附睾内成熟及以后的获能过程中,精子表面糖蛋白的数量及分布均发生了改变[4,5]。许多证据表明,多种动物精子表面有Con A结合糖蛋白的分布,但对其在精子成熟和获能时被修饰的认识还不尽一致[4,6]。
在以前的研究中,我们发现小鼠及羊精子表面有多种糖复合物[7,8]。另外,利用Con A-Sepharose 4B亲合层析结合Sephadex G-100的方法,从牛精子膜上分离了一种能和Con A结合的糖蛋白,因该糖蛋白的分子量为30kD,故称之为SA-30(sperm antigen-30)。用SA-30免疫新西兰雌兔,制备兔抗SA-30抗血清,利用该抗血清对SA-30在牛精子上的定位及其在获能与顶体反应过程中的变化进行了检测[9]。最近的体外试验发现,兔抗SA-30抗血清能阻止小鼠精子与卵透明带的结合,而且对小鼠精子有制动作用(待发表),提示SA-30在受精过程中起重要作用。本实验利用免疫组织化学的方法,对SA-30在小鼠睾丸、附睾、精子及早期胚胎上的分布进行了检测,以了解SA-30在精子发生、附睾内成熟、获能及受精后的变化,从而进一步认识SA-30的生物学意义。
, http://www.100md.com
材料和方法
1. 睾丸与附睾切片
成年雄性昆明系小鼠(购自中国科学院遗传所)5只,颈椎脱臼致死后迅速取睾丸和附睾,于改良的Bouin液(不加冰醋酸)中固定,Paraplast包埋剂包埋,制备5μm厚切片。
2. 精子样品
2.1 附睾内的精子:成年雄性昆明系小鼠5只,颈椎脱臼致死后迅速摘除附睾,剪下附睾头和附睾尾,分别放入盛有0.01mol/L PBS(pH7.4)的培养皿中剪碎,于37℃静置10min,使精子游离出来,4层镜头纸过滤后,制备精子涂片。
2.2 获能精子:同上操作取出附睾尾,于盛有PBS的培养皿中剪碎过滤后(PBS及所用器皿均在37℃预温后使用),镜下调节精子密度为5×107个/ml,用灭菌滴管吸取精子悬液,向发情期小鼠阴道注入(0.5ml/只),进行人工授精,1.5h后处死小鼠,用PBS从子宫角冲洗获得子宫内的精子,精子悬液经4层镜头纸过滤后,制成精子涂片。
, 百拇医药
3. 早期鼠胚切片
成年昆明系小鼠按雌、雄3∶1的比例合笼,第2天清晨检查有阴栓者定为妊娠d0,于妊娠d3和d6各取5只,颈椎脱臼致死后迅速取出整个子宫,于改良的Bouin液中固定,Paraplast包埋剂包埋,制备5μm厚切片。
4. 免疫组织化学染色
切片经二甲苯脱蜡及系列酒精入水(精子涂片此步省略),0.5%H2O2(无水甲醇配制)封闭内源性过氧化物酶,PBS洗5min,10%正常羊血清封闭后,加兔抗SA-30抗血清(自制,1∶20稀释)孵育(4℃过夜),PBS洗涤后加生物素标记羊抗兔IgG(华美公司,1∶20)37℃温育30min,PBS冲洗,加链霉亲合素-HRP(Gibco,1∶200)37℃温育30min,PBS冲洗后用H2O2-DAB(Sigma)显色,常规封片。
, 百拇医药
阴性对照用正常兔血清代替兔抗SA-30抗血清。
结果
1. SA-30在小鼠睾丸及附睾的定位
1.1 曲细精管:曲细精管内各级生精上皮均有抗SA-30抗血清的阳性染色,精原细胞和精母细胞的外周部分有抗SA-30抗血清的强阳性反应,胞核区阴性,但SA-30究竟是仅在膜上还是胞质中也有尚不能确定,需要超微水平的检测。靠近管腔的精子细胞,整个细胞均为强阳性染色(图1)。

图1 抗SA-30抗体在小鼠睾丸的标记。曲精小管内各级生精上皮均有阳性标记,尤其在精子细胞(↑)标记最强 ×100
Fig.1 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse testis. ×100
, http://www.100md.com
1.2 附睾:(1)附睾头 睾丸输出管及附睾管上皮细胞的核上区有强阳性染色,基部稍弱,上皮细胞游离缘的静纤毛及管腔内的精子团也有阳性染色,精子头部较强(图2)。(2)附睾体 附睾管上皮细胞变矮,阳性反应部位基本与附睾头相同,反应强度稍有减弱(图3)。(3)附睾尾 附睾管上皮细胞变得更矮,阳性反应强度和阳性区域基本与附睾体相同(图4)。



图2 抗SA-30抗体在小鼠附睾头的标记 ×100
图3 抗SA-30抗体在小鼠附睾体的标记 ×100
图4 抗SA-30抗体在小鼠附睾尾的标记 ×100
, http://www.100md.com
Fig.2 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse caput epididymis. ×100
Fig.3 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse corpus epididymis. ×100
Fig.4 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse capuda epididymis. ×100
2. SA-30在小鼠精子的定位
2.1 附睾头精子:精子顶体区呈强阳性染色,尾部的胞质小体也有阳性染色,而顶体后区和尾部为阴性(图5)。

, http://www.100md.com
图5 抗SA-30抗体在小鼠附睾头精子上的标记 ×500
Fig.5 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of caput. ×500
2.2 附睾尾精子:阳性部位及阳性反应强度基本与附睾头精子相同(图6)。

图6 抗SA-30抗体在小鼠附睾尾精子上的标记,(↑)示胞质小体 ×500
Fig.6 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of cauda.↑ droplet ×500
, http://www.100md.com
2.3 获能精子:顶体区及尾部为强阳性染色,顶体后区出现中等阳性反应(图7)。

图7 抗SA-30抗体在小鼠获能精子上的标记 ×500
Fig.7 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse sperms of capacitation. ×500
3. SA-30在小鼠早期胚上的定位
妊娠d3的小鼠胚泡游离在子宫腔中,其上有SA-30抗血清的强阳性染色(图8),在胚泡腔的切片,胚泡滋养层及内细胞团均有抗SA-30抗血清的阳性反应。妊娠d6的小鼠胚已经植入子宫壁中,未检测到SA-30的存在(图9)。

, http://www.100md.com
图8 抗SA-30抗体在妊娠d3小鼠胚泡上的标记。E.子宫内膜 ×100
Fig.8 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse embryos(3 day of pregnancy).E,endometrium ×100

图9 抗SA-30抗体在妊娠d6小鼠胚胎上的标记,结果为阴性。D.子宫蜕膜 em.胚胎 ×100
Fig.9 Immunohistochemical staining with polyclonal antibody to SA-30 on mouse embryos(6 day of pregnancy).D,decidua,em,embryo ×100
, 百拇医药
4. 阴性对照
睾丸切片上没发现抗SA-30抗血清的阳性反应(图10)。

图10 阴性对照,睾丸切片上未出现阳性标记 ×100
Fig.10 Negative control. ×100
讨论
SA-30是首先从牛精子上分离到的一种可与Con A结合的糖蛋白[9]。本实验中,抗SA-30的抗血清在小鼠精子表面的成功标记,提示SA-30具有物种间交叉性。此外,抗SA-30抗血清还能与睾丸、附睾及早期胚结合,表明在这些组织上有和牛精子SA-30类似的抗原或抗原决定簇。
, 百拇医药
小鼠睾丸内的各级生精上皮均有抗SA-30抗血清的阳性反应,提示SA-30出现于精子发生的早期。阳性部位在精原细胞和精母细胞仅限于细胞外周部分,核区为阴性,这与Con A亲合细胞化学的实验结果一致[8],靠近管腔的精子细胞,整个细胞均为强阳性染色。研究认为,细胞中蛋白质的糖基化开始于内质网,经高尔基体进一步修饰后,分布到其他膜系统或分泌到胞外[10]。本实验中抗SA-30抗体在各级生精细胞的标记情况可能就反应了SA-30在细胞内的合成过程。附睾是精子成熟的场所,精子在附睾穿行过程中,附睾上皮分泌物对精子表面的组成有很大影响。一方面,这些分泌物可覆盖于精子的表面;另一方面,分泌物中的一些糖苷酶或糖基转移酶对精子表面的糖残基有修饰作用[11,12]。本实验中,附睾各段上皮内均有SA-30抗体的阳性标记,且主要集中在上皮的核上区,这与亲合细胞化学的结果一致[8],提示附睾上皮细胞可能向管腔内分泌SA-30。然而,附睾头精子和附睾尾精子上SA-30的分布区域及强度没有明显差别,另外,精子尾部胞质小体上有SA-30抗体的标记。这就提示,附睾上皮内的SA-30可能是上皮细胞内吞噬从精子上脱落的SA-30的结果,而不是附睾上皮本身有分泌SA-30的能力。
, http://www.100md.com
虽然有人认为附睾分泌物影响精子表面糖复合物的分布及组成,但目前的认识还不尽相同。对羊精子的研究表明,Con A在整个头部均有标记,而且在精子穿越附睾的过程中,Con A结合位点没有变化[4]。利用同样的方法,Sarkar等[6]却认为羊精子在穿越附睾的过程中,其表面的Con A受体明显增多,分布也发生了改变。应用胶体金技术对牛精子进行的标记表明,其表面Con A受体在穿越附睾时没有明显改变[13],对小鼠的实验也得到了相似的结果[8]。Con A受体在精子上分布的不同结果,可能是由于动物种类的不同而引起的,也可能是因为所用方法不同的缘故。我们的实验结果表明,SA-30在附睾头和附睾尾精子上的分布及数量没有明显区别。Runnebaum等[14]从猪精子上分离了一种Con A结合糖蛋白,并制备了其单克隆抗体(MAB436/10),免疫组织化学结果表明,该蛋白分布在精子的顶体区,并且在附睾内的运行过程中没有明显变化。由此我们认为,附睾分泌物对精子表面的Con A结合糖蛋白没有明显影响。
, 百拇医药
Lee等[5]对小鼠精子在获能前后,其Con A结合糖复合物的分布及标记强度进行了比较,未发现明显差异。本实验对小鼠精子进行了体内获能,免疫组织化学结果表明SA-30在获能前后发生了变化。获能前只分布在顶体区,获能后则除顶体区外,顶体后区及尾部也出现了SA-30。我们认为,顶体后区SA-30的出现,可能是获能完成的标志,另外,获能过程中SA-30不丢失,提示它可能在受精过程中起作用。
虽然有许多精子抗原被认为在受精过程中发挥作用[4],但这些抗原是否存在于受精卵质膜或早期胚胎表面尚不清楚。Naz等[15]从兔精子上分离到一种糖蛋白GA-1,用GA-1主动免疫兔及小鼠可引起胚胎死亡。同时他们还证实,精子表面另外一种蛋白(CS-1)的抗体能抑制原核期受精卵的首次分裂,从而导致妊娠失败。以上结果表明,受精卵及早期胚胎上可能具有与精子表面的某些抗原相似或相同的抗原特性。本实验首次证实小鼠早期胚(妊娠d3)上有类SA-30抗原。从以上分析我们推测,当雌性生殖道内有抗SA-30抗体存在时,这些抗体可能对早期胚胎有攻击作用,另外,如果用该精子抗原制备免疫避孕疫苗,即可作用于精子,也可作用于早期胚胎。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39770543)
作者简介:孙秉贵(1971-),男(汉族),河北阜平人,硕士,助教
参考文献
[1]Shalgi R,Raz T.The role of carbohydrate residues in mammalian fertilization[J].Histochem Histopathol,1997,12(4):812-822.
[2]McLeskey SB,Dowds C,Carballada R,et al.Molecules involved in mammallian sperm-egg interaction[J].Int Rev Cytol,1998,177(1):57-113.
, 百拇医药 [3]Arga M,Vanna-Perttula T.Comparision of lectin-staining pattern in testis and epididymis of gerbil,guinea pig,mouse and nutria[J].Am J Anat,1986,175(4):449-469.
[4]Magargee SF,Kunze E,Hammerstedt RH.Changes in lectin-binding features of ram sperm associated with epididymal maturation and ejaculation[J].Biol Reprod,1988,38(3):667-685.
[5]Lee SH,Ahuja KK.An investigation using lectins of glycomponents of mouse spermatoza during capacitation and spermatozona binding[J].J Reprod Fertil,1987,80(1):65-74.
, 百拇医药
[6]Sarkar M,Majumder GC,Chatterjee.Goat sperm membrane:lectin-binding sites of sperm surface and lectin affinity chromatography of the mature sperm membrane antigens[J].Bioch Bioph Acta,1991,1070(1):198-204.
[7]周占祥,邓泽沛.羊精子在成熟和获能过程中表面凝集素标记变化[J].解剖学报,1994,25(3):277~280.
[8]王家鑫,孙秀华,周占祥,等.小鼠精子表面Con A结合糖复合物的形成与变化[J].中国组织化学与细胞化学杂志,1996,5(2):259~263.
[9]周占祥,孙秉贵,邓泽沛.牛精子膜SA-30在获能与顶体反应后的定位变化[J].解剖学报,1998,29(2):178~183.
, http://www.100md.com
[10]Stryer L.Protein targeting.In Stryer L(ed).Biochemistry.4th ed. New York:WH Freeman and Company,1994:911-948.
[11]Olson GE,Danzo BJ.Surface changes in rat spermatozoa during epididymal transit[J].Biol Reprod,1981,24(2):431-433.
[12]Tulsiani DRP,Skudlarek MD,Holand MK,et al.Glycosylation of rat sperm plasma membrane during epididymal maturation[J].Biol Reprod,1993,48(2):417-428.
[13]Sinouatz F,Friess AE.Localization of lectin receptors on bovine epididymal spermatozoa using a colloidal gold technique[J].Histoch,1983,79(4):335-344.
, 百拇医药
[14]Runnebaum IB,Schill WB,Topfer-Peterson.Con A-binding proteins of the sperm surface are conserved through evolution and in sperm maturation[J].Androl,1995,27(1):81-90.
[15]Naz RK.Sperm antigens relevant to fertilization and early embryonic development.In Naz RK(ed).Immunology of Reproduction[M].Boca Raton:CRC,1993:37-55.
【收稿日期】1999-04-30
【修稿日期】1999-07-05, 百拇医药