胚胎小鼠下丘脑培养状态SRIF神经元的发生免疫细胞化学研究
作者:杨浩 梁喆 鞠躬
单位:杨浩(第四军医大学神经科学研究所,西安 710032);梁喆(第四军医大学神经科学研究所,西安 710032);鞠躬(第四军医大学神经科学研究所,西安 710032)
关键词:生长抑素;下丘脑;细胞培养;免疫细胞化学
解剖学报000303 【摘要】 目的 研究胚胎小鼠下丘脑培养状态下SRIF神经元的发生。 方法 采用原代分离培养的方法,将胚胎小鼠下丘脑进行体外分散细胞培养,观察了下丘脑细胞的生长分化过程,并且对培养不同时间的细胞作生长抑素(SRIF)免疫细胞化学染色,阳性神经元记数,各种形态神经元所占的百分比统计。 结果 胚胎小鼠下丘脑SRIF阳性神经元在体外生长发育不同时间细胞指数不同:7d时为24±1.52,10d时为34±2.20,12d时为34±3.30,14d时为104±6.32,16d时为68±5.34,20d时为29±1.54,其中在培养14d时,SRIF阳性神经元达到高峰,以后出现下降趋势。而且神经元的形态、单极、双极、多极神经元的数目以及突起呈色深浅在发育过程中也有较大的变化,各种占比例较大神经元出现的时期也不一样,其中,单极在培养10、14、16d时分别占52.3%、60.0%、43.3%。双极在培养10、14、16d时分别占30.7%、20.7%、30.1%。多极神经元在培养7、12、20d时分别占81.5%、90.1%、67.3%。 结论 (1)在培养状态下,下丘脑不同核区的细胞发育速度不同,并且随时间点的变化呈现规律性变化;(2)不同类型的SRIF神经元的发育随着不同的时间点呈现出不同比例很可能反映一些SRIF神经元的功能发生了转化;(3)体外培养状态下SRIF神经元的发育可能反映在体SRIF神经元的情况。
, 百拇医药
【中图分类号】 R322.81;R321.5 【文献标识码】 A 【文章编号】 0529-1356(2000)03-202
THE ONTOGENCY OF THE SRIF NEURONS IN THE HYPOTHALAMUS
OF EMBRYONIC MICE in vitroA STUDY OF
IMMUNOCYTOCHEMICAL STAINING
YANG Hao, LIANG Zhe, JU Gong
(Institute of Neurosciences,the Fourth Military Medical University,Xi'an 710032,China)
, 百拇医药
【Abstract】 Objective The purpose of the present study is to illustrate ontogency of the SRIF neurons in the hypothalamus of embryonic mice in vitro. Methods Neurons were dissociated from the hypothalamus of embryonic mice and cultured primarily.The process of the growth and differentiation of hypothalamic neurons was observed in vitro.The cultured hypothalamic neurons were stained immunocytochemically with anti-SRIF antibody at different culture times.The number of the SRIF-positive cells,which were different in morphology,was counted and the percentages of different SRIF-positive neurons were calculated. Results The numbers of the SRIF-positive cells were distinct in different growth and differentiation periods.Thus,the number of the neurons was 24±1.52,34±3.30,104±6.32,68±5.34 or 29±1.54 at 7,10,14,16 or 20 days in vitro (DIV),respectively.The number of the neurons increased with culture time,with the highest number at 14 DIV,and decreased when the culture time became longer than 14 days.Furthermore,obvious changes took place in the morphology and immunocytochemical reactivity of the neurons as well as the number of monopolar,bipolar and multipolar neurons at different time points.In addition,the highest percentages of neurons with different profiles turned up at different time points.The per-centages of the monopolar neurons were 52.3%,60% and 43.3% at 10,14 and 16 DIV,respectively,whereas the percentages of those bipolar cells represented 30.7%,20.7% and 30.1% at the corresponding time points.As for the multipolar cells,such percentages reached 81.5%,90.1%,and 67.3% at 7,12 and 20DIV,respectively. Conclusions (1)Distinct hypothalamic neurons develop at different speed under culture conditions and change regularly at different culture time;(2)distinct types of SRIF-positive neurons develop at different rates,suggesting that some of the SRIF-positive neurons may have transformed their types and functions,and (3) in vitro development of the SRIF-positive neurons may reflect their in vivo states.
, 百拇医药
【Key words】 Somatotropin release inhibiting factor; Hypothalamus; Cell culture; Immuncytochemistry
SRIF为环状的14肽,它不仅是一种能够抑制生长激素释放的一种内分泌激素,而且是一种强有力的神经递质或神经调制物。其生理作用广泛而复杂。随着胚胎发育学、细胞生理学、神经内分泌学的飞速发展,作为肽类家族这种兼有激素作用的神经递质,越来越受到学者们的重视,但是关于SRIF神经元发生学方面以原代培养小鼠的下丘脑作为下丘脑细胞的发育过程的研究不多见,国内未见报道。本实验应用小鼠胚胎做下丘脑分散细胞培养,通过不同时期下丘脑神经元的个体生长发育和形态变化以及SRIF阳性神经元的形态特征,为研究在体胚胎期下丘脑SRIF神经元的分泌功能及其调节提供了一个体外途径。
材料和方法
1. 下丘脑神经元细胞培养
, 百拇医药
本工作以杂系17d的胚胎小鼠下丘脑为实验材料,采用原代培养的方法Richard[1]等并且加以改良。将怀孕17d母鼠引颈处死,无菌条件下将胚胎小鼠的颅骨从中线剥开,将小鼠的整个脑组织全部取出。放在细胞解离液D1-SGH(D1为无钙镁离子Pucks液,SGH为蔗糖-葡萄糖和HEPES缓冲液)中,剔除脑膜,将脑底朝上,然后用虹膜刀分别在水平位沿视交叉和中脑各切1刀,再将切好的脑片水平放置,按文献[1]所述位置再切3刀,切弃周围组织。将分离好的下丘脑剪成碎块,移入0.125%的胰蛋白酶中于37℃5%CO2孵育箱中作用25min。然后于胰酶终止液作用10min,最后用完全培养液[DMEM80%,胎牛血清20%(Sigma)],制成单细胞悬液,再将细胞浓度调至1×106细胞/ml,然后再将细胞接种在涂有鼠尾胶原的35mm塑料培养皿中,每皿1ml,于37℃,95%空气和5%CO2培养箱中培养48h后,每皿加入20μl阿糖胞苷(10μmol/L),抑制非神经元的过度增殖,以后每3d换液1次。
, 百拇医药
2. 免疫细胞化学染色
将培养7、10、12、14、16和20d的细胞用0.01mol/LPBS配制的4%多聚甲醛固定1h,然后用SRIF抗血清(1∶500Sigma产品)按ABC法进行免疫细胞化学染色,呈现阳性反应的为SRIF神经元,为避免显色人为差异,严格控制加样反应显色条件时间的一致性。然后在显微镜下进行观察,比较不同时期细胞着色情况。
3. SRIF神经元的细胞指数
将染色的标本于OLYMPUS倒置显微镜下进行观察,观察不同时间7、10、12、14、16、20d细胞的形态变化,并且分别随机选择15个视野计数阳性细胞(视野面积0.12mm2),取平均数。
4. 下丘脑SRIF神经元在不同培养时间的类别比较
在显微镜下按突起的类别统计单极、双极、多极神经元数目,然后计算它们在培养不同时间所占细胞指数的比例。
, 百拇医药
结果
1. 细胞培养及形态学观察
胚胎小鼠的下丘脑细胞大多数在接种24h左右内贴壁,刚贴壁的细胞呈圆形,体积小,立体感强,彼此分散,培养2d后,可见大多数神经元重聚大小不等的细胞团。突起向四周长出,相邻细胞团也有纤维相连。阿糖胞苷作用后,神经元背景明显清晰。培养7d后,神经元明显可以分辨,不等大小的神经元彼此分散生长,只有少部分仍处于团聚状态。随着培养时间的延长,神经元的突起纵横交错,难以辨认突起的起源。
用SRIF抗血清进行免疫细胞化学染色后,不同时间SRIF神经元的形态特征以及着色的深浅不尽相同。7d时进行染色,着色的细胞相对少,而且胞体和突起相对淡,突起短而细,此时阳性细胞主要为多极神经元(图1)。10d后,大部分SRIF阳性神经元出现深染,胞体较大的神经元出现淡染,着色细胞多为单极和双极的小细胞,胞体约3μm左右,突起着色十分深且清晰。只有胞体较大的神经元出现淡染(图2),胞体约20μm。培养12d进行染色,阳性细胞大多数是多极神经元,胞体为中等程度着色,突起十分清晰,而且突起上阳性颗粒明显,呈串珠样排列,也有少数多极神经元出现淡染(图3)。而且着色深浅不一,突起着色模糊,此期阳性神经元最为密集(图4)。16d时,SRIF阳性神经元是团聚的着色。单个细胞也有着色,突起与胞体着色浅,而且突起相对粗短。细胞密度较14d时小(图5)。20d后,SRIF阳性神经元密度大为下降,着色情况与10d相似,但较第10d的细胞着色浅(图6)。
, 百拇医药
2. 培养不同时间后SRIF阳性神经元的细胞指数的变化(图7)
以20倍镜下随机计数15个视野的细胞作为检测SRIF神经元指数变化的指标。结果发现,培养7、10、12、14、16、20d时,SRIF神经元数呈现峰状分布,其中14DIV细胞指数达到高峰,14DIV以后呈现下降趋势。
图7 SRIF神经元在不同培养时间细胞指数的变化,图中各值为在不同培养时间的细胞指数。
Fig.7 Change of SRIF neuron number in different periods in vitro.Each point represents neuron number of different periods in vitro.
, 百拇医药
3. SRIF神经元在培养不同时间的类别比
将培养不同时间的SRIF神经元在10倍镜下分别按突起的多少分类,并且计算单极,双极,多极神经元所占SRIF阳性神经元的比例,详见附表。
讨论
SRIF是种系发生上比较老的肽类物质,它在胚胎个体发生过程中作用很复杂因而受到重视。机体之所以保持正常的发育速度、器官组织机能之所以协调一致的活动。在很大程度上与SRIF的广泛生理作用分不开。因此研究胚胎SRIF神经元的个体发育有着重要的意义。自从运用大鼠下丘脑细胞培养获得成功以来,体外研究SRIF神经元的功能越来越受关注,但是胚胎小鼠SRIF神经元生长发育过程中,在不同的发育时期,细胞指数不同,而且形态比例各异,这到底是一种消退现象,还是这些神经元的功能发生了转化,至今还有争议。本研究通过体外实验发现,这种现象(在不同培养时期SRIF神经元数目不相同,而且神经元的形态比例各异、免疫细胞化学染色的着色情况也有差别)在很大程度上可能与这些神经元的功能转移,核团的发育速度不尽相同有关。在下丘脑细胞培养的整个过程中,如果来自不同核团SRIF神经元发育速度相同,在10d时细胞指数会下降,因为在培养8~10d有个自然死亡期,细胞会大量死亡,10d后趋于稳定状态。从我们细胞计数的结果来看,10d时细胞指数是31.2,明显高于7d的细胞指数22.3。这说明不同核区SRIF神经元的发育速度不可能同步。另外,在培养的不同时间,单极、双极、多极的SRIF神经元所占比例也不相同,在12d,SRIF双极神经元仅占4.4%,而多极占90.1%。14d时SRIF多极神经元减少到19.3%,双极神经元增加到20.7%,在14d、16d时单极有大幅度的增长达到60.0%、43.3%,20d时单极、双极的SRIF神经元分别下降到14.0%、18.7%。多极又回升到67.3%。同时,SRIF免疫细胞化学染色在不同时期的着色也不相同,有的在胞体着色深,有的在突起上着色深,再加上SRIF神经元从7~20d细胞指数折算,我们不难推测SRIF在下丘脑的神经元不同发育时区表达合成可能是不定时的,在发育阶段可能受到自身或其他激素、递质等的影响使得SRIF基因时而表达停止,时而大量表达合成。于是出现了不同时期的形态不同的SRIF神经元的增殖峰,或阳性反应完全消失、减弱。Tornqvist等[2]曾证明视网膜节细胞在发育过程中SRIF基因的表达SRIF多肽的合成是暂时性的。因此,在培养14d后出现细胞数下降的这种趋势,可能是部分SRIF表达合成停止,不以SRIF神经元出现,而并不意味着SRIF神经元退化死亡。在培养10~20d中单极、双极、多极神经元比例变化迅速,也可能提示下丘脑神经元功能发生了转移,SRIF与许多神经递质共存的现象[3],并且它对其他递质的合成释放有一定的调节或影响作用。其他递质可能在一定的生理条件下也能影响SRIF的效应,包括它的合成分泌及执行生理功能。因此当SRIF基因表达停止和SRIF多肽合成停止,也可能不表现SRIF的性能,而以其他能神经元表现,也就是神经元类型和功能发生了转化。
, http://www.100md.com
附表 培养不同时间SRIF神经元的类别比例
Table 1 Percentage of various SRIF neurons at
different periods in vitro 培养时间(d)culture time(day)
单极(%)
monopolar
双极(%)
bipolar
多极(%)
multipolar
7
, 百拇医药
7.2
11
81.5
10
52.3
30.7
17.0
12
5.6
4.4
90.1
14
60.0
, 百拇医药
20.7
19.3
16
43.3
30.1
26.8
20
14.0
18.7
67.3
Daikokus等[4]观察大鼠下丘脑的发育过程认为下丘脑SRIF神经元主要来自3个不同的部位,并且在胚胎的不同时期发生移行,最早是弓状核(arcuate hypothalamic nucleus,ARC),其次腹内侧核(ventyromedial hypothalamic nucleus,VMH)和室周核(periventricular hypothalamic nucleus,Pe),而且下丘脑这些神经元核团发生交错。有些学者[4~6]观察发现,大鼠SRIF神经元形态上为双极、单极或多极,胞体大小主要是中、小型,直径约5~20μm,SRIF阳性反应主要见胞浆和纤维上,Arc内的神经元纤维走向为多方向,而且深染,Pe主要由两类细胞构成,一种是分化程度较低,细胞密度比较稀散的小细胞,另一种是密度较大,呈圆球型的大细胞构成。VMH核区的细胞有中等大小的细胞构成,胞体较圆。在本实验中,从培养7~20d的免疫细胞染色的形态学观察来看,各种形态的细胞在不同培养时间内都有出现,但细胞指数高峰不同,比例不一样,在培养10d时,主要是小细胞(直径约3μm)和淡染的大细胞(直径约20μm),可以推测,此期分化成熟的细胞主要来自于Pe,12d时为纤维走向丰富的多极细胞,可能是Arc细胞分化成熟的高峰。14d主要是中等大小的胞浆淡染的SRIF球型细胞(约10μm),可能主要是VMH的细胞。原代细胞培养是1种通过体外细胞模型来反映在体细胞状况的很好研究方法,培养新生大鼠下丘脑神经元的大小形状基本与在体相似,并且具有在体类似的功能[7,8]。因此在不同的培养期,SRIF神经元出现不同的形态指标,这可能与它们来自不同核团将支配不同的功能区有关,它们在发育成熟的过程中,互相协调互相制约,以维持机体的平衡和正常的发育。在本研究中,SRIF神经元细胞指数达到高峰是第14d,以后出现下降趋势,从传统培养角度来看,这种现象是一种退化现象,但我们认为这可能是SRIF神经元分化成熟的过程中适应其他类型神经元的调节而发生了转化,转化的神经元SRIF免疫原性较弱而未能出现阳性反应。另有些学者[9]报告,在大鼠VMH注入SRIF后,核内的神经元功能受到抑制,推测SRIF可能作为抑制神经元的调制物而影响此区其他神经元的活动。另外,SRIF神经元有与其他神经递质共存的现象,也可以证明,下丘脑细胞在培养的后期,SRIF的数目呈现下降趋势,很可能是由于细胞释放SRIF或其他递质而使一些SRIF神经元受到抑制,使得SRIF合成减少或丧失,其他神经递质合成增加从而发生类型转化,于是不表现出SRIF神经元的一些功能,包括SRIF基因表达停止SRIF合成明显减少,从而不表现免疫细胞化学的阳性反应。因此,体外培养细胞生长高峰后的下降趋势不一定单纯由于退化引起,在很大程度可能与下丘脑不同核团的发育速度不同而相互协调,相互抑制的结果。这种现象十分复杂,有待进一步研究。
, 百拇医药
本文图1~6见插图第3页
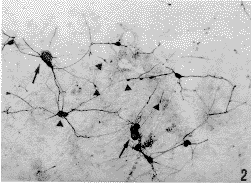


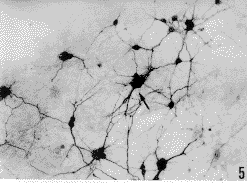

图版说明
图1 培养7d SRIF阳性神经元,细胞淡染,突起短() ×200图2 培养10d SRIF阳性神经元,胞体极小的神经元(▲)约3μm,胞体较大,淡染的神经元(↑)约20μm ×200
, 百拇医药 图3 培养12dSRIF阳性神经元,胞体极小,突起深染的细胞(↑)胞体约5μm。突起上的阳性颗粒(▲) ×200
图4 培养14d SRIF阳性神经元,球形胞体,淡染的细胞(↑) ×200
图5 培养12d SRIF阳性神经元,成团淡染的细胞(↑) ×200
图6 培养20d SRIF阳性神经元() ×200Explanation of figures
Fig.1 SRIF positive neurons for 7 days in vitro,cells are light-staining and neurites are short() ×200
Fig.2 SRIF positive neurons for 10 days in vitro.somas are small,dark-staining neurons(▲)about 3μm,light-staining neurons with big soma(↑)about 20μm ×200
, http://www.100md.com
Fig.3 SRIF positive neurons for 12 days in vitro,some are small,cell with dark-staining(↑) its diameter are about 5μm,Positive granule on neurites(▲) ×200
Fig.4 SRIF positive neurons for 14 days in vitro,light-staining cells with round soma(↑) ×200
Fig.5 SRIF positive neurons for 16 days in vitro,aggregate cells are light-staining(↑) ×200
Fig.6 SRIF positive neurons for 20 days in vitro() ×200
, 百拇医药
【作者简介】 杨浩(1971—),男,陕西西安人,硕士研究生
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Abraham S,Jean DV,Antonia V,et al.A Dissection and Tissue Culture Manual the Nervous System[M].Copyright Alan R,New York:Liss Inc,1989:8-10.
[2]Tornqvist K,Uddman R,Sundler F,et al somatostatin and VIP neurons in retina of different species[J].Histochemistry,1982,76(2):137-152.
, 百拇医药
[3]Vincent SR,Johansson O,Hokfelt T,et al.Neuropeptide coexistence in human cortical neurons[J].Nature,1982,298(5869):65-67.
[4]Daikoku S,Hisano S,Kawano H,et al.Ontogenetic studies on the topographical heterogeneity of somatostatin-staining neurons in the rat hypothalamus[J].Cell Tissue Res,1983,233(2):347-354.
[5]朱长庚.生长抑素[J].神经解剖学杂志,1986,2(2):161~168.
[6]Shiosaka S,Takatsuki K,Sakanaka M,et al.Ontogency of somatostatin-staining neuron system of the rat:immunohistochemical analysis Ⅱ.forebrain and diencephalon[J].J Comp Neurol,1982,204(4):211-224.
, http://www.100md.com
[7]王福庄,丁爱石,张崇理.新生大鼠培养细胞LH-RH免疫组化观察[J].细胞生物学杂志,1994,16(3):134~137.
[8]Barry J,Croix D.Immunofluorescene study of the hypothalamo-infundibular LRH tract and serum gonadotropin levels in the female squirrel monkey during the estrous cycle[J].Cell Tissue Res,1978,192(2):215-226.
[9]Renaud LP,martin JB,Brazeau P.Depressant action of TRH,LH-RH and somtosatatin of activity of central neurons[J].Nature,1975,255(5505):233-235.
【收稿日期】1999-11-15 【修稿日期】2000-01-25, 百拇医药
单位:杨浩(第四军医大学神经科学研究所,西安 710032);梁喆(第四军医大学神经科学研究所,西安 710032);鞠躬(第四军医大学神经科学研究所,西安 710032)
关键词:生长抑素;下丘脑;细胞培养;免疫细胞化学
解剖学报000303 【摘要】 目的 研究胚胎小鼠下丘脑培养状态下SRIF神经元的发生。 方法 采用原代分离培养的方法,将胚胎小鼠下丘脑进行体外分散细胞培养,观察了下丘脑细胞的生长分化过程,并且对培养不同时间的细胞作生长抑素(SRIF)免疫细胞化学染色,阳性神经元记数,各种形态神经元所占的百分比统计。 结果 胚胎小鼠下丘脑SRIF阳性神经元在体外生长发育不同时间细胞指数不同:7d时为24±1.52,10d时为34±2.20,12d时为34±3.30,14d时为104±6.32,16d时为68±5.34,20d时为29±1.54,其中在培养14d时,SRIF阳性神经元达到高峰,以后出现下降趋势。而且神经元的形态、单极、双极、多极神经元的数目以及突起呈色深浅在发育过程中也有较大的变化,各种占比例较大神经元出现的时期也不一样,其中,单极在培养10、14、16d时分别占52.3%、60.0%、43.3%。双极在培养10、14、16d时分别占30.7%、20.7%、30.1%。多极神经元在培养7、12、20d时分别占81.5%、90.1%、67.3%。 结论 (1)在培养状态下,下丘脑不同核区的细胞发育速度不同,并且随时间点的变化呈现规律性变化;(2)不同类型的SRIF神经元的发育随着不同的时间点呈现出不同比例很可能反映一些SRIF神经元的功能发生了转化;(3)体外培养状态下SRIF神经元的发育可能反映在体SRIF神经元的情况。
, 百拇医药
【中图分类号】 R322.81;R321.5 【文献标识码】 A 【文章编号】 0529-1356(2000)03-202
THE ONTOGENCY OF THE SRIF NEURONS IN THE HYPOTHALAMUS
OF EMBRYONIC MICE in vitroA STUDY OF
IMMUNOCYTOCHEMICAL STAINING
YANG Hao, LIANG Zhe, JU Gong
(Institute of Neurosciences,the Fourth Military Medical University,Xi'an 710032,China)
, 百拇医药
【Abstract】 Objective The purpose of the present study is to illustrate ontogency of the SRIF neurons in the hypothalamus of embryonic mice in vitro. Methods Neurons were dissociated from the hypothalamus of embryonic mice and cultured primarily.The process of the growth and differentiation of hypothalamic neurons was observed in vitro.The cultured hypothalamic neurons were stained immunocytochemically with anti-SRIF antibody at different culture times.The number of the SRIF-positive cells,which were different in morphology,was counted and the percentages of different SRIF-positive neurons were calculated. Results The numbers of the SRIF-positive cells were distinct in different growth and differentiation periods.Thus,the number of the neurons was 24±1.52,34±3.30,104±6.32,68±5.34 or 29±1.54 at 7,10,14,16 or 20 days in vitro (DIV),respectively.The number of the neurons increased with culture time,with the highest number at 14 DIV,and decreased when the culture time became longer than 14 days.Furthermore,obvious changes took place in the morphology and immunocytochemical reactivity of the neurons as well as the number of monopolar,bipolar and multipolar neurons at different time points.In addition,the highest percentages of neurons with different profiles turned up at different time points.The per-centages of the monopolar neurons were 52.3%,60% and 43.3% at 10,14 and 16 DIV,respectively,whereas the percentages of those bipolar cells represented 30.7%,20.7% and 30.1% at the corresponding time points.As for the multipolar cells,such percentages reached 81.5%,90.1%,and 67.3% at 7,12 and 20DIV,respectively. Conclusions (1)Distinct hypothalamic neurons develop at different speed under culture conditions and change regularly at different culture time;(2)distinct types of SRIF-positive neurons develop at different rates,suggesting that some of the SRIF-positive neurons may have transformed their types and functions,and (3) in vitro development of the SRIF-positive neurons may reflect their in vivo states.
, 百拇医药
【Key words】 Somatotropin release inhibiting factor; Hypothalamus; Cell culture; Immuncytochemistry
SRIF为环状的14肽,它不仅是一种能够抑制生长激素释放的一种内分泌激素,而且是一种强有力的神经递质或神经调制物。其生理作用广泛而复杂。随着胚胎发育学、细胞生理学、神经内分泌学的飞速发展,作为肽类家族这种兼有激素作用的神经递质,越来越受到学者们的重视,但是关于SRIF神经元发生学方面以原代培养小鼠的下丘脑作为下丘脑细胞的发育过程的研究不多见,国内未见报道。本实验应用小鼠胚胎做下丘脑分散细胞培养,通过不同时期下丘脑神经元的个体生长发育和形态变化以及SRIF阳性神经元的形态特征,为研究在体胚胎期下丘脑SRIF神经元的分泌功能及其调节提供了一个体外途径。
材料和方法
1. 下丘脑神经元细胞培养
, 百拇医药
本工作以杂系17d的胚胎小鼠下丘脑为实验材料,采用原代培养的方法Richard[1]等并且加以改良。将怀孕17d母鼠引颈处死,无菌条件下将胚胎小鼠的颅骨从中线剥开,将小鼠的整个脑组织全部取出。放在细胞解离液D1-SGH(D1为无钙镁离子Pucks液,SGH为蔗糖-葡萄糖和HEPES缓冲液)中,剔除脑膜,将脑底朝上,然后用虹膜刀分别在水平位沿视交叉和中脑各切1刀,再将切好的脑片水平放置,按文献[1]所述位置再切3刀,切弃周围组织。将分离好的下丘脑剪成碎块,移入0.125%的胰蛋白酶中于37℃5%CO2孵育箱中作用25min。然后于胰酶终止液作用10min,最后用完全培养液[DMEM80%,胎牛血清20%(Sigma)],制成单细胞悬液,再将细胞浓度调至1×106细胞/ml,然后再将细胞接种在涂有鼠尾胶原的35mm塑料培养皿中,每皿1ml,于37℃,95%空气和5%CO2培养箱中培养48h后,每皿加入20μl阿糖胞苷(10μmol/L),抑制非神经元的过度增殖,以后每3d换液1次。
, 百拇医药
2. 免疫细胞化学染色
将培养7、10、12、14、16和20d的细胞用0.01mol/LPBS配制的4%多聚甲醛固定1h,然后用SRIF抗血清(1∶500Sigma产品)按ABC法进行免疫细胞化学染色,呈现阳性反应的为SRIF神经元,为避免显色人为差异,严格控制加样反应显色条件时间的一致性。然后在显微镜下进行观察,比较不同时期细胞着色情况。
3. SRIF神经元的细胞指数
将染色的标本于OLYMPUS倒置显微镜下进行观察,观察不同时间7、10、12、14、16、20d细胞的形态变化,并且分别随机选择15个视野计数阳性细胞(视野面积0.12mm2),取平均数。
4. 下丘脑SRIF神经元在不同培养时间的类别比较
在显微镜下按突起的类别统计单极、双极、多极神经元数目,然后计算它们在培养不同时间所占细胞指数的比例。
, 百拇医药
结果
1. 细胞培养及形态学观察
胚胎小鼠的下丘脑细胞大多数在接种24h左右内贴壁,刚贴壁的细胞呈圆形,体积小,立体感强,彼此分散,培养2d后,可见大多数神经元重聚大小不等的细胞团。突起向四周长出,相邻细胞团也有纤维相连。阿糖胞苷作用后,神经元背景明显清晰。培养7d后,神经元明显可以分辨,不等大小的神经元彼此分散生长,只有少部分仍处于团聚状态。随着培养时间的延长,神经元的突起纵横交错,难以辨认突起的起源。
用SRIF抗血清进行免疫细胞化学染色后,不同时间SRIF神经元的形态特征以及着色的深浅不尽相同。7d时进行染色,着色的细胞相对少,而且胞体和突起相对淡,突起短而细,此时阳性细胞主要为多极神经元(图1)。10d后,大部分SRIF阳性神经元出现深染,胞体较大的神经元出现淡染,着色细胞多为单极和双极的小细胞,胞体约3μm左右,突起着色十分深且清晰。只有胞体较大的神经元出现淡染(图2),胞体约20μm。培养12d进行染色,阳性细胞大多数是多极神经元,胞体为中等程度着色,突起十分清晰,而且突起上阳性颗粒明显,呈串珠样排列,也有少数多极神经元出现淡染(图3)。而且着色深浅不一,突起着色模糊,此期阳性神经元最为密集(图4)。16d时,SRIF阳性神经元是团聚的着色。单个细胞也有着色,突起与胞体着色浅,而且突起相对粗短。细胞密度较14d时小(图5)。20d后,SRIF阳性神经元密度大为下降,着色情况与10d相似,但较第10d的细胞着色浅(图6)。
, 百拇医药
2. 培养不同时间后SRIF阳性神经元的细胞指数的变化(图7)
以20倍镜下随机计数15个视野的细胞作为检测SRIF神经元指数变化的指标。结果发现,培养7、10、12、14、16、20d时,SRIF神经元数呈现峰状分布,其中14DIV细胞指数达到高峰,14DIV以后呈现下降趋势。

图7 SRIF神经元在不同培养时间细胞指数的变化,图中各值为在不同培养时间的细胞指数。
Fig.7 Change of SRIF neuron number in different periods in vitro.Each point represents neuron number of different periods in vitro.
, 百拇医药
3. SRIF神经元在培养不同时间的类别比
将培养不同时间的SRIF神经元在10倍镜下分别按突起的多少分类,并且计算单极,双极,多极神经元所占SRIF阳性神经元的比例,详见附表。
讨论
SRIF是种系发生上比较老的肽类物质,它在胚胎个体发生过程中作用很复杂因而受到重视。机体之所以保持正常的发育速度、器官组织机能之所以协调一致的活动。在很大程度上与SRIF的广泛生理作用分不开。因此研究胚胎SRIF神经元的个体发育有着重要的意义。自从运用大鼠下丘脑细胞培养获得成功以来,体外研究SRIF神经元的功能越来越受关注,但是胚胎小鼠SRIF神经元生长发育过程中,在不同的发育时期,细胞指数不同,而且形态比例各异,这到底是一种消退现象,还是这些神经元的功能发生了转化,至今还有争议。本研究通过体外实验发现,这种现象(在不同培养时期SRIF神经元数目不相同,而且神经元的形态比例各异、免疫细胞化学染色的着色情况也有差别)在很大程度上可能与这些神经元的功能转移,核团的发育速度不尽相同有关。在下丘脑细胞培养的整个过程中,如果来自不同核团SRIF神经元发育速度相同,在10d时细胞指数会下降,因为在培养8~10d有个自然死亡期,细胞会大量死亡,10d后趋于稳定状态。从我们细胞计数的结果来看,10d时细胞指数是31.2,明显高于7d的细胞指数22.3。这说明不同核区SRIF神经元的发育速度不可能同步。另外,在培养的不同时间,单极、双极、多极的SRIF神经元所占比例也不相同,在12d,SRIF双极神经元仅占4.4%,而多极占90.1%。14d时SRIF多极神经元减少到19.3%,双极神经元增加到20.7%,在14d、16d时单极有大幅度的增长达到60.0%、43.3%,20d时单极、双极的SRIF神经元分别下降到14.0%、18.7%。多极又回升到67.3%。同时,SRIF免疫细胞化学染色在不同时期的着色也不相同,有的在胞体着色深,有的在突起上着色深,再加上SRIF神经元从7~20d细胞指数折算,我们不难推测SRIF在下丘脑的神经元不同发育时区表达合成可能是不定时的,在发育阶段可能受到自身或其他激素、递质等的影响使得SRIF基因时而表达停止,时而大量表达合成。于是出现了不同时期的形态不同的SRIF神经元的增殖峰,或阳性反应完全消失、减弱。Tornqvist等[2]曾证明视网膜节细胞在发育过程中SRIF基因的表达SRIF多肽的合成是暂时性的。因此,在培养14d后出现细胞数下降的这种趋势,可能是部分SRIF表达合成停止,不以SRIF神经元出现,而并不意味着SRIF神经元退化死亡。在培养10~20d中单极、双极、多极神经元比例变化迅速,也可能提示下丘脑神经元功能发生了转移,SRIF与许多神经递质共存的现象[3],并且它对其他递质的合成释放有一定的调节或影响作用。其他递质可能在一定的生理条件下也能影响SRIF的效应,包括它的合成分泌及执行生理功能。因此当SRIF基因表达停止和SRIF多肽合成停止,也可能不表现SRIF的性能,而以其他能神经元表现,也就是神经元类型和功能发生了转化。
, http://www.100md.com
附表 培养不同时间SRIF神经元的类别比例
Table 1 Percentage of various SRIF neurons at
different periods in vitro 培养时间(d)culture time(day)
单极(%)
monopolar
双极(%)
bipolar
多极(%)
multipolar
7
, 百拇医药
7.2
11
81.5
10
52.3
30.7
17.0
12
5.6
4.4
90.1
14
60.0
, 百拇医药
20.7
19.3
16
43.3
30.1
26.8
20
14.0
18.7
67.3
Daikokus等[4]观察大鼠下丘脑的发育过程认为下丘脑SRIF神经元主要来自3个不同的部位,并且在胚胎的不同时期发生移行,最早是弓状核(arcuate hypothalamic nucleus,ARC),其次腹内侧核(ventyromedial hypothalamic nucleus,VMH)和室周核(periventricular hypothalamic nucleus,Pe),而且下丘脑这些神经元核团发生交错。有些学者[4~6]观察发现,大鼠SRIF神经元形态上为双极、单极或多极,胞体大小主要是中、小型,直径约5~20μm,SRIF阳性反应主要见胞浆和纤维上,Arc内的神经元纤维走向为多方向,而且深染,Pe主要由两类细胞构成,一种是分化程度较低,细胞密度比较稀散的小细胞,另一种是密度较大,呈圆球型的大细胞构成。VMH核区的细胞有中等大小的细胞构成,胞体较圆。在本实验中,从培养7~20d的免疫细胞染色的形态学观察来看,各种形态的细胞在不同培养时间内都有出现,但细胞指数高峰不同,比例不一样,在培养10d时,主要是小细胞(直径约3μm)和淡染的大细胞(直径约20μm),可以推测,此期分化成熟的细胞主要来自于Pe,12d时为纤维走向丰富的多极细胞,可能是Arc细胞分化成熟的高峰。14d主要是中等大小的胞浆淡染的SRIF球型细胞(约10μm),可能主要是VMH的细胞。原代细胞培养是1种通过体外细胞模型来反映在体细胞状况的很好研究方法,培养新生大鼠下丘脑神经元的大小形状基本与在体相似,并且具有在体类似的功能[7,8]。因此在不同的培养期,SRIF神经元出现不同的形态指标,这可能与它们来自不同核团将支配不同的功能区有关,它们在发育成熟的过程中,互相协调互相制约,以维持机体的平衡和正常的发育。在本研究中,SRIF神经元细胞指数达到高峰是第14d,以后出现下降趋势,从传统培养角度来看,这种现象是一种退化现象,但我们认为这可能是SRIF神经元分化成熟的过程中适应其他类型神经元的调节而发生了转化,转化的神经元SRIF免疫原性较弱而未能出现阳性反应。另有些学者[9]报告,在大鼠VMH注入SRIF后,核内的神经元功能受到抑制,推测SRIF可能作为抑制神经元的调制物而影响此区其他神经元的活动。另外,SRIF神经元有与其他神经递质共存的现象,也可以证明,下丘脑细胞在培养的后期,SRIF的数目呈现下降趋势,很可能是由于细胞释放SRIF或其他递质而使一些SRIF神经元受到抑制,使得SRIF合成减少或丧失,其他神经递质合成增加从而发生类型转化,于是不表现出SRIF神经元的一些功能,包括SRIF基因表达停止SRIF合成明显减少,从而不表现免疫细胞化学的阳性反应。因此,体外培养细胞生长高峰后的下降趋势不一定单纯由于退化引起,在很大程度可能与下丘脑不同核团的发育速度不同而相互协调,相互抑制的结果。这种现象十分复杂,有待进一步研究。
, 百拇医药
本文图1~6见插图第3页






图版说明
图1 培养7d SRIF阳性神经元,细胞淡染,突起短() ×200图2 培养10d SRIF阳性神经元,胞体极小的神经元(▲)约3μm,胞体较大,淡染的神经元(↑)约20μm ×200
, 百拇医药 图3 培养12dSRIF阳性神经元,胞体极小,突起深染的细胞(↑)胞体约5μm。突起上的阳性颗粒(▲) ×200
图4 培养14d SRIF阳性神经元,球形胞体,淡染的细胞(↑) ×200
图5 培养12d SRIF阳性神经元,成团淡染的细胞(↑) ×200
图6 培养20d SRIF阳性神经元() ×200Explanation of figures
Fig.1 SRIF positive neurons for 7 days in vitro,cells are light-staining and neurites are short() ×200
Fig.2 SRIF positive neurons for 10 days in vitro.somas are small,dark-staining neurons(▲)about 3μm,light-staining neurons with big soma(↑)about 20μm ×200
, http://www.100md.com
Fig.3 SRIF positive neurons for 12 days in vitro,some are small,cell with dark-staining(↑) its diameter are about 5μm,Positive granule on neurites(▲) ×200
Fig.4 SRIF positive neurons for 14 days in vitro,light-staining cells with round soma(↑) ×200
Fig.5 SRIF positive neurons for 16 days in vitro,aggregate cells are light-staining(↑) ×200
Fig.6 SRIF positive neurons for 20 days in vitro() ×200
, 百拇医药
【作者简介】 杨浩(1971—),男,陕西西安人,硕士研究生
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Abraham S,Jean DV,Antonia V,et al.A Dissection and Tissue Culture Manual the Nervous System[M].Copyright Alan R,New York:Liss Inc,1989:8-10.
[2]Tornqvist K,Uddman R,Sundler F,et al somatostatin and VIP neurons in retina of different species[J].Histochemistry,1982,76(2):137-152.
, 百拇医药
[3]Vincent SR,Johansson O,Hokfelt T,et al.Neuropeptide coexistence in human cortical neurons[J].Nature,1982,298(5869):65-67.
[4]Daikoku S,Hisano S,Kawano H,et al.Ontogenetic studies on the topographical heterogeneity of somatostatin-staining neurons in the rat hypothalamus[J].Cell Tissue Res,1983,233(2):347-354.
[5]朱长庚.生长抑素[J].神经解剖学杂志,1986,2(2):161~168.
[6]Shiosaka S,Takatsuki K,Sakanaka M,et al.Ontogency of somatostatin-staining neuron system of the rat:immunohistochemical analysis Ⅱ.forebrain and diencephalon[J].J Comp Neurol,1982,204(4):211-224.
, http://www.100md.com
[7]王福庄,丁爱石,张崇理.新生大鼠培养细胞LH-RH免疫组化观察[J].细胞生物学杂志,1994,16(3):134~137.
[8]Barry J,Croix D.Immunofluorescene study of the hypothalamo-infundibular LRH tract and serum gonadotropin levels in the female squirrel monkey during the estrous cycle[J].Cell Tissue Res,1978,192(2):215-226.
[9]Renaud LP,martin JB,Brazeau P.Depressant action of TRH,LH-RH and somtosatatin of activity of central neurons[J].Nature,1975,255(5505):233-235.
【收稿日期】1999-11-15 【修稿日期】2000-01-25, 百拇医药