Aβ31-35和ApoE4对体外大鼠基底前脑神经元存活和生长的协同作用
作者:郭文平 阮奕文 周丽华 谢瑶 姚志彬
单位:郭文平(中山医科大学人体解剖学教研室,脑研究室,广州 510089);阮奕文(中山医科大学人体解剖学教研室,脑研究室,广州 510089);周丽华(中山医科大学人体解剖学教研室,脑研究室,广州 510089);谢瑶(中山医科大学人体解剖学教研室,脑研究室,广州 510089);姚志彬(中山医科大学人体解剖学教研室,脑研究室,广州 510089)
关键词:β-淀粉样蛋白;载脂蛋白E4;基底前脑;胆碱能神经元
解剖学报000301 【摘要】 目的 探讨β-淀粉样蛋白(Aβ)和载脂蛋白(ApoE4)对基底前脑神经元存活和生长的影响,研究Alzheimer病(AD)发病的细胞分子机制。 方法 体外培养基底前脑神经细胞,MTT法和免疫细胞化学方法结合体视学分析,观察Aβ31-35和ApoE4对基底前脑神经元存活及胞体和突起生长的影响。 结果 (1)MTT法测得的Aβ-31-35+ApoE4组的A值,与对照组比较明显减小(P<0.05),说明神经元的存活力降低,存活数量减少;(2)Aβ31-35+ApoE4组的神经元胞体最长径和最短径明显低于对照组和ApoE4组(P<0.05);平均突起长度也明显低于对照组、ApoE4组和A β31-35(10μmol/L)组(P<0.01);(3)Aβ31-35(20μmol/L)组平均突起长度比对照组、ApoE4组和Aβ31-35(10μmol/L)组明显减小(P<0.01);(4)Aβ31-35+ApoE4组和Aβ31-35(20μmol/L)组的胆碱能神经元最长突起长度、总突起长度及平均突起长度均明显低于对照组(P<0.01);且这两组的ChAT阳性神经元的胞体平均灰度也明显低于对照组(P<0.05),说明ChAT的活性下降。单独ApoE4对基底前脑神经元的存活和生长均无明显影响。 结论 Aβ31-35+ApoE4比单独Aβ31-35对神经元存活及胞体和突起生长的抑制作用要强,结果提示ApoE4可能有协同Aβ31-35的神经毒性效应的作用。
, http://www.100md.com
【中图分类号】 R329.2+4 【文献标识码】 A 【文章编号】 0529-1356(2000)03-193
COMBINED EFFECTS OF Aβ31-35 AND ApoE4 ON NEURONAL
SURVIVAL AND GROWTH OF THE BASAL FOREBRAIN
in vitro IN THE RAT
GUO Wen-ping, RUAN Yi-wen, ZHOU Li-hua, XIE Yao, YAO Zhi-bin*
(Division of Brain Research,Department of Anatomy,Sun Yat-Sen University of Medical Sciences,Guangzhou 510089,China)
, 百拇医药
【Abstract】 Objective In order to explore the combined effects of β-amyloid protein(Aβ) and apolipoprotein E4(ApoE4) on neurons in the basal forebrain in rat. Methods The survival and growth of cultured neurons were measured by MTT assay and immunocytochemistry combined with morphometry. Results (1)The average A values of group Aβ31-35+ApoE4 were lower than that of the control(P<0.05),which showed that the viability and number of neurons were decreased;(2)The average maximum and minimum diameter of neurons in group Aβ31-35+ApoE4 and group Aβ31-35(20μmol/L)were decreased as compared with those of control and group ApoE4(P<0.05);(3)The average neurite length of group Aβ31-35+ApoE4 and group Aβ31-35(20μmol/L) were decreased significantly as compared with that of control, group ApoE4 and group Aβ-31-35(10μmol/L)(P<0.01);(4)The longest process length,the total neurite length,the average neurite and the average gray degrees of ChAT-positive neurons were decreased significantly in group Aβ-31-35+ApoE4 and group Aβ31-35(20μmol/L) as compared with those of control(P<0.05),the decrease of the gray degrees of ChAT-positive neurons indicated that Aβ31-35+ApoE4 and Aβ31-35 reduced choline acetyltransferase activity(ChAT).ApoE4 had no significant effect on survival and morphology of the basal forebrain neurons. Conclusion The combination of Aβ31-35 with ApoE4 is more neurotoxic than that of Aβ31-35 alone,which implies that ApoE4 may play an important role in enhancing the neurotoxicity of Aβ31-35.
, 百拇医药
【Key words】 Beta amyloid protein(31-35); Apolipoprotein E4; Basal forebrain; Cholinergic neurons
β-淀粉样蛋白(β-amyloid protein,Aβ)是老年斑(senile plaques,SP)的主要成分之一,是由39~43个氨基酸组成的多肽。SP是构成老年性痴呆(Alzheimer disease,AD)病人脑中神经病理改变的主要成分。它在脑内的产生和沉积与AD的病理过程有着密切的联系,其确切机制还不清楚。研究表明不同片段的Aβ在不同的生理状态和条件下有不同的生物活性——神经营养和神经毒性作用[1,2]。载脂蛋白E4(apolipoprotein E type 4 allele,ApoE4)是晚发家族性AD和散发性AD的主要危险因子,在SP中也证实有ApoE4的沉积[3],它在AD发病中的作用还有待于阐明。体外研究显示,ApoE4易与Aβ结合形成一难溶复合物[4]。目前对它们相互结合机制的研究较多,但两者共同作用对神经元影响的研究较少,尤其是对基底前脑胆碱能神经元的作用未见文献报道。故本实验通过从体外来研究Aβ31-35和ApoE4对培养的大鼠基底前脑神经元存活和生长的影响,为揭示它们在AD病理中的作用提供资料。
, 百拇医药
材料和方法
1. 动物和试剂
孕18~20d的SD大鼠(由中山医科大学动物中心提供),单克隆抗神经丝抗体,胆碱乙酰转移酶(ChAT)抗体、Aβ(31-35)、MTT、多聚赖氨酸、ApoE4(均为Sigma公司产),胎牛血清(杭州四季青生物工程公司产),DMEM/F12(GiBCO公司产)。
2. 神经元的培养
戊巴比妥钠(40mg/kg)经腹腔麻醉SD孕鼠,在无菌操作下取出胎鼠,分离出基底前脑,置于盛有D-Hank液的青霉素瓶中,将组织剪碎,加入0.125%的胰蛋白酶,消化15~20min,用含有15%胎牛血清的DMEM/F12培养基终止消化,经悬浮、离心、过滤后收集细胞,按1×105个细胞/毫升的密度接种在预先涂有多聚赖氨酸的96孔板内;按2×105个细胞/毫升的密度接种在24孔培养板内的盖玻片上(0.8×0.8cm2),待细胞贴壁后换含B27添加剂的无血清培养基。将细胞分组并分别加入等体积的5mg/L、10mg/L、20mg/L的ApoE4,10μmol/L、20μmol/L的Aβ(31-35),ApoE4(10mg/L)+Aβ31-35(10μmol/L)及ApoE4(10mg/L)+Aβ31-35(20μmol/L)试剂。对照组以等量的无血清培养基替代,置于37℃、5%CO2培养箱中培养。96孔板中的神经元培养48h,用于测量神经元的存活;24孔板中的神经元培养4d,用于形态学观察神经元胞体和突起的生长。另24孔板中的神经元培养10d(每3d换1次含有等量试剂的培养基,并加入阿糖胞苷,抑制非神经元的生长和增殖),用于观察胆碱能神经元的生长。
, 百拇医药
3. 培养神经元的鉴定及胆碱能神经元的染色
用抗神经丝抗体(1∶120)标记培养4d的基底前脑神经元,用ChAT抗体(1∶250)标记培养10d的胆碱能神经元,上述标记均用免疫组织化学ABC法。
4. Aβ31-35的“老化”处理
将1mg的Aβ31-35溶解在1ml的双蒸水中,经0.22μm滤器过滤除菌后,置于37℃恒温箱内孵育4~7d,即为老化状态。
5. 快速自动比色微量分析(MTT比色微量分析)
四唑氮盐[3-(4,5-dimethylthiazol-2-y1)-2,5-diphenyltetrazolium bromide,MTT]。终止培养前4h,每孔加入10μl MTT(1.5g/L DMEM)继续培养,4h后每孔加入100μl 0.08mol/L的盐酸-异丙醇溶液终止反应,吹打蓝色颗粒产物匀后,将96孔培养板置于酶标仪下,采用实验波长为570nm和参考波长为630nm,测量每孔样品中MTT阳性产物的光密度值(A值)。
, 百拇医药
6. 图像分析和统计学分析
采用德国KONTRON公司IBAS Rel,2.0图像分析系统测量神经元胞体的最长径、最短径和突起长度及ChAT阳性神经元胞体的灰度、最长突起长度、总突起长度。统计学分析,分别用参数检验和非参数检验,两两比较用Newman-kenls检验,非齐性检验用F检验,以0.05和0.01为显著性标准。
结果
1. Aβ31-35和ApoE4对基底前脑神经元存活的影响
神经元存活力是通过测定MTT在线粒体脱氢酶代谢过程中形成的有色产物的A值来评价,A值高反映了神经元存活力强,存活数量多。MTT法测量结果显示:Aβ31-35和ApoE4单独作用各组测定的A值与对照组比较无明显差异。Aβ31-35(10μmol/L)+ApoE4(10μmol/L)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)两组测得的A值分别为0.172±0.021,0.155±0.014,比对照组(0.208±0.018)低,有显著差异(P<0.05),说明Aβ31-35+ApoE4对基底前脑神经元存活有抑制作用(图1,2a,2b)。
, 百拇医药
图1 Aβ31-35和ApoE4作用于培养的基底前脑神经元48h,神经元存活的情况 *表示与对照组比较有显著性差异(P<0.05)
Fig.1 The change of the A values of neurons treated with Aβ31-35 and ApoE4 for 48h relative to viability of cells by MTT assay* compared with control P<0.05
2. Aβ31-35和ApoE4对培养基底前脑神经元生长的影响
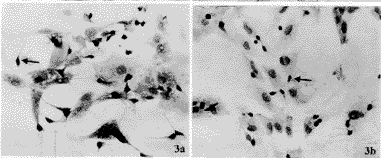
由表1可见,Aβ31-35(20μmol/L)组、Aβ31-35+ApoE4的两个浓度组的胞体最长径、最短径明显小于对照组、ApoE4组(P<0.05);平均突起长度显著小于对照组、ApoE4组及Aβ31-35(10μmol/L)组(P<0.01)。结果表明Aβ31-35(20μmol/L)和Aβ31-35+ApoE4对神经元胞体的发育有抑制作用,而且对神经元的突起生长也有显著抑制作用,见图3a,b,c。
, 百拇医药
3. Aβ31-35和ApoE4对培养基底前脑胆碱能神经元生长的影响
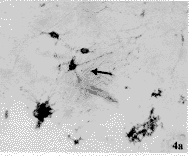
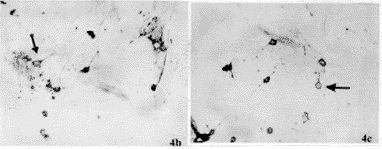
由表2显示:Aβ31-31(20μmol/L)和Aβ31-35(20μmol/L)+ApoE4(10μg/ml)使培养10d的基底前脑胆碱能神经元最长突起长度、突起总长度、平均突起长度比对照组明显减少(P<0.01),ChAT阳性神经元胞体的平均灰度也明显低于对照组(P<0.05),结果表明Aβ31-35(20μmol/L)和Aβ31-35+ApoE4对胆碱能神经元突起生长和发出的突起数量及ChAT的活性均有明显的抑制作用,见图4a,b,c。
表1 Aβ31-35和ApoE4对培养4d基底前脑神经元生长的影响(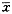 ±s,μm n=80)
±s,μm n=80)
Table 1 The effect of Aβ31-35 and ApoE4 on growth of
, http://www.100md.com
neurons in the basal forebrain after treatment
for 4d(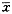 ±s,μm n=80)
±s,μm n=80)
胞体最长径the maximum
diameter
胞体最短径
the minimum
diameter
平均突起长度
the average
, 百拇医药 neurite length
对照组(control)
13.91±2.80
7.98±1.55
28.95± 8.72
ApoE4(10mg/L)
13.85±3.49
7.37±1.45
26.69± 6.02
Aβ31-35(10μmol/L)
13.21±2.04
, 百拇医药
7.04±1.50
26.93±11.52
Aβ31-35(20μmol/L)
12.54±2.71*
6.16±1.04*
23.67± 8.01**
Aβ31-35(10μmol/L)+ApoE4(10μg/ml)
12.18±2.47*
6.56±1.09*
, http://www.100md.com 23.54± 5.57**Δ
Aβ31-35(20μmol/L)
+ApoE4(10mg/L)
11.94±2.42*
6.13±1.19*
21.98± 5.62**Δ
*示与对照组和ApoE4组比较有显著性差异,P<0.05
**示与对照组和ApoE4组比较差异有高度显著性,P<0.01
Δ示与Aβ31-35(10μmol/L)组比较差异有高度显著性,P<0.01
, http://www.100md.com
*Compared with control and group ApoE4,P<0.05
**Compared with control and group ApoE4,P<0.01
ΔCompared with group Aβ31-35(10μmol/L),P<0.01表2 Aβ31-35+ApoE4对培养10d基底前脑胆碱能神经元生长的影响(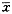 ±s,n=60)
±s,n=60)
Table 2 The effect of Aβ31-35+ApoE4 on growth of cholinergic neurons in the basal forebrain for 10d in culture(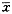 ±s,n=60)
±s,n=60)
, 百拇医药
突起长度(length of process)(μm)
胞体平均灰度
the average grey degree
最长突起the longest process length
总突起
the total process length
平均突起
the average process length
对照组(control)
51.68±9.57
, 百拇医药
2115.60±14.34
35.26±14.32
110.73±4.06
Aβ31-35(20μmol/L)
45.15±12.19*
1663.21±14.62*
28.19±14.62*
106.16±4.37*
Aβ31-35(20μmol/L)+ApoE4(10mg/L)
, 百拇医药 43.93±6.60**
1505.68±14.39*
25.52±14.39**
104.04±4.92*
*示与对照组比较差异有显著性,P<0.05
**示与对照组比较有高度显著性差异,P<0.01
*Compared with control,P<0.05
** Compared with control, P<0.01
讨论
, 百拇医药
1. Aβ31-35对基底前脑神经元存活和生长的作用及其机制
基底前脑是AD神经病变的敏感脑区,其胆碱能神经元丢失程度和老年斑(SP)分布的密度均非常高,且AD患者脑内ChAT活性也明显降低[5]。本实验以Aβ31-35片段经过“老化”处理后,作用于体外培养的基底前脑神经元48h,发现Aβ31-35对培养初期神经元的存活无抑制作用,这与其他体外实验结果相似[6],可能是因为培养初期的神经元具有较强的适应性和可塑性。培养4d,Aβ31-35浓度为10μmol/L时对基底前脑神经元的胞体及突起的生长无明显影响。但Aβ(31-35)为20μmol/L时,对基底前脑神经元的胞体和突起生长均有抑制作用。说明随培养时间的延长,且在较高浓度下,Aβ31-35对培养的基底前脑神经元呈现了神经毒性作用。Pike等[7]把高浓度Aβ1-40孵育老化后,作用海马神经元产生毒性作用,而可溶性的Aβ1-40无毒性作用。Aβ溶液为β-折叠、α-螺旋和自由缠绕的混合形式,Aβ的老化可促使α-螺旋转变成β-折叠形式,与SP中Aβ结构形式相似。从AD患者脑内提取的Aβ注入大鼠的海马和皮层均引起了类似AD的神经元变性。因此,聚集状态是Aβ产生神经毒性的基础。在衰老过程中缺血、自由基[8]、金属离子[9]等都可以促进Aβ的聚集。关于Aβ对培养基底前脑胆碱能神经元作用的文献未见报道。因此,我们将基底前脑神经元继续培养至第10d,作ChAT免疫组织化学发现“老化”的Aβ31-35对培养的基底前脑胆碱能神经元突起生长有明显抑制作用,且使胞体内胆碱乙酰化酶活性显著下降。说明Aβ31-35对基底前脑胆碱能神经元也具有毒性作用。Harkany等[10]把Aβ1-42注射至大鼠的基底前脑Meynert基底核,发现同侧大脑皮质的乙酰胆碱脂酶(AchE)和胆碱乙酰转移酶(ChAT)活性下降,胆碱能神经纤维发生溃变。可见Aβ能选择性地损伤胆碱能神经元,这可能构成AD患者记忆力下降的病理基础。多数实验已证实Aβ1-40和Aβ25-35氨基酸片段有毒性作用,而Aβ31-35片段包含在它们序列之内,由此我们推断Aβ31-35可能是Aβ产生神经毒性的主要部位。Aβ产生毒性作用的机制可能是(1)与细胞表面非特异性或特异性的受体结合,直接损伤或杀死培养的神经元;(2)Aβ本身无神经毒性产生,但它可以促使神经元对各种损害(如兴奋性毒性、低血糖及过氧化物等损伤)产生易感性。Aβ作用于Tachykinin受体,引起Ca2+选择性通道开放,导致Ca2+内流增加,使损伤阈值降低。Harkany[11]等也证实钙结合蛋白在防止由Aβ1-42诱发的细胞内Ca2+升高而产生的胆碱能神经毒性作用方面可能起着重要的作用。
, 百拇医药
2. Aβ(31-35)+ApoE4协同作用的毒性机制
ApoE是一种载脂蛋白,存在于多种脂蛋白颗粒中,不仅在调解脂质代谢,维持胆固醇平衡方面起着重要作用,同时也参与神经系统损伤后的修复过程。近来发现,ApoE与AD关系密切,尤其是ApoE4基因被认为是AD的易感基因。我们在观察ApoE4和Aβ31-35单一作用于神经元的同时,也着重观察了两者的共同作用,发现ApoE4+Aβ31-35明显抑制基底前脑神经元中MTT阳性反应产物,说明神经细胞内的线粒体内膜功能可能受到损害,造成细胞能量代谢障碍,从而导致神经元的死亡,而且对神经元的胞体和突起的生长均有明显抑制作用。同时对基底前脑胆碱能神经元的突起生长和ChAT活性也均有显著性抑制作用。ApoE4和Aβ31-35(10μmol/L)单独作用神经元时却无明显毒性作用,说明ApoE4对Aβ31-35毒性效应可能具有协同作用。胆碱能神经元突起总长度的减少也间接反映了神经元发出的突起数目的减少,提示神经元损伤的同时也失去了代偿能力,这也从一方面解释了AD病变渐进性不可逆改变的一个原因。我们的实验表明,ApoE4+Aβ31-35的毒性效应发挥时间早、强度大,神经元功能的改变可能早于形态的改变。为什么ApoE4能协同Aβ31-35毒性效应?目前认为老年斑的形成过程依赖于“核心”的形成,ApoE4可能通过加速“核心”的形成促进淀粉样蛋白的形成。ApoE4-Aβ复合物可能作为“异源核心”激发Aβ快速聚合。实验证实ApoE4能高亲和力地结合Aβ,并形成能够耐受SDS沸水的复合物[12]。由于ApoE4在112位上的氨基酸不同,不能通过双硫键部分形成二聚体,因此,ApoE4对Aβ沉积的抑制强度较弱,对“核心的形成”无效或低效的抑制,则导致了SP的快速沉积,加速了对神经元的损害,放大了Aβ的毒性作用。我们的结果为理解为什么带有ApoE4基因的AD病人发病年龄早、生存期缩短提供了实验依据。
, 百拇医药
本实验承蒙袁群芳老师在技术上的大力协助,在此表示衷心感谢。
本文图2a~4c见插图第1页

图版说明
图2 基底前脑神经元培养48h时,对照组(图2a)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)组(图2b)神经元MTT阳性反应产物的比较,图2b中神经元MTT阳性反应产物比图2a多。倒置相差显微镜 ×200
, 百拇医药
图3 基底前脑神经元培养4d,对照组(图3a)、Aβ31-35(20μmol/L)组(图3b)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)组(图3c)的神经元胞体大小和突起长度的比较,图3a中的神经元胞体和突起比图3b和图3c中的神经元胞体大、突起长。(抗神经丝免疫组织化学染色) ×20
图4 胆碱能神经元培养10d,对照组(图4a)、Aβ31-35(20μmol/L)组(图4b)和A31-35(20μmol/L)+ApoE4(10μg/ml)组(图4c)的胆碱能神经元突起长度的比较,图4a比图4b和图4c中的胆碱能神经元最长突起长、突起的数目多、ChAT染色深。(ChAT免疫组织化学染色) ×20
Explanation of figures
Fig.2 Showing MTT positive products of the basal forebrain neurons in cultures after treated with Aβ31-35 and ApoE4 for 48h.a,control;b,group Aβ31-35+ApoE4.MTT positive products of neurons in normal control are richer than those of group Aβ31-35+ApoE4 phase-contrast microscopy. ×200
, http://www.100md.com
Fig.3 Arrow shows anti-neurofilament positive immunostain of the basal forebrain neurons after treated with Aβ31-35 and ApoE4 for 4d.a,control; b,group Aβ31-35 (20μmol/L);c,group Aβ31-35+ApoE4. ×20
Fig.4 Arrow shows ChAT positive immunostain of cholinergic neurons after treated with Aβ31-35 and ApoE4 for 10d.a,control; b,group Aβ31-35 (20μmol/L);c,group Aβ31-35+ApoE4 ×20
【基金项目】国家自然科学基金资助项目(39670224)和广东省自然科学基金资助项目
, http://www.100md.com
【作者简介】 郭文平(1968—),男(汉族),甘肃省人,医学硕士,讲师,现在石河子大学医学院解剖学教研室工作,832002
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Le WD,Wen JX,Kong R,et al.β-protein-induced neurotoxity of a phybrid septal cell line associated with increased Tau phosphorylation and expression of β-amyloid precursor protein[J].J Neurodism,1997,69(3):978-985.
[2]Yankner BA,Duffy LK,Kirschner DA,et al.Neurotoxicity of a fragment of the amyloid precursor assoriated with Alzhemier disease[J].Science,1990,250(4978):279-282.
, http://www.100md.com
[3]Namba Y,Tomonaga M,Lesley R,et al.Apolipoprotein E immunoreactivity in cerebral amyloid deposits and neurofibrillary tangles in Alzheimer disease and kur plaque amyloid in Creutzfeldt-Jakob disease[J].Brain Res,1991,54(1)1:163-166.
[4]Yanker BA,Dawes LR.Neurotoxicity of a fragment of the amyloid precursor associated with Alzheimer disease[J].Science,1989,245(4916):417-420.
[5]Bird TD,Strancham S,Sumi SM,et al.Alzheimer disease:choline acetyltransferase activity in brain tissue from clinical and pathological subgroups[J].Amm Neurol,1983,14(3):284-293.
, 百拇医药
[6]Travis J.New piece in Alzheimer disease puzzle[J].Science,1993,261(5123):828-829.
[7]Pike CJ,Walencewicz AJ,Glabe CG,et al.In vitro aging of β-amyloid protein causes peptedes aggregation and neurotoxicity[J].Brain Res,1991,563(1-2):311-314.
[8]Behl C,Davis JB,Lesley R,et al.Hydrogen peroxide mediates amyloid protein toxicity[J].Cell,1994,77(6):817-827.
[9]Mantyh PW,Ghilorrdi JR,Roger S,et al.Aluminum,iron,and zinc ions promote aggregation of physiological concentrations of beta-amyloid peptide[J].J Neurochem,1993,61(3):1171-1174.
, http://www.100md.com
[10]Harkany T,Lengyel Z,Soos K,et al.Cholinotoxic effects of beta-amyloid(1-42)peptide on cortical projections of the rat nucleus basalis magnonocellularis[J].Brain Res,1995,695(1):71-75.
[11]Harkany T,De-Jong CI,Soos K,et al.Beta-amyloid(1-42)affects cholinergic but parvalbumin-containing neurons in the septal complex of the rat[J].Brain Res,1995,698(1-2):270-274.
[12]Bush AI,Pettingell W,de Paradis M,et al.The amyloid beta-protein precursor and its mammalian homologues.Evidence for a zinc-modulated heparin-binding superfamily[J].J Bio Chem,1994,269(43):26618-26621.
【收稿日期】1999-04-02 【修稿日期】1999-12-07, 百拇医药
单位:郭文平(中山医科大学人体解剖学教研室,脑研究室,广州 510089);阮奕文(中山医科大学人体解剖学教研室,脑研究室,广州 510089);周丽华(中山医科大学人体解剖学教研室,脑研究室,广州 510089);谢瑶(中山医科大学人体解剖学教研室,脑研究室,广州 510089);姚志彬(中山医科大学人体解剖学教研室,脑研究室,广州 510089)
关键词:β-淀粉样蛋白;载脂蛋白E4;基底前脑;胆碱能神经元
解剖学报000301 【摘要】 目的 探讨β-淀粉样蛋白(Aβ)和载脂蛋白(ApoE4)对基底前脑神经元存活和生长的影响,研究Alzheimer病(AD)发病的细胞分子机制。 方法 体外培养基底前脑神经细胞,MTT法和免疫细胞化学方法结合体视学分析,观察Aβ31-35和ApoE4对基底前脑神经元存活及胞体和突起生长的影响。 结果 (1)MTT法测得的Aβ-31-35+ApoE4组的A值,与对照组比较明显减小(P<0.05),说明神经元的存活力降低,存活数量减少;(2)Aβ31-35+ApoE4组的神经元胞体最长径和最短径明显低于对照组和ApoE4组(P<0.05);平均突起长度也明显低于对照组、ApoE4组和A β31-35(10μmol/L)组(P<0.01);(3)Aβ31-35(20μmol/L)组平均突起长度比对照组、ApoE4组和Aβ31-35(10μmol/L)组明显减小(P<0.01);(4)Aβ31-35+ApoE4组和Aβ31-35(20μmol/L)组的胆碱能神经元最长突起长度、总突起长度及平均突起长度均明显低于对照组(P<0.01);且这两组的ChAT阳性神经元的胞体平均灰度也明显低于对照组(P<0.05),说明ChAT的活性下降。单独ApoE4对基底前脑神经元的存活和生长均无明显影响。 结论 Aβ31-35+ApoE4比单独Aβ31-35对神经元存活及胞体和突起生长的抑制作用要强,结果提示ApoE4可能有协同Aβ31-35的神经毒性效应的作用。
, http://www.100md.com
【中图分类号】 R329.2+4 【文献标识码】 A 【文章编号】 0529-1356(2000)03-193
COMBINED EFFECTS OF Aβ31-35 AND ApoE4 ON NEURONAL
SURVIVAL AND GROWTH OF THE BASAL FOREBRAIN
in vitro IN THE RAT
GUO Wen-ping, RUAN Yi-wen, ZHOU Li-hua, XIE Yao, YAO Zhi-bin*
(Division of Brain Research,Department of Anatomy,Sun Yat-Sen University of Medical Sciences,Guangzhou 510089,China)
, 百拇医药
【Abstract】 Objective In order to explore the combined effects of β-amyloid protein(Aβ) and apolipoprotein E4(ApoE4) on neurons in the basal forebrain in rat. Methods The survival and growth of cultured neurons were measured by MTT assay and immunocytochemistry combined with morphometry. Results (1)The average A values of group Aβ31-35+ApoE4 were lower than that of the control(P<0.05),which showed that the viability and number of neurons were decreased;(2)The average maximum and minimum diameter of neurons in group Aβ31-35+ApoE4 and group Aβ31-35(20μmol/L)were decreased as compared with those of control and group ApoE4(P<0.05);(3)The average neurite length of group Aβ31-35+ApoE4 and group Aβ31-35(20μmol/L) were decreased significantly as compared with that of control, group ApoE4 and group Aβ-31-35(10μmol/L)(P<0.01);(4)The longest process length,the total neurite length,the average neurite and the average gray degrees of ChAT-positive neurons were decreased significantly in group Aβ-31-35+ApoE4 and group Aβ31-35(20μmol/L) as compared with those of control(P<0.05),the decrease of the gray degrees of ChAT-positive neurons indicated that Aβ31-35+ApoE4 and Aβ31-35 reduced choline acetyltransferase activity(ChAT).ApoE4 had no significant effect on survival and morphology of the basal forebrain neurons. Conclusion The combination of Aβ31-35 with ApoE4 is more neurotoxic than that of Aβ31-35 alone,which implies that ApoE4 may play an important role in enhancing the neurotoxicity of Aβ31-35.
, 百拇医药
【Key words】 Beta amyloid protein(31-35); Apolipoprotein E4; Basal forebrain; Cholinergic neurons
β-淀粉样蛋白(β-amyloid protein,Aβ)是老年斑(senile plaques,SP)的主要成分之一,是由39~43个氨基酸组成的多肽。SP是构成老年性痴呆(Alzheimer disease,AD)病人脑中神经病理改变的主要成分。它在脑内的产生和沉积与AD的病理过程有着密切的联系,其确切机制还不清楚。研究表明不同片段的Aβ在不同的生理状态和条件下有不同的生物活性——神经营养和神经毒性作用[1,2]。载脂蛋白E4(apolipoprotein E type 4 allele,ApoE4)是晚发家族性AD和散发性AD的主要危险因子,在SP中也证实有ApoE4的沉积[3],它在AD发病中的作用还有待于阐明。体外研究显示,ApoE4易与Aβ结合形成一难溶复合物[4]。目前对它们相互结合机制的研究较多,但两者共同作用对神经元影响的研究较少,尤其是对基底前脑胆碱能神经元的作用未见文献报道。故本实验通过从体外来研究Aβ31-35和ApoE4对培养的大鼠基底前脑神经元存活和生长的影响,为揭示它们在AD病理中的作用提供资料。
, 百拇医药
材料和方法
1. 动物和试剂
孕18~20d的SD大鼠(由中山医科大学动物中心提供),单克隆抗神经丝抗体,胆碱乙酰转移酶(ChAT)抗体、Aβ(31-35)、MTT、多聚赖氨酸、ApoE4(均为Sigma公司产),胎牛血清(杭州四季青生物工程公司产),DMEM/F12(GiBCO公司产)。
2. 神经元的培养
戊巴比妥钠(40mg/kg)经腹腔麻醉SD孕鼠,在无菌操作下取出胎鼠,分离出基底前脑,置于盛有D-Hank液的青霉素瓶中,将组织剪碎,加入0.125%的胰蛋白酶,消化15~20min,用含有15%胎牛血清的DMEM/F12培养基终止消化,经悬浮、离心、过滤后收集细胞,按1×105个细胞/毫升的密度接种在预先涂有多聚赖氨酸的96孔板内;按2×105个细胞/毫升的密度接种在24孔培养板内的盖玻片上(0.8×0.8cm2),待细胞贴壁后换含B27添加剂的无血清培养基。将细胞分组并分别加入等体积的5mg/L、10mg/L、20mg/L的ApoE4,10μmol/L、20μmol/L的Aβ(31-35),ApoE4(10mg/L)+Aβ31-35(10μmol/L)及ApoE4(10mg/L)+Aβ31-35(20μmol/L)试剂。对照组以等量的无血清培养基替代,置于37℃、5%CO2培养箱中培养。96孔板中的神经元培养48h,用于测量神经元的存活;24孔板中的神经元培养4d,用于形态学观察神经元胞体和突起的生长。另24孔板中的神经元培养10d(每3d换1次含有等量试剂的培养基,并加入阿糖胞苷,抑制非神经元的生长和增殖),用于观察胆碱能神经元的生长。
, 百拇医药
3. 培养神经元的鉴定及胆碱能神经元的染色
用抗神经丝抗体(1∶120)标记培养4d的基底前脑神经元,用ChAT抗体(1∶250)标记培养10d的胆碱能神经元,上述标记均用免疫组织化学ABC法。
4. Aβ31-35的“老化”处理
将1mg的Aβ31-35溶解在1ml的双蒸水中,经0.22μm滤器过滤除菌后,置于37℃恒温箱内孵育4~7d,即为老化状态。
5. 快速自动比色微量分析(MTT比色微量分析)
四唑氮盐[3-(4,5-dimethylthiazol-2-y1)-2,5-diphenyltetrazolium bromide,MTT]。终止培养前4h,每孔加入10μl MTT(1.5g/L DMEM)继续培养,4h后每孔加入100μl 0.08mol/L的盐酸-异丙醇溶液终止反应,吹打蓝色颗粒产物匀后,将96孔培养板置于酶标仪下,采用实验波长为570nm和参考波长为630nm,测量每孔样品中MTT阳性产物的光密度值(A值)。
, 百拇医药
6. 图像分析和统计学分析
采用德国KONTRON公司IBAS Rel,2.0图像分析系统测量神经元胞体的最长径、最短径和突起长度及ChAT阳性神经元胞体的灰度、最长突起长度、总突起长度。统计学分析,分别用参数检验和非参数检验,两两比较用Newman-kenls检验,非齐性检验用F检验,以0.05和0.01为显著性标准。
结果
1. Aβ31-35和ApoE4对基底前脑神经元存活的影响
神经元存活力是通过测定MTT在线粒体脱氢酶代谢过程中形成的有色产物的A值来评价,A值高反映了神经元存活力强,存活数量多。MTT法测量结果显示:Aβ31-35和ApoE4单独作用各组测定的A值与对照组比较无明显差异。Aβ31-35(10μmol/L)+ApoE4(10μmol/L)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)两组测得的A值分别为0.172±0.021,0.155±0.014,比对照组(0.208±0.018)低,有显著差异(P<0.05),说明Aβ31-35+ApoE4对基底前脑神经元存活有抑制作用(图1,2a,2b)。

, 百拇医药
图1 Aβ31-35和ApoE4作用于培养的基底前脑神经元48h,神经元存活的情况 *表示与对照组比较有显著性差异(P<0.05)
Fig.1 The change of the A values of neurons treated with Aβ31-35 and ApoE4 for 48h relative to viability of cells by MTT assay* compared with control P<0.05
2. Aβ31-35和ApoE4对培养基底前脑神经元生长的影响
由表1可见,Aβ31-35(20μmol/L)组、Aβ31-35+ApoE4的两个浓度组的胞体最长径、最短径明显小于对照组、ApoE4组(P<0.05);平均突起长度显著小于对照组、ApoE4组及Aβ31-35(10μmol/L)组(P<0.01)。结果表明Aβ31-35(20μmol/L)和Aβ31-35+ApoE4对神经元胞体的发育有抑制作用,而且对神经元的突起生长也有显著抑制作用,见图3a,b,c。
, 百拇医药
3. Aβ31-35和ApoE4对培养基底前脑胆碱能神经元生长的影响
由表2显示:Aβ31-31(20μmol/L)和Aβ31-35(20μmol/L)+ApoE4(10μg/ml)使培养10d的基底前脑胆碱能神经元最长突起长度、突起总长度、平均突起长度比对照组明显减少(P<0.01),ChAT阳性神经元胞体的平均灰度也明显低于对照组(P<0.05),结果表明Aβ31-35(20μmol/L)和Aβ31-35+ApoE4对胆碱能神经元突起生长和发出的突起数量及ChAT的活性均有明显的抑制作用,见图4a,b,c。
表1 Aβ31-35和ApoE4对培养4d基底前脑神经元生长的影响(
 ±s,μm n=80)
±s,μm n=80)Table 1 The effect of Aβ31-35 and ApoE4 on growth of
, http://www.100md.com
neurons in the basal forebrain after treatment
for 4d(
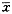 ±s,μm n=80)
±s,μm n=80)胞体最长径the maximum
diameter
胞体最短径
the minimum
diameter
平均突起长度
the average
, 百拇医药 neurite length
对照组(control)
13.91±2.80
7.98±1.55
28.95± 8.72
ApoE4(10mg/L)
13.85±3.49
7.37±1.45
26.69± 6.02
Aβ31-35(10μmol/L)
13.21±2.04
, 百拇医药
7.04±1.50
26.93±11.52
Aβ31-35(20μmol/L)
12.54±2.71*
6.16±1.04*
23.67± 8.01**
Aβ31-35(10μmol/L)+ApoE4(10μg/ml)
12.18±2.47*
6.56±1.09*
, http://www.100md.com 23.54± 5.57**Δ
Aβ31-35(20μmol/L)
+ApoE4(10mg/L)
11.94±2.42*
6.13±1.19*
21.98± 5.62**Δ
*示与对照组和ApoE4组比较有显著性差异,P<0.05
**示与对照组和ApoE4组比较差异有高度显著性,P<0.01
Δ示与Aβ31-35(10μmol/L)组比较差异有高度显著性,P<0.01
, http://www.100md.com
*Compared with control and group ApoE4,P<0.05
**Compared with control and group ApoE4,P<0.01
ΔCompared with group Aβ31-35(10μmol/L),P<0.01表2 Aβ31-35+ApoE4对培养10d基底前脑胆碱能神经元生长的影响(
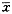 ±s,n=60)
±s,n=60)Table 2 The effect of Aβ31-35+ApoE4 on growth of cholinergic neurons in the basal forebrain for 10d in culture(
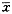 ±s,n=60)
±s,n=60), 百拇医药
突起长度(length of process)(μm)
胞体平均灰度
the average grey degree
最长突起the longest process length
总突起
the total process length
平均突起
the average process length
对照组(control)
51.68±9.57
, 百拇医药
2115.60±14.34
35.26±14.32
110.73±4.06
Aβ31-35(20μmol/L)
45.15±12.19*
1663.21±14.62*
28.19±14.62*
106.16±4.37*
Aβ31-35(20μmol/L)+ApoE4(10mg/L)
, 百拇医药 43.93±6.60**
1505.68±14.39*
25.52±14.39**
104.04±4.92*
*示与对照组比较差异有显著性,P<0.05
**示与对照组比较有高度显著性差异,P<0.01
*Compared with control,P<0.05
** Compared with control, P<0.01
讨论
, 百拇医药
1. Aβ31-35对基底前脑神经元存活和生长的作用及其机制
基底前脑是AD神经病变的敏感脑区,其胆碱能神经元丢失程度和老年斑(SP)分布的密度均非常高,且AD患者脑内ChAT活性也明显降低[5]。本实验以Aβ31-35片段经过“老化”处理后,作用于体外培养的基底前脑神经元48h,发现Aβ31-35对培养初期神经元的存活无抑制作用,这与其他体外实验结果相似[6],可能是因为培养初期的神经元具有较强的适应性和可塑性。培养4d,Aβ31-35浓度为10μmol/L时对基底前脑神经元的胞体及突起的生长无明显影响。但Aβ(31-35)为20μmol/L时,对基底前脑神经元的胞体和突起生长均有抑制作用。说明随培养时间的延长,且在较高浓度下,Aβ31-35对培养的基底前脑神经元呈现了神经毒性作用。Pike等[7]把高浓度Aβ1-40孵育老化后,作用海马神经元产生毒性作用,而可溶性的Aβ1-40无毒性作用。Aβ溶液为β-折叠、α-螺旋和自由缠绕的混合形式,Aβ的老化可促使α-螺旋转变成β-折叠形式,与SP中Aβ结构形式相似。从AD患者脑内提取的Aβ注入大鼠的海马和皮层均引起了类似AD的神经元变性。因此,聚集状态是Aβ产生神经毒性的基础。在衰老过程中缺血、自由基[8]、金属离子[9]等都可以促进Aβ的聚集。关于Aβ对培养基底前脑胆碱能神经元作用的文献未见报道。因此,我们将基底前脑神经元继续培养至第10d,作ChAT免疫组织化学发现“老化”的Aβ31-35对培养的基底前脑胆碱能神经元突起生长有明显抑制作用,且使胞体内胆碱乙酰化酶活性显著下降。说明Aβ31-35对基底前脑胆碱能神经元也具有毒性作用。Harkany等[10]把Aβ1-42注射至大鼠的基底前脑Meynert基底核,发现同侧大脑皮质的乙酰胆碱脂酶(AchE)和胆碱乙酰转移酶(ChAT)活性下降,胆碱能神经纤维发生溃变。可见Aβ能选择性地损伤胆碱能神经元,这可能构成AD患者记忆力下降的病理基础。多数实验已证实Aβ1-40和Aβ25-35氨基酸片段有毒性作用,而Aβ31-35片段包含在它们序列之内,由此我们推断Aβ31-35可能是Aβ产生神经毒性的主要部位。Aβ产生毒性作用的机制可能是(1)与细胞表面非特异性或特异性的受体结合,直接损伤或杀死培养的神经元;(2)Aβ本身无神经毒性产生,但它可以促使神经元对各种损害(如兴奋性毒性、低血糖及过氧化物等损伤)产生易感性。Aβ作用于Tachykinin受体,引起Ca2+选择性通道开放,导致Ca2+内流增加,使损伤阈值降低。Harkany[11]等也证实钙结合蛋白在防止由Aβ1-42诱发的细胞内Ca2+升高而产生的胆碱能神经毒性作用方面可能起着重要的作用。
, 百拇医药
2. Aβ(31-35)+ApoE4协同作用的毒性机制
ApoE是一种载脂蛋白,存在于多种脂蛋白颗粒中,不仅在调解脂质代谢,维持胆固醇平衡方面起着重要作用,同时也参与神经系统损伤后的修复过程。近来发现,ApoE与AD关系密切,尤其是ApoE4基因被认为是AD的易感基因。我们在观察ApoE4和Aβ31-35单一作用于神经元的同时,也着重观察了两者的共同作用,发现ApoE4+Aβ31-35明显抑制基底前脑神经元中MTT阳性反应产物,说明神经细胞内的线粒体内膜功能可能受到损害,造成细胞能量代谢障碍,从而导致神经元的死亡,而且对神经元的胞体和突起的生长均有明显抑制作用。同时对基底前脑胆碱能神经元的突起生长和ChAT活性也均有显著性抑制作用。ApoE4和Aβ31-35(10μmol/L)单独作用神经元时却无明显毒性作用,说明ApoE4对Aβ31-35毒性效应可能具有协同作用。胆碱能神经元突起总长度的减少也间接反映了神经元发出的突起数目的减少,提示神经元损伤的同时也失去了代偿能力,这也从一方面解释了AD病变渐进性不可逆改变的一个原因。我们的实验表明,ApoE4+Aβ31-35的毒性效应发挥时间早、强度大,神经元功能的改变可能早于形态的改变。为什么ApoE4能协同Aβ31-35毒性效应?目前认为老年斑的形成过程依赖于“核心”的形成,ApoE4可能通过加速“核心”的形成促进淀粉样蛋白的形成。ApoE4-Aβ复合物可能作为“异源核心”激发Aβ快速聚合。实验证实ApoE4能高亲和力地结合Aβ,并形成能够耐受SDS沸水的复合物[12]。由于ApoE4在112位上的氨基酸不同,不能通过双硫键部分形成二聚体,因此,ApoE4对Aβ沉积的抑制强度较弱,对“核心的形成”无效或低效的抑制,则导致了SP的快速沉积,加速了对神经元的损害,放大了Aβ的毒性作用。我们的结果为理解为什么带有ApoE4基因的AD病人发病年龄早、生存期缩短提供了实验依据。
, 百拇医药
本实验承蒙袁群芳老师在技术上的大力协助,在此表示衷心感谢。
本文图2a~4c见插图第1页





图版说明
图2 基底前脑神经元培养48h时,对照组(图2a)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)组(图2b)神经元MTT阳性反应产物的比较,图2b中神经元MTT阳性反应产物比图2a多。倒置相差显微镜 ×200
, 百拇医药
图3 基底前脑神经元培养4d,对照组(图3a)、Aβ31-35(20μmol/L)组(图3b)和Aβ31-35(20μmol/L)+ApoE4(10mg/L)组(图3c)的神经元胞体大小和突起长度的比较,图3a中的神经元胞体和突起比图3b和图3c中的神经元胞体大、突起长。(抗神经丝免疫组织化学染色) ×20
图4 胆碱能神经元培养10d,对照组(图4a)、Aβ31-35(20μmol/L)组(图4b)和A31-35(20μmol/L)+ApoE4(10μg/ml)组(图4c)的胆碱能神经元突起长度的比较,图4a比图4b和图4c中的胆碱能神经元最长突起长、突起的数目多、ChAT染色深。(ChAT免疫组织化学染色) ×20
Explanation of figures
Fig.2 Showing MTT positive products of the basal forebrain neurons in cultures after treated with Aβ31-35 and ApoE4 for 48h.a,control;b,group Aβ31-35+ApoE4.MTT positive products of neurons in normal control are richer than those of group Aβ31-35+ApoE4 phase-contrast microscopy. ×200
, http://www.100md.com
Fig.3 Arrow shows anti-neurofilament positive immunostain of the basal forebrain neurons after treated with Aβ31-35 and ApoE4 for 4d.a,control; b,group Aβ31-35 (20μmol/L);c,group Aβ31-35+ApoE4. ×20
Fig.4 Arrow shows ChAT positive immunostain of cholinergic neurons after treated with Aβ31-35 and ApoE4 for 10d.a,control; b,group Aβ31-35 (20μmol/L);c,group Aβ31-35+ApoE4 ×20
【基金项目】国家自然科学基金资助项目(39670224)和广东省自然科学基金资助项目
, http://www.100md.com
【作者简介】 郭文平(1968—),男(汉族),甘肃省人,医学硕士,讲师,现在石河子大学医学院解剖学教研室工作,832002
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Le WD,Wen JX,Kong R,et al.β-protein-induced neurotoxity of a phybrid septal cell line associated with increased Tau phosphorylation and expression of β-amyloid precursor protein[J].J Neurodism,1997,69(3):978-985.
[2]Yankner BA,Duffy LK,Kirschner DA,et al.Neurotoxicity of a fragment of the amyloid precursor assoriated with Alzhemier disease[J].Science,1990,250(4978):279-282.
, http://www.100md.com
[3]Namba Y,Tomonaga M,Lesley R,et al.Apolipoprotein E immunoreactivity in cerebral amyloid deposits and neurofibrillary tangles in Alzheimer disease and kur plaque amyloid in Creutzfeldt-Jakob disease[J].Brain Res,1991,54(1)1:163-166.
[4]Yanker BA,Dawes LR.Neurotoxicity of a fragment of the amyloid precursor associated with Alzheimer disease[J].Science,1989,245(4916):417-420.
[5]Bird TD,Strancham S,Sumi SM,et al.Alzheimer disease:choline acetyltransferase activity in brain tissue from clinical and pathological subgroups[J].Amm Neurol,1983,14(3):284-293.
, 百拇医药
[6]Travis J.New piece in Alzheimer disease puzzle[J].Science,1993,261(5123):828-829.
[7]Pike CJ,Walencewicz AJ,Glabe CG,et al.In vitro aging of β-amyloid protein causes peptedes aggregation and neurotoxicity[J].Brain Res,1991,563(1-2):311-314.
[8]Behl C,Davis JB,Lesley R,et al.Hydrogen peroxide mediates amyloid protein toxicity[J].Cell,1994,77(6):817-827.
[9]Mantyh PW,Ghilorrdi JR,Roger S,et al.Aluminum,iron,and zinc ions promote aggregation of physiological concentrations of beta-amyloid peptide[J].J Neurochem,1993,61(3):1171-1174.
, http://www.100md.com
[10]Harkany T,Lengyel Z,Soos K,et al.Cholinotoxic effects of beta-amyloid(1-42)peptide on cortical projections of the rat nucleus basalis magnonocellularis[J].Brain Res,1995,695(1):71-75.
[11]Harkany T,De-Jong CI,Soos K,et al.Beta-amyloid(1-42)affects cholinergic but parvalbumin-containing neurons in the septal complex of the rat[J].Brain Res,1995,698(1-2):270-274.
[12]Bush AI,Pettingell W,de Paradis M,et al.The amyloid beta-protein precursor and its mammalian homologues.Evidence for a zinc-modulated heparin-binding superfamily[J].J Bio Chem,1994,269(43):26618-26621.
【收稿日期】1999-04-02 【修稿日期】1999-12-07, 百拇医药