与平滑肌细胞联合培养的内皮细胞的抗凝血因子、粘附分子
作者:陈双红 姜宗来 张炎 张传森 李玉泉 丛兴忠
单位:陈双红(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);姜宗来(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);张炎(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);张传森(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);李玉泉(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433)
关键词:血管;内皮细胞;平滑肌细胞;联合培养;前列腺环素;Ⅷ因子相关抗原;粘附分子β1亚族
解剖学报000414 【摘要】 目的 探讨平滑肌细胞对内皮细胞功能的影响,为内皮细胞种植的组织工程学提供理论基础。 方法 模拟血管壁的内层结构及内皮细胞与平滑肌细胞间的相互影响途径,建立内皮细胞与平滑肌细胞接触生长的联合培养模型,用免疫细胞化学、放射免疫学技术和图像分析等方法研究内皮细胞vWF、PGI2、CD29的合成、分泌及表达。 结果 联合培养的内皮细胞的Ⅷ因子相关抗原(vWF)的合成减弱,前列腺环素的分泌增加,整合素β1亚族的表达增强。 结论 联合培养内皮细胞的细胞因子的合成、分泌和表达的变化更有利于其抗凝血及抗应力功能的调节。
, 百拇医药
【中图分类号】 R318.01;R318.11 【文献标识码】 A 【文章编号】 0529-1356(2000)04-347
ANTICOAGULANT FACTORS AND ADEHISION FACTORS
OF ECs CO-CULTURED WITH SMCs
CHEN Shuang-hong JIANG Zong-lai ZHANG Yan ZHANG Chuan-sen LI Yu-quan CONG Xing-zhong
(Department of Anatomy, Institute of Biomedical Engineering,the Second Millitary Medical University, Shanghai 200433,China)
, 百拇医药
【Abstract】 Objective
Effects of smooth muscle cells(SMCs)on function of endothelial cells(ECs) has been studied in order to support the basic theory for tissue engineering to ECs seeding. Methods A new co-culture model of ECs-SMCs which mimicked the interior architecture of vessel and also imitated the interaction patterns between ECs and SMCs was established. Immuno-cytochemistry, radio-immunity and image analysis were applied in the research of synthesis, secretion and expression of von willebrand factor(vWF),prostacycline(PGI2) and integrins β1(CD29)of the ECs. Results The production of vWF reduced, and the releasing of PGI2 and expression of CD29 increased. Conclusion The change of the synthesis, releasing and expression of some factors of the ECs is beneficial to regulating the functions of anticoagulatnt and stress-resistance of the ECs in co-culture model.
, http://www.100md.com
【Key words】 Vessel; Endothelial cells; Smooth muscle cells; Co-culture; Prostacyclin;Von Willebrand factor;Integrins β1
随着生物医学技术的发展,人工生物替代材料在心血管系统疾病治疗中的应用越来越多,改善生物材料与血液的相容性以减少生物材料诱发血栓和钙化形成已成为研究热点。内皮细胞是天然的保护层,种植于人工材料表面的内皮单层可以产生类似的在体效果。然而,内皮细胞种植技术一直存在未解决的问题,即细胞的抗凝血功能明显不足、抗应力能力弱,导致内皮细胞种植的成功率不高。进一步完善人工血管内皮细胞种植技术,是当前组织工程学所面临的一个重要课题。研究表明[1],完整的内皮细胞单层是防止血栓和钙化的前提,内皮细胞合成分泌许多因子,参与凝血和粘附过程。PGI2是至今所知最强的血小板聚集和释放的抑制因子,vWF是血小板粘附于内皮下层所必不可少的因素,β1粘附分子亚族是细胞与基质粘附的主要介导分子。因此,对内皮细胞中vWF、PGI2、β1粘附分子亚族的表达和活性的调节,将直接影响种植内皮细胞局部血栓形成和内皮细胞的粘附能力。国内外已有的研究中,对联合培养条件下,平滑肌细胞如何调节和影响内皮细胞的凝血因子和粘附分子的合成、分泌和表达,尚未见报道。本研究在建立内皮细胞与平滑肌细胞联合培养模型的基础上,对其中内皮细胞的凝血因子和粘附分子作了进一步研究,以探讨平滑肌细胞对内皮细胞功能的影响,为完善人工皮内细胞种植的组织工程学技术提供理论依据。
, 百拇医药
材料和方法
1.内皮细胞和平滑肌细胞的联合培养
新生牛胸主动脉5~10cm,胶原酶(Sigma公司)和胰酶(Sigma公司)混合消化,获取内膜的内皮细胞;胰蛋白酶消化,获取中膜的平滑肌细胞。原代培养,传代至2~10代的平滑肌细胞经胰酶消化,调整细胞浓度到5×104个/ml,种植于PET膜(美国Falcon公司)的外面;在膜的内面以同样的浓度种值2~10代的内皮细胞,然后将PET膜插入配套的6孔培养板(美国Falcon公司)中,进行联合培养[2]。同时以单独培养的内皮细胞和在平滑肌细胞的条件培养基中培养的内皮细胞分别作为对照。
2.内皮细胞Ⅷ因子相关抗原的免疫细胞化学
取2、4、6、8d 3种培养条件下的内皮细胞各1组,PBS洗3遍,4%多聚甲醛固定25~30min,羊血清(Sigma公司)37℃、30min,兔抗人vWF(Sigma公司)37℃、60min,羊抗兔第二抗体(Sigma公司)37℃、60min,A液B液各37℃、30min(ABC试剂盒,华美生物工程公司),DAB呈色。
, 百拇医药
3.内皮细胞前列腺环素(PGI2)的放射免疫检测
传代的内皮细胞,以5×104个/ml的浓度种植于3种培养条件的多孔PET膜上,每个膜孔加培养基2ml,每天收集各组培养基0.6ml,弃去多余培养基,加入新鲜培养基。收集的培养基离心后,置于-20℃冰箱保存,标本收集齐后,按试剂盒操作(6-酮-PGF1a试剂盒,苏州医学院血栓与止血研究所),测定6-酮-PGF1a的含量作为PGI2的含量。
4.内皮细胞整合素β1亚族(CD29)的免疫细胞化学
取上述3种培养条件下8~72h生长的内皮细胞各1组,PBS洗3遍,4%的多聚甲醛固定后,羊血清(深圳晶美生物工程公司分装)37℃、30min,鼠抗人CD29抗体(深圳晶美生物工程公司分装),羊抗鼠第二抗体(Sigma公司)37℃、60min,A液B液各37℃、30min(ABC试剂盒,华美生物工程公司),DAB呈色。
, http://www.100md.com
5.图像分析
每组标本取50个细胞,测出每个细胞的灰度值后,取其平均值。组间的比较用t检验。
结 果
1.内皮细胞的Ⅷ因子相关抗原(vWF)
三种培养条件下的内皮细胞vWF均为阳性反应,阳性颗粒主要集中在细胞质中,细胞核空染。其中单独培养内皮细胞的阳性颗粒明显强于条件培养细胞,联合培养的内皮细胞最弱。图像分析结果表明,单独培养的内皮细胞胞浆中vWF的灰度值较同期条件培养的内皮细胞小,即vWF的合成增多。而联合培养的内皮细胞灰度值最大,即vWF合成最少,同时相的3组结果有显著性差异(P<0.05),图1,2。
图1 内皮细胞vWF免疫细胞化学显色的灰度
, http://www.100md.com
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞;(AvsC P<0.05)
(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
Fig.1 Immuno-cytochemistry gray of vWF in ECs
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs.
, http://www.100md.com
*(AvsC P<0.05) * *(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05) ※※(BvsC P<0.01)

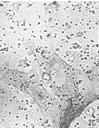
图2 内皮细胞VWF免疫细胞化学。 A.单独培养的内皮细胞 B.条件培养的内皮细胞 C.联合培养的内皮细胞 DAB染色 ×40
Fig.2 Immuno-cytochemistry staining of vWF in ECSs. A,ECs cultured alone B,ECs cultured in condition media C,co-cultured ECs Dyed by DAB ×40
, http://www.100md.com
2.内皮细胞的前列腺环素(PGI2)
PGI2是前列腺素代谢途径的一个重要产物,性质极不稳定,半衰期很短,约3.5~30min,衰退后很快转变成为没有活性的6-酮-PGF1a,该产物性质相对稳定,本实验用I125标记的6-酮-PGF1a抗体,检测培养基中6-酮-PGF1a的含量代替PGI2的累积量。放射免疫法检测发现,联合培养的内皮细胞的培养基中6-酮-PGF1a的含量最高,条件培养内皮细胞的次之,单独培养内皮细胞的最低,同期3组之间相比具有显著性差异(P<0.05)(图3)。
图3 内皮细胞PGI2的放射免疫检测(μg/L)
, 百拇医药
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞;(AvsC P<0.05)
(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
Fig.3 Radio-immunity reasearching of PGI2 released by ECs.
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs.
, http://www.100md.com
*(AvsC P<0.05) * *(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
3.内皮细胞的整合素β1亚族(CD29)
三种培养条件的内皮细胞均呈阳性反应,阳性颗粒主要集中在细胞膜上。但联合培养内皮细胞的灰度值较条件培养的内皮细胞小,阳性反应明显(P<0.05),条件培养的与单独培养的内皮细胞无差异(P<0.05)(图4,5)。
讨论
1.与平滑肌细胞联合培养的内皮细胞的Ⅷ因子相关抗原(vWF)
, 百拇医药
vWF是由血管内皮细胞合成,并分泌释放到血液中的高分子糖蛋白,血浆中的vWF主要由内皮细胞合成。血管壁中的成纤维细胞,平滑肌细胞都没有这种功能,因此,vWF也常常作为一个特异性的标志,用来鉴定内皮细胞[3]。胞质中的vWF释放到血浆后主要与凝血因子Ⅷ结合,以循环复合物的形式存在。vWF作为桥梁在内皮损伤后,使血小板吸附于血管内膜,促发生理性止血和局部的血栓形成。vWF不仅加速启动和介导血小板在损伤部位内皮下的聚集,而且还激发血小板表面血小板衍生因子的释放,进一步加速凝血过程,并且被激活的血小板还能刺激损伤部位平滑肌细胞的增生,导致管腔堵塞,这些都是阻碍受损伤血管和人工血管移植物移植成功及长期稳定存在的不利因素[1,4]。在血管的功能活动中,调节内皮细胞中vWF的合成和分泌将直接影响血小板的解聚能力和释放程度,直接调节血栓形成的规模和范围。因此,本研究观察到内皮细胞经联合培养后vWF的产生减少,对人工血管移植物表面抗凝血功能的调节有重要意义。
, 百拇医药
图4 内皮细胞CD29免疫细胞化学染色的灰度
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞
(AvsC P<0.05) ※(BvsC P<0.05)
Fig.4 Immuno-cytochemistry gray of
CD29 synthesised by ECs.
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs
, 百拇医药
*(AvsC P<0.05) ※(BvsC P<0.05)


图5 内皮细胞CD29免疫细胞化学。 A.单独培养的内皮细胞 B.条件培养的内皮细胞 C.联合培养的内皮细胞 DAB染色 ×40
Fig.5 Immuno-cytochemistry staining of CD29 synthesised by ECs. A,ECs cultured alone B,ECs cultured in condition media C,co-cultured ECs Dyed by DAB ×40
, http://www.100md.com
2.与平滑肌细胞联合培养的内皮细胞的前列腺环素(PGI2)
血管内皮细胞是一种多功能的活性细胞,它可以产生一些活性物质调节血管的收缩性和血小板的聚集。PGI2作为舒血管物质之一,也是至今所知的由内皮细胞分泌的最强的血小板聚集抑制因子[5]。它也能增强纤维活化素的功能,抑制血管平滑肌细胞的增殖。PGI2的作用是通过刺激腺苷酸环化酶的活性,升高血小板内PGI2的水平,从而抑制血小板的聚集反应,在正常生理状态下内皮细胞合成的PGI2有助于防止血小板的过度聚集,防止血栓形成。当血管受损伤时,内皮细胞合成的PGI2能限制血小板的聚集使血栓局限在损伤的局部,减少管腔的堵塞和局部平滑肌细胞的增生。
在本研究内皮细胞培养的3种模式中,联合培养内皮细胞的培养基中PGI2增加最明显。生理状态下,刺激血小板激活因子生成的因素都可以促进PGI2的生成,这也是机体中凝血和抗凝机制达到天然平衡的一种调节因素。平滑肌细胞分泌的血管紧张素Ⅱ、血小板诱导生长因子(platelete-derived growth factors, PDGF)同样可刺激PGI2的合成,同时平滑肌细胞上还有PGI2的受体,不仅能和PGI2结合调节血管的紧张性,也能刺激内皮细胞PGI2的合成和释放。
, 百拇医药
本研究结果表明,平滑肌细胞通过直接或间接的方式影响内皮细胞PGI2的合成和分泌活动,使得联合培养内皮细胞中PGI2的分泌量增加最多。因此,联合培养的内皮细胞种植后更有利于抑制血小板在移植物局部的聚集,更有利于防止血栓的形成。
3.与平滑肌细胞联合培养的内皮细胞的整合素β1亚族(CD29)
整合素(integrins)是一类广泛存在于细胞膜表面的蛋白质,均由α、β两个亚基经非共价键组成异质二聚体,其中以β亚基的不同而分为不同亚族。β1(CD29)亚族可以与α1~8、αv结合形成9种不同的整合素。它的配体主要存在于细胞外基质中,β1整合素与基质中的配体结合后除参与细胞内外多种信息的传递外,还主要介导细胞与细胞间,细胞与细胞外基质的粘连[6]。因此对β1的功能和活性的调节将对调节内皮细胞的粘附能力有重要意义。
, 百拇医药
本研究结果表明,联合培养内皮细胞阳性反应较单独培养的内皮细胞增强。体外培养内皮细胞的粘附分子的表达和分泌受很多因素的影响[7],如:培养时细胞的损伤和恢复程度、体外培养时间、外加的刺激因素等,其中细胞外基质成分的改变对整合素的影响最明显。当增加细胞外基质整合素配体的量时,相应的整合素表达量增多,且具有特异性。因此,在实验或实际应用中,可以通过改变细胞外基质的成分来调节相应整合素的表达和分泌。已有的实验证实,平滑肌细胞能够合成、分泌并参与影响内皮细胞胞外基质成分,但具体种类并不清楚。因此,平滑肌细胞有可能通过直接或间接途径影响内皮细胞胞外基质,从而参与影响内皮细胞中表达状况。当然,CD29是一亚族,其能与α亚基形成多种整合素亚型,平滑肌细胞对其中某一种或几种亚型产生何种影响,还待深入研究。同时,整合素的表达并非与其功能有完全直接的对应关系,只有被激活的整合素才能与其配体结合发挥功能。平滑肌细胞是否还能通过激活或改变整合素的活性以调节其功能也须进一步研究。
本文图2,5见插图第12页
, 百拇医药
【基金项目】 国家自然科学基金资助项目(39670200)和军队“九五”科研基金资助项目(96M068)
【作者简介】 陈双红(1971—),女(汉族),安徽省人,医学硕士,现为海军医学研究所助理研究员
作者单位:丛兴忠(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433)
参考文献
[1]Rubin BG,ToursarkissianB, Petrinec D.Preincubation of Dacron grafts with recombinant tissue factor pathway inhibitor decrease their thrombogenicity in vivo[J].J Vasc Surg,1996,24(5):865-870.
, 百拇医药
[2]MarkF F,Fillinger MD, Sampson CN.Coculture of Ecs and SMCs in bilater and conditioned media models[J].J Surg Res, 1997,67(2):169-178.
[3]成令忠.组织学[M].北京:人民卫生出版社,1993:839~841.
[4]李凤芝,颜培华,刘有梅.冷损伤对血管内皮细胞合成因子Ⅷ相关抗原的影响[J].中国应用生理学杂志,1993,9(2):137~139.
[5]张积明,松涛.流行性出血热病毒感染对离体人脐静脉血管内皮细胞分泌前列环素的影响[J].徐州医学院学报,1997,17(1):93~95.
[6]Girard PR.Nerem RM.Shear stress modulates cell morphology and f-actin organization through the regulation of focal adhesion associated proteins[J].J Cell physiol,1995,163(1):179-193.
[7]Crocket T,Torabi E.Selecting and mechanisms of signal transduction[J].J Leukoc Biol,1998,63(1):1-14.
【收稿日期】 1999-07-23
【修回日期】 2000-01-18, 百拇医药
单位:陈双红(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);姜宗来(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);张炎(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);张传森(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433);李玉泉(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433)
关键词:血管;内皮细胞;平滑肌细胞;联合培养;前列腺环素;Ⅷ因子相关抗原;粘附分子β1亚族
解剖学报000414 【摘要】 目的 探讨平滑肌细胞对内皮细胞功能的影响,为内皮细胞种植的组织工程学提供理论基础。 方法 模拟血管壁的内层结构及内皮细胞与平滑肌细胞间的相互影响途径,建立内皮细胞与平滑肌细胞接触生长的联合培养模型,用免疫细胞化学、放射免疫学技术和图像分析等方法研究内皮细胞vWF、PGI2、CD29的合成、分泌及表达。 结果 联合培养的内皮细胞的Ⅷ因子相关抗原(vWF)的合成减弱,前列腺环素的分泌增加,整合素β1亚族的表达增强。 结论 联合培养内皮细胞的细胞因子的合成、分泌和表达的变化更有利于其抗凝血及抗应力功能的调节。
, 百拇医药
【中图分类号】 R318.01;R318.11 【文献标识码】 A 【文章编号】 0529-1356(2000)04-347
ANTICOAGULANT FACTORS AND ADEHISION FACTORS
OF ECs CO-CULTURED WITH SMCs
CHEN Shuang-hong JIANG Zong-lai ZHANG Yan ZHANG Chuan-sen LI Yu-quan CONG Xing-zhong
(Department of Anatomy, Institute of Biomedical Engineering,the Second Millitary Medical University, Shanghai 200433,China)
, 百拇医药
【Abstract】 Objective
Effects of smooth muscle cells(SMCs)on function of endothelial cells(ECs) has been studied in order to support the basic theory for tissue engineering to ECs seeding. Methods A new co-culture model of ECs-SMCs which mimicked the interior architecture of vessel and also imitated the interaction patterns between ECs and SMCs was established. Immuno-cytochemistry, radio-immunity and image analysis were applied in the research of synthesis, secretion and expression of von willebrand factor(vWF),prostacycline(PGI2) and integrins β1(CD29)of the ECs. Results The production of vWF reduced, and the releasing of PGI2 and expression of CD29 increased. Conclusion The change of the synthesis, releasing and expression of some factors of the ECs is beneficial to regulating the functions of anticoagulatnt and stress-resistance of the ECs in co-culture model.
, http://www.100md.com
【Key words】 Vessel; Endothelial cells; Smooth muscle cells; Co-culture; Prostacyclin;Von Willebrand factor;Integrins β1
随着生物医学技术的发展,人工生物替代材料在心血管系统疾病治疗中的应用越来越多,改善生物材料与血液的相容性以减少生物材料诱发血栓和钙化形成已成为研究热点。内皮细胞是天然的保护层,种植于人工材料表面的内皮单层可以产生类似的在体效果。然而,内皮细胞种植技术一直存在未解决的问题,即细胞的抗凝血功能明显不足、抗应力能力弱,导致内皮细胞种植的成功率不高。进一步完善人工血管内皮细胞种植技术,是当前组织工程学所面临的一个重要课题。研究表明[1],完整的内皮细胞单层是防止血栓和钙化的前提,内皮细胞合成分泌许多因子,参与凝血和粘附过程。PGI2是至今所知最强的血小板聚集和释放的抑制因子,vWF是血小板粘附于内皮下层所必不可少的因素,β1粘附分子亚族是细胞与基质粘附的主要介导分子。因此,对内皮细胞中vWF、PGI2、β1粘附分子亚族的表达和活性的调节,将直接影响种植内皮细胞局部血栓形成和内皮细胞的粘附能力。国内外已有的研究中,对联合培养条件下,平滑肌细胞如何调节和影响内皮细胞的凝血因子和粘附分子的合成、分泌和表达,尚未见报道。本研究在建立内皮细胞与平滑肌细胞联合培养模型的基础上,对其中内皮细胞的凝血因子和粘附分子作了进一步研究,以探讨平滑肌细胞对内皮细胞功能的影响,为完善人工皮内细胞种植的组织工程学技术提供理论依据。
, 百拇医药
材料和方法
1.内皮细胞和平滑肌细胞的联合培养
新生牛胸主动脉5~10cm,胶原酶(Sigma公司)和胰酶(Sigma公司)混合消化,获取内膜的内皮细胞;胰蛋白酶消化,获取中膜的平滑肌细胞。原代培养,传代至2~10代的平滑肌细胞经胰酶消化,调整细胞浓度到5×104个/ml,种植于PET膜(美国Falcon公司)的外面;在膜的内面以同样的浓度种值2~10代的内皮细胞,然后将PET膜插入配套的6孔培养板(美国Falcon公司)中,进行联合培养[2]。同时以单独培养的内皮细胞和在平滑肌细胞的条件培养基中培养的内皮细胞分别作为对照。
2.内皮细胞Ⅷ因子相关抗原的免疫细胞化学
取2、4、6、8d 3种培养条件下的内皮细胞各1组,PBS洗3遍,4%多聚甲醛固定25~30min,羊血清(Sigma公司)37℃、30min,兔抗人vWF(Sigma公司)37℃、60min,羊抗兔第二抗体(Sigma公司)37℃、60min,A液B液各37℃、30min(ABC试剂盒,华美生物工程公司),DAB呈色。
, 百拇医药
3.内皮细胞前列腺环素(PGI2)的放射免疫检测
传代的内皮细胞,以5×104个/ml的浓度种植于3种培养条件的多孔PET膜上,每个膜孔加培养基2ml,每天收集各组培养基0.6ml,弃去多余培养基,加入新鲜培养基。收集的培养基离心后,置于-20℃冰箱保存,标本收集齐后,按试剂盒操作(6-酮-PGF1a试剂盒,苏州医学院血栓与止血研究所),测定6-酮-PGF1a的含量作为PGI2的含量。
4.内皮细胞整合素β1亚族(CD29)的免疫细胞化学
取上述3种培养条件下8~72h生长的内皮细胞各1组,PBS洗3遍,4%的多聚甲醛固定后,羊血清(深圳晶美生物工程公司分装)37℃、30min,鼠抗人CD29抗体(深圳晶美生物工程公司分装),羊抗鼠第二抗体(Sigma公司)37℃、60min,A液B液各37℃、30min(ABC试剂盒,华美生物工程公司),DAB呈色。
, http://www.100md.com
5.图像分析
每组标本取50个细胞,测出每个细胞的灰度值后,取其平均值。组间的比较用t检验。
结 果
1.内皮细胞的Ⅷ因子相关抗原(vWF)
三种培养条件下的内皮细胞vWF均为阳性反应,阳性颗粒主要集中在细胞质中,细胞核空染。其中单独培养内皮细胞的阳性颗粒明显强于条件培养细胞,联合培养的内皮细胞最弱。图像分析结果表明,单独培养的内皮细胞胞浆中vWF的灰度值较同期条件培养的内皮细胞小,即vWF的合成增多。而联合培养的内皮细胞灰度值最大,即vWF合成最少,同时相的3组结果有显著性差异(P<0.05),图1,2。

图1 内皮细胞vWF免疫细胞化学显色的灰度
, http://www.100md.com
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞;(AvsC P<0.05)
(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
Fig.1 Immuno-cytochemistry gray of vWF in ECs
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs.
, http://www.100md.com
*(AvsC P<0.05) * *(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05) ※※(BvsC P<0.01)



图2 内皮细胞VWF免疫细胞化学。 A.单独培养的内皮细胞 B.条件培养的内皮细胞 C.联合培养的内皮细胞 DAB染色 ×40
Fig.2 Immuno-cytochemistry staining of vWF in ECSs. A,ECs cultured alone B,ECs cultured in condition media C,co-cultured ECs Dyed by DAB ×40
, http://www.100md.com
2.内皮细胞的前列腺环素(PGI2)
PGI2是前列腺素代谢途径的一个重要产物,性质极不稳定,半衰期很短,约3.5~30min,衰退后很快转变成为没有活性的6-酮-PGF1a,该产物性质相对稳定,本实验用I125标记的6-酮-PGF1a抗体,检测培养基中6-酮-PGF1a的含量代替PGI2的累积量。放射免疫法检测发现,联合培养的内皮细胞的培养基中6-酮-PGF1a的含量最高,条件培养内皮细胞的次之,单独培养内皮细胞的最低,同期3组之间相比具有显著性差异(P<0.05)(图3)。

图3 内皮细胞PGI2的放射免疫检测(μg/L)
, 百拇医药
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞;(AvsC P<0.05)
(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
Fig.3 Radio-immunity reasearching of PGI2 released by ECs.
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs.
, http://www.100md.com
*(AvsC P<0.05) * *(AvsC P<0.01) #(AvsB P<0.05)
##(AvsB P<0.01) ※(BvsC P<0.05)
※※(BvsC P<0.01)
3.内皮细胞的整合素β1亚族(CD29)
三种培养条件的内皮细胞均呈阳性反应,阳性颗粒主要集中在细胞膜上。但联合培养内皮细胞的灰度值较条件培养的内皮细胞小,阳性反应明显(P<0.05),条件培养的与单独培养的内皮细胞无差异(P<0.05)(图4,5)。
讨论
1.与平滑肌细胞联合培养的内皮细胞的Ⅷ因子相关抗原(vWF)
, 百拇医药
vWF是由血管内皮细胞合成,并分泌释放到血液中的高分子糖蛋白,血浆中的vWF主要由内皮细胞合成。血管壁中的成纤维细胞,平滑肌细胞都没有这种功能,因此,vWF也常常作为一个特异性的标志,用来鉴定内皮细胞[3]。胞质中的vWF释放到血浆后主要与凝血因子Ⅷ结合,以循环复合物的形式存在。vWF作为桥梁在内皮损伤后,使血小板吸附于血管内膜,促发生理性止血和局部的血栓形成。vWF不仅加速启动和介导血小板在损伤部位内皮下的聚集,而且还激发血小板表面血小板衍生因子的释放,进一步加速凝血过程,并且被激活的血小板还能刺激损伤部位平滑肌细胞的增生,导致管腔堵塞,这些都是阻碍受损伤血管和人工血管移植物移植成功及长期稳定存在的不利因素[1,4]。在血管的功能活动中,调节内皮细胞中vWF的合成和分泌将直接影响血小板的解聚能力和释放程度,直接调节血栓形成的规模和范围。因此,本研究观察到内皮细胞经联合培养后vWF的产生减少,对人工血管移植物表面抗凝血功能的调节有重要意义。

, 百拇医药
图4 内皮细胞CD29免疫细胞化学染色的灰度
A.单独培养的内皮细胞 B.条件培养的内皮细胞
C.联合培养的内皮细胞
(AvsC P<0.05) ※(BvsC P<0.05)
Fig.4 Immuno-cytochemistry gray of
CD29 synthesised by ECs.
A,ECs cultured alone B, ECs cultured in
condition media C,co-cultured ECs
, 百拇医药
*(AvsC P<0.05) ※(BvsC P<0.05)



图5 内皮细胞CD29免疫细胞化学。 A.单独培养的内皮细胞 B.条件培养的内皮细胞 C.联合培养的内皮细胞 DAB染色 ×40
Fig.5 Immuno-cytochemistry staining of CD29 synthesised by ECs. A,ECs cultured alone B,ECs cultured in condition media C,co-cultured ECs Dyed by DAB ×40
, http://www.100md.com
2.与平滑肌细胞联合培养的内皮细胞的前列腺环素(PGI2)
血管内皮细胞是一种多功能的活性细胞,它可以产生一些活性物质调节血管的收缩性和血小板的聚集。PGI2作为舒血管物质之一,也是至今所知的由内皮细胞分泌的最强的血小板聚集抑制因子[5]。它也能增强纤维活化素的功能,抑制血管平滑肌细胞的增殖。PGI2的作用是通过刺激腺苷酸环化酶的活性,升高血小板内PGI2的水平,从而抑制血小板的聚集反应,在正常生理状态下内皮细胞合成的PGI2有助于防止血小板的过度聚集,防止血栓形成。当血管受损伤时,内皮细胞合成的PGI2能限制血小板的聚集使血栓局限在损伤的局部,减少管腔的堵塞和局部平滑肌细胞的增生。
在本研究内皮细胞培养的3种模式中,联合培养内皮细胞的培养基中PGI2增加最明显。生理状态下,刺激血小板激活因子生成的因素都可以促进PGI2的生成,这也是机体中凝血和抗凝机制达到天然平衡的一种调节因素。平滑肌细胞分泌的血管紧张素Ⅱ、血小板诱导生长因子(platelete-derived growth factors, PDGF)同样可刺激PGI2的合成,同时平滑肌细胞上还有PGI2的受体,不仅能和PGI2结合调节血管的紧张性,也能刺激内皮细胞PGI2的合成和释放。
, 百拇医药
本研究结果表明,平滑肌细胞通过直接或间接的方式影响内皮细胞PGI2的合成和分泌活动,使得联合培养内皮细胞中PGI2的分泌量增加最多。因此,联合培养的内皮细胞种植后更有利于抑制血小板在移植物局部的聚集,更有利于防止血栓的形成。
3.与平滑肌细胞联合培养的内皮细胞的整合素β1亚族(CD29)
整合素(integrins)是一类广泛存在于细胞膜表面的蛋白质,均由α、β两个亚基经非共价键组成异质二聚体,其中以β亚基的不同而分为不同亚族。β1(CD29)亚族可以与α1~8、αv结合形成9种不同的整合素。它的配体主要存在于细胞外基质中,β1整合素与基质中的配体结合后除参与细胞内外多种信息的传递外,还主要介导细胞与细胞间,细胞与细胞外基质的粘连[6]。因此对β1的功能和活性的调节将对调节内皮细胞的粘附能力有重要意义。
, 百拇医药
本研究结果表明,联合培养内皮细胞阳性反应较单独培养的内皮细胞增强。体外培养内皮细胞的粘附分子的表达和分泌受很多因素的影响[7],如:培养时细胞的损伤和恢复程度、体外培养时间、外加的刺激因素等,其中细胞外基质成分的改变对整合素的影响最明显。当增加细胞外基质整合素配体的量时,相应的整合素表达量增多,且具有特异性。因此,在实验或实际应用中,可以通过改变细胞外基质的成分来调节相应整合素的表达和分泌。已有的实验证实,平滑肌细胞能够合成、分泌并参与影响内皮细胞胞外基质成分,但具体种类并不清楚。因此,平滑肌细胞有可能通过直接或间接途径影响内皮细胞胞外基质,从而参与影响内皮细胞中表达状况。当然,CD29是一亚族,其能与α亚基形成多种整合素亚型,平滑肌细胞对其中某一种或几种亚型产生何种影响,还待深入研究。同时,整合素的表达并非与其功能有完全直接的对应关系,只有被激活的整合素才能与其配体结合发挥功能。平滑肌细胞是否还能通过激活或改变整合素的活性以调节其功能也须进一步研究。
本文图2,5见插图第12页
, 百拇医药
【基金项目】 国家自然科学基金资助项目(39670200)和军队“九五”科研基金资助项目(96M068)
【作者简介】 陈双红(1971—),女(汉族),安徽省人,医学硕士,现为海军医学研究所助理研究员
作者单位:丛兴忠(第二军医大学解剖学教研室 生物医学工程学研究所,上海 200433)
参考文献
[1]Rubin BG,ToursarkissianB, Petrinec D.Preincubation of Dacron grafts with recombinant tissue factor pathway inhibitor decrease their thrombogenicity in vivo[J].J Vasc Surg,1996,24(5):865-870.
, 百拇医药
[2]MarkF F,Fillinger MD, Sampson CN.Coculture of Ecs and SMCs in bilater and conditioned media models[J].J Surg Res, 1997,67(2):169-178.
[3]成令忠.组织学[M].北京:人民卫生出版社,1993:839~841.
[4]李凤芝,颜培华,刘有梅.冷损伤对血管内皮细胞合成因子Ⅷ相关抗原的影响[J].中国应用生理学杂志,1993,9(2):137~139.
[5]张积明,松涛.流行性出血热病毒感染对离体人脐静脉血管内皮细胞分泌前列环素的影响[J].徐州医学院学报,1997,17(1):93~95.
[6]Girard PR.Nerem RM.Shear stress modulates cell morphology and f-actin organization through the regulation of focal adhesion associated proteins[J].J Cell physiol,1995,163(1):179-193.
[7]Crocket T,Torabi E.Selecting and mechanisms of signal transduction[J].J Leukoc Biol,1998,63(1):1-14.
【收稿日期】 1999-07-23
【修回日期】 2000-01-18, 百拇医药