GABAA受体激动剂和拮抗剂对大鼠梨形皮质、海马Fos表达的影响及其与癫痫发病的关系*
作者:马春玲 朱长庚 刘庆莹 魏瑛 彭宣林 童逸龄
单位:同济医科大学基础医学院脑研究室, 武汉 430030
关键词:马桑内酯;GABAA受体;蝇蕈醇;荷包牡丹碱;Fos蛋白;癫痫
同济医科大学学报990203 摘要 为探讨γ-氨基丁酸受体(GABAA)与癫痫发病机制之间的关系,应用免疫组化技术结合脑电图就GABAA受体激动剂蝇蕈醇对马桑内酯致痫大鼠大脑皮质、海马Fos表达的影响进行研究,并与GABAA受体拮抗剂荷包牡丹碱致痫大鼠的Fos表达进行比较。结果显示:侧脑室注射马桑内酯诱发癫痫发作后1 h,双侧齿状回颗粒细胞层、海马锥体细胞层及注射侧梨形皮质有大量Fos阳性细胞, 对侧梨形皮质未检测到Fos表达; 侧脑室注射蝇蕈醇可明显抑制齿状回、海马Fos的表达, 但梨状皮质Fos表达未受影响。一侧侧脑室注射荷包牡丹碱诱发癫痫发作后1 h,双侧梨状皮质有较强的Fos表达,但齿状回、海马未见表达。脑电图也证实马桑内酯及荷包牡丹碱均能诱发棘慢波、尖慢波,蝇蕈醇则能明显抑制这种痫样放电。结果提示,GABAA受体在癫痫发病过程中起重要作用。
, 百拇医药
中图法分类号 Q51, R742.1
Effects of the GABAA-receptor Agonist and Antagonist on Fos Expression in
Rat Piriform Cortex and Hippocampus and Their Relationship with Epilepsy
Ma Chunling, Zhu Changgeng, Liu Qingying et al
Brain Institute, School of Basic Medical Sciences, Tongji Medical University,Wuhan 430030
Abstract In order to investigate the relationship between epileptogenetic mechanism and GABAA-receptor, the effect of GABAA-receptor agonist (muscimol) on Fos protein expression were studied in cerebral cortex and hippocampus of epileptic rats induced by coriaria lactone (CL) by using immunohistochemical staining, and the Fos expression was compared with that of epileptic rats induced by GABAA -receptor antagonist (bicuculline). The results showed that there were a lot of Fos-positive cells in bilateral granular cellular layer of dentate gyrus, hippocampal pyramidal cellular layer and piriform cortex of injecting side 1h after seizure induced by injecting CL into the lateral ventricle. Fos expression was not observed in contralateral piriform cortex. Muscimol injected into the lateral ventricle inhibited remarkably Fos expression in the dentate gyrus, hippocampal gyrus, while the piriform cortex was not affected. The stronger Fos expression in bilateral piriform cortex but no expression in the dentate gyrus and hippocampus was observed 1h after seizure induced by bicuculline. The electroencephalogram (EEG) confirmed that CL and bicuculline induced spike, slow complex or sharp, slow complex waves, whereas muscimol inhibited these epileptic discharges. These data suggested that GABAA receptor might play an important role in epileptogenesis.
, 百拇医药
Key words coriaria lactone; GABAA receptor; muscimol; bicuculline; Fos protein; epilepsy
癫痫是一种神经元发作性异常放电所引起的、以反复痫样发作为特征的临床症候群,其病因复杂, 发病机制尚未阐明。目前,对癫痫发病机制的研究表明,γ-氨基丁酸(GABA)起着不可忽视的作用。一般认为GABA含量降低是神经细胞过度兴奋诱发同步放电的原因之一[1,2],而GABA的作用是通过其受体实现的,因此,兴奋或抑制GABAA受体以观察其对癫痫的影响是探讨癫痫发病机制的重要手段。此外,c-fos表达作为一种反映神经细胞功能活动的指标已被广泛采用[3,4],在各种化学和电刺激所造成的癫痫中其表达增强;而一些抗痫药具有抑制该基 因表达的作用[5],因此可利用癫痫模型,以Fos蛋白为指标来研究某些致痫剂或抗痫剂与癫痫发病机制的关系, 因此本实验拟用免疫组织化学技术观察GABA 受体激动剂和拮抗剂对马桑内酯(CL)致痫大鼠大脑皮质、海马内Fos蛋白表达的影响,旨在进一步探讨GABAA受体在癫痫发病中所起的作用。
, 百拇医药
1 材料与方法
1.1 动物分组及模型制备
健康雌性SD大鼠22只(同济医科大学实验动物学部提供),体重150~200 g,将其随机分为4组。① C组:4只,不注射马桑内酯, 用4 g/L的戊巴比妥钠腹腔麻醉(10 ml/kg),随即灌注取材。② CL组:6只, 将马桑内酯3 μl(5 μg/μl)在立体定位仪下注入右侧侧脑室后存活1 h。注射坐标: 前囟后0.8 mm、中线旁1.5 mm、颅骨下3.8 mm。注射速度1 μl/min,注射后留针5 min,然后缓慢退出。③M+CL组:6只,将蝇蕈醇(M)5 μl (500 ng/μl) 注入右侧侧脑室0.5 h后再于同侧注入马桑内酯3 μl存活1 h。④B组:6只, 将荷包牡丹碱5 μl (1 μg/μl) 注入右侧侧脑室后存活1 h。
1.2 EEG描记
在右侧大脑皮质、海马放置针电极,直径0.5 mm。额叶皮质电极:前囟前2.0 mm、中线旁2.0 mm、硬膜下0.5 mm。海马电极: 前囟后3.8 mm, 中线旁2.0 mm, 硬膜下2.6 mm,全部电极用牙托粉加502胶固定。采用日本San-EI八导脑电图机记录,电极连接:①右皮质-右耳;②右海马-右耳;定标:2 mm=50 μV;纸速:3 cm/s;脑电波波幅高5 mm为低幅、6~10 mm为中幅、11~20 mm为高幅,当出现尖波、棘波、尖(棘)慢综合波、多棘慢波时判定EEG为痫样活动。注药后先连续观察EEG 15 min,然后每隔5 min记录1 min,共记录1 h。计算痫波发放的潜伏期和频率,取10次记录中尖波或棘波数目的均值作为每min平均痫波发放频率。
, 百拇医药
1.3 行为观察
侧脑室注药后连续观察大鼠行为1 h,并记录痫样发作的潜伏期和发作程度,从注药到首次出现须动所需的时间为潜伏期,参考Schultz-Krohn[6]的标准以出现4~5级发作为重型发作,3级或3级以下为轻型发作。
1.4 免疫组织化学染色
各组动物于深麻醉下迅速经升主动脉顺序灌注生理盐水150 ml 、冷的 含40 g/L多聚甲醛的磷酸缓冲液(pH 7.4) 400 ml,持续约1 h,取材后固定于上述固定液3 h,后入200 g/L蔗糖磷酸缓冲液4 ℃过夜,次日恒冷箱切片(厚30 μm) ,取背侧海马最大切面,每4张取1张收集于PBS中,按下列程序进行免疫组织化学染色:0.03 % H2O2/甲醇室温下孵育30 min, 正常兔血清1∶50 37 ℃ 1 h,再入羊抗Fos血清(1:300 Cambridge Research Biochemical)中4 ℃孵育72 h, 生物素化兔抗羊IgG(1∶100 Boster) 37 ℃ 1 h,SABC液(1∶100 Boster) 37 ℃ 1 h,用DAB-4 HCl/H2O2呈色5 min,贴片、脱水、透明及封片。上述每一步骤间均用PBS充分漂洗,光镜下观察。对照试验: 用正常羊血清代替第一抗体孵育切片,结果为阴性。
, 百拇医药
1.5 显微图像分析
应用TTTY-400TC真彩色细胞图像分析仪对各组大鼠齿状回颗粒细胞层、海马回CA3区及梨形皮质的FOS免疫反应细胞进行显微图像分析,每组取10张切片,每张切片随机检测20个阳性细胞的光密度,计算其平均光密度。所有数据均以( ±s)表示,各组数据用t检验做差异显著性分析。
±s)表示,各组数据用t检验做差异显著性分析。
2 结 果
2.1 行为表现
C组:无痫样表现。CL组:注射CL后均于15 min内出现痫样发作,6只动物均为重型发作;M+CL组:注射CL后平均25 min左右出现痫性发作,其中5只为轻型发作,1只无行为变化;B组:注射BIC后均于2 min内发作,6只均为重型发作。
, 百拇医药
2.2 EEG改变
C组:各导联均为α或β波,偶有θ波 即基础波(图1);CL组:注入CL后大鼠皮质及海马脑电图出现阵发性痫性放电,表现为高电位的棘慢波、尖慢波(图2);M+CL组:注入CL后各导联出现单个低到中电位棘-慢波,未见长、短程发放的多棘、多棘慢综合波(图3);B组:于BIC注射后30 s内即出现尖慢波,2 min开始出现阵发性多棘慢波,15 min出现长程高-特高幅棘慢波、尖-慢综合波(图4),以后放电频率逐渐减少。
图1 对照组脑电图以α、β波为主,偶见θ波。上:皮层; 下:海马。 下同
图2 CL致痫组脑电图呈短阵发放尖波、棘波、棘慢综合波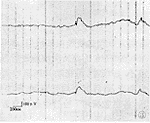
, 百拇医药
图3 蝇蕈醇+CL致痫组脑电图示以α、β波为主,偶发高电位棘-慢波
图4 荷包牡丹碱致痫组脑电图示高电位阵发性棘-慢波、尖-慢波
2.3 免疫组化结果
C组:在梨形皮质、海马偶见散在的FOS阳性细胞。CL组:致痫后1 h,注射侧齿状回颗粒细胞层有众多的Fos标记细胞(图5),对侧齿状回次之(图6);海马锥体细胞可见较多的Fos阳性细胞,但染色较齿状回弱;注射侧梨形皮质出现强阳性Fos标记细胞, 但对侧梨形皮质未见Fos标记细胞。M+CL组:致痫后1 h,双侧齿状回颗粒细胞层、海马Fos免疫反应明显减弱(图7),而梨形皮质与CL组无显著差异。B组:致痫后1 h,双侧梨形皮质均出现Fos阳性细胞,注射侧较对侧免疫反应强(图8),海马及齿状回未见Fos阳性细胞。各组大鼠梨形皮质、海马Fos表达变化的显微图像分析结果见附表。
, http://www.100md.com
图5 CL致痫1 h后注射侧齿状回颗粒细胞层,海马CA4区Fos免疫反应阳性细胞 ×40
图6 CL致痫1 h后对侧齿状回颗粒细胞层,海马CA4区Fos免疫反应阳性细胞 ×40
图7 M+CL组,CL注射1 h后注射侧齿状回颗粒细胞层Fos免疫反应阳性细胞 ×40
图8 BIC致痫1 h后注射侧梨形皮质Fos免疫反应阳性细胞 ×40
附表 各组大鼠梨形皮质、海马Fos表达的变化 (平均光密度) 组别
, 百拇医药
n
梨形皮质
海马CA3区
齿状回颗粒细胞
注射侧
对侧
注射侧
对侧
注射侧
对侧
C
4
-
, http://www.100md.com -
-
-
-
-
CL
6
0.22±0.02##
-
0.17±0.01
0.15±0.01++
0.20±0.02
0.18±0.02++
, 百拇医药
M+CL
6
0.15±0.01**
-
0.13±0.01**
0.13±0.01++
0.13±0.01**
0.12±0.01++
BIC
6
0.35±0.01**
, http://www.100md.com
0.19±0.03++
-
-
-
-
与C比较 ##P<0.01; 与CL比较 **P<0.01;与注射侧比较 ++P<0.013 讨 论
大量资料表明, 原癌基因c-fos、c-jun在神经元活动时表达活跃,被广泛用做神经元活动的标志物[3],在各种药物和电刺激诱发的癫痫模型,皆可诱导脑内c-fos基因的表达,但这种表达具有刺激特异性、细胞特异性和时程特异性[6];不同刺激所诱发的癫痫模型,其FOS表达的部位及持续时间不同[7],通过观察致痫后c-fos基因表达的情况,可以确定不同类型癫痫活动最初启动的脑区及播散范围。有研究者发现c-fos基因表达区域往往是Ca2+通道和兴奋性氨基酸受体密度最高的部位,而后两者与癫痫有密切关系。本实验发现,侧脑室注射CL 1 h后,Fos表达部位主要集中在双侧海马齿状回颗粒细胞层和锥体细胞层,注射侧强于对侧,这与刘庆莹等[8]报道的结果一致;梨形皮质Fos表达仅见于注射侧。而脑室内注射荷包牡丹碱(BIC)1 h后, 情况与此不同,Fos集中表达于双侧梨形皮质,海马未见Fos的表达。两种致痫剂Fos表达部位的不同,提示两者的致痫灶及作用机制可能不同。
, 百拇医药
有资料表明马桑内酯可引起海马谷氨酸免疫反应明显增强[8],证实了脑内谷氨酸含量增高是癫痫发作的因素之一;癫痫发作时GABAA受体γ2亚单位mRNA明显减少[9], 并且GABA神经元有不同程度的损伤[10];而且发现马桑内酯可使培养的海马、大脑皮质细胞内游离Ca2+明显增加,故推测马桑内酯致痫的过程可能为:马桑内酯通过电压门控或配体门控离子通道, 使胞内钙增加和激活第三信使, 从而促进基因转录, 使谷氨酸的合成和释放增加或GABA的功能减弱,导致神经元兴奋性增高和癫痫发作。本实验发现Fos蛋白的表达部位集中在双侧海马及注射侧的梨形皮质, 而对侧梨形皮质未见Fos表达。方一心等[11]在观察马桑内酯所致癫痫大鼠的脑组织化学时发现:某些酶的异常主要发生于大脑皮质运动区和海马的锥体细胞,与本实验Fos表达部位相似。
荷包牡丹碱是作用于GABAA受体识别位点的一种生物碱, 可选择性地阻断GABAA受体。GABAA受体与Cl-通道相偶联,通过调节对Cl-通道的开启和关闭发挥作用, 它和突触后膜的一些亚单位组成复合物,包括GABAA受体,苯二氮卓(benzodiazepine BZ)受体,印防己毒素受体和Cl-载体,统称GABAA受体-离子载体复合物[12],三种受体间存在生理偶联,当一种配体与其受体结合后,可通过变构效应相互影响,增加或抑制其他配基与其受体的结合[13]。GABA与受体结合可降低Cl-通道阻力,Cl-内流增加,引起突触后膜超极化,当兴奋性刺激传入时,通过防止膜的去极化达到突触后抑制。荷包牡丹碱对GABAA受体的阻断,妨碍了GABA的作用,使GABA-GABAA受体系统的活动减弱,进而导致谷氨酸-NMDA受体系统的活动相对增强,诱导c-fos表达, 导致癫痫发生[14]。荷包牡丹碱与马桑内酯诱导Fos表达部位的不同,可能与荷包牡丹碱致痫最初启动的脑区及传播途径与马桑内酯不同有关。Fedefic et al[15]研究发现在灌注液中加入荷包牡丹碱可诱导痫样活动,且其传播的速度及范围呈剂量依赖性,低剂量时(20 μmol/L)痫样活动仅见于内嗅皮质(EC)及内侧皮质杏仁核(PA),高剂量时(100 μmol/L)痫样活动波及至后梨形皮质、后鼻周皮质及岛叶。与此相似,本实验结果发现荷包牡丹碱致痫时Fos阳性细胞仅见于梨形皮质,提示荷包牡丹碱可能特异性作用于上述部位。
, 百拇医药
蝇蕈醇(muscimol)是一种强烈的GABAA受体激动剂,其作用比GABA强10倍,它可以作用于GABAA受体,使Cl-内流增强,引起突触后膜超极化。本实验在脑室内注射蝇蕈醇0.5 h后再注射马桑内酯,结果无论是EEG还是行为观察痫样活动均明显减弱,海马Fos表达也明显降低,说明蝇蕈醇对癫痫发作有强烈的抑制作用。
*国家自然科学基金资助项目(No. 39770755)
作者简介:马春玲,女,1964年生,博士研究生
参考文献
1 Meldrum B S. GABAergic mechanisms in the pathogenesis and treatment of epilepsy. Br J Clin Pharmacol, 1989, 27(Supple 1): 35
, 百拇医药
2 Tasker J G, Dudek F E. Electrophysiology of GABA-mediated synaptic transmission and possible roles in epilepsy. Neurochem Res,1991, 16: 251
3 Bullitt E. Expression of c-fos like protein as a marker for neuronal activity following noxious stimulation in the rat. J Comp Neurol, 1990,296:517
4 Kiessling M, Gass P. Immediate early gene expression in experimental epilepsy. Brain pathol, 1993,3:381
, 百拇医药 5 Sonnenberg J L, Mitchelmore C, Macgregor-Leon P F. Glutamate receptor agonists increase the expression of Fos,Fra and AP-1 DNA binding activity in the mammalian brain. J Neurosci Res,1989,24:72
6 朱和明,朱长庚.第三信使的诱导及其分子机制.神经解剖学杂志,1996,12 (1):75
7 Morgan J I, Curran T. Proto-oncogene transcription factors and epilepsy. Trends Pharmacol Sci, 1991,12(9):343
8 刘庆莹, 魏 瑛, 朱长庚等. 马桑内酯致痫大鼠海马c-fos原癌基因表达及谷氨酸免疫反应的变化. 解剖学报, 1996, 27(1):1
, http://www.100md.com
9 朱长庚,刘庆莹,朱家祥等.慢性癫痫大鼠海马内GABAA受体γ2亚单位的改变——原位杂交组织化学研究. 解剖学报,1995,26(4):352
10 朱长庚,蔡秋云,朱家祥等. 慢性癫痫动物模型海马内GABA能神经元的超微结构改变. 解剖学报,1994,25(4):345
11 方一心,吴良芳,宋玉芳等. 马桑内酯致痫大鼠的脑组织化学研究.华西医科大学学报,1987,18(2):107
12 Olsen R W. The GABA postsynaptic membrane receptor-ionophore complex. Mol Cell Biochem, 1981, 39: 261
13 Ticku M K, Maksay G. Convulsant /depressant site of action at the allosteric benzodiazepine-GABA receptor-ionophore complex. Life Science, 1983,33:2363
, 百拇医药
14 Gloor P. Epilepsy:relationships between electrophysiology and intracelllular mechanisms involving second messengers and gene expression. Can J Neurol Sci, 1989, 16: 8
15 Federico P, Macvicar B A. Imaging induction and spread of seizure activity in isolated brain of the guinea pig: the roles of GABA and glutamate receptors. J Neurophysiol, 1996, 76: 3471
收稿日期:1998-10-09, 百拇医药
单位:同济医科大学基础医学院脑研究室, 武汉 430030
关键词:马桑内酯;GABAA受体;蝇蕈醇;荷包牡丹碱;Fos蛋白;癫痫
同济医科大学学报990203 摘要 为探讨γ-氨基丁酸受体(GABAA)与癫痫发病机制之间的关系,应用免疫组化技术结合脑电图就GABAA受体激动剂蝇蕈醇对马桑内酯致痫大鼠大脑皮质、海马Fos表达的影响进行研究,并与GABAA受体拮抗剂荷包牡丹碱致痫大鼠的Fos表达进行比较。结果显示:侧脑室注射马桑内酯诱发癫痫发作后1 h,双侧齿状回颗粒细胞层、海马锥体细胞层及注射侧梨形皮质有大量Fos阳性细胞, 对侧梨形皮质未检测到Fos表达; 侧脑室注射蝇蕈醇可明显抑制齿状回、海马Fos的表达, 但梨状皮质Fos表达未受影响。一侧侧脑室注射荷包牡丹碱诱发癫痫发作后1 h,双侧梨状皮质有较强的Fos表达,但齿状回、海马未见表达。脑电图也证实马桑内酯及荷包牡丹碱均能诱发棘慢波、尖慢波,蝇蕈醇则能明显抑制这种痫样放电。结果提示,GABAA受体在癫痫发病过程中起重要作用。
, 百拇医药
中图法分类号 Q51, R742.1
Effects of the GABAA-receptor Agonist and Antagonist on Fos Expression in
Rat Piriform Cortex and Hippocampus and Their Relationship with Epilepsy
Ma Chunling, Zhu Changgeng, Liu Qingying et al
Brain Institute, School of Basic Medical Sciences, Tongji Medical University,Wuhan 430030
Abstract In order to investigate the relationship between epileptogenetic mechanism and GABAA-receptor, the effect of GABAA-receptor agonist (muscimol) on Fos protein expression were studied in cerebral cortex and hippocampus of epileptic rats induced by coriaria lactone (CL) by using immunohistochemical staining, and the Fos expression was compared with that of epileptic rats induced by GABAA -receptor antagonist (bicuculline). The results showed that there were a lot of Fos-positive cells in bilateral granular cellular layer of dentate gyrus, hippocampal pyramidal cellular layer and piriform cortex of injecting side 1h after seizure induced by injecting CL into the lateral ventricle. Fos expression was not observed in contralateral piriform cortex. Muscimol injected into the lateral ventricle inhibited remarkably Fos expression in the dentate gyrus, hippocampal gyrus, while the piriform cortex was not affected. The stronger Fos expression in bilateral piriform cortex but no expression in the dentate gyrus and hippocampus was observed 1h after seizure induced by bicuculline. The electroencephalogram (EEG) confirmed that CL and bicuculline induced spike, slow complex or sharp, slow complex waves, whereas muscimol inhibited these epileptic discharges. These data suggested that GABAA receptor might play an important role in epileptogenesis.
, 百拇医药
Key words coriaria lactone; GABAA receptor; muscimol; bicuculline; Fos protein; epilepsy
癫痫是一种神经元发作性异常放电所引起的、以反复痫样发作为特征的临床症候群,其病因复杂, 发病机制尚未阐明。目前,对癫痫发病机制的研究表明,γ-氨基丁酸(GABA)起着不可忽视的作用。一般认为GABA含量降低是神经细胞过度兴奋诱发同步放电的原因之一[1,2],而GABA的作用是通过其受体实现的,因此,兴奋或抑制GABAA受体以观察其对癫痫的影响是探讨癫痫发病机制的重要手段。此外,c-fos表达作为一种反映神经细胞功能活动的指标已被广泛采用[3,4],在各种化学和电刺激所造成的癫痫中其表达增强;而一些抗痫药具有抑制该基 因表达的作用[5],因此可利用癫痫模型,以Fos蛋白为指标来研究某些致痫剂或抗痫剂与癫痫发病机制的关系, 因此本实验拟用免疫组织化学技术观察GABA 受体激动剂和拮抗剂对马桑内酯(CL)致痫大鼠大脑皮质、海马内Fos蛋白表达的影响,旨在进一步探讨GABAA受体在癫痫发病中所起的作用。
, 百拇医药
1 材料与方法
1.1 动物分组及模型制备
健康雌性SD大鼠22只(同济医科大学实验动物学部提供),体重150~200 g,将其随机分为4组。① C组:4只,不注射马桑内酯, 用4 g/L的戊巴比妥钠腹腔麻醉(10 ml/kg),随即灌注取材。② CL组:6只, 将马桑内酯3 μl(5 μg/μl)在立体定位仪下注入右侧侧脑室后存活1 h。注射坐标: 前囟后0.8 mm、中线旁1.5 mm、颅骨下3.8 mm。注射速度1 μl/min,注射后留针5 min,然后缓慢退出。③M+CL组:6只,将蝇蕈醇(M)5 μl (500 ng/μl) 注入右侧侧脑室0.5 h后再于同侧注入马桑内酯3 μl存活1 h。④B组:6只, 将荷包牡丹碱5 μl (1 μg/μl) 注入右侧侧脑室后存活1 h。
1.2 EEG描记
在右侧大脑皮质、海马放置针电极,直径0.5 mm。额叶皮质电极:前囟前2.0 mm、中线旁2.0 mm、硬膜下0.5 mm。海马电极: 前囟后3.8 mm, 中线旁2.0 mm, 硬膜下2.6 mm,全部电极用牙托粉加502胶固定。采用日本San-EI八导脑电图机记录,电极连接:①右皮质-右耳;②右海马-右耳;定标:2 mm=50 μV;纸速:3 cm/s;脑电波波幅高5 mm为低幅、6~10 mm为中幅、11~20 mm为高幅,当出现尖波、棘波、尖(棘)慢综合波、多棘慢波时判定EEG为痫样活动。注药后先连续观察EEG 15 min,然后每隔5 min记录1 min,共记录1 h。计算痫波发放的潜伏期和频率,取10次记录中尖波或棘波数目的均值作为每min平均痫波发放频率。
, 百拇医药
1.3 行为观察
侧脑室注药后连续观察大鼠行为1 h,并记录痫样发作的潜伏期和发作程度,从注药到首次出现须动所需的时间为潜伏期,参考Schultz-Krohn[6]的标准以出现4~5级发作为重型发作,3级或3级以下为轻型发作。
1.4 免疫组织化学染色
各组动物于深麻醉下迅速经升主动脉顺序灌注生理盐水150 ml 、冷的 含40 g/L多聚甲醛的磷酸缓冲液(pH 7.4) 400 ml,持续约1 h,取材后固定于上述固定液3 h,后入200 g/L蔗糖磷酸缓冲液4 ℃过夜,次日恒冷箱切片(厚30 μm) ,取背侧海马最大切面,每4张取1张收集于PBS中,按下列程序进行免疫组织化学染色:0.03 % H2O2/甲醇室温下孵育30 min, 正常兔血清1∶50 37 ℃ 1 h,再入羊抗Fos血清(1:300 Cambridge Research Biochemical)中4 ℃孵育72 h, 生物素化兔抗羊IgG(1∶100 Boster) 37 ℃ 1 h,SABC液(1∶100 Boster) 37 ℃ 1 h,用DAB-4 HCl/H2O2呈色5 min,贴片、脱水、透明及封片。上述每一步骤间均用PBS充分漂洗,光镜下观察。对照试验: 用正常羊血清代替第一抗体孵育切片,结果为阴性。
, 百拇医药
1.5 显微图像分析
应用TTTY-400TC真彩色细胞图像分析仪对各组大鼠齿状回颗粒细胞层、海马回CA3区及梨形皮质的FOS免疫反应细胞进行显微图像分析,每组取10张切片,每张切片随机检测20个阳性细胞的光密度,计算其平均光密度。所有数据均以(
 ±s)表示,各组数据用t检验做差异显著性分析。
±s)表示,各组数据用t检验做差异显著性分析。2 结 果
2.1 行为表现
C组:无痫样表现。CL组:注射CL后均于15 min内出现痫样发作,6只动物均为重型发作;M+CL组:注射CL后平均25 min左右出现痫性发作,其中5只为轻型发作,1只无行为变化;B组:注射BIC后均于2 min内发作,6只均为重型发作。
, 百拇医药
2.2 EEG改变
C组:各导联均为α或β波,偶有θ波 即基础波(图1);CL组:注入CL后大鼠皮质及海马脑电图出现阵发性痫性放电,表现为高电位的棘慢波、尖慢波(图2);M+CL组:注入CL后各导联出现单个低到中电位棘-慢波,未见长、短程发放的多棘、多棘慢综合波(图3);B组:于BIC注射后30 s内即出现尖慢波,2 min开始出现阵发性多棘慢波,15 min出现长程高-特高幅棘慢波、尖-慢综合波(图4),以后放电频率逐渐减少。

图1 对照组脑电图以α、β波为主,偶见θ波。上:皮层; 下:海马。 下同

图2 CL致痫组脑电图呈短阵发放尖波、棘波、棘慢综合波

, 百拇医药
图3 蝇蕈醇+CL致痫组脑电图示以α、β波为主,偶发高电位棘-慢波

图4 荷包牡丹碱致痫组脑电图示高电位阵发性棘-慢波、尖-慢波
2.3 免疫组化结果
C组:在梨形皮质、海马偶见散在的FOS阳性细胞。CL组:致痫后1 h,注射侧齿状回颗粒细胞层有众多的Fos标记细胞(图5),对侧齿状回次之(图6);海马锥体细胞可见较多的Fos阳性细胞,但染色较齿状回弱;注射侧梨形皮质出现强阳性Fos标记细胞, 但对侧梨形皮质未见Fos标记细胞。M+CL组:致痫后1 h,双侧齿状回颗粒细胞层、海马Fos免疫反应明显减弱(图7),而梨形皮质与CL组无显著差异。B组:致痫后1 h,双侧梨形皮质均出现Fos阳性细胞,注射侧较对侧免疫反应强(图8),海马及齿状回未见Fos阳性细胞。各组大鼠梨形皮质、海马Fos表达变化的显微图像分析结果见附表。

, http://www.100md.com
图5 CL致痫1 h后注射侧齿状回颗粒细胞层,海马CA4区Fos免疫反应阳性细胞 ×40

图6 CL致痫1 h后对侧齿状回颗粒细胞层,海马CA4区Fos免疫反应阳性细胞 ×40

图7 M+CL组,CL注射1 h后注射侧齿状回颗粒细胞层Fos免疫反应阳性细胞 ×40

图8 BIC致痫1 h后注射侧梨形皮质Fos免疫反应阳性细胞 ×40
附表 各组大鼠梨形皮质、海马Fos表达的变化 (平均光密度) 组别
, 百拇医药
n
梨形皮质
海马CA3区
齿状回颗粒细胞
注射侧
对侧
注射侧
对侧
注射侧
对侧
C
4
-
, http://www.100md.com -
-
-
-
-
CL
6
0.22±0.02##
-
0.17±0.01
0.15±0.01++
0.20±0.02
0.18±0.02++
, 百拇医药
M+CL
6
0.15±0.01**
-
0.13±0.01**
0.13±0.01++
0.13±0.01**
0.12±0.01++
BIC
6
0.35±0.01**
, http://www.100md.com
0.19±0.03++
-
-
-
-
与C比较 ##P<0.01; 与CL比较 **P<0.01;与注射侧比较 ++P<0.013 讨 论
大量资料表明, 原癌基因c-fos、c-jun在神经元活动时表达活跃,被广泛用做神经元活动的标志物[3],在各种药物和电刺激诱发的癫痫模型,皆可诱导脑内c-fos基因的表达,但这种表达具有刺激特异性、细胞特异性和时程特异性[6];不同刺激所诱发的癫痫模型,其FOS表达的部位及持续时间不同[7],通过观察致痫后c-fos基因表达的情况,可以确定不同类型癫痫活动最初启动的脑区及播散范围。有研究者发现c-fos基因表达区域往往是Ca2+通道和兴奋性氨基酸受体密度最高的部位,而后两者与癫痫有密切关系。本实验发现,侧脑室注射CL 1 h后,Fos表达部位主要集中在双侧海马齿状回颗粒细胞层和锥体细胞层,注射侧强于对侧,这与刘庆莹等[8]报道的结果一致;梨形皮质Fos表达仅见于注射侧。而脑室内注射荷包牡丹碱(BIC)1 h后, 情况与此不同,Fos集中表达于双侧梨形皮质,海马未见Fos的表达。两种致痫剂Fos表达部位的不同,提示两者的致痫灶及作用机制可能不同。
, 百拇医药
有资料表明马桑内酯可引起海马谷氨酸免疫反应明显增强[8],证实了脑内谷氨酸含量增高是癫痫发作的因素之一;癫痫发作时GABAA受体γ2亚单位mRNA明显减少[9], 并且GABA神经元有不同程度的损伤[10];而且发现马桑内酯可使培养的海马、大脑皮质细胞内游离Ca2+明显增加,故推测马桑内酯致痫的过程可能为:马桑内酯通过电压门控或配体门控离子通道, 使胞内钙增加和激活第三信使, 从而促进基因转录, 使谷氨酸的合成和释放增加或GABA的功能减弱,导致神经元兴奋性增高和癫痫发作。本实验发现Fos蛋白的表达部位集中在双侧海马及注射侧的梨形皮质, 而对侧梨形皮质未见Fos表达。方一心等[11]在观察马桑内酯所致癫痫大鼠的脑组织化学时发现:某些酶的异常主要发生于大脑皮质运动区和海马的锥体细胞,与本实验Fos表达部位相似。
荷包牡丹碱是作用于GABAA受体识别位点的一种生物碱, 可选择性地阻断GABAA受体。GABAA受体与Cl-通道相偶联,通过调节对Cl-通道的开启和关闭发挥作用, 它和突触后膜的一些亚单位组成复合物,包括GABAA受体,苯二氮卓(benzodiazepine BZ)受体,印防己毒素受体和Cl-载体,统称GABAA受体-离子载体复合物[12],三种受体间存在生理偶联,当一种配体与其受体结合后,可通过变构效应相互影响,增加或抑制其他配基与其受体的结合[13]。GABA与受体结合可降低Cl-通道阻力,Cl-内流增加,引起突触后膜超极化,当兴奋性刺激传入时,通过防止膜的去极化达到突触后抑制。荷包牡丹碱对GABAA受体的阻断,妨碍了GABA的作用,使GABA-GABAA受体系统的活动减弱,进而导致谷氨酸-NMDA受体系统的活动相对增强,诱导c-fos表达, 导致癫痫发生[14]。荷包牡丹碱与马桑内酯诱导Fos表达部位的不同,可能与荷包牡丹碱致痫最初启动的脑区及传播途径与马桑内酯不同有关。Fedefic et al[15]研究发现在灌注液中加入荷包牡丹碱可诱导痫样活动,且其传播的速度及范围呈剂量依赖性,低剂量时(20 μmol/L)痫样活动仅见于内嗅皮质(EC)及内侧皮质杏仁核(PA),高剂量时(100 μmol/L)痫样活动波及至后梨形皮质、后鼻周皮质及岛叶。与此相似,本实验结果发现荷包牡丹碱致痫时Fos阳性细胞仅见于梨形皮质,提示荷包牡丹碱可能特异性作用于上述部位。
, 百拇医药
蝇蕈醇(muscimol)是一种强烈的GABAA受体激动剂,其作用比GABA强10倍,它可以作用于GABAA受体,使Cl-内流增强,引起突触后膜超极化。本实验在脑室内注射蝇蕈醇0.5 h后再注射马桑内酯,结果无论是EEG还是行为观察痫样活动均明显减弱,海马Fos表达也明显降低,说明蝇蕈醇对癫痫发作有强烈的抑制作用。
*国家自然科学基金资助项目(No. 39770755)
作者简介:马春玲,女,1964年生,博士研究生
参考文献
1 Meldrum B S. GABAergic mechanisms in the pathogenesis and treatment of epilepsy. Br J Clin Pharmacol, 1989, 27(Supple 1): 35
, 百拇医药
2 Tasker J G, Dudek F E. Electrophysiology of GABA-mediated synaptic transmission and possible roles in epilepsy. Neurochem Res,1991, 16: 251
3 Bullitt E. Expression of c-fos like protein as a marker for neuronal activity following noxious stimulation in the rat. J Comp Neurol, 1990,296:517
4 Kiessling M, Gass P. Immediate early gene expression in experimental epilepsy. Brain pathol, 1993,3:381
, 百拇医药 5 Sonnenberg J L, Mitchelmore C, Macgregor-Leon P F. Glutamate receptor agonists increase the expression of Fos,Fra and AP-1 DNA binding activity in the mammalian brain. J Neurosci Res,1989,24:72
6 朱和明,朱长庚.第三信使的诱导及其分子机制.神经解剖学杂志,1996,12 (1):75
7 Morgan J I, Curran T. Proto-oncogene transcription factors and epilepsy. Trends Pharmacol Sci, 1991,12(9):343
8 刘庆莹, 魏 瑛, 朱长庚等. 马桑内酯致痫大鼠海马c-fos原癌基因表达及谷氨酸免疫反应的变化. 解剖学报, 1996, 27(1):1
, http://www.100md.com
9 朱长庚,刘庆莹,朱家祥等.慢性癫痫大鼠海马内GABAA受体γ2亚单位的改变——原位杂交组织化学研究. 解剖学报,1995,26(4):352
10 朱长庚,蔡秋云,朱家祥等. 慢性癫痫动物模型海马内GABA能神经元的超微结构改变. 解剖学报,1994,25(4):345
11 方一心,吴良芳,宋玉芳等. 马桑内酯致痫大鼠的脑组织化学研究.华西医科大学学报,1987,18(2):107
12 Olsen R W. The GABA postsynaptic membrane receptor-ionophore complex. Mol Cell Biochem, 1981, 39: 261
13 Ticku M K, Maksay G. Convulsant /depressant site of action at the allosteric benzodiazepine-GABA receptor-ionophore complex. Life Science, 1983,33:2363
, 百拇医药
14 Gloor P. Epilepsy:relationships between electrophysiology and intracelllular mechanisms involving second messengers and gene expression. Can J Neurol Sci, 1989, 16: 8
15 Federico P, Macvicar B A. Imaging induction and spread of seizure activity in isolated brain of the guinea pig: the roles of GABA and glutamate receptors. J Neurophysiol, 1996, 76: 3471
收稿日期:1998-10-09, 百拇医药