SD大鼠血管内皮细胞损伤模型的制作方法
作者:赵建宏 林琳 高继发 曹卉 朱凡河 毛庆波
单位:赵建宏(济宁医学院中医学教研室, 邮政编码 济宁272013);林琳(病理生理学教研室);高继发(病理生理学教研室)曹卉(微生物学教研室);朱凡河(病理生理学教研室);毛庆波(病理生理学教研室)
关键词:大鼠;血管内皮;损伤;动物模型
微循环学杂志000210
目的: 建立SD大鼠血管内皮细胞损伤动物模型。方法: SD大鼠随机分为正常对照组和模型组。 模型组大鼠皮下注射稀释1.5倍的肾上腺素0.05/100 g, 连续5天。 于第4天起, 每二次给药中间时间将大鼠置于0℃冰水中5 min, 共4次。 正常对照组则皮下注射等量0.9% NS。 于第6天, 二组大鼠自颈总动脉取血, 分别测定CEC计数、 t-PA、 PAI活性、 6-Keto-PGF1α含量及血小板最大聚集率。结果: 模型组较正常对照组大鼠CEC计数、 PAI活性、 血小板最大聚集率明显升高(P<0.001~0.01), t-PA活性、 6-Keto-PGF1α含量降低(P<0.01~0.05)。结论: 大剂量肾上腺素加冰泳刺激确能造成SD大鼠血管内皮细胞损伤。
, 百拇医药
To Establish a Model of Vascular Endothelial Cell Injury in SD Rats
Zhao Jianhong, Lin Lin, Gao Jifa
(Jining Medical College, Jining 272013)
Objective: To establish a model of the vascular endothelial cells (VEC) injury in SD rats.Method: SD rats were randomly divided into the control and the model groups. The model rats were injected adrenaline diluted 1.5 multiple 0.05 ml/100 g for 5 days contionously. From 4th day, they were irritated 5 min into 0℃ cold-water in the middle of the time injecting adrenaline every two times. the control rats were given 0.9% NS as above. After 5 days, all rats were taken blood from their carotid arteries and detected the CEC count, t-PA、 PAI activities, 6-Keto-PGF1α content and the platelet aggregation rate max (CPAgTmax) respectively.Results: In the model group, as compared with those of the control group, t-PA activity and 6-Keto-PGF1α content decreased significantly(P<0.001~0.01).Conclusion: A large dose of adrenaline in combination with cold-water irritation can cause the VEC injury in SD rats certainly.
, 百拇医药
Key words:Rats; Endothelia; Injury; Model
近年的研究表明: 血管内皮细胞(vascular endothelial cell, VEC)损伤已成为许多疾病发 生发展的基本病理过程, 而且可能是血栓性疾病发生的重要因素之一[1,2]。 多 年来, 血栓性疾病与血液流变学的关系研究较多, 但随着细胞分子生物学的飞速发展, V EC形态及内分泌功能异常与血栓性疾病关系的研究倍受重视。 因此, 从保护VEC的形态及 功能这一新的角度研究新型有效的抗血栓药物, 对于血栓性疾病的防治具有良好的发展前 景及临床使用价值。 有鉴于此, 建立一种能够筛选新药的、 简便有效的VEC损伤动物模型 , 则是基本的保障条件。 本项实验应用大剂量肾上腺素, 同时给予冰泳刺激的方法, 复 制SD大鼠VEC损伤动物模型, 获得了成功。
1 材料与方法
, http://www.100md.com 1.1仪器、 试剂
1.1.1 仪器: GXM酶标光度计(四川分析仪器厂)、 TYXN-91A型智能血液聚 集仪(上海通用机电技术所)、 FT-646A型微机放免仪(北京核仪器厂)。
1.1.2 试剂: 盐酸肾上腺素制剂(北京制药厂提供)、 t-PA、 PAI活性试 剂盒(上海医科大学遗传学研究室提供)、 6-Keto-PGF1α放免试剂盒(北京东亚免 疫所提供)、 兔抗人ⅧR∶Ag抗血清、 羊抗兔FITC-IgG荧光抗体(上海华美生物制品公司 提供)。
1.2 实验方法
1.2.1 动物分组: SD大鼠34只, 体重230~290 g, 雌雄不拘(由山东医 科大学实验动物中心提供), 随机分为正常对照组和模型组各17只。
1.2.2 造模方法:
, 百拇医药
模型组: 将1 mg/ml的盐酸肾上腺素用0.9%生理盐水稀释1.5倍, 于每日的8∶0 0 am、 12∶00 am、 4∶00 pm均在皮下注射稀释后的盐酸肾上腺素0.05 ml /100 g, 连续5天, 自第4天起每二次给药中间时间将大鼠放入0℃的冰水中冰泳5 min, 共4次。
正常对照组: 于相同部位、 相同注射等量0.9%生理盐水。
1.2.3 检测指标:
于第6天晨, 将上述二组大鼠以3%戊巴比妥钠腹腔麻醉(4.5 mg/100 g), 自颈总动脉 取血分别做循环内皮细胞(CEC)计数、 血浆t-PA、 PAI活性、 6-Keto-PGF1α含 量、 血小板最大聚集率(PAgTmax)测定。
(1) CEC计数: 采用Hladovec方法[3]。 (2) 血浆t-PA、 PAI活性测定: 采用发 色底物分析法, 实验操作按试剂盒说明书。 (3) 6-Keto-PGF1α含量测定: 采用 放免法, 实验操作按试剂盒说明书。 (4) PAgTmax测定: 采用比浊法[4] 。
, 百拇医药
1.3 统计学分析
各项数据用 ±s表示, 采用t检验分析组间差异的显著性。
±s表示, 采用t检验分析组间差异的显著性。
1.4 CEC鉴定和观察
将少许CEC混悬液置于玻片上, 干后用95%甲醇固定5 min, 流水冲洗后, 再用PBS缓冲液 漂洗3次。 干后滴加兔抗人ⅧR∶Ag抗血清(将原液1∶100稀释), 37℃孵育30 min, 再用P BS缓冲液漂洗3次, 干后滴加羊抗兔FITC-IgG荧光抗体(将原液1∶4稀释), 37℃再孵育30 min, 再用PBS缓冲液漂洗3次。 干后滴加缓冲甘油, 置于Olympus-BH型荧光显微镜下观 察。 本实验排除了血小板等血细胞的影响, 镜下所见的免疫荧光细胞即CEC(见附图)。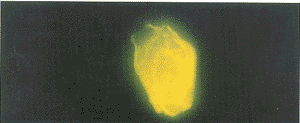
, http://www.100md.com
附图 荧光显微镜下的循环内皮细胞×400
2 结 果
大剂量肾上腺素加冰泳刺激后, 大鼠血中CEC数量较正常对照组明显增多(P<0.001 ), 表明模型组大鼠VEC损伤严重, 脱落增多; 同时VEC内分泌功能也发生变化, 表现为 t-PA活性明显降低(P<0.01), PAI活性明显升高(P<0.01), 6-Keto-P GF1α含量降低(P<0.05), PAgTmax显著升高(P<0.01), 结 果见附表。
附表 正常对照组及模型组大鼠各 项检测指标之比较(n均=17, ±s) 组 别
±s) 组 别
CEC计数
, http://www.100md.com (个/μl)
t-PA
(IU/ml)
PAI
(AU/ml)
6-Keto-PGF1α
(pg/ml)
PA gTmax
(%)
正 常
对照组
0.73±
, http://www.100md.com
0.16
4.49±
1.27
8.04±
2.2
115.95±
23.56
44.42±
11.45
模型组
2.36±
0.831)
, http://www.100md.com 2.11±
1.422)
17.33±
6.442)
79.41±
17.933)
68.13±
9.202)
注: 与正常对照组比较: 1) P<0.001, 2) P<0.01, 3) P<0.05
3 讨 论
, 百拇医药
VEC是衬附于血管腔内面的细胞, 它不仅具有屏障及转运功能, 而且还参与机体的凝血、 免疫、 生物活性物质的释放和血管舒缩功能的调节等生命重要过程。 广大的表面积是VEC 实现其复杂生理功能的基础, 同时也是VEC易于遭受损害的重要因素[1,5]。 现 已证实: CEC(circulating endothelial cellsf)即损伤脱落于血液循环中的VEC。 Ma rin[6]建立了从形态学上判断VEC损伤的标准, 确定VEC的缺失与脱落是VEC损伤最 重要的改变之一。 因此CEC数量的变化可以反映VEC损伤脱落的程度, 而且是活体内唯一直 接反映VEC损伤的特异性指标[7]。
目前国内外尚无成熟的VEC损伤动物模型。 我们依据有关报道: VEC是高血压损害的重要靶 器官, 急性血压升高时产生的机械性损害, 可导致VEC通透性增加, 形态和数量异常等血 管壁损伤, 血中新鲜脱落的CEC增多[8]。 据此, 我们根据肾上腺素具有强烈的 缩血管作用, 且冰泳刺激既可造成血管收缩, 又可作为一种不良刺激引起机体的应激反应 , 使内源性性肾腺素分泌增多, 三方面的作用迭加均可使血管痉挛加重, 血管内压力升 高, 应能造成大鼠VEC损伤。
, 百拇医药
我们选用反映VEC损伤程度的指标CEC计数及VEC产生、 释放的与凝血有关的生物活性物质t -PA、 PAI、 6-Keto-PGF1α(PGI2的代谢产物)及血小板聚集功能的变化加以佐 证。 结果显示: 模型组大鼠不仅VEC损伤脱落增多, 使CEC计数明显增加, 而且VEC内分 泌功能也发生变化, 出现抗栓作用降低(t-PA活性降低、 6-Keto-PGF1α含量降 低), 促栓作用增强(PAI活性升高), 由于VEC形态和功能受损, 使抗栓表面变成了致栓表 面, 将使机体易于发生血栓性疾病, 因而模型组大鼠血小板最大聚集率升高。 上述二方 面的变化充分证明: 大剂量肾上腺素加冰泳刺激确能造成大鼠VEC损伤。
本实验首次应用SD大鼠活体复制VEC损伤模型, 而且具有成功率高、 简便等特点。 该模型 的研制, 为从VEC角度完善血栓性疾病的病理生理机制、 阐明临床药理学原理、 寻找新型 血管保护剂、 预防血栓形成, 开辟了新的研究途径, 具有重要的临床实用价值。
, 百拇医药
山东省教委资助课题(J96K19)
本文作者简介:赵建宏(1958~), 男, 汉族, 副教授
参考文献
1,杨映波, 王正国. 循环内皮细胞研究进展. 生理科学进展, 1993, 24(1):70 ~72.
2,陈云波, 王奇, 赖世隆. 从血管内皮细胞功能改变看血瘀证实质及活血化瘀机 理. 中国中医基础医学杂志, 1996, 2(1):37~38.
3,Hladovec J, Rossman P. Circulating endothelial cells isolated together with platelet and the experimental modificatin of their counts in rats, Thromb Res, 1973, 3:665~764.
, 百拇医药
4,王鸿利, 包承鑫, 阮长耿, 等主编. 血栓与止血检验技术. 上海: 上海科学 技术出版社, 1992.24.
5,杨映波, 王正国, 朱佩芳, 等. 化学和机械损伤对血管内皮细胞的影响. 中 国病理生理杂志, 1996, 9(6):727~29.
6,Marin ML. Immunomodulation of vascular endothelium. l. Uitrostructural changes following ultraviolett B irradiation of periheral veins. J Surg Res, 19 90, 48:134.
7,Takahashi H, Harker LA. Measurement of human endothelial cells in whol e blood. Thromb Res, 1983, 31:1~12.
8,祝之明, 杨成明, 宋克群, 等. 高血压病患者血液中血管内皮细胞的变化及 临床意义. 中华心血管杂志, 1991, 19(4):15~19.
本文1999-11-19收到, 2000-04-24接受, 百拇医药
单位:赵建宏(济宁医学院中医学教研室, 邮政编码 济宁272013);林琳(病理生理学教研室);高继发(病理生理学教研室)曹卉(微生物学教研室);朱凡河(病理生理学教研室);毛庆波(病理生理学教研室)
关键词:大鼠;血管内皮;损伤;动物模型
微循环学杂志000210
目的: 建立SD大鼠血管内皮细胞损伤动物模型。方法: SD大鼠随机分为正常对照组和模型组。 模型组大鼠皮下注射稀释1.5倍的肾上腺素0.05/100 g, 连续5天。 于第4天起, 每二次给药中间时间将大鼠置于0℃冰水中5 min, 共4次。 正常对照组则皮下注射等量0.9% NS。 于第6天, 二组大鼠自颈总动脉取血, 分别测定CEC计数、 t-PA、 PAI活性、 6-Keto-PGF1α含量及血小板最大聚集率。结果: 模型组较正常对照组大鼠CEC计数、 PAI活性、 血小板最大聚集率明显升高(P<0.001~0.01), t-PA活性、 6-Keto-PGF1α含量降低(P<0.01~0.05)。结论: 大剂量肾上腺素加冰泳刺激确能造成SD大鼠血管内皮细胞损伤。
, 百拇医药
To Establish a Model of Vascular Endothelial Cell Injury in SD Rats
Zhao Jianhong, Lin Lin, Gao Jifa
(Jining Medical College, Jining 272013)
Objective: To establish a model of the vascular endothelial cells (VEC) injury in SD rats.Method: SD rats were randomly divided into the control and the model groups. The model rats were injected adrenaline diluted 1.5 multiple 0.05 ml/100 g for 5 days contionously. From 4th day, they were irritated 5 min into 0℃ cold-water in the middle of the time injecting adrenaline every two times. the control rats were given 0.9% NS as above. After 5 days, all rats were taken blood from their carotid arteries and detected the CEC count, t-PA、 PAI activities, 6-Keto-PGF1α content and the platelet aggregation rate max (CPAgTmax) respectively.Results: In the model group, as compared with those of the control group, t-PA activity and 6-Keto-PGF1α content decreased significantly(P<0.001~0.01).Conclusion: A large dose of adrenaline in combination with cold-water irritation can cause the VEC injury in SD rats certainly.
, 百拇医药
Key words:Rats; Endothelia; Injury; Model
近年的研究表明: 血管内皮细胞(vascular endothelial cell, VEC)损伤已成为许多疾病发 生发展的基本病理过程, 而且可能是血栓性疾病发生的重要因素之一[1,2]。 多 年来, 血栓性疾病与血液流变学的关系研究较多, 但随着细胞分子生物学的飞速发展, V EC形态及内分泌功能异常与血栓性疾病关系的研究倍受重视。 因此, 从保护VEC的形态及 功能这一新的角度研究新型有效的抗血栓药物, 对于血栓性疾病的防治具有良好的发展前 景及临床使用价值。 有鉴于此, 建立一种能够筛选新药的、 简便有效的VEC损伤动物模型 , 则是基本的保障条件。 本项实验应用大剂量肾上腺素, 同时给予冰泳刺激的方法, 复 制SD大鼠VEC损伤动物模型, 获得了成功。
1 材料与方法
, http://www.100md.com 1.1仪器、 试剂
1.1.1 仪器: GXM酶标光度计(四川分析仪器厂)、 TYXN-91A型智能血液聚 集仪(上海通用机电技术所)、 FT-646A型微机放免仪(北京核仪器厂)。
1.1.2 试剂: 盐酸肾上腺素制剂(北京制药厂提供)、 t-PA、 PAI活性试 剂盒(上海医科大学遗传学研究室提供)、 6-Keto-PGF1α放免试剂盒(北京东亚免 疫所提供)、 兔抗人ⅧR∶Ag抗血清、 羊抗兔FITC-IgG荧光抗体(上海华美生物制品公司 提供)。
1.2 实验方法
1.2.1 动物分组: SD大鼠34只, 体重230~290 g, 雌雄不拘(由山东医 科大学实验动物中心提供), 随机分为正常对照组和模型组各17只。
1.2.2 造模方法:
, 百拇医药
模型组: 将1 mg/ml的盐酸肾上腺素用0.9%生理盐水稀释1.5倍, 于每日的8∶0 0 am、 12∶00 am、 4∶00 pm均在皮下注射稀释后的盐酸肾上腺素0.05 ml /100 g, 连续5天, 自第4天起每二次给药中间时间将大鼠放入0℃的冰水中冰泳5 min, 共4次。
正常对照组: 于相同部位、 相同注射等量0.9%生理盐水。
1.2.3 检测指标:
于第6天晨, 将上述二组大鼠以3%戊巴比妥钠腹腔麻醉(4.5 mg/100 g), 自颈总动脉 取血分别做循环内皮细胞(CEC)计数、 血浆t-PA、 PAI活性、 6-Keto-PGF1α含 量、 血小板最大聚集率(PAgTmax)测定。
(1) CEC计数: 采用Hladovec方法[3]。 (2) 血浆t-PA、 PAI活性测定: 采用发 色底物分析法, 实验操作按试剂盒说明书。 (3) 6-Keto-PGF1α含量测定: 采用 放免法, 实验操作按试剂盒说明书。 (4) PAgTmax测定: 采用比浊法[4] 。
, 百拇医药
1.3 统计学分析
各项数据用
 ±s表示, 采用t检验分析组间差异的显著性。
±s表示, 采用t检验分析组间差异的显著性。1.4 CEC鉴定和观察
将少许CEC混悬液置于玻片上, 干后用95%甲醇固定5 min, 流水冲洗后, 再用PBS缓冲液 漂洗3次。 干后滴加兔抗人ⅧR∶Ag抗血清(将原液1∶100稀释), 37℃孵育30 min, 再用P BS缓冲液漂洗3次, 干后滴加羊抗兔FITC-IgG荧光抗体(将原液1∶4稀释), 37℃再孵育30 min, 再用PBS缓冲液漂洗3次。 干后滴加缓冲甘油, 置于Olympus-BH型荧光显微镜下观 察。 本实验排除了血小板等血细胞的影响, 镜下所见的免疫荧光细胞即CEC(见附图)。

, http://www.100md.com
附图 荧光显微镜下的循环内皮细胞×400
2 结 果
大剂量肾上腺素加冰泳刺激后, 大鼠血中CEC数量较正常对照组明显增多(P<0.001 ), 表明模型组大鼠VEC损伤严重, 脱落增多; 同时VEC内分泌功能也发生变化, 表现为 t-PA活性明显降低(P<0.01), PAI活性明显升高(P<0.01), 6-Keto-P GF1α含量降低(P<0.05), PAgTmax显著升高(P<0.01), 结 果见附表。
附表 正常对照组及模型组大鼠各 项检测指标之比较(n均=17,
 ±s) 组 别
±s) 组 别CEC计数
, http://www.100md.com (个/μl)
t-PA
(IU/ml)
PAI
(AU/ml)
6-Keto-PGF1α
(pg/ml)
PA gTmax
(%)
正 常
对照组
0.73±
, http://www.100md.com
0.16
4.49±
1.27
8.04±
2.2
115.95±
23.56
44.42±
11.45
模型组
2.36±
0.831)
, http://www.100md.com 2.11±
1.422)
17.33±
6.442)
79.41±
17.933)
68.13±
9.202)
注: 与正常对照组比较: 1) P<0.001, 2) P<0.01, 3) P<0.05
3 讨 论
, 百拇医药
VEC是衬附于血管腔内面的细胞, 它不仅具有屏障及转运功能, 而且还参与机体的凝血、 免疫、 生物活性物质的释放和血管舒缩功能的调节等生命重要过程。 广大的表面积是VEC 实现其复杂生理功能的基础, 同时也是VEC易于遭受损害的重要因素[1,5]。 现 已证实: CEC(circulating endothelial cellsf)即损伤脱落于血液循环中的VEC。 Ma rin[6]建立了从形态学上判断VEC损伤的标准, 确定VEC的缺失与脱落是VEC损伤最 重要的改变之一。 因此CEC数量的变化可以反映VEC损伤脱落的程度, 而且是活体内唯一直 接反映VEC损伤的特异性指标[7]。
目前国内外尚无成熟的VEC损伤动物模型。 我们依据有关报道: VEC是高血压损害的重要靶 器官, 急性血压升高时产生的机械性损害, 可导致VEC通透性增加, 形态和数量异常等血 管壁损伤, 血中新鲜脱落的CEC增多[8]。 据此, 我们根据肾上腺素具有强烈的 缩血管作用, 且冰泳刺激既可造成血管收缩, 又可作为一种不良刺激引起机体的应激反应 , 使内源性性肾腺素分泌增多, 三方面的作用迭加均可使血管痉挛加重, 血管内压力升 高, 应能造成大鼠VEC损伤。
, 百拇医药
我们选用反映VEC损伤程度的指标CEC计数及VEC产生、 释放的与凝血有关的生物活性物质t -PA、 PAI、 6-Keto-PGF1α(PGI2的代谢产物)及血小板聚集功能的变化加以佐 证。 结果显示: 模型组大鼠不仅VEC损伤脱落增多, 使CEC计数明显增加, 而且VEC内分 泌功能也发生变化, 出现抗栓作用降低(t-PA活性降低、 6-Keto-PGF1α含量降 低), 促栓作用增强(PAI活性升高), 由于VEC形态和功能受损, 使抗栓表面变成了致栓表 面, 将使机体易于发生血栓性疾病, 因而模型组大鼠血小板最大聚集率升高。 上述二方 面的变化充分证明: 大剂量肾上腺素加冰泳刺激确能造成大鼠VEC损伤。
本实验首次应用SD大鼠活体复制VEC损伤模型, 而且具有成功率高、 简便等特点。 该模型 的研制, 为从VEC角度完善血栓性疾病的病理生理机制、 阐明临床药理学原理、 寻找新型 血管保护剂、 预防血栓形成, 开辟了新的研究途径, 具有重要的临床实用价值。
, 百拇医药
山东省教委资助课题(J96K19)
本文作者简介:赵建宏(1958~), 男, 汉族, 副教授
参考文献
1,杨映波, 王正国. 循环内皮细胞研究进展. 生理科学进展, 1993, 24(1):70 ~72.
2,陈云波, 王奇, 赖世隆. 从血管内皮细胞功能改变看血瘀证实质及活血化瘀机 理. 中国中医基础医学杂志, 1996, 2(1):37~38.
3,Hladovec J, Rossman P. Circulating endothelial cells isolated together with platelet and the experimental modificatin of their counts in rats, Thromb Res, 1973, 3:665~764.
, 百拇医药
4,王鸿利, 包承鑫, 阮长耿, 等主编. 血栓与止血检验技术. 上海: 上海科学 技术出版社, 1992.24.
5,杨映波, 王正国, 朱佩芳, 等. 化学和机械损伤对血管内皮细胞的影响. 中 国病理生理杂志, 1996, 9(6):727~29.
6,Marin ML. Immunomodulation of vascular endothelium. l. Uitrostructural changes following ultraviolett B irradiation of periheral veins. J Surg Res, 19 90, 48:134.
7,Takahashi H, Harker LA. Measurement of human endothelial cells in whol e blood. Thromb Res, 1983, 31:1~12.
8,祝之明, 杨成明, 宋克群, 等. 高血压病患者血液中血管内皮细胞的变化及 临床意义. 中华心血管杂志, 1991, 19(4):15~19.
本文1999-11-19收到, 2000-04-24接受, 百拇医药