Lp(a)与LDL氧化修饰的比较
作者:林春榕 洪嘉玲 吴学东
单位:林春榕 云南大理医学院生物化学教研室,吴学东 外科学教研室,云南大理671000;洪嘉玲 湖北医科大学生物化学教研室,武汉430071
关键词:脂蛋白(a);低密度脂蛋白;氧化修饰
基础医学与临床990512 摘要 脂蛋白(a)[Lp(a)]是一种特殊的血浆脂蛋白,其结构、理化性质和脂质组成与低密度脂蛋白(LDL)极为相似。氧化低密度脂蛋白(Ox-LDL)在动脉粥样硬化(AS)的发生、发展中起重要作用,Lp(a)的氧化亦发生于体内动脉壁。在体外,Lp(a)能经铜离子(Cu2+)介导发生氧化修饰,但与LDL相比,Lp(a)氧化的延迟时间是LDL的1.62倍,氧化速率和氧化程度均只有LDL的63%,故Lp(a)对氧化的敏感性和氧化程度均较LDL为低,其高度致AS作用,难以完全用较高的氧化敏感性来加以解释。
, http://www.100md.com
Comparasion of Lp(a) and LDL Oxidative Modification
Lin Chunrong1 Hong Jialing2 Wu Xuedong3
(1、3 DaLi Medical College;2 HuBei Medical University)
Lipoprotein(a) is a specific plasma lipoprotein that closely resembles LDL in structure,physical and chemical properties,and lipid compositions.Oxidation of LDL plays a pivotal role in foam cell formation; while Lp(a) oxidation also occurs in vivo in the arterial wall.In copper (Ⅱ)-induced lipid peroxidation experiments in vitro,the lag-phase of Lp(a) was 1.62 longer,while the propgagtion phase and total diene production were 63% lower than the corresponding LDL preparation from the same blood donor.It implies that the susceptiblity of Lp(a) for oxidation was lower than that of LDL,and the postulated higher atherogenic properties of Lp(a) as compared to LDL might not be directly related to a higher sensitivity towards oxidative modifications.
, 百拇医药
Key words Lipoprotein(a) LDL Oxidative modification
脂蛋白(a)[Lp(a)]是一种高度致动脉粥样硬化(AS)的血浆脂蛋白,其血浆浓度大于300mg/L时,被认为是AS和心肌梗塞的独立危险因子[1]。Lp(a)是一种直径比低密度脂蛋白(LDL)大的球形颗粒,由载脂蛋白(a)[apo(a)]和一个类似LDL的脂蛋白颗粒组成,其结构、理化性质和脂质组成与LDL极为相似[2]。用免疫荧光方法发现,动脉内皮下基质有Lp(a)的聚集,浓度与其血浆浓度呈正相关[3],从手术获得的人动脉粥样斑块中提取出氧化脂蛋白(a)[Ox-Lp(a)]进一步证实,Lp(a)的氧化修饰发生于体内的动脉壁[4]。
在体外,Lp(a)能否也象LDL一样被氧化修饰,其对氧化的敏感性和氧化程度与LDL相比有何不同。本文就上述问题比较研究了Lp(a)与LDL在体外经Cu2+介导的氧化修饰,以期进一步从脂质过氧化促使泡沫细胞形成的角度阐明Lp(a)高度致AS形成的机理。
, http://www.100md.com
1 材料与方法
1.1 材料与仪器
Sepharose 6B(Pharmacia公司产品);羊抗人apo(a)、apoB抗血清(湖北医科大学生物化学教研室提供);超速离心机(L8-80M型、美国贝克曼公司);全自动层析仪(美国Bio-Rad公司);UV-265自动记录分光光度仪(日本岛津公司)。
1.2 方法
1.2.1 Lp(a)、LDL的分离、纯化:用快速ELISA法筛选高Lp(a)含量血,密度梯度超速离心分离Lp(a)、50 000r/min,22h,离心两次,收集d=1.055~1.120g/mL部分。透析、浓缩后上Sepharose 6B柱(1.6×100cm),10 ℃,0.01mol/L PBS平衡及洗脱,用全自动层析仪在280nm波长处监测,收集A280峰值各管。蛋白质含量按Lowry法测定。
, 百拇医药
1.2.2 Lp(a)、LDL的纯度鉴定:预染脂蛋白聚丙烯酰胺凝胶电泳,苏丹黑预染脂蛋白、3.85%分离胶、2.5%浓缩胶、电泳90min;双层火箭免疫电泳;制备分别含抗apo(a)、抗apoB抗体的双层琼脂糖凝胶板,在含抗apo(a)抗体的凝胶一侧打孔,上样后,电压10V/cm,电泳9h。
1.2.3 Lp(a)与LDL的氧化修饰:将分离纯化的Lp(a)和LDL对0.01mol/L PBS分别充氮透析24h,取1mg/mL(蛋白浓度)的Lp(a)和LDL中分别加CuSO4至终浓度20μmol/L,37 ℃起动氧化反应。氧化过程中,用自动记录紫外分光光度仪在240min内,每30min连续监测234nm波长处吸光值的变化。同时用硫代巴比妥酸比色法[5]测脂质过氧化物的含量。5h后加EDTA.Na2终止氧化反应。预染脂蛋白琼脂糖凝胶电泳,观察氧化修饰后脂蛋白电负性的改变。
, http://www.100md.com
2 结果
2.1 Lp(a)、LDL的纯化
经密度梯度超速离心所得d=1.055~1.120g/mL部分,在Sepharose 6B凝胶柱层析洗脱图中呈现三个连续洗脱峰(见图1),根据分子量大小推测最先洗脱下来的I峰为VLDL,Ⅱ峰为Lp(a),LDL形成峰Ⅲ。然后进一步对峰Ⅱ、峰Ⅲ进行纯度鉴定。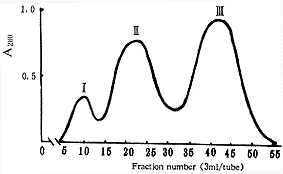
图1 脂蛋白(d=1.055~1.120g/mL)凝胶柱层析洗脱图
Fig1 Elution profile of the gel column chromatography of lipoproteins (d=1.055~1.120g/mL)
2.2 Lp(a)、LDL的纯度鉴定
, http://www.100md.com
预染脂蛋白聚丙烯酰胺凝胶电泳结果显示(图2):峰Ⅱ的中间部分表现为单一区带,其电泳位置介于血清β和前β脂蛋白之间,峰Ⅱ、峰Ⅲ的交界部分有两条区带,一条位置同峰Ⅱ的中间部分,另一条位置同血清β脂蛋白,峰Ⅲ的后半部分为单一区带,位置同血清β脂蛋白。进一步通过双层火箭免疫电泳证实(图3),峰Ⅱ的中间部分只在含抗apo(a)抗体的凝胶一侧形成火箭峰,峰Ⅲ后半部分只在含抗apoB凝胶一侧产生火箭峰,两峰交界部分则在含抗apo(a)和抗apoB两部分凝胶中均产生火箭峰。鉴定结果表明,峰Ⅱ中间部分为纯Lp(a),而峰Ⅲ的后半部分为纯LDL。
图2 预染脂蛋白PAGE电泳图谱
Fig2 PAGE electrophoretograms of lipoproteins pre-stained for lipid (the arrow shows the start of 3.85% polyacrylamide gel)
, 百拇医药
A. tubes 18~27 B. tubes 28~37
C. tubes 38~55 D. serum
图3 脂蛋白双层火箭免疫电泳图谱
Fig3 The double-decker rocket immunoelectrophoretograms of lipoproteins
1,2. tubes 18~27 3,4. tubes 28~37 5,6. tubes 38~55
2.3 Lp(a)与LDL的氧化修饰
脂质氧化产生的结合二烯在234nm处有一吸收高峰,运用消光系数29500可计算结合二烯的形成量。以二烯的形成量为纵轴,时间为横轴作图,延迟相用曲线的切线与横轴的截距表示,氧化的速率为最大二烯形成量/Tmax,氧化程度用二烯产生的最大量表示。结果如图4、表1所示。在氧化过程中不同时间点所测Lp(a)氧化产生的结合二烯量均比LDL低。经测算,Lp(a)氧化的延迟时间是LDL的1.62倍,氧化速率和氧化程度均只有LDL的63%。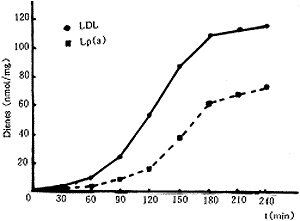
, 百拇医药
图4 Lp(a)和LDL氧化的动态变化
Fig4 Kinetics of Lp(a) and LDLoxidation
表1 Lp(a)与LDL的氧化参数
Table1 Oxidation Parameters of Lp(a) and LDL
lipoproteins
Conjoigated dienes
(nM/mg)
Rate of diene formation
(nM/mg.min)
, 百拇医药
Lag phase
(min)
Relative lag
phase of Lp(a)
Lp(a)
71
0.296
102
1.62
LDL
113
0.47
, 百拇医药 63
在同等条件下,用硫代巴比妥酸比色法测脂质过氧化产物丙二醛(Malondialdehyde,MDA)的产生量,Lp(a)的MDA产生量也比LDL低,且与结合二烯产生量有相同的变化趋势(图5)。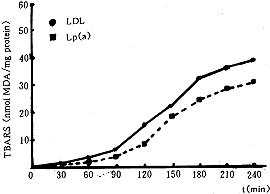
图5 Lp(a)和LDL氧化过程中硫代巴比妥酸反应物质的产生量
Fig5 Production of TBARS in Lp(a) and LDL oxidation
预染脂蛋白琼脂糖凝胶电泳结果显示(图6),Lp(a)、LDL经氧化修饰后,电泳迁移率均明显增加,相对增加的幅度Ox-LDL大于Ox-Lp(a)。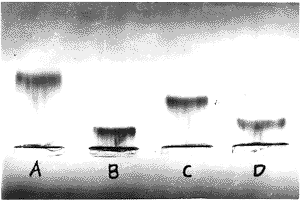
, http://www.100md.com
图6 天然和氧化Lp(a)和LDL的琼脂糖凝胶电泳图
Fig6 Agrose gel electrophoresis of native and oxidized Lp(a) and LDL
A. ox-LDL B. n-LDL C. ox-Lp(a) D. n-Lp(a)
3 讨论
本文旨在比较Lp(a)、LDL在体外的氧化修饰,获得绝对纯品至关重要,然而血中Lp(a)含量低,虽有特征性的抗原apo(a),但其组成成份中部分与LDL相似,密度范围与LDL和HDL有部分重叠,且Lp(a)呈现分子大小和水合密度上的异质性[6],故分离纯化的难度大。本研究在分离纯化前先筛选 出高Lp(a)含量血,用密度梯度超速离心获得d=1.055~1.120g/mL的脂蛋白部分,再经凝胶柱层析将混杂在该密度范围内的LDL与Lp(a)完全分离,经鉴定证明,所得Lp(a)和LDL均为纯品。在分离过程中,直接将血浆调至所需密度,分两次超速离心,避免离心过程中密度层改变,减少了Lp(a)的损耗。
, 百拇医药
为了明确Lp(a)在体外发生氧化修饰的过程,进一步了解Lp(a)致AS的机理,本文比较研究了Lp(a)与LDL在体外经Cu2+介导氧化反应的动力学参数,发现从同一个体中分离纯化的Lp(a)与LDL相比,其对氧化的敏感度和氧化程度均较低。Lp(a)与LDL脂质组成、含量极为相似,抗氧化物组分的含量也无明显差异[7]。引起Lp(a)对氧化敏感程度较低的原因可能在于其所含特殊抗原成分Apo(a)。Sattler等[8]在研究中发现Apo(a)含有较高的N-乙酰神经氨酸,有阻碍Lp(a)被氧化的功能。脂质过氧化产物MDA通过结合于载脂蛋白的赖氨酸残基修饰脂蛋白,Lp(a)的赖氨酸残基89%以上分布于Apo B100,位于Lp(a)颗粒表面的Apo(a)对MDA修饰的位阻,可能也是Lp(a)较LDL难于氧化的原因之一[9]。
总之,Lp(a)能发生氧化修饰,这是其致AS的重要机制之一。然而,Lp(a)作为AS,心肌梗塞的独立危险因子,对AS的发生较LDL及其它脂质参数有更强的预示性,但其高度致AS作用却难以完全用较高的氧化敏感性及氧化程度来进行解释;当然,对Lp(a)氧化修饰后理化性质及生物学特性的改变,Ox-Lp(a)在AS形成中的许多机理均有待于进一步研究。
, 百拇医药
作者简介:洪学东 博士生导师
参考文献
1 Scann AM,GM Fless.Lipoprotein (a): heterogeneity and biological relevance.J Clin Invest,1990,85:1709
2 Gaubatz JW,C Heideman,AM Gotto,et al.Human plasma Lp(a) structural properties.J Biol Chem,1983,258:4582
3 Repin JM,JA O Neil,HF Hoff.Quantlfication of apo(a) and apoB in human atherosclerotic lesions.J Lipid Res,1991,32:317
, 百拇医药
4 Hoff HF.Partial characterization of lipoproteins containing apo(a) in human atherosclerotic lesions.J Lipid Res,1993,34:789
5 Ramos R.Effect of temperture and phase transition on oxidation resistance of LDL.J Lipid Res,1995,36:2113
6 M Bewu AD and DN Durrington.Lipoprotein (a): structure,properties and possible involvement in thrombogenesis and atherogenesis.Atherosclerosis,1990,85:1
7 Naruszewicz M,E Selinger,J Davignon.Oxidation modification of Lp(a) and the β-carotene.Metabolism,1992,41:1215
8 Sattler W,GM Kostner,G Waeg,et al.Oxidation of Lp(a): a comparison with LDL.Biochem Biophy Acta,1991,1081:65
9 Haberland ME,GM Fless,AM Scanu,et al.Malondialdehyde modification of Lp(a) produces avid uptake by human monocyte-macrophages.J Biol Chem,1992,267:4143, 百拇医药
单位:林春榕 云南大理医学院生物化学教研室,吴学东 外科学教研室,云南大理671000;洪嘉玲 湖北医科大学生物化学教研室,武汉430071
关键词:脂蛋白(a);低密度脂蛋白;氧化修饰
基础医学与临床990512 摘要 脂蛋白(a)[Lp(a)]是一种特殊的血浆脂蛋白,其结构、理化性质和脂质组成与低密度脂蛋白(LDL)极为相似。氧化低密度脂蛋白(Ox-LDL)在动脉粥样硬化(AS)的发生、发展中起重要作用,Lp(a)的氧化亦发生于体内动脉壁。在体外,Lp(a)能经铜离子(Cu2+)介导发生氧化修饰,但与LDL相比,Lp(a)氧化的延迟时间是LDL的1.62倍,氧化速率和氧化程度均只有LDL的63%,故Lp(a)对氧化的敏感性和氧化程度均较LDL为低,其高度致AS作用,难以完全用较高的氧化敏感性来加以解释。
, http://www.100md.com
Comparasion of Lp(a) and LDL Oxidative Modification
Lin Chunrong1 Hong Jialing2 Wu Xuedong3
(1、3 DaLi Medical College;2 HuBei Medical University)
Lipoprotein(a) is a specific plasma lipoprotein that closely resembles LDL in structure,physical and chemical properties,and lipid compositions.Oxidation of LDL plays a pivotal role in foam cell formation; while Lp(a) oxidation also occurs in vivo in the arterial wall.In copper (Ⅱ)-induced lipid peroxidation experiments in vitro,the lag-phase of Lp(a) was 1.62 longer,while the propgagtion phase and total diene production were 63% lower than the corresponding LDL preparation from the same blood donor.It implies that the susceptiblity of Lp(a) for oxidation was lower than that of LDL,and the postulated higher atherogenic properties of Lp(a) as compared to LDL might not be directly related to a higher sensitivity towards oxidative modifications.
, 百拇医药
Key words Lipoprotein(a) LDL Oxidative modification
脂蛋白(a)[Lp(a)]是一种高度致动脉粥样硬化(AS)的血浆脂蛋白,其血浆浓度大于300mg/L时,被认为是AS和心肌梗塞的独立危险因子[1]。Lp(a)是一种直径比低密度脂蛋白(LDL)大的球形颗粒,由载脂蛋白(a)[apo(a)]和一个类似LDL的脂蛋白颗粒组成,其结构、理化性质和脂质组成与LDL极为相似[2]。用免疫荧光方法发现,动脉内皮下基质有Lp(a)的聚集,浓度与其血浆浓度呈正相关[3],从手术获得的人动脉粥样斑块中提取出氧化脂蛋白(a)[Ox-Lp(a)]进一步证实,Lp(a)的氧化修饰发生于体内的动脉壁[4]。
在体外,Lp(a)能否也象LDL一样被氧化修饰,其对氧化的敏感性和氧化程度与LDL相比有何不同。本文就上述问题比较研究了Lp(a)与LDL在体外经Cu2+介导的氧化修饰,以期进一步从脂质过氧化促使泡沫细胞形成的角度阐明Lp(a)高度致AS形成的机理。
, http://www.100md.com
1 材料与方法
1.1 材料与仪器
Sepharose 6B(Pharmacia公司产品);羊抗人apo(a)、apoB抗血清(湖北医科大学生物化学教研室提供);超速离心机(L8-80M型、美国贝克曼公司);全自动层析仪(美国Bio-Rad公司);UV-265自动记录分光光度仪(日本岛津公司)。
1.2 方法
1.2.1 Lp(a)、LDL的分离、纯化:用快速ELISA法筛选高Lp(a)含量血,密度梯度超速离心分离Lp(a)、50 000r/min,22h,离心两次,收集d=1.055~1.120g/mL部分。透析、浓缩后上Sepharose 6B柱(1.6×100cm),10 ℃,0.01mol/L PBS平衡及洗脱,用全自动层析仪在280nm波长处监测,收集A280峰值各管。蛋白质含量按Lowry法测定。
, 百拇医药
1.2.2 Lp(a)、LDL的纯度鉴定:预染脂蛋白聚丙烯酰胺凝胶电泳,苏丹黑预染脂蛋白、3.85%分离胶、2.5%浓缩胶、电泳90min;双层火箭免疫电泳;制备分别含抗apo(a)、抗apoB抗体的双层琼脂糖凝胶板,在含抗apo(a)抗体的凝胶一侧打孔,上样后,电压10V/cm,电泳9h。
1.2.3 Lp(a)与LDL的氧化修饰:将分离纯化的Lp(a)和LDL对0.01mol/L PBS分别充氮透析24h,取1mg/mL(蛋白浓度)的Lp(a)和LDL中分别加CuSO4至终浓度20μmol/L,37 ℃起动氧化反应。氧化过程中,用自动记录紫外分光光度仪在240min内,每30min连续监测234nm波长处吸光值的变化。同时用硫代巴比妥酸比色法[5]测脂质过氧化物的含量。5h后加EDTA.Na2终止氧化反应。预染脂蛋白琼脂糖凝胶电泳,观察氧化修饰后脂蛋白电负性的改变。
, http://www.100md.com
2 结果
2.1 Lp(a)、LDL的纯化
经密度梯度超速离心所得d=1.055~1.120g/mL部分,在Sepharose 6B凝胶柱层析洗脱图中呈现三个连续洗脱峰(见图1),根据分子量大小推测最先洗脱下来的I峰为VLDL,Ⅱ峰为Lp(a),LDL形成峰Ⅲ。然后进一步对峰Ⅱ、峰Ⅲ进行纯度鉴定。

图1 脂蛋白(d=1.055~1.120g/mL)凝胶柱层析洗脱图
Fig1 Elution profile of the gel column chromatography of lipoproteins (d=1.055~1.120g/mL)
2.2 Lp(a)、LDL的纯度鉴定
, http://www.100md.com
预染脂蛋白聚丙烯酰胺凝胶电泳结果显示(图2):峰Ⅱ的中间部分表现为单一区带,其电泳位置介于血清β和前β脂蛋白之间,峰Ⅱ、峰Ⅲ的交界部分有两条区带,一条位置同峰Ⅱ的中间部分,另一条位置同血清β脂蛋白,峰Ⅲ的后半部分为单一区带,位置同血清β脂蛋白。进一步通过双层火箭免疫电泳证实(图3),峰Ⅱ的中间部分只在含抗apo(a)抗体的凝胶一侧形成火箭峰,峰Ⅲ后半部分只在含抗apoB凝胶一侧产生火箭峰,两峰交界部分则在含抗apo(a)和抗apoB两部分凝胶中均产生火箭峰。鉴定结果表明,峰Ⅱ中间部分为纯Lp(a),而峰Ⅲ的后半部分为纯LDL。

图2 预染脂蛋白PAGE电泳图谱
Fig2 PAGE electrophoretograms of lipoproteins pre-stained for lipid (the arrow shows the start of 3.85% polyacrylamide gel)
, 百拇医药
A. tubes 18~27 B. tubes 28~37
C. tubes 38~55 D. serum

图3 脂蛋白双层火箭免疫电泳图谱
Fig3 The double-decker rocket immunoelectrophoretograms of lipoproteins
1,2. tubes 18~27 3,4. tubes 28~37 5,6. tubes 38~55
2.3 Lp(a)与LDL的氧化修饰
脂质氧化产生的结合二烯在234nm处有一吸收高峰,运用消光系数29500可计算结合二烯的形成量。以二烯的形成量为纵轴,时间为横轴作图,延迟相用曲线的切线与横轴的截距表示,氧化的速率为最大二烯形成量/Tmax,氧化程度用二烯产生的最大量表示。结果如图4、表1所示。在氧化过程中不同时间点所测Lp(a)氧化产生的结合二烯量均比LDL低。经测算,Lp(a)氧化的延迟时间是LDL的1.62倍,氧化速率和氧化程度均只有LDL的63%。

, 百拇医药
图4 Lp(a)和LDL氧化的动态变化
Fig4 Kinetics of Lp(a) and LDLoxidation
表1 Lp(a)与LDL的氧化参数
Table1 Oxidation Parameters of Lp(a) and LDL
lipoproteins
Conjoigated dienes
(nM/mg)
Rate of diene formation
(nM/mg.min)
, 百拇医药
Lag phase
(min)
Relative lag
phase of Lp(a)
Lp(a)
71
0.296
102
1.62
LDL
113
0.47
, 百拇医药 63
在同等条件下,用硫代巴比妥酸比色法测脂质过氧化产物丙二醛(Malondialdehyde,MDA)的产生量,Lp(a)的MDA产生量也比LDL低,且与结合二烯产生量有相同的变化趋势(图5)。

图5 Lp(a)和LDL氧化过程中硫代巴比妥酸反应物质的产生量
Fig5 Production of TBARS in Lp(a) and LDL oxidation
预染脂蛋白琼脂糖凝胶电泳结果显示(图6),Lp(a)、LDL经氧化修饰后,电泳迁移率均明显增加,相对增加的幅度Ox-LDL大于Ox-Lp(a)。

, http://www.100md.com
图6 天然和氧化Lp(a)和LDL的琼脂糖凝胶电泳图
Fig6 Agrose gel electrophoresis of native and oxidized Lp(a) and LDL
A. ox-LDL B. n-LDL C. ox-Lp(a) D. n-Lp(a)
3 讨论
本文旨在比较Lp(a)、LDL在体外的氧化修饰,获得绝对纯品至关重要,然而血中Lp(a)含量低,虽有特征性的抗原apo(a),但其组成成份中部分与LDL相似,密度范围与LDL和HDL有部分重叠,且Lp(a)呈现分子大小和水合密度上的异质性[6],故分离纯化的难度大。本研究在分离纯化前先筛选 出高Lp(a)含量血,用密度梯度超速离心获得d=1.055~1.120g/mL的脂蛋白部分,再经凝胶柱层析将混杂在该密度范围内的LDL与Lp(a)完全分离,经鉴定证明,所得Lp(a)和LDL均为纯品。在分离过程中,直接将血浆调至所需密度,分两次超速离心,避免离心过程中密度层改变,减少了Lp(a)的损耗。
, 百拇医药
为了明确Lp(a)在体外发生氧化修饰的过程,进一步了解Lp(a)致AS的机理,本文比较研究了Lp(a)与LDL在体外经Cu2+介导氧化反应的动力学参数,发现从同一个体中分离纯化的Lp(a)与LDL相比,其对氧化的敏感度和氧化程度均较低。Lp(a)与LDL脂质组成、含量极为相似,抗氧化物组分的含量也无明显差异[7]。引起Lp(a)对氧化敏感程度较低的原因可能在于其所含特殊抗原成分Apo(a)。Sattler等[8]在研究中发现Apo(a)含有较高的N-乙酰神经氨酸,有阻碍Lp(a)被氧化的功能。脂质过氧化产物MDA通过结合于载脂蛋白的赖氨酸残基修饰脂蛋白,Lp(a)的赖氨酸残基89%以上分布于Apo B100,位于Lp(a)颗粒表面的Apo(a)对MDA修饰的位阻,可能也是Lp(a)较LDL难于氧化的原因之一[9]。
总之,Lp(a)能发生氧化修饰,这是其致AS的重要机制之一。然而,Lp(a)作为AS,心肌梗塞的独立危险因子,对AS的发生较LDL及其它脂质参数有更强的预示性,但其高度致AS作用却难以完全用较高的氧化敏感性及氧化程度来进行解释;当然,对Lp(a)氧化修饰后理化性质及生物学特性的改变,Ox-Lp(a)在AS形成中的许多机理均有待于进一步研究。
, 百拇医药
作者简介:洪学东 博士生导师
参考文献
1 Scann AM,GM Fless.Lipoprotein (a): heterogeneity and biological relevance.J Clin Invest,1990,85:1709
2 Gaubatz JW,C Heideman,AM Gotto,et al.Human plasma Lp(a) structural properties.J Biol Chem,1983,258:4582
3 Repin JM,JA O Neil,HF Hoff.Quantlfication of apo(a) and apoB in human atherosclerotic lesions.J Lipid Res,1991,32:317
, 百拇医药
4 Hoff HF.Partial characterization of lipoproteins containing apo(a) in human atherosclerotic lesions.J Lipid Res,1993,34:789
5 Ramos R.Effect of temperture and phase transition on oxidation resistance of LDL.J Lipid Res,1995,36:2113
6 M Bewu AD and DN Durrington.Lipoprotein (a): structure,properties and possible involvement in thrombogenesis and atherogenesis.Atherosclerosis,1990,85:1
7 Naruszewicz M,E Selinger,J Davignon.Oxidation modification of Lp(a) and the β-carotene.Metabolism,1992,41:1215
8 Sattler W,GM Kostner,G Waeg,et al.Oxidation of Lp(a): a comparison with LDL.Biochem Biophy Acta,1991,1081:65
9 Haberland ME,GM Fless,AM Scanu,et al.Malondialdehyde modification of Lp(a) produces avid uptake by human monocyte-macrophages.J Biol Chem,1992,267:4143, 百拇医药