一氧化氮在中枢神经系统中的作用
作者:方以群 刘景昌
单位:方以群(海军医学研究所,上海市 200433);刘景昌(海军医学研究所,上海市 200433)
关键词:一氧化氮;神经系统▲
海军医学杂志000138 摘 要:近年来国内外的学者研究发现一氧化氮不仅可以舒张血管,而且在体内是一种新型的神经元信使,广泛参与机体的生理和病理过程,并与部分疾病的发生有关。文中介绍了一氧化氮的特性、代谢、神经系统中的分布、生理作用及在神经系统疾病中作用的研究现状。
1980年,Furchgott等[1]发现血管内皮细胞能使血管平滑肌松弛和血管舒张 ,认为此现象是由内皮细胞释放的内皮细胞源性舒张因子(Endotheliunderived relaxing f actor, EDRF)所介导。从此,人们对EDRF的特性、本质及其功能进行了大量研究,并取得了 巨大进展。1987年,Palmer等[2]用化学发光方法证实EDRF的本质是一氧化氮(NO) 。近年来研究发现,NO不仅对心血管功能有调节作用,其在体内对多个系统均有作用,它还 参与体内众多的生理和病理过程,是一种新型的神经元信使[3],起神经递质的作 用,介导兴奋性氨基酸(EAA)对神经细胞的毒性作用。本文拟对NO在中枢神经系统中的作用 做一简介。
, 百拇医药
1 NO的特性及代谢
NO是一个不带电荷的分子,很不稳定,其半衰期(T1/2)变异较大,在5~30s[4 ],具有水溶性和脂溶性,极易通过细胞膜,可在细胞内外自由扩散。由于其含有一个未 配对的电子,因而具有顺磁性,可与另一顺磁性物质如O2、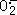 起反应,起自由基 的作用。例如:2NO+O2→2NO2;NO2+NO2→N2O4;NO2+NO→N2O3。
起反应,起自由基 的作用。例如:2NO+O2→2NO2;NO2+NO2→N2O4;NO2+NO→N2O3。
N2O3在水中生成亚硝酸根,N2O4则生成亚硝酸根和硝酸根。NO也可与超氧阴离 子(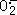 )很快反应生成ONOO-。ONOO-是一强 氧化剂,其共轭酸ONOOH裂解生成氧化性更强的OH·。
)很快反应生成ONOO-。ONOO-是一强 氧化剂,其共轭酸ONOOH裂解生成氧化性更强的OH·。
, 百拇医药
NO+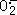 →ONOO-
→ONOO-
ONOO-+H+ →ONOOH
ONOOH→NO2+OH·
但一部分ONOOH可自发脱质子生成非反应性的NO3-,以清除NO和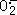 ,ONOO-也 可与谷胱甘肽[5]或葡萄糖[6]反应生成NO供体以清除。
,ONOO-也 可与谷胱甘肽[5]或葡萄糖[6]反应生成NO供体以清除。
NO是由一氧化氮合酶(nitric oxide synthase, NOS)催化L-精氨酸和氧反应后生成的,同时 产生瓜氨酸(citrulline, Cit)[7]。此反应过程由两步组成:第一步,L-精氨酸 中的两个电子被氧化,生成Nω-羟基-L-精氨酸(Nω-hydroxy-L- arginine, NHA);第 二步NHA的三个电子被氧化生成NO和L-瓜氨酸。反应过程中,需要黄素腺嘌呤二核苷酸(FDA) 、黄素单核苷酸(FMN)、血红素和四氢叶酸(BH4)作为NOS的辅基。因为在此反应中,NADP H为NOS反应中的辅因子,人们有时利用NADP-黄递酶组化染色方法,研究NOS在体内的分布。 同时应用L-精氨酸的类似物如L-NA(Nω-NO3-L-精氨酸)等NOS抑制剂作为NOS的假性底 物,阻断NO的合成,以研究NO在体内的作用及其在疾病防治中的作用。
, 百拇医药
2 脑内NOS的特性及其结构
NOS是一个同功酶,广泛分布于体内,根据其分布及表达的方式不同,一般分为神经元型NOS (neuronal NOS, nNOS)、诱导型NOS(inducible NOS, iNOS)和内皮型NOS(endothelial NOS, eNOS)。其中神经元型NOS主要存在于神经元和肌肉细胞内。在大鼠和猪的小脑中NOS已被纯 化,在脑内的nNOS是可溶性酶,分子量为150~160kDa[8,9],其活性为Ca 2+/CaM依赖性,受细胞内Ca2+浓度的生理性调节。C-末端为还原酶区,序列与 细胞色素P450还原酶同源[10],N-末端为氧化酶区,含有血红素(heme)、 四氢叶酸(BH4)和L-精氨酸的结合位点。
nNOS的二级结构目前已经了解,其中含有30%的α螺旋、14%的反平行β片层结构、7%的平行 β片层结构、19%的β转角及31%的其他结构。从大鼠和人脑中分离出的nNOS和cDNA,经推算 它们的氨基酸残基分别为1 429和1 433,酶蛋白分子量分别为160kDa和161kDa,与蛋白质纯 化的结果相一致。大鼠和人的NOS氨基酸序列有93%一致[8],其NO形成的最大速率 为42pmol/mg.min,L-精氨酸为底物时的Km值(L-精氨酸浓度)为8.4μmol/L[11 ]。
, 百拇医药
NOS的抑制剂主要有Nω-甲基-L-精氨酸(Nω-monomethyl-L-arginine, L-NMMA)、Nω - 硝基-L-精氨酸(Nω-nitric-L-arginine, L-NNA)及Nω-硝基-L-精氨酸甲脂(Nω-nit ro-L-arginine methyl ester, L-NAME)和Nω-NO3-L-精氨酸(Nω-nitro-L-arginin e, L-NA)。它们的作用机理在于与L-精氨酸竞争NOS的底物结合位点,为竞争性抑制,增加L -精氨酸浓度后可逆转这些物质的药理作用。
3 NO在脑内的分布
由于NO极不稳定,半衰期极短,目前尚无法直接定位组织中的NO,主要通过对NOS的定位来 反映NO的分布。研究发现nNOS在神经系统中有极其广泛的分布。用原位杂交方法,发现nNOS 散在地分布于全脑中,其中在小脑中含量最高,其次是嗅球、上下丘脑、海马、大脑皮层及 纹状体。在大脑皮层、海马及纹状体中,含nNOS的神经元占该区域所有细胞的1%~2%;在海 马中,nNOS主要存在于CA1区的中间神经元和齿状回的颗粒细胞中;下丘脑中主要位于视上 核和室旁核;小脑中主要位于颗粒细胞蓝状细胞和发出的平行纤维中;嗅球中主要位于 颗粒细胞层。
, 百拇医药
4 NO对神经系统的作用
自从1988年Garthwaite等[12]提出NO可能作为一种信息传递物质在中枢神经系统 起作用以来,NO的生理及病理作用开始引起了广大神经科学工作者极大的兴趣。目前发现NO 参与脑内许多生理功能作用,主要作用有以下几方面:
4.1 一氧化氮对突触传递和学习、记忆的作用 研究发现,NO在神经系 统中作为一个信息传递物质,合成后以扩散方式到达邻近细胞,在靶细胞内起作用。作用表 现在两方面:
一是海马长时程增强效应。长时程增强效应(long-term potentiation, LTP)是突触可塑性 的一种形式,被认为与学习、记忆密切相关,是神经元学习和记忆机制的模式之一。人们对 长时程增强效应(LTP)的机制及其影响因素进行了大量研究,发现NO参与了LTP[13] ,应用NOS的抑制剂L-NNA可以阻断海马CA1区LTP的形成,而增加L-精氨酸后可对抗上述 抑制剂的作用。目前认为,在LTP的形成过程中,谷氨酸激活NMDA受体,Ca2+进入突 触后膜,激活NOS,产生NO,并扩散至突触前膜,使突触前膜离子通道活性发生改变,突触 前神经递质释放增加,增强突触传导。
, 百拇医药
二是长时程突触传导抑制。长时程突触传导抑制(long-term synaptic depression, LTD) 也参与了学习、记忆的过程,被认为是小脑运动学习体系中的一种分子机理。在小脑中,攀 缘纤维和颗粒细胞的平行纤维与浦肯野细胞间突触形成LTD,而攀缘纤维和平行纤维的递质 为谷氨酸,突触前攀缘纤维释放Glu后,激活浦肯野细胞上的NMDA受体,使后者去极化,电 压门控性钙通道打开,Ca2+内流;平行纤维的Glu的释放,可进一步激活磷脂酶C,产 生二酰基甘油(DAG)及三磷酸肌醇(IP3),IP3可促进细胞内Ca2+的释放,DAG激 活蛋白激酶C,蛋白激酶激活后可改变AMPA受体敏感性,其敏感性下降后可导致LTD。而小脑 中广泛分布NOS,NO参与LTD的可能机制是:平行纤维产生NO后,NO扩散至浦肯野细胞,导致 浦肯野细胞cGMP增加,激活依赖cGMP的蛋白激酶,使AMPA受体或有关分子磷酸化,降低AMPA 受体的敏感性,产生LTD。同时应用NOS的抑制剂L-NMMA也可阻断LTD的发生,证明NO参与了 LTD的发生。
, 百拇医药
由于一氧化氮在LTP、LTD的产生中都起作用,因此人们对NO在整体动物学习、记忆中的作用 也进行了研究。大鼠应用NOS抑制剂L-NNA后,其对“技能”的掌握和记忆所需的时间明显延 长,应用L-精氨酸后可对抗上述作用。当动物已经掌握了“技能”后,再应用L-NNA,对动 物学习的过程则无明显影响,表明NO参与了学习和记忆的过程。
4.2 一氧化氮与谷氨酸受体的关系 在神经系统中cGMP水平与兴奋性神 经 传导有密切关系。研究发现,一方面谷氨酸可通过神经细胞中NMDA受体的激活,引起细胞Ca 2+浓度提高,活化NOS产生NO;另一方面NO在NMDA受体兴奋过程中起一种负反馈作用 ,细胞内NO增多后,它又可通过扩散方式作用突触后膜的NMDA受体,抑制其活性,发挥作用 。
4.3 一氧化氮对脑血流的调节作用 NO参与外周和脑内血管张力的调节 ,在脑血流的调节中具有十分重要的作用。研究发现,脑血管内皮细胞中均存在NOS,正常 情况下,脑血管内皮细胞持续释放NO,NO激活鸟苷酸环化酶(soluble guanylate cyclase) ,提高cGMP水平,使血管处于舒张状态,NOS抑制剂可抑制脑血管内皮细胞NO的合成,从而 使脑血管收缩。在体外试验中,应用NOS抑制剂L-NMMA和L-NNA能抑制P物质和乙酰胆碱引起 的内皮细胞依赖性血管舒张,抑制Ach引起的基底动脉和软脑膜动脉的舒张反应,应用过量 的L-精氨酸可逆转此作用;鸟苷酸环化酶抑制剂美兰、血红蛋白也可以抑制这种血管舒张作 用。但是,L-NNA并不抑制非内皮细胞依赖性血管舒张剂硝酸甘油和硝普钠引起的舒张反应 ,这是由于硝酸甘油和硝普钠在体内可自行分解产生NO,舒张血管,因而并不依赖内皮细胞 通过NOS产生NO,NO通过血管平滑肌的作用调节脑循环的血流。同时,研究发现,脑血管也 受肾上腺素能非胆碱能(NANC)神经支配,而NO则介导了NANC神经与脑血管平滑肌之间的信息 传递作用,起到调节血管张力,调节脑血流的作用。
, 百拇医药
5 一氧化氮在神经系统疾病中的作用
由于一氧化氮可能作为不典型递质,并在神经系统中广泛存在,因此其在神经系统疾病中的 作用也引人关注。研究发现,NO在脑缺血、癫痫、帕金森氏症和脑炎的发生中,都起了一定 的作用。
5.1 在脑缺血中的作用 目前研究已基本确定了NO在脑缺血时起了神经 毒性作用。研究表明,外源性或内源性NO过量产生或释放时,具有神经毒性。原代培养的大 鼠皮层、纹状体和海马区中,硝普钠可模拟NMDA引起的细胞死亡,且具有剂量和时间依赖性 ,应用硝普钠4h以内神经组织有较轻的损伤,12h后加重;如将硝普钠直接注入正常动物 的海马,可诱发神经元的死亡,其他NO释放剂在培养的皮层和纹状体内均可引起正常动物神 经元死亡。Huang等[14]将小鼠nNOS基因去除后,制作大脑动脉阻塞模型,发现 脑梗塞的体积比未去除nNOS基因的正常对照动物明显减少。应用nNOS抑制剂也可减轻神经细 胞的损伤、死亡,缩小坏死面积。用基因表达方法发现,缺血动物组织中nNOSmRNA的表达量 显著增加,表明NO在脑缺血发病机理中起重要作用,如减少NO的产生,则可在一定程度上防 治脑缺血或减轻脑缺血损伤的程度。
, 百拇医药
关于NO在脑缺血发病机理中的作用,一般认为是在脑缺血时,谷氨酸释放增加,使NMDA受体 激活,化学递质门控性钙通道过度开放,大量Ca2+内流并与CaM结合,受Ca2+- CaM直接调节的NOS被大量结合,导致合成过量的NO,NO通过超氧自由基起细胞毒性作用,破 坏蛋白质、核酸及脂质膜,并可与含铁-硫的酶如琥珀酸氧化还原酶、顺乌头酸氧化还原酶 形成复合物,使酶失活,阻断细胞内能量合成及DNA的复制;NO还可使糖酵解中的甘油醛-3- 磷酸脱氢酶亚酰化,使催化位点ADP-核糖化,使酶失活,迅速导致能量耗竭。
5.2 在癫痫病中的作用 由于癫痫的发生、发展与NMDA受体的激活和Ca 2+内流有密切关系,而NO又介导了NMDA受体过度激活引起的损伤,因此NO在癫痫发生 中的作用自然受到重视。研究发现,NO在癫痫的发生过程中有双重作用,一是NO可诱发癫 痫。将海人藻酸(kainic acid, KA)及NMDA注入动物大脑,可引起癫痫发作,若应用NOS抑制 剂L-NMMA,则可抑制癫痫的发作,表明NO参与了癫痫的发作;二是NO可能有抗癫痫的作用 。研究发现,用KA及毛果芸香碱致癫痫时,NOS抑制剂L-NNA能明显加强癫痫样发作的程度及 提高死亡率,若增加组织中NO的含量,则可抑制该病的发作,说明NO具有抗癫痫作用[ 15]。NO在癫痫病中的机理可能为[16]:NO对神经元的作用取决于NO的氧化 还原状态-NO-及NO+,NO-具有神经毒性作用,NO+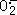 →ONOO-,ONOO-再降解为OH.和.NO2自由基 ,起毒性作用;而NO+可作用NMDA受体的氧化还原调节部位中的巯基,起下调作用, 减少Ca2+内流,减轻神经毒性作用,因而NO具有双重作用。对此尚需深入研究。
→ONOO-,ONOO-再降解为OH.和.NO2自由基 ,起毒性作用;而NO+可作用NMDA受体的氧化还原调节部位中的巯基,起下调作用, 减少Ca2+内流,减轻神经毒性作用,因而NO具有双重作用。对此尚需深入研究。
, http://www.100md.com
5.3 对帕金森氏症(Parkinson's disease, PD)、脑炎的作用 研究发 现,在中枢神经系统中的小胶质细胞表达iNOS而不表达nNOS,在PD患者的黑质内,小脑胶质 细胞、巨噬细胞剧增,iNOS的表达及活性大增,伴有多巴胺(DA)神经元的减少。Huang [17]等对死亡患者脑组织iNOS进行了研究,发现患PD的病人脑组织iNOS的表达明显增 强,表明NO参与了帕金森氏症的发病过程。
Koprowski等[18]采用逆转录-聚合酶链式反应(PT-PCR)技术,研究了大鼠、小鼠 实验性过敏性脑炎和病毒感染后脑组织NOSmRNA的表达,发现NOSmRNA的表达先于症状出现, 其表达量与临床症状及炎症反应程度相一致。
NO对帕金森氏症和脑炎的损伤机理一般也归于NO与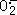 反应生成强毒性的ONOO-,其 分解为·O2和OH*,通过脂质过氧化而加剧神经元的损伤,在PD中,NO对DA 的释放还有调节作用,NO可在小剂量时依剂量依赖方式促进DA的释放,因此大量NO的产生 对DA的损伤作用具有协同、加强作用。
反应生成强毒性的ONOO-,其 分解为·O2和OH*,通过脂质过氧化而加剧神经元的损伤,在PD中,NO对DA 的释放还有调节作用,NO可在小剂量时依剂量依赖方式促进DA的释放,因此大量NO的产生 对DA的损伤作用具有协同、加强作用。
, 百拇医药
5.4 对惊厥性氧中毒的作用 王文俊等[19]研究发现,氧惊厥 时大鼠海马突触体内游离钙离子浓度([Ca2+]i)和作为一氧化氮合成水平指标的cGM P浓度均升高,而应用一氧化氮合酶抑制剂,LNNA可使突触体内游离钙离子和cGMP浓度分别 下降至氧惊厥组的70%和36%。李金声等[20]研究了在0.25MPa的高压氧下不同暴 露时间大鼠纹状体、下丘脑和黑质的NOS阳性细胞数的改变,发现暴露1h后,NOS阳性细胞数 无显著性改变,而暴露4、7h后NOS阳性细胞数明显增加(P<0.05),暴露 7h NOS阳性细胞数比暴露4h的显著增多(P<0.05)。Oury等[21] 应用NOS抑制剂Nω-nitro-L-arginine对脑内过度表达人细胞外超氧化物歧化酶的转基 因大鼠和非转基因的大鼠进行了研究,发现NOS有显著的防护氧惊厥作用,可延缓惊厥发生 的时间,增加动物的生存率,表明NO对中枢神经系统型氧中毒的发生具有重要作用。其作用 机理为:①NO作为血管扩张剂,减轻高压氧源性的血管收缩,增加脑组织的氧化作用,引起 中枢神经系统氧毒性;②NO作为兴奋性氨基酸作用的递质,介导兴奋毒性;③NO抑制线粒体 呼吸链中的电子传递,导致ATP的耗竭,细胞死亡;④NO与H2O2反应生成OH-反应生 成OH-或与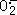 反应生成ONOO-,进 而损伤神经细胞。对于NO作用机制,Zhang 等也 作了试验[22],研究发现NOS抑制剂L-NAME并不降低高压氧(4ATA)暴露时的皮层 脑血流量(CBF)和组织氧分压(PO2),对上述的机理提出了异议。因此,NO在氧惊厥发生 中的作用机理尚需深入研究。
反应生成ONOO-,进 而损伤神经细胞。对于NO作用机制,Zhang 等也 作了试验[22],研究发现NOS抑制剂L-NAME并不降低高压氧(4ATA)暴露时的皮层 脑血流量(CBF)和组织氧分压(PO2),对上述的机理提出了异议。因此,NO在氧惊厥发生 中的作用机理尚需深入研究。
, http://www.100md.com
参考文献:
[1]Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature, 1980, 288:373
[2]Palmer RMJ, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature, 1987, 327: 524
[3]Bredt DS, Snyder SH. Nitric oside: A physiologic messenger molecul ar.Annu Rev Biochem, 1994, 63: 175
, 百拇医药
[4]Calotta E, Koshland DE. NO news is good news. Science, 1992, 258: 1862
[5]Moro MA, Darley-Usmar VM, Goodwin DA et al. Paradoxica l fate and biological action of peroxynitrite on human platelets. Proc Natl Ac ad Sci USA, 1994,91: 6702
[6]Moro MA, Darley-usmar VM, Lazasoain I et al. The terma tion of nitric oxide dornor from poroxynitrite. Br J Pharmacol, 1995, 116:1999[ ZK)
[7]Nathan C. Nitric oxide as a secretory product of mammalian cells. FASE BJ,1992, 6:3051
, 百拇医药
[8]Forstermann U, Closs EI, Pollock JS et al. Nitric oxide synthase isozymes: characterization, purification, molecular coloning and funct ions. Hypertension, 1994, 23:1121
[9]Marletta MA. Nitric oxide synthase structure and mechanism. The Journal of Biological Chemistry, 1993, 268: 12231
[10]Bredt DS, Hwang PM, Glatt CE et al. Cloned and express ed nitric oxide synthase structurally resembles cytochrome P-450 reductase. Natu re, 1991, 351: 714
, 百拇医药
[11]Knowles RG, Palacios M, Palmer RMJ et al. Kinetic char acteristics of nitric oxide synthase from rat brain. Biochem J, 1990, 269:207[ ZK)
[12]Garthwaite J, Charles SL, Chess-Williams R. Endothelium-derived relaxing factor release on activation of NMDA receptors suggests role as intracellu lar messenger in the brain. Nature, 1988, 336:385
[13]O'Dell TJ, Hawkins RD, Kandel ER et al. Tests of th e roles of two diffusible substances in long-term potentiation: evidence for ni tric oxide as a possible early retrograde messenger. Proc Natl Acad Sci USA, 199 1, 88:11285
, 百拇医药
[14]Huang ZH, Huang PL, Panahian N et al. Effects of cereb ral ischemia in mice deficient in neuronal nitric oxide synthase. Science, 1994, 265: 1883
[15]Maggio R, Fumagalli F, Donati E et al. Inhibition of n itric oxide synthase dramatically potentiates seizures induced by kainic acid an d pilocarpine in rats. Brain Res, 1995, 679:184
[16]Lipton SA, Chol YB, Pan ZH et al. A redox-based mecha nism for the neuroprotective and neurodestructive effects of nitric oxide and re lated nitroso-compounds. Nature, 1993, 364: 626
, 百拇医药
[17]Huang S, Boissiere F, Faucheux B et al. Nitric oxide s ynthase and neuronal vulnerability in Parkinson's disease. Neuroscience, 1996, 7 2: 355
[18]Koprowski H, Zheng YM, Heber-Katz E et al. In vivo ex pression of inducible nitric oxide synthase in experimentally induced neurologic diseases. Proc Natl Acad Sci USA, 1993, 90: 3024
[19]王文俊,颜天华,严玉兰等.氧惊厥大鼠海马突触体内一氧化氮与钙离子水平的变化.中华航海医学杂志,1996, 3(4): 205
, http://www.100md.com
[20]李金声,郭守一,高健宝等.高压氧对鼠脑一氧化氮合酶(NOS)阳性细胞分布的影响及NOS抑制剂的抗氧惊厥作用.中华航海医学杂志,1997, (4): 231
[21]Oury TD, Ho YS, Piantadosi CA et al. Extracellular sup eroxide dismutase, nitric oxide, and central nervous system O2 toxicity. Proc Natl Acd Sci USA,1992, 89: 9715
[22]Zhang J, Sam AD, Klitzman B et al. Inhibition of nitric oxide synthase on brain oxygenation in anesthetized rats exposed to hyperbaric oxygen. Undersea & Hyperbaric Medicine, 1995, 22: 377
收稿日期:1998-12-04, 百拇医药
单位:方以群(海军医学研究所,上海市 200433);刘景昌(海军医学研究所,上海市 200433)
关键词:一氧化氮;神经系统▲
海军医学杂志000138 摘 要:近年来国内外的学者研究发现一氧化氮不仅可以舒张血管,而且在体内是一种新型的神经元信使,广泛参与机体的生理和病理过程,并与部分疾病的发生有关。文中介绍了一氧化氮的特性、代谢、神经系统中的分布、生理作用及在神经系统疾病中作用的研究现状。
1980年,Furchgott等[1]发现血管内皮细胞能使血管平滑肌松弛和血管舒张 ,认为此现象是由内皮细胞释放的内皮细胞源性舒张因子(Endotheliunderived relaxing f actor, EDRF)所介导。从此,人们对EDRF的特性、本质及其功能进行了大量研究,并取得了 巨大进展。1987年,Palmer等[2]用化学发光方法证实EDRF的本质是一氧化氮(NO) 。近年来研究发现,NO不仅对心血管功能有调节作用,其在体内对多个系统均有作用,它还 参与体内众多的生理和病理过程,是一种新型的神经元信使[3],起神经递质的作 用,介导兴奋性氨基酸(EAA)对神经细胞的毒性作用。本文拟对NO在中枢神经系统中的作用 做一简介。
, 百拇医药
1 NO的特性及代谢
NO是一个不带电荷的分子,很不稳定,其半衰期(T1/2)变异较大,在5~30s[4 ],具有水溶性和脂溶性,极易通过细胞膜,可在细胞内外自由扩散。由于其含有一个未 配对的电子,因而具有顺磁性,可与另一顺磁性物质如O2、
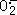 起反应,起自由基 的作用。例如:2NO+O2→2NO2;NO2+NO2→N2O4;NO2+NO→N2O3。
起反应,起自由基 的作用。例如:2NO+O2→2NO2;NO2+NO2→N2O4;NO2+NO→N2O3。N2O3在水中生成亚硝酸根,N2O4则生成亚硝酸根和硝酸根。NO也可与超氧阴离 子(
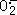 )很快反应生成ONOO-。ONOO-是一强 氧化剂,其共轭酸ONOOH裂解生成氧化性更强的OH·。
)很快反应生成ONOO-。ONOO-是一强 氧化剂,其共轭酸ONOOH裂解生成氧化性更强的OH·。, 百拇医药
NO+
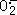 →ONOO-
→ONOO-ONOO-+H+ →ONOOH
ONOOH→NO2+OH·
但一部分ONOOH可自发脱质子生成非反应性的NO3-,以清除NO和
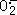 ,ONOO-也 可与谷胱甘肽[5]或葡萄糖[6]反应生成NO供体以清除。
,ONOO-也 可与谷胱甘肽[5]或葡萄糖[6]反应生成NO供体以清除。NO是由一氧化氮合酶(nitric oxide synthase, NOS)催化L-精氨酸和氧反应后生成的,同时 产生瓜氨酸(citrulline, Cit)[7]。此反应过程由两步组成:第一步,L-精氨酸 中的两个电子被氧化,生成Nω-羟基-L-精氨酸(Nω-hydroxy-L- arginine, NHA);第 二步NHA的三个电子被氧化生成NO和L-瓜氨酸。反应过程中,需要黄素腺嘌呤二核苷酸(FDA) 、黄素单核苷酸(FMN)、血红素和四氢叶酸(BH4)作为NOS的辅基。因为在此反应中,NADP H为NOS反应中的辅因子,人们有时利用NADP-黄递酶组化染色方法,研究NOS在体内的分布。 同时应用L-精氨酸的类似物如L-NA(Nω-NO3-L-精氨酸)等NOS抑制剂作为NOS的假性底 物,阻断NO的合成,以研究NO在体内的作用及其在疾病防治中的作用。
, 百拇医药
2 脑内NOS的特性及其结构
NOS是一个同功酶,广泛分布于体内,根据其分布及表达的方式不同,一般分为神经元型NOS (neuronal NOS, nNOS)、诱导型NOS(inducible NOS, iNOS)和内皮型NOS(endothelial NOS, eNOS)。其中神经元型NOS主要存在于神经元和肌肉细胞内。在大鼠和猪的小脑中NOS已被纯 化,在脑内的nNOS是可溶性酶,分子量为150~160kDa[8,9],其活性为Ca 2+/CaM依赖性,受细胞内Ca2+浓度的生理性调节。C-末端为还原酶区,序列与 细胞色素P450还原酶同源[10],N-末端为氧化酶区,含有血红素(heme)、 四氢叶酸(BH4)和L-精氨酸的结合位点。
nNOS的二级结构目前已经了解,其中含有30%的α螺旋、14%的反平行β片层结构、7%的平行 β片层结构、19%的β转角及31%的其他结构。从大鼠和人脑中分离出的nNOS和cDNA,经推算 它们的氨基酸残基分别为1 429和1 433,酶蛋白分子量分别为160kDa和161kDa,与蛋白质纯 化的结果相一致。大鼠和人的NOS氨基酸序列有93%一致[8],其NO形成的最大速率 为42pmol/mg.min,L-精氨酸为底物时的Km值(L-精氨酸浓度)为8.4μmol/L[11 ]。
, 百拇医药
NOS的抑制剂主要有Nω-甲基-L-精氨酸(Nω-monomethyl-L-arginine, L-NMMA)、Nω - 硝基-L-精氨酸(Nω-nitric-L-arginine, L-NNA)及Nω-硝基-L-精氨酸甲脂(Nω-nit ro-L-arginine methyl ester, L-NAME)和Nω-NO3-L-精氨酸(Nω-nitro-L-arginin e, L-NA)。它们的作用机理在于与L-精氨酸竞争NOS的底物结合位点,为竞争性抑制,增加L -精氨酸浓度后可逆转这些物质的药理作用。
3 NO在脑内的分布
由于NO极不稳定,半衰期极短,目前尚无法直接定位组织中的NO,主要通过对NOS的定位来 反映NO的分布。研究发现nNOS在神经系统中有极其广泛的分布。用原位杂交方法,发现nNOS 散在地分布于全脑中,其中在小脑中含量最高,其次是嗅球、上下丘脑、海马、大脑皮层及 纹状体。在大脑皮层、海马及纹状体中,含nNOS的神经元占该区域所有细胞的1%~2%;在海 马中,nNOS主要存在于CA1区的中间神经元和齿状回的颗粒细胞中;下丘脑中主要位于视上 核和室旁核;小脑中主要位于颗粒细胞蓝状细胞和发出的平行纤维中;嗅球中主要位于 颗粒细胞层。
, 百拇医药
4 NO对神经系统的作用
自从1988年Garthwaite等[12]提出NO可能作为一种信息传递物质在中枢神经系统 起作用以来,NO的生理及病理作用开始引起了广大神经科学工作者极大的兴趣。目前发现NO 参与脑内许多生理功能作用,主要作用有以下几方面:
4.1 一氧化氮对突触传递和学习、记忆的作用 研究发现,NO在神经系 统中作为一个信息传递物质,合成后以扩散方式到达邻近细胞,在靶细胞内起作用。作用表 现在两方面:
一是海马长时程增强效应。长时程增强效应(long-term potentiation, LTP)是突触可塑性 的一种形式,被认为与学习、记忆密切相关,是神经元学习和记忆机制的模式之一。人们对 长时程增强效应(LTP)的机制及其影响因素进行了大量研究,发现NO参与了LTP[13] ,应用NOS的抑制剂L-NNA可以阻断海马CA1区LTP的形成,而增加L-精氨酸后可对抗上述 抑制剂的作用。目前认为,在LTP的形成过程中,谷氨酸激活NMDA受体,Ca2+进入突 触后膜,激活NOS,产生NO,并扩散至突触前膜,使突触前膜离子通道活性发生改变,突触 前神经递质释放增加,增强突触传导。
, 百拇医药
二是长时程突触传导抑制。长时程突触传导抑制(long-term synaptic depression, LTD) 也参与了学习、记忆的过程,被认为是小脑运动学习体系中的一种分子机理。在小脑中,攀 缘纤维和颗粒细胞的平行纤维与浦肯野细胞间突触形成LTD,而攀缘纤维和平行纤维的递质 为谷氨酸,突触前攀缘纤维释放Glu后,激活浦肯野细胞上的NMDA受体,使后者去极化,电 压门控性钙通道打开,Ca2+内流;平行纤维的Glu的释放,可进一步激活磷脂酶C,产 生二酰基甘油(DAG)及三磷酸肌醇(IP3),IP3可促进细胞内Ca2+的释放,DAG激 活蛋白激酶C,蛋白激酶激活后可改变AMPA受体敏感性,其敏感性下降后可导致LTD。而小脑 中广泛分布NOS,NO参与LTD的可能机制是:平行纤维产生NO后,NO扩散至浦肯野细胞,导致 浦肯野细胞cGMP增加,激活依赖cGMP的蛋白激酶,使AMPA受体或有关分子磷酸化,降低AMPA 受体的敏感性,产生LTD。同时应用NOS的抑制剂L-NMMA也可阻断LTD的发生,证明NO参与了 LTD的发生。
, 百拇医药
由于一氧化氮在LTP、LTD的产生中都起作用,因此人们对NO在整体动物学习、记忆中的作用 也进行了研究。大鼠应用NOS抑制剂L-NNA后,其对“技能”的掌握和记忆所需的时间明显延 长,应用L-精氨酸后可对抗上述作用。当动物已经掌握了“技能”后,再应用L-NNA,对动 物学习的过程则无明显影响,表明NO参与了学习和记忆的过程。
4.2 一氧化氮与谷氨酸受体的关系 在神经系统中cGMP水平与兴奋性神 经 传导有密切关系。研究发现,一方面谷氨酸可通过神经细胞中NMDA受体的激活,引起细胞Ca 2+浓度提高,活化NOS产生NO;另一方面NO在NMDA受体兴奋过程中起一种负反馈作用 ,细胞内NO增多后,它又可通过扩散方式作用突触后膜的NMDA受体,抑制其活性,发挥作用 。
4.3 一氧化氮对脑血流的调节作用 NO参与外周和脑内血管张力的调节 ,在脑血流的调节中具有十分重要的作用。研究发现,脑血管内皮细胞中均存在NOS,正常 情况下,脑血管内皮细胞持续释放NO,NO激活鸟苷酸环化酶(soluble guanylate cyclase) ,提高cGMP水平,使血管处于舒张状态,NOS抑制剂可抑制脑血管内皮细胞NO的合成,从而 使脑血管收缩。在体外试验中,应用NOS抑制剂L-NMMA和L-NNA能抑制P物质和乙酰胆碱引起 的内皮细胞依赖性血管舒张,抑制Ach引起的基底动脉和软脑膜动脉的舒张反应,应用过量 的L-精氨酸可逆转此作用;鸟苷酸环化酶抑制剂美兰、血红蛋白也可以抑制这种血管舒张作 用。但是,L-NNA并不抑制非内皮细胞依赖性血管舒张剂硝酸甘油和硝普钠引起的舒张反应 ,这是由于硝酸甘油和硝普钠在体内可自行分解产生NO,舒张血管,因而并不依赖内皮细胞 通过NOS产生NO,NO通过血管平滑肌的作用调节脑循环的血流。同时,研究发现,脑血管也 受肾上腺素能非胆碱能(NANC)神经支配,而NO则介导了NANC神经与脑血管平滑肌之间的信息 传递作用,起到调节血管张力,调节脑血流的作用。
, 百拇医药
5 一氧化氮在神经系统疾病中的作用
由于一氧化氮可能作为不典型递质,并在神经系统中广泛存在,因此其在神经系统疾病中的 作用也引人关注。研究发现,NO在脑缺血、癫痫、帕金森氏症和脑炎的发生中,都起了一定 的作用。
5.1 在脑缺血中的作用 目前研究已基本确定了NO在脑缺血时起了神经 毒性作用。研究表明,外源性或内源性NO过量产生或释放时,具有神经毒性。原代培养的大 鼠皮层、纹状体和海马区中,硝普钠可模拟NMDA引起的细胞死亡,且具有剂量和时间依赖性 ,应用硝普钠4h以内神经组织有较轻的损伤,12h后加重;如将硝普钠直接注入正常动物 的海马,可诱发神经元的死亡,其他NO释放剂在培养的皮层和纹状体内均可引起正常动物神 经元死亡。Huang等[14]将小鼠nNOS基因去除后,制作大脑动脉阻塞模型,发现 脑梗塞的体积比未去除nNOS基因的正常对照动物明显减少。应用nNOS抑制剂也可减轻神经细 胞的损伤、死亡,缩小坏死面积。用基因表达方法发现,缺血动物组织中nNOSmRNA的表达量 显著增加,表明NO在脑缺血发病机理中起重要作用,如减少NO的产生,则可在一定程度上防 治脑缺血或减轻脑缺血损伤的程度。
, 百拇医药
关于NO在脑缺血发病机理中的作用,一般认为是在脑缺血时,谷氨酸释放增加,使NMDA受体 激活,化学递质门控性钙通道过度开放,大量Ca2+内流并与CaM结合,受Ca2+- CaM直接调节的NOS被大量结合,导致合成过量的NO,NO通过超氧自由基起细胞毒性作用,破 坏蛋白质、核酸及脂质膜,并可与含铁-硫的酶如琥珀酸氧化还原酶、顺乌头酸氧化还原酶 形成复合物,使酶失活,阻断细胞内能量合成及DNA的复制;NO还可使糖酵解中的甘油醛-3- 磷酸脱氢酶亚酰化,使催化位点ADP-核糖化,使酶失活,迅速导致能量耗竭。
5.2 在癫痫病中的作用 由于癫痫的发生、发展与NMDA受体的激活和Ca 2+内流有密切关系,而NO又介导了NMDA受体过度激活引起的损伤,因此NO在癫痫发生 中的作用自然受到重视。研究发现,NO在癫痫的发生过程中有双重作用,一是NO可诱发癫 痫。将海人藻酸(kainic acid, KA)及NMDA注入动物大脑,可引起癫痫发作,若应用NOS抑制 剂L-NMMA,则可抑制癫痫的发作,表明NO参与了癫痫的发作;二是NO可能有抗癫痫的作用 。研究发现,用KA及毛果芸香碱致癫痫时,NOS抑制剂L-NNA能明显加强癫痫样发作的程度及 提高死亡率,若增加组织中NO的含量,则可抑制该病的发作,说明NO具有抗癫痫作用[ 15]。NO在癫痫病中的机理可能为[16]:NO对神经元的作用取决于NO的氧化 还原状态-NO-及NO+,NO-具有神经毒性作用,NO+
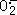 →ONOO-,ONOO-再降解为OH.和.NO2自由基 ,起毒性作用;而NO+可作用NMDA受体的氧化还原调节部位中的巯基,起下调作用, 减少Ca2+内流,减轻神经毒性作用,因而NO具有双重作用。对此尚需深入研究。
→ONOO-,ONOO-再降解为OH.和.NO2自由基 ,起毒性作用;而NO+可作用NMDA受体的氧化还原调节部位中的巯基,起下调作用, 减少Ca2+内流,减轻神经毒性作用,因而NO具有双重作用。对此尚需深入研究。, http://www.100md.com
5.3 对帕金森氏症(Parkinson's disease, PD)、脑炎的作用 研究发 现,在中枢神经系统中的小胶质细胞表达iNOS而不表达nNOS,在PD患者的黑质内,小脑胶质 细胞、巨噬细胞剧增,iNOS的表达及活性大增,伴有多巴胺(DA)神经元的减少。Huang [17]等对死亡患者脑组织iNOS进行了研究,发现患PD的病人脑组织iNOS的表达明显增 强,表明NO参与了帕金森氏症的发病过程。
Koprowski等[18]采用逆转录-聚合酶链式反应(PT-PCR)技术,研究了大鼠、小鼠 实验性过敏性脑炎和病毒感染后脑组织NOSmRNA的表达,发现NOSmRNA的表达先于症状出现, 其表达量与临床症状及炎症反应程度相一致。
NO对帕金森氏症和脑炎的损伤机理一般也归于NO与
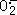 反应生成强毒性的ONOO-,其 分解为·O2和OH*,通过脂质过氧化而加剧神经元的损伤,在PD中,NO对DA 的释放还有调节作用,NO可在小剂量时依剂量依赖方式促进DA的释放,因此大量NO的产生 对DA的损伤作用具有协同、加强作用。
反应生成强毒性的ONOO-,其 分解为·O2和OH*,通过脂质过氧化而加剧神经元的损伤,在PD中,NO对DA 的释放还有调节作用,NO可在小剂量时依剂量依赖方式促进DA的释放,因此大量NO的产生 对DA的损伤作用具有协同、加强作用。, 百拇医药
5.4 对惊厥性氧中毒的作用 王文俊等[19]研究发现,氧惊厥 时大鼠海马突触体内游离钙离子浓度([Ca2+]i)和作为一氧化氮合成水平指标的cGM P浓度均升高,而应用一氧化氮合酶抑制剂,LNNA可使突触体内游离钙离子和cGMP浓度分别 下降至氧惊厥组的70%和36%。李金声等[20]研究了在0.25MPa的高压氧下不同暴 露时间大鼠纹状体、下丘脑和黑质的NOS阳性细胞数的改变,发现暴露1h后,NOS阳性细胞数 无显著性改变,而暴露4、7h后NOS阳性细胞数明显增加(P<0.05),暴露 7h NOS阳性细胞数比暴露4h的显著增多(P<0.05)。Oury等[21] 应用NOS抑制剂Nω-nitro-L-arginine对脑内过度表达人细胞外超氧化物歧化酶的转基 因大鼠和非转基因的大鼠进行了研究,发现NOS有显著的防护氧惊厥作用,可延缓惊厥发生 的时间,增加动物的生存率,表明NO对中枢神经系统型氧中毒的发生具有重要作用。其作用 机理为:①NO作为血管扩张剂,减轻高压氧源性的血管收缩,增加脑组织的氧化作用,引起 中枢神经系统氧毒性;②NO作为兴奋性氨基酸作用的递质,介导兴奋毒性;③NO抑制线粒体 呼吸链中的电子传递,导致ATP的耗竭,细胞死亡;④NO与H2O2反应生成OH-反应生 成OH-或与
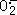 反应生成ONOO-,进 而损伤神经细胞。对于NO作用机制,Zhang 等也 作了试验[22],研究发现NOS抑制剂L-NAME并不降低高压氧(4ATA)暴露时的皮层 脑血流量(CBF)和组织氧分压(PO2),对上述的机理提出了异议。因此,NO在氧惊厥发生 中的作用机理尚需深入研究。
反应生成ONOO-,进 而损伤神经细胞。对于NO作用机制,Zhang 等也 作了试验[22],研究发现NOS抑制剂L-NAME并不降低高压氧(4ATA)暴露时的皮层 脑血流量(CBF)和组织氧分压(PO2),对上述的机理提出了异议。因此,NO在氧惊厥发生 中的作用机理尚需深入研究。, http://www.100md.com
参考文献:
[1]Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature, 1980, 288:373
[2]Palmer RMJ, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature, 1987, 327: 524
[3]Bredt DS, Snyder SH. Nitric oside: A physiologic messenger molecul ar.Annu Rev Biochem, 1994, 63: 175
, 百拇医药
[4]Calotta E, Koshland DE. NO news is good news. Science, 1992, 258: 1862
[5]Moro MA, Darley-Usmar VM, Goodwin DA et al. Paradoxica l fate and biological action of peroxynitrite on human platelets. Proc Natl Ac ad Sci USA, 1994,91: 6702
[6]Moro MA, Darley-usmar VM, Lazasoain I et al. The terma tion of nitric oxide dornor from poroxynitrite. Br J Pharmacol, 1995, 116:1999[ ZK)
[7]Nathan C. Nitric oxide as a secretory product of mammalian cells. FASE BJ,1992, 6:3051
, 百拇医药
[8]Forstermann U, Closs EI, Pollock JS et al. Nitric oxide synthase isozymes: characterization, purification, molecular coloning and funct ions. Hypertension, 1994, 23:1121
[9]Marletta MA. Nitric oxide synthase structure and mechanism. The Journal of Biological Chemistry, 1993, 268: 12231
[10]Bredt DS, Hwang PM, Glatt CE et al. Cloned and express ed nitric oxide synthase structurally resembles cytochrome P-450 reductase. Natu re, 1991, 351: 714
, 百拇医药
[11]Knowles RG, Palacios M, Palmer RMJ et al. Kinetic char acteristics of nitric oxide synthase from rat brain. Biochem J, 1990, 269:207[ ZK)
[12]Garthwaite J, Charles SL, Chess-Williams R. Endothelium-derived relaxing factor release on activation of NMDA receptors suggests role as intracellu lar messenger in the brain. Nature, 1988, 336:385
[13]O'Dell TJ, Hawkins RD, Kandel ER et al. Tests of th e roles of two diffusible substances in long-term potentiation: evidence for ni tric oxide as a possible early retrograde messenger. Proc Natl Acad Sci USA, 199 1, 88:11285
, 百拇医药
[14]Huang ZH, Huang PL, Panahian N et al. Effects of cereb ral ischemia in mice deficient in neuronal nitric oxide synthase. Science, 1994, 265: 1883
[15]Maggio R, Fumagalli F, Donati E et al. Inhibition of n itric oxide synthase dramatically potentiates seizures induced by kainic acid an d pilocarpine in rats. Brain Res, 1995, 679:184
[16]Lipton SA, Chol YB, Pan ZH et al. A redox-based mecha nism for the neuroprotective and neurodestructive effects of nitric oxide and re lated nitroso-compounds. Nature, 1993, 364: 626
, 百拇医药
[17]Huang S, Boissiere F, Faucheux B et al. Nitric oxide s ynthase and neuronal vulnerability in Parkinson's disease. Neuroscience, 1996, 7 2: 355
[18]Koprowski H, Zheng YM, Heber-Katz E et al. In vivo ex pression of inducible nitric oxide synthase in experimentally induced neurologic diseases. Proc Natl Acad Sci USA, 1993, 90: 3024
[19]王文俊,颜天华,严玉兰等.氧惊厥大鼠海马突触体内一氧化氮与钙离子水平的变化.中华航海医学杂志,1996, 3(4): 205
, http://www.100md.com
[20]李金声,郭守一,高健宝等.高压氧对鼠脑一氧化氮合酶(NOS)阳性细胞分布的影响及NOS抑制剂的抗氧惊厥作用.中华航海医学杂志,1997, (4): 231
[21]Oury TD, Ho YS, Piantadosi CA et al. Extracellular sup eroxide dismutase, nitric oxide, and central nervous system O2 toxicity. Proc Natl Acd Sci USA,1992, 89: 9715
[22]Zhang J, Sam AD, Klitzman B et al. Inhibition of nitric oxide synthase on brain oxygenation in anesthetized rats exposed to hyperbaric oxygen. Undersea & Hyperbaric Medicine, 1995, 22: 377
收稿日期:1998-12-04, 百拇医药