hIL-10基因转导抑制大鼠心肌细胞诱生炎症细胞因子
作者:李锦华 陈永雄 张仕光 廖晓星
单位:李锦华 陈永雄 张仕光 中山医科大学附属第一医院 肾内科 ;廖晓星 急诊科; 广州, 510080
关键词:基因转移;白细胞介素10;心肌;炎症
中山医科大学学报/990305
摘要 目的:观察人白细胞介素10 (human Interleukin 10, hIL-10)基因转导对脂多糖(LPS)诱导大鼠心肌细胞(CMC)的炎症细胞因子的产生及其基因表达的影响。方法:通过重组逆转录病毒载体pLX(IL-10)SN将人IL-10基因导入大鼠CMC,应用PCR,RT-PCR和ELISA:①检测IL-10基因的整合和表达;②观察IL-10基因转导对LPS诱导的CMC肿瘤坏死因子-α(TNF-α)的mRNA表达及白细胞介素-1β(IL-1β)和TNF-α的蛋白质的产生的影响。结果:外源性IL-10基因已整合到靶细胞染色体DNA并有效地表达,并能抑制LPS诱生CMC产生IL-1β,TNF-α。结论:逆转录病毒载体介导的人IL-10基因转导能抑制CMC炎症效应中细胞因子的产生及其基因表达。
, 百拇医药
中图号 R 542.2; R 392.32
hIL-10 Gene Transfer on Secretion of Inflammatory
Cytokines in Rat Cardiomyocytes Induced
Li Jinhua Chen Yongxiong Zhang Shiguang Lao Xiaoxing
( 1 Nephrology Department 2 Emergency Department, First Affiliated Hospital, Sun Yat-sen
University of Medical Sciences, Guangzhou, 510080)
, 百拇医药
Abstract Objective:To investigate the effects of interleukin-10(IL-10) gene transfer on secretion of inflammatory cytokines in rat cardiomyocytes(CMC) induced by LPS in vitro. Method: Exogenous human IL-10(hIL-10) gene was transferred into rat CMC by retroviral vector pLX(IL-10)SN. The polymerase chain reaction (PCR), the reverse transcription polymerase chain reaction (RT-PCR) and ELISA were used ① to detect integration and expression of hIL-10 gene in rat CMC; ② to observe the effects of interleukin 10 gene transfer on secretion of inflammatory cytokines in rat CMC cells induced by LPS in vitro. Result: Human IL-10 gene had been integrated into the chromosal DNA of the transfected rat CMC cells and hIL-10 gene could be expressed effectively by the transfected rat CMC cells. Exogenous IL-10 gene transfer could inhibit secretion of inflammatory cytokines IL-1β and TNF-α in the transfected rat CMC at mRNA and protein level induced by LPS. Conclusion:Exogenous interleukin 10 gene transfer can inhibit secretion of inflammatory cytokines in CMC.
, 百拇医药
Subject headings gene transfer; interleukin-10; myocardium; inflammation
白细胞介素10[1]是T辅助细胞产生的,以抑制Th1细胞克隆的细胞因子合成为特点的多效免疫调节因子,具有重要的抗炎及免疫抑制作用。本实验通过逆转录病毒载体将人IL-10基因转导至大鼠(cardiomyocyte,CMC),观察IL-10基因转移对LPS诱导的大鼠CMC生成IL-1和TNF-α的影响,以探讨IL-10基因转导作为抗炎、抗排斥治疗手段的可能性及其作用。
1 材料和方法
1.1 重组逆转录病毒载体的包装与重组病毒感染滴度测定
含人IL-10全长cDNA(0.61 kb)的逆转录病毒载体pLX(IL-10)SN由本室构建[2]。将重组载体pLX(IL-10)SN和空白载体pLXSN用DOTAP(Boehringer Mannheim)导入PA317(军事医学科学院),用G418(G1BCO BRL)进行筛选:以NIH 3T3细胞(军事医学科学院)测定重组病毒感染滴度。单位为CFU/mL。
, http://www.100md.com
1.2 大鼠CMC的转染
按文献[3]的方法培养Wistar大鼠(中山医科大学实验动物中心)CMC。抗G418抗性克隆pLX(IL-10)SN和pLXSN感染大鼠CMC,120 h后取CMC按文献[4]的方法提取DNA和RNA。
1.3 目的基因IL-10在CMC表达的检测
①PCR:按照PCR试剂盒(华美公司)提供的方法进行。引物A(pLXSN 1 511~1 530 bp:5′-GTCAAGCCCTTTGTACACCC-3′,引物C(hIL-10 cDNA 546~525 bp:5′-CCTGATGGT CTCAGTTTCGTATC-3′)(引物由中国科学院上海生物工程研究中心合成,以下引物相同)检测目的基因IL-10在大鼠CMC的整合,产物679 bp。②RT-PCR:按照RT-PCR试剂盒(Promega)提供的方法进行。上游引物B(hIL-10 cDNA 129~150 bp:5′-TCT CCG AGA TGC CTT TCA GCA GA-3′),引物C(见上)作RT-PCR检测目的基因IL-10在大鼠CMC的转录,产物418 bp。以一对引物(RAT GAPDH cDNA sense 21~40 bp:5′-CAT AGA CAA GAT GGT GAA GG-3′,anti-sense 590~571 bp:5′-TCC ACA GTC TTC TGA GTG GC-3′)扩增大鼠看家基因GAPDH的mRNA为阳性内参照,产物570 bp。③按照ELISA试剂盒(深圳晶美公司)提供的方法检测目的的基因IL-10在大鼠CMC的蛋白质表达。
, 百拇医药
1.4 IL-10基因转移对LPS诱导大鼠CMC分泌细胞因子的作用
将第2代培养的CMC实验分组:①对照组:未加LPS(Difco Laboratory);②诱导组:加LPS(10 μg/mL);③转染抗G418抗性克隆pLX(IL-10)SN, 72 h后加LPS(10 μg/mL),然后分别于3,6,12,24 h收集上清液和细胞备检。按文献[4]的方法提取总RNA。按照RT-PCR试剂盒提供的方法行RT-PCR。以引物(sense, 141~160 bp:5′-CTT CTG TCT ACT GAA CTT CG-3′,anti-sense, 538~519 bp:5′-GTG CTT GAT CTG TTG TTT CC-3′)扩增大鼠CMC的TNFα mRNA, 产物为398 bp。以1对引物(sense,41~60 bp:5′-CAT AGA CAA GAT GGT GAA GG-3′,anti-sense,485~466 bp:5′-GAC AAT CTT GAG GGA GTT GTC-3′)扩增大鼠看家基因GAPDH的mRNA为阳性内参照,产物为445 bp。用薄层扫描仪(CS-9000,岛津,日本)检测DNA带的含量,计算每一样品的TNFα/GAPDH PCR扩增产物的相对比值。按照ELISA试剂盒(深圳晶美公司)提供的方法检测CMC培养上清液,各实验组的IL-1β,TNF α含量。
, 百拇医药
1.5 资料统计
每个样品重复测定6次,求均值,实验数据用 ±s表示。用计算机医用统计程序(SPSS/PC)对数据进行F及q检验。
±s表示。用计算机医用统计程序(SPSS/PC)对数据进行F及q检验。
2 结果
2.1 重组病毒感染滴度测定
经NIH3T3测定,重组病毒最高感染滴度为6×105CFU。
2.2 目的基因在转染大鼠CMC的表达
PCR扩增产物在15 g/L琼脂糖电泳显示转染pLX(IL-10)SN载体的有特异性扩增的pLXSN(1511 bp)至IL-10 cDNA的片段,为679 bp,而转染空白载体pLXSN的大鼠CMC则没有(图1);RT-PCR扩增产物在15 g/L琼脂糖电泳分析显示转染载体pLX(IL-10)SN有特异扩增的IL-10 mRNA片段:418 bp,而转染空白载体pLXSN的大鼠CMC则没有(图2)。ELISA检测显示IL-10基因在pLX(IL-10)SN转染大鼠CMC 2 d后开始表达,以每个细胞每24 h产量计达538 fg,高峰在第3天为1 755 fg,第7天、第14天、第28天分别为13.58 fg、10.57 fg、9.63 fg。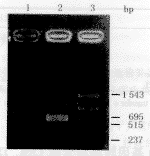
, 百拇医药
图1 PCR检测转染大鼠CMC DNA的IL-10基因
Fig. 1 PCR detection of IL-10 gene transferred into rat CMC
1. PCR product of rat CMC DNA(transfected with pLXSN vector). 2. PCR product of rat CMC DNA [transfected with pLX(IL-10)SN vector]: 679 bp. 3. PCR marker
图2 RT-PCR检测转染大鼠CMC RNA的IL-10 mRNA
, 百拇医药
Fig. 2 RT-PCR detection of IL-10 mRNA in rat CMC
1. Internal control: RT-PCR product of rat GAPDH mRNA: 570 bp. 2.RT-PCR product of rat CMC mRNA (transfected with pLXSN vector). 3. RT-PCR product of rat CMC mRNA [transfected with pLX(IL-10)SN vector]:418 bp. 4. PCR marker
2.3 IL-10基因转移对大鼠CMC产生IL-1β,TNFα蛋白质含量的影响
从表1和表2可看出:①对照组,正常大鼠CMC IL-1β、TNFα分泌量极低;②诱导组,LPS诱导IL-1β,TNFα蛋白质的产生明显增加;诱导组与对照组相比差异有显著性(P<0.05);③IL-10基因转移+LPS 10 mg/L组各个时点IL-1β,TNFα的产生与诱导组相比均减少,有明显的抑制作用(P<0.05)。
, http://www.100md.com
表1 IL-10基因转移对大鼠CMC产生IL-1β的影响
Table 1 The effect of IL-10 gene transfer on secretion of Proin-
flammatory cytokine IL-1β in rat Cardiomyocytes induced
(c/μg.L-1) Group
3 h
6 h
12 h
24 h
Control
, http://www.100md.com
132±12
165±14
136±12
132±12
LPS 10 mg/L
378±31
554±39
788±39
787±22
IL-10 gene transfer+
LPS 10 mg/L
150±14
, 百拇医药
175±14
188±17
188±14
IL-10 gene transfer+LPS 10 mg/L compared with LPS 10 mg/L,P<0.052.4 IL-10基因转移对大鼠CMC TNF-α mRNA表达的影响
对照组,正常大鼠CMC TNF-α分泌量极低,经LPS诱导后TNF-α/GAPDH 于3,6,12,24 h分别为0.458,0.942, 0.808和0.620,TNFα mRNA表达显著增加,IL-10基因转移后,用LPS诱导,TNFα/GAPDH于3,6,12,24 h分别为0.365,0.686,0.638和0.421,IL-10基因转移能显著抑制LPS诱导大鼠CMC产生TNFα。
表2 IL-10基因转移对大鼠CMC产生TNFα的影响
, http://www.100md.com
Table 2 The effect of IL-10 gene transfer on secretion of proin-flammatory cytokine TNFα in rat Cardiomyocytes induced
(c/μg.L-1) Group
3 h
6 h
12 h
24 h
Control
123±12
156±14
, http://www.100md.com
228±17
187±15
LPS 10 mg/L
455±32
1013±88
784±40
655±45
IL-10 gene transfer+
LPS 10 mg/L
201±19
274±27
304±27
, http://www.100md.com
225±20
IL-10 gene transfer+LPS 10 mg/L compared with LPS 10 mg/L,P<0.05
图3 RT-PCR检测大鼠CMC TNF α mRNA
Fig.3 RT-PCR detection of rat CMC TNF α mRNA
10,8,4,2:RT-PCR products of rat GMC TNFα mRNA after adding LPS(10 mg/L) 3,6,12,24 hours respectively, transfected with anti-G418 clone pLX(IL-10)SN. 9,7,3,1:RT-PCR products of rat GMC TNF α mRNA after adding LPS(10 mg/L) 3、6、12、24 hours respectively,not transfected with anti-G418 clone pLX(IL-10)SN. 5:PCR marker:1543,994,695,515,377,237 bp. 6:Control
, http://www.100md.com
3 讨论
心肌细胞(CMC)在病理状态下,如心脏移植排斥反应,急性心肌缺血缺氧,心脏再灌注损伤,充血性心力衰竭等,可释放TNFα,IL-1,IL-6与ICAM-1等多种炎症介质,此时CMC既是靶细胞,又通过多种途径成为参与者,其中通过分泌TNFα,IL-1,ICAM-1,活性氧等参与炎症损伤[5,6]是它的重要效应。而细胞因子的自分泌和旁分泌作用所导致的不断放大的炎症效应是许多心脏疾病持续发展和不断恶化的一个重要环节。Roberts[7]等认为细胞因子可以通过不依赖于细胞因子诱导的NO合成影响钙的稳定性从而抑制心肌细胞的收缩功能,而另一方面可以通过IL-1β,γ-IFN介导的NO合成加重心肌细胞的损伤[8]。TNFα不论对完整的左心室还是厚的心肌组织、体外培养的心肌细胞[9]都有负性肌力作用。TNFα对心肌的短时(10~30 min)负性肌力作用主要由鞘氨醇介导[8],而长时(24~72 h)负性肌力作用主要由NO介导。TNFα长时间的升高还引起左室功能失调、心肌病、肺水肿和左心室重构等。IL-1引起心律失常,抑制心肌收缩,通过间接途径抑制RNA和蛋白质的合成[10]。由于炎症效应是许多心脏疾病持续发展和不断恶化的一个重要环节,因而打断这一环节有可能延缓甚/或逆转疾病的发展进程。
, 百拇医药
本研究所用的逆转录载体pLXSN是双表达载体,其外源性目的基因由5′LTR中的调控序列起动控制,而选择性基因Neo基因由SV40增强启动子调控。构建表达IL-10的逆转录病毒重组体PLX(IL-10)SN,通过转染包装细胞PA317获得对大鼠CMC的感染性,外源性IL-10基因可以转移到大鼠CMC并稳定表达,它能抑制CMC炎症效应中细胞因子的过度产生及其基因表达,但对炎症因子的基础分泌没有影响。因而有可能利用IL-10基因转移抑制炎症因子所致的不断放大的炎症效应,在心脏疾病的炎症反应中发挥抗炎作用,从而延缓甚至逆转某些心脏疾病的发展进程。
参考文献
1.Howard M. Biological properties of IL-10. Immunol Today, 1992,13(67):198
2.李锦华,陈永雄,刘 军,等. 大鼠肾小球系膜细胞表达人白细胞介素-10. 中山大学学报(自然科学版),1998,37(增刊):88
, http://www.100md.com
3.王光武,王凡. 氢过氧化枯烯对心肌细胞DNA的影响. 白求恩医科大学学报, 1996,22(3):226
4.王申五主编. 基因诊断技术—非放射性操作手册. 北京:北京医科大学中国协和医科大学联合出版社. 1992. 39,46,109~111
5.Kapadia S, Lee J R, Torre A G, et al. Tumor necrosis factor gene and protein expression in adult feline myocardium after endotoxin administration. J Clin Invest, 1995,96(2):1042
6.Hawkins H K, Entman M L, Jessica Y Z, et al. Acute Inflammatory reaction after myocardial ischemic injury and reperfusion development and use of a neutrophil-specific antibody. Am J Pathol, 1996,148(6):1957
, 百拇医药
7.Roberts A B, Vodovotz Y, Roche N S, et al. Role of nitric oxide in antagonistic effects of transforming growth factor-beta and interleukin-1 beta on the beating rate of culture cardiac myocytes. Mol Endocrinol, 1992,6(11):1921
8.Dachun Wang, McMillin J B, Roger B,et al. Response of the neonatal rat cardiomyocyte in culture to energy depletion:effects of cytokines, nitric oxide, and heat shock proteins. Lab Invest,1996,75(6):809
, http://www.100md.com 9.Weisensee D, Bereiter H J, Schoeppe W, et al. Effects of cytokines on the contractility of cultured cardiac myocytes. Int J Immunopharmacol,1993,15(5):581
10.Hosenpud J D, Campbell S M, Pan G. Indirect inhibition of myocyte RNA and protein synthesis by interleukin-1. J Mol Cell Cardiol, 1990,22(2):213
1999 - 03 - 15收稿
1999 - 04 - 21修回
, 百拇医药
单位:李锦华 陈永雄 张仕光 中山医科大学附属第一医院 肾内科 ;廖晓星 急诊科; 广州, 510080
关键词:基因转移;白细胞介素10;心肌;炎症
中山医科大学学报/990305
摘要 目的:观察人白细胞介素10 (human Interleukin 10, hIL-10)基因转导对脂多糖(LPS)诱导大鼠心肌细胞(CMC)的炎症细胞因子的产生及其基因表达的影响。方法:通过重组逆转录病毒载体pLX(IL-10)SN将人IL-10基因导入大鼠CMC,应用PCR,RT-PCR和ELISA:①检测IL-10基因的整合和表达;②观察IL-10基因转导对LPS诱导的CMC肿瘤坏死因子-α(TNF-α)的mRNA表达及白细胞介素-1β(IL-1β)和TNF-α的蛋白质的产生的影响。结果:外源性IL-10基因已整合到靶细胞染色体DNA并有效地表达,并能抑制LPS诱生CMC产生IL-1β,TNF-α。结论:逆转录病毒载体介导的人IL-10基因转导能抑制CMC炎症效应中细胞因子的产生及其基因表达。
, 百拇医药
中图号 R 542.2; R 392.32
hIL-10 Gene Transfer on Secretion of Inflammatory
Cytokines in Rat Cardiomyocytes Induced
Li Jinhua Chen Yongxiong Zhang Shiguang Lao Xiaoxing
( 1 Nephrology Department 2 Emergency Department, First Affiliated Hospital, Sun Yat-sen
University of Medical Sciences, Guangzhou, 510080)
, 百拇医药
Abstract Objective:To investigate the effects of interleukin-10(IL-10) gene transfer on secretion of inflammatory cytokines in rat cardiomyocytes(CMC) induced by LPS in vitro. Method: Exogenous human IL-10(hIL-10) gene was transferred into rat CMC by retroviral vector pLX(IL-10)SN. The polymerase chain reaction (PCR), the reverse transcription polymerase chain reaction (RT-PCR) and ELISA were used ① to detect integration and expression of hIL-10 gene in rat CMC; ② to observe the effects of interleukin 10 gene transfer on secretion of inflammatory cytokines in rat CMC cells induced by LPS in vitro. Result: Human IL-10 gene had been integrated into the chromosal DNA of the transfected rat CMC cells and hIL-10 gene could be expressed effectively by the transfected rat CMC cells. Exogenous IL-10 gene transfer could inhibit secretion of inflammatory cytokines IL-1β and TNF-α in the transfected rat CMC at mRNA and protein level induced by LPS. Conclusion:Exogenous interleukin 10 gene transfer can inhibit secretion of inflammatory cytokines in CMC.
, 百拇医药
Subject headings gene transfer; interleukin-10; myocardium; inflammation
白细胞介素10[1]是T辅助细胞产生的,以抑制Th1细胞克隆的细胞因子合成为特点的多效免疫调节因子,具有重要的抗炎及免疫抑制作用。本实验通过逆转录病毒载体将人IL-10基因转导至大鼠(cardiomyocyte,CMC),观察IL-10基因转移对LPS诱导的大鼠CMC生成IL-1和TNF-α的影响,以探讨IL-10基因转导作为抗炎、抗排斥治疗手段的可能性及其作用。
1 材料和方法
1.1 重组逆转录病毒载体的包装与重组病毒感染滴度测定
含人IL-10全长cDNA(0.61 kb)的逆转录病毒载体pLX(IL-10)SN由本室构建[2]。将重组载体pLX(IL-10)SN和空白载体pLXSN用DOTAP(Boehringer Mannheim)导入PA317(军事医学科学院),用G418(G1BCO BRL)进行筛选:以NIH 3T3细胞(军事医学科学院)测定重组病毒感染滴度。单位为CFU/mL。
, http://www.100md.com
1.2 大鼠CMC的转染
按文献[3]的方法培养Wistar大鼠(中山医科大学实验动物中心)CMC。抗G418抗性克隆pLX(IL-10)SN和pLXSN感染大鼠CMC,120 h后取CMC按文献[4]的方法提取DNA和RNA。
1.3 目的基因IL-10在CMC表达的检测
①PCR:按照PCR试剂盒(华美公司)提供的方法进行。引物A(pLXSN 1 511~1 530 bp:5′-GTCAAGCCCTTTGTACACCC-3′,引物C(hIL-10 cDNA 546~525 bp:5′-CCTGATGGT CTCAGTTTCGTATC-3′)(引物由中国科学院上海生物工程研究中心合成,以下引物相同)检测目的基因IL-10在大鼠CMC的整合,产物679 bp。②RT-PCR:按照RT-PCR试剂盒(Promega)提供的方法进行。上游引物B(hIL-10 cDNA 129~150 bp:5′-TCT CCG AGA TGC CTT TCA GCA GA-3′),引物C(见上)作RT-PCR检测目的基因IL-10在大鼠CMC的转录,产物418 bp。以一对引物(RAT GAPDH cDNA sense 21~40 bp:5′-CAT AGA CAA GAT GGT GAA GG-3′,anti-sense 590~571 bp:5′-TCC ACA GTC TTC TGA GTG GC-3′)扩增大鼠看家基因GAPDH的mRNA为阳性内参照,产物570 bp。③按照ELISA试剂盒(深圳晶美公司)提供的方法检测目的的基因IL-10在大鼠CMC的蛋白质表达。
, 百拇医药
1.4 IL-10基因转移对LPS诱导大鼠CMC分泌细胞因子的作用
将第2代培养的CMC实验分组:①对照组:未加LPS(Difco Laboratory);②诱导组:加LPS(10 μg/mL);③转染抗G418抗性克隆pLX(IL-10)SN, 72 h后加LPS(10 μg/mL),然后分别于3,6,12,24 h收集上清液和细胞备检。按文献[4]的方法提取总RNA。按照RT-PCR试剂盒提供的方法行RT-PCR。以引物(sense, 141~160 bp:5′-CTT CTG TCT ACT GAA CTT CG-3′,anti-sense, 538~519 bp:5′-GTG CTT GAT CTG TTG TTT CC-3′)扩增大鼠CMC的TNFα mRNA, 产物为398 bp。以1对引物(sense,41~60 bp:5′-CAT AGA CAA GAT GGT GAA GG-3′,anti-sense,485~466 bp:5′-GAC AAT CTT GAG GGA GTT GTC-3′)扩增大鼠看家基因GAPDH的mRNA为阳性内参照,产物为445 bp。用薄层扫描仪(CS-9000,岛津,日本)检测DNA带的含量,计算每一样品的TNFα/GAPDH PCR扩增产物的相对比值。按照ELISA试剂盒(深圳晶美公司)提供的方法检测CMC培养上清液,各实验组的IL-1β,TNF α含量。
, 百拇医药
1.5 资料统计
每个样品重复测定6次,求均值,实验数据用
2 结果
2.1 重组病毒感染滴度测定
经NIH3T3测定,重组病毒最高感染滴度为6×105CFU。
2.2 目的基因在转染大鼠CMC的表达
PCR扩增产物在15 g/L琼脂糖电泳显示转染pLX(IL-10)SN载体的有特异性扩增的pLXSN(1511 bp)至IL-10 cDNA的片段,为679 bp,而转染空白载体pLXSN的大鼠CMC则没有(图1);RT-PCR扩增产物在15 g/L琼脂糖电泳分析显示转染载体pLX(IL-10)SN有特异扩增的IL-10 mRNA片段:418 bp,而转染空白载体pLXSN的大鼠CMC则没有(图2)。ELISA检测显示IL-10基因在pLX(IL-10)SN转染大鼠CMC 2 d后开始表达,以每个细胞每24 h产量计达538 fg,高峰在第3天为1 755 fg,第7天、第14天、第28天分别为13.58 fg、10.57 fg、9.63 fg。

, 百拇医药
图1 PCR检测转染大鼠CMC DNA的IL-10基因
Fig. 1 PCR detection of IL-10 gene transferred into rat CMC
1. PCR product of rat CMC DNA(transfected with pLXSN vector). 2. PCR product of rat CMC DNA [transfected with pLX(IL-10)SN vector]: 679 bp. 3. PCR marker

图2 RT-PCR检测转染大鼠CMC RNA的IL-10 mRNA
, 百拇医药
Fig. 2 RT-PCR detection of IL-10 mRNA in rat CMC
1. Internal control: RT-PCR product of rat GAPDH mRNA: 570 bp. 2.RT-PCR product of rat CMC mRNA (transfected with pLXSN vector). 3. RT-PCR product of rat CMC mRNA [transfected with pLX(IL-10)SN vector]:418 bp. 4. PCR marker
2.3 IL-10基因转移对大鼠CMC产生IL-1β,TNFα蛋白质含量的影响
从表1和表2可看出:①对照组,正常大鼠CMC IL-1β、TNFα分泌量极低;②诱导组,LPS诱导IL-1β,TNFα蛋白质的产生明显增加;诱导组与对照组相比差异有显著性(P<0.05);③IL-10基因转移+LPS 10 mg/L组各个时点IL-1β,TNFα的产生与诱导组相比均减少,有明显的抑制作用(P<0.05)。
, http://www.100md.com
表1 IL-10基因转移对大鼠CMC产生IL-1β的影响
Table 1 The effect of IL-10 gene transfer on secretion of Proin-
flammatory cytokine IL-1β in rat Cardiomyocytes induced
(c/μg.L-1) Group
3 h
6 h
12 h
24 h
Control
, http://www.100md.com
132±12
165±14
136±12
132±12
LPS 10 mg/L
378±31
554±39
788±39
787±22
IL-10 gene transfer+
LPS 10 mg/L
150±14
, 百拇医药
175±14
188±17
188±14
IL-10 gene transfer+LPS 10 mg/L compared with LPS 10 mg/L,P<0.052.4 IL-10基因转移对大鼠CMC TNF-α mRNA表达的影响
对照组,正常大鼠CMC TNF-α分泌量极低,经LPS诱导后TNF-α/GAPDH 于3,6,12,24 h分别为0.458,0.942, 0.808和0.620,TNFα mRNA表达显著增加,IL-10基因转移后,用LPS诱导,TNFα/GAPDH于3,6,12,24 h分别为0.365,0.686,0.638和0.421,IL-10基因转移能显著抑制LPS诱导大鼠CMC产生TNFα。
表2 IL-10基因转移对大鼠CMC产生TNFα的影响
, http://www.100md.com
Table 2 The effect of IL-10 gene transfer on secretion of proin-flammatory cytokine TNFα in rat Cardiomyocytes induced
(c/μg.L-1) Group
3 h
6 h
12 h
24 h
Control
123±12
156±14
, http://www.100md.com
228±17
187±15
LPS 10 mg/L
455±32
1013±88
784±40
655±45
IL-10 gene transfer+
LPS 10 mg/L
201±19
274±27
304±27
, http://www.100md.com
225±20
IL-10 gene transfer+LPS 10 mg/L compared with LPS 10 mg/L,P<0.05

图3 RT-PCR检测大鼠CMC TNF α mRNA
Fig.3 RT-PCR detection of rat CMC TNF α mRNA
10,8,4,2:RT-PCR products of rat GMC TNFα mRNA after adding LPS(10 mg/L) 3,6,12,24 hours respectively, transfected with anti-G418 clone pLX(IL-10)SN. 9,7,3,1:RT-PCR products of rat GMC TNF α mRNA after adding LPS(10 mg/L) 3、6、12、24 hours respectively,not transfected with anti-G418 clone pLX(IL-10)SN. 5:PCR marker:1543,994,695,515,377,237 bp. 6:Control
, http://www.100md.com
3 讨论
心肌细胞(CMC)在病理状态下,如心脏移植排斥反应,急性心肌缺血缺氧,心脏再灌注损伤,充血性心力衰竭等,可释放TNFα,IL-1,IL-6与ICAM-1等多种炎症介质,此时CMC既是靶细胞,又通过多种途径成为参与者,其中通过分泌TNFα,IL-1,ICAM-1,活性氧等参与炎症损伤[5,6]是它的重要效应。而细胞因子的自分泌和旁分泌作用所导致的不断放大的炎症效应是许多心脏疾病持续发展和不断恶化的一个重要环节。Roberts[7]等认为细胞因子可以通过不依赖于细胞因子诱导的NO合成影响钙的稳定性从而抑制心肌细胞的收缩功能,而另一方面可以通过IL-1β,γ-IFN介导的NO合成加重心肌细胞的损伤[8]。TNFα不论对完整的左心室还是厚的心肌组织、体外培养的心肌细胞[9]都有负性肌力作用。TNFα对心肌的短时(10~30 min)负性肌力作用主要由鞘氨醇介导[8],而长时(24~72 h)负性肌力作用主要由NO介导。TNFα长时间的升高还引起左室功能失调、心肌病、肺水肿和左心室重构等。IL-1引起心律失常,抑制心肌收缩,通过间接途径抑制RNA和蛋白质的合成[10]。由于炎症效应是许多心脏疾病持续发展和不断恶化的一个重要环节,因而打断这一环节有可能延缓甚/或逆转疾病的发展进程。
, 百拇医药
本研究所用的逆转录载体pLXSN是双表达载体,其外源性目的基因由5′LTR中的调控序列起动控制,而选择性基因Neo基因由SV40增强启动子调控。构建表达IL-10的逆转录病毒重组体PLX(IL-10)SN,通过转染包装细胞PA317获得对大鼠CMC的感染性,外源性IL-10基因可以转移到大鼠CMC并稳定表达,它能抑制CMC炎症效应中细胞因子的过度产生及其基因表达,但对炎症因子的基础分泌没有影响。因而有可能利用IL-10基因转移抑制炎症因子所致的不断放大的炎症效应,在心脏疾病的炎症反应中发挥抗炎作用,从而延缓甚至逆转某些心脏疾病的发展进程。
参考文献
1.Howard M. Biological properties of IL-10. Immunol Today, 1992,13(67):198
2.李锦华,陈永雄,刘 军,等. 大鼠肾小球系膜细胞表达人白细胞介素-10. 中山大学学报(自然科学版),1998,37(增刊):88
, http://www.100md.com
3.王光武,王凡. 氢过氧化枯烯对心肌细胞DNA的影响. 白求恩医科大学学报, 1996,22(3):226
4.王申五主编. 基因诊断技术—非放射性操作手册. 北京:北京医科大学中国协和医科大学联合出版社. 1992. 39,46,109~111
5.Kapadia S, Lee J R, Torre A G, et al. Tumor necrosis factor gene and protein expression in adult feline myocardium after endotoxin administration. J Clin Invest, 1995,96(2):1042
6.Hawkins H K, Entman M L, Jessica Y Z, et al. Acute Inflammatory reaction after myocardial ischemic injury and reperfusion development and use of a neutrophil-specific antibody. Am J Pathol, 1996,148(6):1957
, 百拇医药
7.Roberts A B, Vodovotz Y, Roche N S, et al. Role of nitric oxide in antagonistic effects of transforming growth factor-beta and interleukin-1 beta on the beating rate of culture cardiac myocytes. Mol Endocrinol, 1992,6(11):1921
8.Dachun Wang, McMillin J B, Roger B,et al. Response of the neonatal rat cardiomyocyte in culture to energy depletion:effects of cytokines, nitric oxide, and heat shock proteins. Lab Invest,1996,75(6):809
, http://www.100md.com 9.Weisensee D, Bereiter H J, Schoeppe W, et al. Effects of cytokines on the contractility of cultured cardiac myocytes. Int J Immunopharmacol,1993,15(5):581
10.Hosenpud J D, Campbell S M, Pan G. Indirect inhibition of myocyte RNA and protein synthesis by interleukin-1. J Mol Cell Cardiol, 1990,22(2):213
1999 - 03 - 15收稿
1999 - 04 - 21修回
, 百拇医药