IL-12、LPS对肾小管上皮细胞中lck/P38信号传递的影响
作者:李清刚 李幼姬 李志坚 黄凌虹
单位:中山医科大学附属第一医院肾内科,广东 广州 510080
关键词:肾小管;上皮细胞;白细胞介素12;脂多糖类,淋巴细胞特异蛋白质酪氨酸激酶p56(LCK);P38
中山医科大学学报000309
摘 要:【目的】探讨IL-12、LPS对肾小管上皮细胞中lck基因表达及活性改变的影响,明确lck/P38信号传递途径在炎症过程的作用。【方法】用原位杂交、放射自显影分别检测lck基因表达及lck活性,用免疫印迹法对肾小管上皮细胞在IL-12、LPS刺激下其P38磷酸化进行测定。【结果】肾小管上皮细胞经IL-12,LPS刺激后lck mRNA表达水平增高,lck活性在刺激后5 min时最强,加入lck抑制剂PP1,IL-12刺激lck活性明显减弱。IL-12及LPS可以促进肾小管上皮细胞中P38活化、磷酸化,在15 min时最强,加入lck抑制剂后则抑制IL-12刺激时的P38磷酸化,而LPS刺激组不明显。【结论】IL-12,LPS可通过促进肾小管上皮细胞中lck/P38活化,参与炎症过程。
, http://www.100md.com
中图分类号:R 392.11 文献标识码:A 文献编号:1000-257X(2000)03-0190-03
Effect of IL-12 and LPS on lck/P38 Signalling Pathaways in Tubular Epithelium
LI Qing-gang,LI You-ji,LI Zhi-jian,HUANG Ling-hong
(Department of Nephrology,First Affiliated Hospital of Sun Yat-sen University of Medical Sciences,Guangzhou 510080,China)
Abstract:【Objective】In order to investigate IL-12 and LPS on Lck gene expression and its activity in renal tubular epithelial cells(TEC) and clarify roles of IL-12 and P38 signalling pathways involved in inflammation.【Methods】mRNA expression of lck and lck activity were determined by in situ hybridization and autoradiography respectively.P38 phosphorylation upon IL-12 and LPS stimulations was detected by Western blot analysis.【Results】Increased mRNA expression of lck was observed after stimulation of TEC with IL-12 and LPS .The maximal effect on lck activity was present at 5 min after stimulation and the activity of lck was martly decreased upon IL-12 treatment in the presence of lck selective inhibitor PP1.Moreover,IL-12 and LPS may induce the phosphorylation of P38 in TEC,maximal phosphorylation occurred at 15 min after stimulation.In addition,PP1 inhibited the phosphorylation of P38 induced by IL-12.【Conclusion】IL-12 and LPS are involved in inflammation via the activation of lck/P38 in TEC.
, 百拇医药
Key words:kidney tubules; epithelial cells; interleukin-12;lipopolysaccharide receptes; lymphocyte specific protein tyrosine kinase p56(LCK); P38
最近报道狼疮肾炎肾小管上皮细胞异常合成白细胞介素12(IL-12)[1],它与肾间质病理改变密切相关,但对它发挥生物学作用的细胞内信号传递机制尚不清楚。 目前发现IL-12在T淋巴细胞可以促进lck表达及活化,而lck又可调节P38活化,发挥生物学作用[2]。本实验目的是探讨肾小管上皮细胞是否存在lck及IL-12、LPS对肾小管上皮细胞作用时lck/P38信号传递途径的变化,寻找它们对肾小管上皮细胞作用的内在机制。
1 材料与方法
, 百拇医药
1.1 细胞来源
取BALB/C小鼠,雌性,5~6周,参照文献[3]分离培养肾小管上皮细胞,经形态学及酶学鉴定,取2~3代细胞进行实验。
1.2 方 法
1.2.1 试 剂 单抗(Neomarkers公司,英国),P38试剂盒(Newlab,英国); IL-12(Propo Tech,美国),LPS(军事医学科学院);lck探针参照基因库(Gene Bank U19834)由上海生物工程研究所合成,3′末端标记检测试剂盒(Roche,德国)地高辛原位杂交试剂盒(博士德公司,武汉);γ-32P ATP由北京原子能研究所提供。
1.2.2 肾小管上皮细胞中lck mRNA检测 肾小管上皮细胞分别经IL-12、LPS刺激培养16 h,用原位杂交方法检测lck基因表达。
, 百拇医药
1.2.3 肾小管上皮细胞中lck活性检测 肾小管上皮细胞分别经IL-12、LPS、IL-12+PP1和LPS+PP1刺激5 min、30 min ,并设空白对照,然后提取蛋白,进行SDS-PAGE电泳后放射自显影(-20 ℃暗盒中曝光24 h)检测其活性。
1.2.4 肾小管上皮细胞中P38磷酸化检测 设LPS,IL-12、IL-12+PP1和IL-12+SB203580刺激15 min,并设空白对照组,用2×SDS加样缓冲液提取蛋白,SDS-PAGE电转后免疫化学发光检测其蛋白磷酸化。
1.3 资料分析处理
在200倍视野下随机选取10 个细胞,用Kontron IBAS2.0全自动图象分析系统测定细胞内杂交产物的平均吸光值,在IBM PC/XT486计算机SAS软件中进行t检验统计处理。
, http://www.100md.com
2 结 果
如图1A、B,肾小管上皮细胞经IL-12和LPS分别刺激培养16 h后进行lck原位杂交,在肾小管上皮细胞胞膜可见深棕色的致密颗粒,IL-12和LPS组较正常对照组增加,LPS组最明显。细胞内杂交产物的平均A值,IL-12(0.293±0.026)和LPS(0.364±0.012)组均显著高于对照组(0.267±0.021),P<0.05或<0.01。而lck活性在肾小管上皮细胞经IL-12、LPS刺激后,5 min时最强,30 min时开始强度减弱,对照组则未发生磷酸化;而加入lck 抑制剂PP1后,IL-12或LPS刺激lck活性的作用均明显受抑制(见图2,参照Hanke方法[4])。
肾小管上皮细胞经IL-12或LPS刺激后均可发生P38磷酸化,后者作用较强,而加入PP1或SB203 580后,除LPS+PP1组仍有P38磷酸化外,其余均未发生磷酸化(见图3,按照Trevillyan方法[4])。
, http://www.100md.com
图1 肾小管上皮细胞Lck mRNA表达
Fig.1 mRNA expression of lck in renal epithelial cells(ln situ hybridiazation ×400)
A:IL-2,B:LPS; The positive brown particles were found in the cellular membrane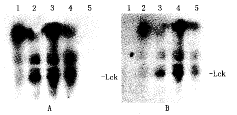
图2 IL-12、LPS 分别刺激肾小管上皮细胞时Lck活性
Fig.2 Lck activity in TEC stimulated with IL-12 and LPS,respectively (Radiography)
, 百拇医药
A:5 min,B:30 min ; 1.Blank,2.LPS,3.IL-12,4.IL-12+PP1,5. LPS+PP1;The lanes marked 56 ku of 2,3 were the most obvious in A,B graphs
3 讨 论
肾小管上皮细胞的异常抗原递呈及炎症因子的自分泌、旁分泌是多种小管间质病理改变的重要环节。许多研究证实肾小管上皮细胞具有抗原递呈功能,可表达HLA I、II类抗原,合成补体C2、C3、C4,分泌IL-1、IL-6、IL-8、 IL-12等多种细胞因子,参与小管炎症过程,然而这些细胞因子影响肾小管上皮细胞生物学活性的细胞内信号传递途径至今尚未完全明确。
, http://www.100md.com
图3 IL-12、LPS 分别刺激肾小管上皮细胞15 min的P38磷酸化
Fig.3 Phosphorylation of P38 in TEC was stimulated for 15 min with IL-12 or LPS (Westers blot)
A: Phosphorylation of P38 B: Nonphosphorylation of P38 1.Marker,2.IL-12,3.Blank,4.LPS+SB203580,5.IL-12+PP1,6.LPS+PP1
在酪氨酸激酶家族中,lck是非受体蛋白酪氨酸激酶丝氨酸家族成员之一,lck主要存在于T和NK细胞。其对T细胞抗原--受体信号传递途径很重要[5]。Claudio等发现IL-12可促进Jurkat3细胞的lck表达及发生活化,近期还发现lck并非限于淋巴细胞,在乳腺上皮细胞中亦存在[6]。我们的研究发现肾小管上皮细胞中存在lck基因表达,并且经IL-12和LPS刺激后lck激酶可被激活,应用lck抑制剂封闭其酶活性位点后,IL-12和LPS不能激活lck,与国外报道相一致[5]。这提示IL-12和LPS可作用于lck的某些位点而激活lck,发挥其生物学作用。
, http://www.100md.com
P38是一种分裂原蛋白激酶(MAPK),有学者发现抑制lck活性会阻抑P38激酶[5]。我们在实验中亦证实应用lck抑制剂后,IL-12刺激的P38磷酸化明显受抑制,而LPS则仍使P38磷酸化。这提示IL-12对P38的磷酸化是唯一通过lck激活后实现的,lck激活促使P38磷酸化,而LPS可能还通过除lck外的途径活化P38。应用SB203580直接抑制了P38磷酸化,使P38不能作用于下游信号传导分子,这与Trevillyan等[6]的报道结论是一致的。现在研究发现,P38的激活可磷酸化多种转录因子,如活化转录因子ELK(丝氨酸383/389),使其和血清反应元体SRE结合;它也能活化转录因子ATF2(丝氨酸89171),介导ATF2和cAMP反应元体(CRE)的结合;它还能磷酸化转录因子Max(丝氨酸82),致使Max和myc转录因子形成复合物,从而发挥多种生物学作用。
, 百拇医药
我们的实验发现,IL-12,LPS可以通过激活lck诱使P38磷酸化,亦证实了在肾小管上皮细胞,IL-12作用时P38活化可受lck调节,而LPS亦可通过lck途经激活P38,发挥P38的多种信号传递作用。
基金项目:卫生部基金资助课题(94-1-105)
作者简介:李清刚(1970-),男,山东临沂人,在职博士生.
参考文献
[1]Fan X,Oertli B,Wuthich R P,et al.Up-regulation of tubular epithelial interleukin-12 in autoimmune MRL-Fas (lpr) mice with renal injury[J].Kidney Int.1997,51(1):79.
, 百拇医药
[2]Konakova M,Huch O F,Schceuing.Downstream targets of urokinase-type plasminogen-activator-mediated signal transduction[J].Eur J Biochem,1998,253(2):2421.
[3]Detisac C J,sews M A,Garvin A J,et al.Tissue culture of human kidney epithelial cells of proximal tubule origin[J].Kidney Int,1984,25(2):383.
[4]Hanke J H ,Gander J L,Dow R L,et al.Discovery of a novel,potent,and src family-selective tyrosine kinase inhibitor:study of lck-and fyn-T-dependent T cell activation[J].J Biolo Chem,1996,271(2):695.
, 百拇医药
[5]Trevillyan J M,Chiou X G,Ballaron S J,et al.Inhibition of p56 (lck) tyrosine kinase by isothiazolones[J].Arch Biochem Biophys,1999,364(1):19 .
[6]Gerritsma J S J,Hiemstra P S,Gerritsen A F,et al.IL-8 by human proximal tubular epithelial cells in vitro[J].Clin Exp Immunol ,1996,103(2):289.
[7]Gerristsma J S,Gerristen A F,Van kooteen C,et al.Interleukin-1a enhances the biosynthesis of complement C3 and factor B by human proximal tubular epithelial cells in vitro[J].Mol Immunol,1996,33[10]:847.
, http://www.100md.com
[8]Gerritsma J S J,Gerristen A F,Deley M,et al.Interferon-γ induces biosynthesis of complement C2,C4 and factor H by human proximal tubular epithelial cells[J].Cytokine,1997,9(4):275.
[9]Amundatottir L T,Leder P.Signal transduction pathways activated and required for mammary carcinogenesis in response to specific oncogenes[J].Oncogene,1998,16(6):737.
收稿日期:2000-01-04, 百拇医药
单位:中山医科大学附属第一医院肾内科,广东 广州 510080
关键词:肾小管;上皮细胞;白细胞介素12;脂多糖类,淋巴细胞特异蛋白质酪氨酸激酶p56(LCK);P38
中山医科大学学报000309
摘 要:【目的】探讨IL-12、LPS对肾小管上皮细胞中lck基因表达及活性改变的影响,明确lck/P38信号传递途径在炎症过程的作用。【方法】用原位杂交、放射自显影分别检测lck基因表达及lck活性,用免疫印迹法对肾小管上皮细胞在IL-12、LPS刺激下其P38磷酸化进行测定。【结果】肾小管上皮细胞经IL-12,LPS刺激后lck mRNA表达水平增高,lck活性在刺激后5 min时最强,加入lck抑制剂PP1,IL-12刺激lck活性明显减弱。IL-12及LPS可以促进肾小管上皮细胞中P38活化、磷酸化,在15 min时最强,加入lck抑制剂后则抑制IL-12刺激时的P38磷酸化,而LPS刺激组不明显。【结论】IL-12,LPS可通过促进肾小管上皮细胞中lck/P38活化,参与炎症过程。
, http://www.100md.com
中图分类号:R 392.11 文献标识码:A 文献编号:1000-257X(2000)03-0190-03
Effect of IL-12 and LPS on lck/P38 Signalling Pathaways in Tubular Epithelium
LI Qing-gang,LI You-ji,LI Zhi-jian,HUANG Ling-hong
(Department of Nephrology,First Affiliated Hospital of Sun Yat-sen University of Medical Sciences,Guangzhou 510080,China)
Abstract:【Objective】In order to investigate IL-12 and LPS on Lck gene expression and its activity in renal tubular epithelial cells(TEC) and clarify roles of IL-12 and P38 signalling pathways involved in inflammation.【Methods】mRNA expression of lck and lck activity were determined by in situ hybridization and autoradiography respectively.P38 phosphorylation upon IL-12 and LPS stimulations was detected by Western blot analysis.【Results】Increased mRNA expression of lck was observed after stimulation of TEC with IL-12 and LPS .The maximal effect on lck activity was present at 5 min after stimulation and the activity of lck was martly decreased upon IL-12 treatment in the presence of lck selective inhibitor PP1.Moreover,IL-12 and LPS may induce the phosphorylation of P38 in TEC,maximal phosphorylation occurred at 15 min after stimulation.In addition,PP1 inhibited the phosphorylation of P38 induced by IL-12.【Conclusion】IL-12 and LPS are involved in inflammation via the activation of lck/P38 in TEC.
, 百拇医药
Key words:kidney tubules; epithelial cells; interleukin-12;lipopolysaccharide receptes; lymphocyte specific protein tyrosine kinase p56(LCK); P38
最近报道狼疮肾炎肾小管上皮细胞异常合成白细胞介素12(IL-12)[1],它与肾间质病理改变密切相关,但对它发挥生物学作用的细胞内信号传递机制尚不清楚。 目前发现IL-12在T淋巴细胞可以促进lck表达及活化,而lck又可调节P38活化,发挥生物学作用[2]。本实验目的是探讨肾小管上皮细胞是否存在lck及IL-12、LPS对肾小管上皮细胞作用时lck/P38信号传递途径的变化,寻找它们对肾小管上皮细胞作用的内在机制。
1 材料与方法
, 百拇医药
1.1 细胞来源
取BALB/C小鼠,雌性,5~6周,参照文献[3]分离培养肾小管上皮细胞,经形态学及酶学鉴定,取2~3代细胞进行实验。
1.2 方 法
1.2.1 试 剂 单抗(Neomarkers公司,英国),P38试剂盒(Newlab,英国); IL-12(Propo Tech,美国),LPS(军事医学科学院);lck探针参照基因库(Gene Bank U19834)由上海生物工程研究所合成,3′末端标记检测试剂盒(Roche,德国)地高辛原位杂交试剂盒(博士德公司,武汉);γ-32P ATP由北京原子能研究所提供。
1.2.2 肾小管上皮细胞中lck mRNA检测 肾小管上皮细胞分别经IL-12、LPS刺激培养16 h,用原位杂交方法检测lck基因表达。
, 百拇医药
1.2.3 肾小管上皮细胞中lck活性检测 肾小管上皮细胞分别经IL-12、LPS、IL-12+PP1和LPS+PP1刺激5 min、30 min ,并设空白对照,然后提取蛋白,进行SDS-PAGE电泳后放射自显影(-20 ℃暗盒中曝光24 h)检测其活性。
1.2.4 肾小管上皮细胞中P38磷酸化检测 设LPS,IL-12、IL-12+PP1和IL-12+SB203580刺激15 min,并设空白对照组,用2×SDS加样缓冲液提取蛋白,SDS-PAGE电转后免疫化学发光检测其蛋白磷酸化。
1.3 资料分析处理
在200倍视野下随机选取10 个细胞,用Kontron IBAS2.0全自动图象分析系统测定细胞内杂交产物的平均吸光值,在IBM PC/XT486计算机SAS软件中进行t检验统计处理。
, http://www.100md.com
2 结 果
如图1A、B,肾小管上皮细胞经IL-12和LPS分别刺激培养16 h后进行lck原位杂交,在肾小管上皮细胞胞膜可见深棕色的致密颗粒,IL-12和LPS组较正常对照组增加,LPS组最明显。细胞内杂交产物的平均A值,IL-12(0.293±0.026)和LPS(0.364±0.012)组均显著高于对照组(0.267±0.021),P<0.05或<0.01。而lck活性在肾小管上皮细胞经IL-12、LPS刺激后,5 min时最强,30 min时开始强度减弱,对照组则未发生磷酸化;而加入lck 抑制剂PP1后,IL-12或LPS刺激lck活性的作用均明显受抑制(见图2,参照Hanke方法[4])。
肾小管上皮细胞经IL-12或LPS刺激后均可发生P38磷酸化,后者作用较强,而加入PP1或SB203 580后,除LPS+PP1组仍有P38磷酸化外,其余均未发生磷酸化(见图3,按照Trevillyan方法[4])。

, http://www.100md.com
图1 肾小管上皮细胞Lck mRNA表达
Fig.1 mRNA expression of lck in renal epithelial cells(ln situ hybridiazation ×400)
A:IL-2,B:LPS; The positive brown particles were found in the cellular membrane

图2 IL-12、LPS 分别刺激肾小管上皮细胞时Lck活性
Fig.2 Lck activity in TEC stimulated with IL-12 and LPS,respectively (Radiography)
, 百拇医药
A:5 min,B:30 min ; 1.Blank,2.LPS,3.IL-12,4.IL-12+PP1,5. LPS+PP1;The lanes marked 56 ku of 2,3 were the most obvious in A,B graphs
3 讨 论
肾小管上皮细胞的异常抗原递呈及炎症因子的自分泌、旁分泌是多种小管间质病理改变的重要环节。许多研究证实肾小管上皮细胞具有抗原递呈功能,可表达HLA I、II类抗原,合成补体C2、C3、C4,分泌IL-1、IL-6、IL-8、 IL-12等多种细胞因子,参与小管炎症过程,然而这些细胞因子影响肾小管上皮细胞生物学活性的细胞内信号传递途径至今尚未完全明确。

, http://www.100md.com
图3 IL-12、LPS 分别刺激肾小管上皮细胞15 min的P38磷酸化
Fig.3 Phosphorylation of P38 in TEC was stimulated for 15 min with IL-12 or LPS (Westers blot)
A: Phosphorylation of P38 B: Nonphosphorylation of P38 1.Marker,2.IL-12,3.Blank,4.LPS+SB203580,5.IL-12+PP1,6.LPS+PP1
在酪氨酸激酶家族中,lck是非受体蛋白酪氨酸激酶丝氨酸家族成员之一,lck主要存在于T和NK细胞。其对T细胞抗原--受体信号传递途径很重要[5]。Claudio等发现IL-12可促进Jurkat3细胞的lck表达及发生活化,近期还发现lck并非限于淋巴细胞,在乳腺上皮细胞中亦存在[6]。我们的研究发现肾小管上皮细胞中存在lck基因表达,并且经IL-12和LPS刺激后lck激酶可被激活,应用lck抑制剂封闭其酶活性位点后,IL-12和LPS不能激活lck,与国外报道相一致[5]。这提示IL-12和LPS可作用于lck的某些位点而激活lck,发挥其生物学作用。
, http://www.100md.com
P38是一种分裂原蛋白激酶(MAPK),有学者发现抑制lck活性会阻抑P38激酶[5]。我们在实验中亦证实应用lck抑制剂后,IL-12刺激的P38磷酸化明显受抑制,而LPS则仍使P38磷酸化。这提示IL-12对P38的磷酸化是唯一通过lck激活后实现的,lck激活促使P38磷酸化,而LPS可能还通过除lck外的途径活化P38。应用SB203580直接抑制了P38磷酸化,使P38不能作用于下游信号传导分子,这与Trevillyan等[6]的报道结论是一致的。现在研究发现,P38的激活可磷酸化多种转录因子,如活化转录因子ELK(丝氨酸383/389),使其和血清反应元体SRE结合;它也能活化转录因子ATF2(丝氨酸89171),介导ATF2和cAMP反应元体(CRE)的结合;它还能磷酸化转录因子Max(丝氨酸82),致使Max和myc转录因子形成复合物,从而发挥多种生物学作用。
, 百拇医药
我们的实验发现,IL-12,LPS可以通过激活lck诱使P38磷酸化,亦证实了在肾小管上皮细胞,IL-12作用时P38活化可受lck调节,而LPS亦可通过lck途经激活P38,发挥P38的多种信号传递作用。
基金项目:卫生部基金资助课题(94-1-105)
作者简介:李清刚(1970-),男,山东临沂人,在职博士生.
参考文献
[1]Fan X,Oertli B,Wuthich R P,et al.Up-regulation of tubular epithelial interleukin-12 in autoimmune MRL-Fas (lpr) mice with renal injury[J].Kidney Int.1997,51(1):79.
, 百拇医药
[2]Konakova M,Huch O F,Schceuing.Downstream targets of urokinase-type plasminogen-activator-mediated signal transduction[J].Eur J Biochem,1998,253(2):2421.
[3]Detisac C J,sews M A,Garvin A J,et al.Tissue culture of human kidney epithelial cells of proximal tubule origin[J].Kidney Int,1984,25(2):383.
[4]Hanke J H ,Gander J L,Dow R L,et al.Discovery of a novel,potent,and src family-selective tyrosine kinase inhibitor:study of lck-and fyn-T-dependent T cell activation[J].J Biolo Chem,1996,271(2):695.
, 百拇医药
[5]Trevillyan J M,Chiou X G,Ballaron S J,et al.Inhibition of p56 (lck) tyrosine kinase by isothiazolones[J].Arch Biochem Biophys,1999,364(1):19 .
[6]Gerritsma J S J,Hiemstra P S,Gerritsen A F,et al.IL-8 by human proximal tubular epithelial cells in vitro[J].Clin Exp Immunol ,1996,103(2):289.
[7]Gerristsma J S,Gerristen A F,Van kooteen C,et al.Interleukin-1a enhances the biosynthesis of complement C3 and factor B by human proximal tubular epithelial cells in vitro[J].Mol Immunol,1996,33[10]:847.
, http://www.100md.com
[8]Gerritsma J S J,Gerristen A F,Deley M,et al.Interferon-γ induces biosynthesis of complement C2,C4 and factor H by human proximal tubular epithelial cells[J].Cytokine,1997,9(4):275.
[9]Amundatottir L T,Leder P.Signal transduction pathways activated and required for mammary carcinogenesis in response to specific oncogenes[J].Oncogene,1998,16(6):737.
收稿日期:2000-01-04, 百拇医药