人胎肝细胞冻存复苏的基础研究
作者:李永翔 宣正荣 王蔚萱 宋海屏 孟翔凌 朱化刚
单位:安徽医科大学第一附属医院普外科,合肥 230032
关键词:肝;胚胎学;低温保存;胎组织;移植
安徽医科大学学报000305
摘要 目的 通过对胎肝细胞冻存和培养的研究,了解冻存后的胎肝细胞的形态、结构和功能。方法 采用二步灌注法分离人胎肝细胞,将分离后的胎肝细胞分为4组:A组为新鲜肝细胞;B、C、D组分别为冻存2、3、6周的胎肝细胞。4组肝细胞经台盼蓝染色测活,A、B、C 3组进行原代培养,观察和检测形态、结构和功能指标。结果 冻存肝细胞具有较高的活率〔B、D组活率分别为(85.9±5.3)%、(74.1±2.7)%〕;其形态、结构和白蛋白、尿素氮的分泌功能和新鲜肝细胞相似。结论 使用本法冻存的胎肝细胞具有正常的形态、结构和功能,是一种较好的长期保存肝细胞的方法,建立“细胞库”是可行的。
, 百拇医药
中图分类号 R322.47
文献标识码 A 文章编号 1000-1492(2000)03-0176-03
Study on human fetal hepatocytes following their
recovery from cryopreservation
Li Yongxiang, Xuan Zhengrong, Wang Weixuan et al
(Dept of General Surgry, The First Affiliated Hospital of Anhui Medical University, Hefei 230022)
Abstract Objective Through the study on cryopreservation and cultivation of fetal hepatocytes to evaluate morphology, structure, function of cryopreserved hepatocytes. Methods Adopting the single 2-step method in human fetal liver isolation. The isolated hepatocytes were seperated into four groups, A: fresh cells;B,C,D:after 2,3,6 weeks of cryopreservation respectively. Four groups were investigated in excluding trypan blue dye. A,B,C groups were investigated in primary culture, observing the morphology, constructure and testing the function. Results Cryopreserved hepatocytes showed similar behaviors to fresh hepatocytes such as: living rate, construction, secretion of ALB(albumin),UN(urea nitrogen). Conclusion Cryoprerved hepatocytes can be used in HT and EBLSS(extracorporeal bioartificial liver support systems). Buiding storeroom of hepatocytes is feasible.
, 百拇医药
MeSH livev/embryology; cryopreservation; fetal tissue preservation; transplantation
肝细胞移植可用于治疗急性肝衰、肝硬化、遗传代谢性疾病,以及肝移植前期过渡治疗、肝移植后无功能期的替代治疗〔1~8〕。然而,肝细胞移植也同样面临供体不足的问题,如何对肝细胞进行长期保存成为一个重要课题。本研通过对冻存前后肝细胞的形态、结构和功能的研究,探讨长期保存肝细胞的可能性。
1 材料和方法
1.1 材料 Hepes、Trypanblue(上海华美公司),胶原酶Ⅳ、HAMF-12、DMSO(Sigma),新鲜小牛血清(安徽医科大学微生物学教研室提供,各项指标符合标准,如:ALB 29.0 g.L-1,ALT 9 U,AST 39 U,LDH 37 U BUN 6.4 mmol.L-1),地塞米松、青霉素、链霉素、胰岛素、肝素(国产)。CO2孵箱(美国产,5410-220型),100级超净工作台(苏州产,SW-CJ-1F型),六孔培养板,2 ml冻存瓶(Nunc),3~6个月米非司酮加米索前列醇引产胎儿(孕妇乙肝六项指标阴性,肝功能正常,无已知传染病,非宫内死胎)。
, http://www.100md.com
1.2 方法
1.2.1 肝细胞的分离和培养 取引产胎儿置无菌托盘,全身用酒精消毒后,完整取出肝脏放入预先加入无钙HEPES缓冲液的培养皿中。将无钙的HEPES缓冲液分别从门静脉及下腔静脉反复冲洗肝脏待肝脏呈灰白色,将肝脏剪成1 mm3大小放入预热的0.25 g.L-1胶原酶中,震荡消化约30 min。沉淀片刻,弃除上清,沉淀用180目的金属网过滤。过滤后的细胞悬液50×g离心10 min,沉淀加入5倍体积的HAMF-12培养液50×g离心3 min×3次。所得肝细胞加适量F-12培养液配成细胞悬液,白细胞计数法计算浓度,台盼蓝染色测定肝细胞活率。将每个肝脏分离出的肝细胞分成4组:A组:新鲜细胞(对照组);B组:细胞冻存2周;C组:细胞冻存3周;D组:细胞冻存6周。
A、B、C 3组,按每毫升2×106个细胞接种于培养板内,加入合成培养基HAMF-12+100 g.L-1小牛血清。培养液中均含胰岛素100 μg.L-1 ,青霉素1×105 U.L-1,链霉素100 μg.L-1,地塞米松10-8 mol.L-1,置37℃、体积分数为5%的CO2、100%湿度下进行培养,24 h换液1次。换液时收集培养肝细胞上清液,低温冻存,分批检测ALB、UN、ALT、AST、LDH含量。使用Epi Info6.0软件进行统计学分析。采用倒置相差显微镜观察新鲜肝细胞形态、贴壁情况、增殖情况,并在不同时间进行拍照。收集新鲜肝细胞、原代培养11天后的细胞及冻存3周培养18 h的肝细胞,采用日本JEM-100SX型电镜(透射电镜)观察细胞超微结构并摄片。
, 百拇医药
1.2.2 肝细胞的冻存和复苏 将肝细胞悬液配成每毫升含肝细胞1×107个的冻存混合液(其中含小牛血清10%,F-12培养液80%,DMSO10%,均为体积分数),将肝细胞冻存混合液加入已编号的冻存管中(每管放入1.5 ml),按以下顺序降温:4℃,30 min;-25℃,1 h;-80℃,3~5 h后-196℃低温保存。
于冻存后的相应时间将冻存管从液氮罐中取出,38℃恒温水浴1 min内解冻复苏。加入培养液制成肝细胞悬液,计数、测活,计算肝细胞,回收率及肝细胞活率,并行原代培养。
2 结果
新鲜肝细胞活率为90.4%±5.3%。冻存2周及6周后细胞活率分别为85.9%±5.3%和74.1%±2.7%,回收率分别为83.0%±11.7%和81.8%±8.5%。
新鲜肝细胞和冻存肝细胞均具有较强的白蛋白、尿素氮分泌功能(表1~3)。新鲜肝细胞经原代培养48~144 h为白蛋白的分泌高峰。而冻存2周及冻存3周的肝细胞复苏后经原代培养虽然也具有较强的分泌白蛋白功能,但后两组白蛋白分泌高峰不明显(图1)。
, 百拇医药
表1 肝细胞培养过程中培养液中的白蛋白浓度(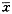 ±s) 冻存时间(d)
±s) 冻存时间(d)
浓度(g.L-1)
0
5.555±±1.533
14
4.807±1.338
21
5.031±0.919
P>0.05表2 肝细胞培养过程中培养液中的尿素氮浓度(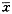 ±s) 冻存时间(d)
±s) 冻存时间(d)
, http://www.100md.com
浓度(mmol.L-1)
0
0.839±0.297
14
0.759±0.280
21
0.841±0.284
P>0.05表3 肝细胞培养过程中白蛋白的浓度变化(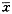 ±s) 培养时间(h)
±s) 培养时间(h)
A
B
, 百拇医药
C
24
4.793±1.069
5.250±0.475
5.675±0.670
48
5.530±0.890
5.043±0.779
5.263±1.124
72
7.182±2.065
5.775±0.419
, 百拇医药
5.300±0.784
96
6.008±1.895
4.957±1.282
4.350±1.239
120
6.285±1.611
4.817±1.057
5.117±0.736
144
6.691±2.236
4.091±1.615
, http://www.100md.com
5.467±0.489
168
5.018±0.951
4.576±0.838
5.267±0.862
192
5.162±0.893
4.733±0.771
4.233±1.069
216
5.227±0.763
4.920±2.183
, http://www.100md.com
5.150±0.495
240
4.900±0.320
3.960±1.958
3.400±0.707
264
5.280±0.192
4.075±1.884
5.133±0.404
新鲜肝细胞原代培养24~72 h ALT及AST的浓度最高,此时的LDH也较高。肝细胞培养到240 h左右ALT、AST、LDH再次升高。冻存2周及3周的肝细胞原代培养时ALT、AST、LDH的浓度变化和未冻存肝细胞相比相似。
, http://www.100md.com
2.4 形态学观察
2.4.1 光镜 新分离的肝细胞呈圆球形,培养1 h开始贴壁,15 h大部分贴壁,24 h培养细胞完全贴壁,细胞相互连接呈串珠样。贴壁的细胞面积增大,呈多边形,细胞核及细胞膜边界非常清晰,细胞大小均匀;胎肝细胞培养3~4天,细胞相互接触,布满瓶底;3~7天可见较多的增殖的肝细胞(双核细胞);10天培养肝细胞开始变为球形,核仁松散,边缘模糊;14天左右肝细胞逐渐脱壁,可见细胞日渐减少。冻存复苏后的肝细胞培养开始时也呈圆球形,细胞没有新鲜肝细胞均匀,贴壁能力也较新鲜肝细胞差;培养到36 h细胞基本贴壁;培养96 h细胞形态大小基本均匀;2~4天,肝细胞相互接触布满瓶底;培养3~7天也可看到增殖的肝细胞但数目较新鲜培养肝细胞差;培养到8天后肝细胞边缘开始模糊核仁松散;10天左右细胞逐渐脱壁,细胞数目逐渐减少。
图1 各组肝细胞白蛋白的分泌情况
, 百拇医药
2.4.2 电镜 新鲜肝细胞结构正常,但培养到11天后线粒体肿胀,内质网扩张,染色质边集,细胞呈变性改变;冻存3周复苏后培养18 h的肝细胞细胞膜及核膜完整,细胞器丰富,无明显变性改变。
3 讨论
目前治疗急性肝衰和终末期肝病最有效的方法是肝移植,但肝移植也存在不少局限性。因此国内外学者在开展肝移植的同时长期致力于肝细胞移植及人工生物肝的研究。动物实验表明肝细胞移植可用来治疗急慢性肝衰、遗传性及代谢性疾病等〔1~5〕。近期的临床研究也表明肝细胞移植可用于原位肝移植的过渡期治疗以及用于治疗急慢性肝衰〔6~8〕。肝细胞移植和器官移植相比具有操作简单、费用低、损伤性小等优点。但成人肝细胞较难获得,胎肝细胞具有丰富的细胞器及很多代谢所需要的多种酶,人胎肝细胞含有成人肝细胞所具有的各种超微结构,和成人肝细胞相比,胎肝细胞异位移植具有更大的优越性〔9〕。肝细胞移植的疗效在一定程度上与肝细胞的活率呈正比,活率越高,效果越好。肝细胞移植最好使用新鲜肝细胞,但新鲜肝细胞不可能随用随取。这就要求有长期保存肝细胞的方法。
, 百拇医药
肝细胞的长期保存常见有两种方法:一是细胞原代培养,普通培养条件下,肝细胞仅能培养2~3周,在培养过程中其生物学特性将发生新的变化。本研究发现新鲜肝细胞培养11天后虽具有白蛋白、尿素氮的分泌功能,但普通显微镜及电镜下均发现其结构出现了变性改变,因此,使用原代培养作为肝细胞的长期保存方法还不完善。肝细胞的传代培养更为困难,传代培养后肝细胞的生物学特性改变更大,这种肝细胞不能作为移植材料进行肝细胞移植。目前,冻存被认为是细胞长期保存的较好方法。但肝细胞冻存的影响因素较多,复苏后其活率、功能各方面报道不一〔10~12〕。肝细胞冻存的成功与否取决于冷冻技术、保存条件、降温速度和冷冻保护剂等。本研究采用普通冰箱、低温冰箱、液氮阶段性降温进行肝细胞的冻存。复苏后的肝细胞无论是肝细胞的活率还是回收率均较高;普通显微镜及电镜观察,冻存肝细胞形态结构均正常;冻存肝细胞分泌白蛋白及尿素氮的功能都较高。研究结果表明用本方法能长期保存肝细胞,用于“肝细胞库”的建立是可行的。
本研究采用米非司酮加米索前列醇引产的胎儿作为实验标本,从肝细胞的功能和形态结构来看,引产药物对胎肝细胞没有明显的损害。因此部分解决了实验用人肝细胞来源困难的问题,可以加以推广。至于米非司酮加米索前列醇引产的胎儿肝细胞是否能作临床应用的供体还有待进一步研究。
, 百拇医药
作者简介:李永翔,男,31岁,硕士,主治医师
宣正荣,男,54岁,主任医师,博士,现为上海龙华医院外科主任,博士生导师
参考文献
1,Markus PM, Becker H. Hepatocellular transplantation-from the beginning to clinical application. Chirurg,1999;70(2):162~168
2,Genin B, Andereggen E, Rubbia-Brandt L et al. Improvement of the effect of hepatocyte isograft in the Gunn rat by cotransplantation of islets of Langerhans. J Pediatr Surg,1999;34(2):321~324
, 百拇医药
3,Te-Velde AA, Bosman DK, Oldenburg J et al. Three different hepatocyte transplantation techniques for exzyme deficiency disease and acute hepatic failure. Artif Organs,1992;16(5):522~526
4,Tada K, Roy-Chowdhury N, Prasad V et al. Long-term amelioration of bilirubin glucuronidation defect in Gunn rats by transplanting genetically modified immortalized autologous hepatocytes. Cell Transplant,1998;7(6):607~616
5,Andereoletti M,LePercq J, Loux Z et al. In utero allotransplantation of retrovirally transduced fetal hepatocytes in primates:feasibility and short-term follow-up. J Matern Fetal Med,1998;7(6):296~303
, 百拇医药
6,Clement B, Desille M, Fremond B et al. Hepatocytes in cell therapy. Transfus Clin Biol,1998;5(1):80~87
7,Strom SC, Chowdhury JR, Fox IJ. Hepatocyte transplantation for the treatment of human disease. Semin Liver Dis,1999;19(1):39~48
8,Strom SC,Fish-ra, Thompson MT et al. Hepatocyte transplantation as a bridge to orthtopic liver transplantation. Transplantation,1997;63(4):559~569
9,Cusick RA, Lee H, Sano K et al. The effect of donor and recenient age on engraftment of tissue-engineered liver. J Pedidiatr Surg,1997;32(2):357~360
, http://www.100md.com
10,林丛,候宽永,张文秀等.低温保存肝细胞移植救治实验性急性肝功能衰竭.中华外科杂志,1994;19(1):57~58
11,刘作斌,刘海川,魏汉东等.人胎肝细胞低温保存的临床基础研究.中国人民解放军军医进修学院学报,1989;10(2):102~105
12,innes GK, Fuller BJ, Hobbs KE et al. Function of hepatocytes following their recovery form cryopreservation. Cryology,1988;25(1):23~30
1999-12-07收稿,2000-04-11修回, http://www.100md.com
单位:安徽医科大学第一附属医院普外科,合肥 230032
关键词:肝;胚胎学;低温保存;胎组织;移植
安徽医科大学学报000305
摘要 目的 通过对胎肝细胞冻存和培养的研究,了解冻存后的胎肝细胞的形态、结构和功能。方法 采用二步灌注法分离人胎肝细胞,将分离后的胎肝细胞分为4组:A组为新鲜肝细胞;B、C、D组分别为冻存2、3、6周的胎肝细胞。4组肝细胞经台盼蓝染色测活,A、B、C 3组进行原代培养,观察和检测形态、结构和功能指标。结果 冻存肝细胞具有较高的活率〔B、D组活率分别为(85.9±5.3)%、(74.1±2.7)%〕;其形态、结构和白蛋白、尿素氮的分泌功能和新鲜肝细胞相似。结论 使用本法冻存的胎肝细胞具有正常的形态、结构和功能,是一种较好的长期保存肝细胞的方法,建立“细胞库”是可行的。
, 百拇医药
中图分类号 R322.47
文献标识码 A 文章编号 1000-1492(2000)03-0176-03
Study on human fetal hepatocytes following their
recovery from cryopreservation
Li Yongxiang, Xuan Zhengrong, Wang Weixuan et al
(Dept of General Surgry, The First Affiliated Hospital of Anhui Medical University, Hefei 230022)
Abstract Objective Through the study on cryopreservation and cultivation of fetal hepatocytes to evaluate morphology, structure, function of cryopreserved hepatocytes. Methods Adopting the single 2-step method in human fetal liver isolation. The isolated hepatocytes were seperated into four groups, A: fresh cells;B,C,D:after 2,3,6 weeks of cryopreservation respectively. Four groups were investigated in excluding trypan blue dye. A,B,C groups were investigated in primary culture, observing the morphology, constructure and testing the function. Results Cryopreserved hepatocytes showed similar behaviors to fresh hepatocytes such as: living rate, construction, secretion of ALB(albumin),UN(urea nitrogen). Conclusion Cryoprerved hepatocytes can be used in HT and EBLSS(extracorporeal bioartificial liver support systems). Buiding storeroom of hepatocytes is feasible.
, 百拇医药
MeSH livev/embryology; cryopreservation; fetal tissue preservation; transplantation
肝细胞移植可用于治疗急性肝衰、肝硬化、遗传代谢性疾病,以及肝移植前期过渡治疗、肝移植后无功能期的替代治疗〔1~8〕。然而,肝细胞移植也同样面临供体不足的问题,如何对肝细胞进行长期保存成为一个重要课题。本研通过对冻存前后肝细胞的形态、结构和功能的研究,探讨长期保存肝细胞的可能性。
1 材料和方法
1.1 材料 Hepes、Trypanblue(上海华美公司),胶原酶Ⅳ、HAMF-12、DMSO(Sigma),新鲜小牛血清(安徽医科大学微生物学教研室提供,各项指标符合标准,如:ALB 29.0 g.L-1,ALT 9 U,AST 39 U,LDH 37 U BUN 6.4 mmol.L-1),地塞米松、青霉素、链霉素、胰岛素、肝素(国产)。CO2孵箱(美国产,5410-220型),100级超净工作台(苏州产,SW-CJ-1F型),六孔培养板,2 ml冻存瓶(Nunc),3~6个月米非司酮加米索前列醇引产胎儿(孕妇乙肝六项指标阴性,肝功能正常,无已知传染病,非宫内死胎)。
, http://www.100md.com
1.2 方法
1.2.1 肝细胞的分离和培养 取引产胎儿置无菌托盘,全身用酒精消毒后,完整取出肝脏放入预先加入无钙HEPES缓冲液的培养皿中。将无钙的HEPES缓冲液分别从门静脉及下腔静脉反复冲洗肝脏待肝脏呈灰白色,将肝脏剪成1 mm3大小放入预热的0.25 g.L-1胶原酶中,震荡消化约30 min。沉淀片刻,弃除上清,沉淀用180目的金属网过滤。过滤后的细胞悬液50×g离心10 min,沉淀加入5倍体积的HAMF-12培养液50×g离心3 min×3次。所得肝细胞加适量F-12培养液配成细胞悬液,白细胞计数法计算浓度,台盼蓝染色测定肝细胞活率。将每个肝脏分离出的肝细胞分成4组:A组:新鲜细胞(对照组);B组:细胞冻存2周;C组:细胞冻存3周;D组:细胞冻存6周。
A、B、C 3组,按每毫升2×106个细胞接种于培养板内,加入合成培养基HAMF-12+100 g.L-1小牛血清。培养液中均含胰岛素100 μg.L-1 ,青霉素1×105 U.L-1,链霉素100 μg.L-1,地塞米松10-8 mol.L-1,置37℃、体积分数为5%的CO2、100%湿度下进行培养,24 h换液1次。换液时收集培养肝细胞上清液,低温冻存,分批检测ALB、UN、ALT、AST、LDH含量。使用Epi Info6.0软件进行统计学分析。采用倒置相差显微镜观察新鲜肝细胞形态、贴壁情况、增殖情况,并在不同时间进行拍照。收集新鲜肝细胞、原代培养11天后的细胞及冻存3周培养18 h的肝细胞,采用日本JEM-100SX型电镜(透射电镜)观察细胞超微结构并摄片。
, 百拇医药
1.2.2 肝细胞的冻存和复苏 将肝细胞悬液配成每毫升含肝细胞1×107个的冻存混合液(其中含小牛血清10%,F-12培养液80%,DMSO10%,均为体积分数),将肝细胞冻存混合液加入已编号的冻存管中(每管放入1.5 ml),按以下顺序降温:4℃,30 min;-25℃,1 h;-80℃,3~5 h后-196℃低温保存。
于冻存后的相应时间将冻存管从液氮罐中取出,38℃恒温水浴1 min内解冻复苏。加入培养液制成肝细胞悬液,计数、测活,计算肝细胞,回收率及肝细胞活率,并行原代培养。
2 结果
新鲜肝细胞活率为90.4%±5.3%。冻存2周及6周后细胞活率分别为85.9%±5.3%和74.1%±2.7%,回收率分别为83.0%±11.7%和81.8%±8.5%。
新鲜肝细胞和冻存肝细胞均具有较强的白蛋白、尿素氮分泌功能(表1~3)。新鲜肝细胞经原代培养48~144 h为白蛋白的分泌高峰。而冻存2周及冻存3周的肝细胞复苏后经原代培养虽然也具有较强的分泌白蛋白功能,但后两组白蛋白分泌高峰不明显(图1)。
, 百拇医药
表1 肝细胞培养过程中培养液中的白蛋白浓度(
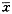 ±s) 冻存时间(d)
±s) 冻存时间(d)浓度(g.L-1)
0
5.555±±1.533
14
4.807±1.338
21
5.031±0.919
P>0.05表2 肝细胞培养过程中培养液中的尿素氮浓度(
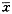 ±s) 冻存时间(d)
±s) 冻存时间(d), http://www.100md.com
浓度(mmol.L-1)
0
0.839±0.297
14
0.759±0.280
21
0.841±0.284
P>0.05表3 肝细胞培养过程中白蛋白的浓度变化(
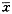 ±s) 培养时间(h)
±s) 培养时间(h)A
B
, 百拇医药
C
24
4.793±1.069
5.250±0.475
5.675±0.670
48
5.530±0.890
5.043±0.779
5.263±1.124
72
7.182±2.065
5.775±0.419
, 百拇医药
5.300±0.784
96
6.008±1.895
4.957±1.282
4.350±1.239
120
6.285±1.611
4.817±1.057
5.117±0.736
144
6.691±2.236
4.091±1.615
, http://www.100md.com
5.467±0.489
168
5.018±0.951
4.576±0.838
5.267±0.862
192
5.162±0.893
4.733±0.771
4.233±1.069
216
5.227±0.763
4.920±2.183
, http://www.100md.com
5.150±0.495
240
4.900±0.320
3.960±1.958
3.400±0.707
264
5.280±0.192
4.075±1.884
5.133±0.404
新鲜肝细胞原代培养24~72 h ALT及AST的浓度最高,此时的LDH也较高。肝细胞培养到240 h左右ALT、AST、LDH再次升高。冻存2周及3周的肝细胞原代培养时ALT、AST、LDH的浓度变化和未冻存肝细胞相比相似。
, http://www.100md.com
2.4 形态学观察
2.4.1 光镜 新分离的肝细胞呈圆球形,培养1 h开始贴壁,15 h大部分贴壁,24 h培养细胞完全贴壁,细胞相互连接呈串珠样。贴壁的细胞面积增大,呈多边形,细胞核及细胞膜边界非常清晰,细胞大小均匀;胎肝细胞培养3~4天,细胞相互接触,布满瓶底;3~7天可见较多的增殖的肝细胞(双核细胞);10天培养肝细胞开始变为球形,核仁松散,边缘模糊;14天左右肝细胞逐渐脱壁,可见细胞日渐减少。冻存复苏后的肝细胞培养开始时也呈圆球形,细胞没有新鲜肝细胞均匀,贴壁能力也较新鲜肝细胞差;培养到36 h细胞基本贴壁;培养96 h细胞形态大小基本均匀;2~4天,肝细胞相互接触布满瓶底;培养3~7天也可看到增殖的肝细胞但数目较新鲜培养肝细胞差;培养到8天后肝细胞边缘开始模糊核仁松散;10天左右细胞逐渐脱壁,细胞数目逐渐减少。

图1 各组肝细胞白蛋白的分泌情况
, 百拇医药
2.4.2 电镜 新鲜肝细胞结构正常,但培养到11天后线粒体肿胀,内质网扩张,染色质边集,细胞呈变性改变;冻存3周复苏后培养18 h的肝细胞细胞膜及核膜完整,细胞器丰富,无明显变性改变。
3 讨论
目前治疗急性肝衰和终末期肝病最有效的方法是肝移植,但肝移植也存在不少局限性。因此国内外学者在开展肝移植的同时长期致力于肝细胞移植及人工生物肝的研究。动物实验表明肝细胞移植可用来治疗急慢性肝衰、遗传性及代谢性疾病等〔1~5〕。近期的临床研究也表明肝细胞移植可用于原位肝移植的过渡期治疗以及用于治疗急慢性肝衰〔6~8〕。肝细胞移植和器官移植相比具有操作简单、费用低、损伤性小等优点。但成人肝细胞较难获得,胎肝细胞具有丰富的细胞器及很多代谢所需要的多种酶,人胎肝细胞含有成人肝细胞所具有的各种超微结构,和成人肝细胞相比,胎肝细胞异位移植具有更大的优越性〔9〕。肝细胞移植的疗效在一定程度上与肝细胞的活率呈正比,活率越高,效果越好。肝细胞移植最好使用新鲜肝细胞,但新鲜肝细胞不可能随用随取。这就要求有长期保存肝细胞的方法。
, 百拇医药
肝细胞的长期保存常见有两种方法:一是细胞原代培养,普通培养条件下,肝细胞仅能培养2~3周,在培养过程中其生物学特性将发生新的变化。本研究发现新鲜肝细胞培养11天后虽具有白蛋白、尿素氮的分泌功能,但普通显微镜及电镜下均发现其结构出现了变性改变,因此,使用原代培养作为肝细胞的长期保存方法还不完善。肝细胞的传代培养更为困难,传代培养后肝细胞的生物学特性改变更大,这种肝细胞不能作为移植材料进行肝细胞移植。目前,冻存被认为是细胞长期保存的较好方法。但肝细胞冻存的影响因素较多,复苏后其活率、功能各方面报道不一〔10~12〕。肝细胞冻存的成功与否取决于冷冻技术、保存条件、降温速度和冷冻保护剂等。本研究采用普通冰箱、低温冰箱、液氮阶段性降温进行肝细胞的冻存。复苏后的肝细胞无论是肝细胞的活率还是回收率均较高;普通显微镜及电镜观察,冻存肝细胞形态结构均正常;冻存肝细胞分泌白蛋白及尿素氮的功能都较高。研究结果表明用本方法能长期保存肝细胞,用于“肝细胞库”的建立是可行的。
本研究采用米非司酮加米索前列醇引产的胎儿作为实验标本,从肝细胞的功能和形态结构来看,引产药物对胎肝细胞没有明显的损害。因此部分解决了实验用人肝细胞来源困难的问题,可以加以推广。至于米非司酮加米索前列醇引产的胎儿肝细胞是否能作临床应用的供体还有待进一步研究。
, 百拇医药
作者简介:李永翔,男,31岁,硕士,主治医师
宣正荣,男,54岁,主任医师,博士,现为上海龙华医院外科主任,博士生导师
参考文献
1,Markus PM, Becker H. Hepatocellular transplantation-from the beginning to clinical application. Chirurg,1999;70(2):162~168
2,Genin B, Andereggen E, Rubbia-Brandt L et al. Improvement of the effect of hepatocyte isograft in the Gunn rat by cotransplantation of islets of Langerhans. J Pediatr Surg,1999;34(2):321~324
, 百拇医药
3,Te-Velde AA, Bosman DK, Oldenburg J et al. Three different hepatocyte transplantation techniques for exzyme deficiency disease and acute hepatic failure. Artif Organs,1992;16(5):522~526
4,Tada K, Roy-Chowdhury N, Prasad V et al. Long-term amelioration of bilirubin glucuronidation defect in Gunn rats by transplanting genetically modified immortalized autologous hepatocytes. Cell Transplant,1998;7(6):607~616
5,Andereoletti M,LePercq J, Loux Z et al. In utero allotransplantation of retrovirally transduced fetal hepatocytes in primates:feasibility and short-term follow-up. J Matern Fetal Med,1998;7(6):296~303
, 百拇医药
6,Clement B, Desille M, Fremond B et al. Hepatocytes in cell therapy. Transfus Clin Biol,1998;5(1):80~87
7,Strom SC, Chowdhury JR, Fox IJ. Hepatocyte transplantation for the treatment of human disease. Semin Liver Dis,1999;19(1):39~48
8,Strom SC,Fish-ra, Thompson MT et al. Hepatocyte transplantation as a bridge to orthtopic liver transplantation. Transplantation,1997;63(4):559~569
9,Cusick RA, Lee H, Sano K et al. The effect of donor and recenient age on engraftment of tissue-engineered liver. J Pedidiatr Surg,1997;32(2):357~360
, http://www.100md.com
10,林丛,候宽永,张文秀等.低温保存肝细胞移植救治实验性急性肝功能衰竭.中华外科杂志,1994;19(1):57~58
11,刘作斌,刘海川,魏汉东等.人胎肝细胞低温保存的临床基础研究.中国人民解放军军医进修学院学报,1989;10(2):102~105
12,innes GK, Fuller BJ, Hobbs KE et al. Function of hepatocytes following their recovery form cryopreservation. Cryology,1988;25(1):23~30
1999-12-07收稿,2000-04-11修回, http://www.100md.com