SOD单层脂质体的制备*
作者:金丽琴
单位:温州医学院生化教研室(325027)
关键词:脂质体;超氧化物歧化酶;制备
温州医学院学报990119 摘 要 目的 摸索超氧化物歧化酶(SOD)单层脂质体制备的最佳条件,为进一步研究SOD脂质体对人类的抗老防病的药理作用打下基础。方法 采用去污剂去除法制备SOD单层脂质体。结果 SOD单层脂质体大小为40~100nm。SOD包封率为59.3%,将脂质体中SOD与溶液中SOD稳定性作了比较,两者差异有显著性。结论 本法操作方便,所需设备简单,操作过程各种条件温和,而且产率高。
超氧化物歧化酶(SOD)是催化超氧阴离子歧化反应的金属酶,在解氧毒、抗辐射损伤以及预防衰老等方面具有重要作用。但因其在体内半衰期短,且可能产生过敏反应,故在临床和营养保健方面的应用受到限制。而脂质体可将SOD包封于脂质双分子层中,可促使SOD进入细胞,并使SOD与生物体内环境隔绝,减轻SOD的破坏而延长其半衰期,同时可避免引起免疫反应。本实验采用去污剂去除法制备SOD单层脂质体,并测定其包封率、稳定性、形态大小以及分析研究实验条件,为进一步对SOD脂质体作为药物剂型,改善药剂,以及作为化妆品、食品添加剂等的研究打下基础。
, 百拇医药
1 材料和方法
1.1 材料
1.1.1 主要药品试剂和材料:SOD由苏州医学院江家贵教授提供,比活力为6000邻苯三酚单位/mg.p.;SOD活力测定试剂盒。由南京聚力生物医学工程研究所生产,批号960618;卵磷脂:由上海禽蛋二厂生产,批号950202;脱氧胆酸钠:Serva进口分装,上海化学试剂站分装厂,批号940519;葡聚糖凝胶G-75(Sephadex G-75):Pharmacia进口分装,上海化学试剂采购供应站试剂厂,批号881101;透析袋:截流分子量为5000,用法见参考文献[1]。
1.1.2 主要仪器:超声清洗机由无锡超声电子设备厂生产,(SALAN GID)H66025 T型;电子微量泵由浙江新昌国康仪器厂生产,WLB-78-A型、B型;恒温磁力搅拌器由温州市医疗电器厂生产,HWCB-2型。
, 百拇医药
1.2 方法
1.2.1 脂质/去污剂混合微团的设备:参照文献[1,2],稍加改进。将100mg脂质(卵磷脂)与去污剂脱氧胆酸钠105.4mg一起溶于5ml氯仿/甲醇液(3∶1)的小烧杯中,充分混匀,持续通氮气干燥成脂质薄膜, 再加入溶有10mg SOD的pH7.4的PBS(磷酸缓冲液)10ml。 在磷脂相变温度(TC)以上温度,经超声波振荡处理5min(每处理0.5min,间歇0.5
min)[3],变清,即形成混合微团液。
1.2.2 去除去污剂——透析[1]:将6ml脂质/去污剂混合微团液注入透析袋,透析袋悬吊于盛有200ml PBS透析液的烧杯中(如附图)。磁力恒温搅拌控制搅拌速度在75~100n/min,温度在TC以上,用蠕动泵控制透析液的流速在0.3~3.0ml/ml,持续透析24hrs,形成脂质体。 附图 制作脂质体的透析装置
附图 制作脂质体的透析装置
, 百拇医药
A:恒温磁力搅拌器,B:透析缓冲液(PBS),C:废液,D:透析袋,E:蠕动泵。
1.2.3 分离去除未包裹的游离SOD——凝胶过滤[4]:先用与样品相同材料组成的空白脂质体液通过1cm×30cm的Sephadex G-75的层析柱子,以预饱和柱子(避免SOD脂质体与柱子相结合)再将上述制作的SOD脂质体混合液灌入层析柱,用PBS液洗脱,收集SOD脂质体。
1.2.4 SOD脂质体直径和形态的检查:采用电镜负染技术。
1.2.5 SOD活力测定:采用黄嘌呤氧化酶法测定SOD活力。试剂盒由南京聚力生物医学工程研究所提供,原理、操作见说明书。
SOD活力计算:
, 百拇医药
单位为NU/ml
SOD包封率计算:
SOD稳定性测定:SOD脂质体4℃过夜放置24h,比较前后的脂质体SOD活力。
2 结果
2.1 SOD脂质体的直径和形态:SOD脂质体呈球状,大小均匀,其直径在40~100nm之间,与参考文献[1]报道相一致。
2.2 SOD脂质体的包封率:重复三次,第一次包封率60.4%,第二次59.8%,第三次57.7%,平均数为59.3%。
2.3 脂质体中SOD与溶液中SOD稳定性比较:将制备好的SOD脂质体与SOD溶液贮存于4℃冰箱,24hrs取样(各取三份样品,每份100μl)测定SOD的剩余活力。重复三次,取均数值计算:
, 百拇医药
SOD溶液4℃放置24hrs,其活力从59.85NU/ml降到34.85NU/ml, 差值为25NU/ml, 即下降率为41.77%。而SOD脂质体(经层析分离去除游离SOD)经4℃放置24hrs后,SOD活力从19.53NU/ml降到13.33NU/ml,差值为6.2NU/ml,即下降率为31.74%。脂质体中SOD与溶液中SOD的活力下降率有非常显著性差异(P<0.01)。结果说明由脂质体包埋的SOD稳定性比未经脂质体包埋的游离存在的SOD的稳定性好得多。(见附表)
附表 脂质体中SOD与溶液中SOD稳定性比较 SOD活力:NU/ml
n
4℃过夜前
4℃过夜后
差值
, 百拇医药 下降率(%)
均值
均值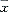 ±s
±s
SOD溶液
3
59.85
34.85
25.00±1.34***
41.77
SOD脂质体
, 百拇医药
3
19.53
13.33
6.20±0.45***
31.74
***P<0.001
3 讨论
3.1 SOD脂质体可作为SOD的载体将SOD输送到特定的组织细胞以减少SOD降解,降低SOD的毒副作用,提高SOD疗效。由于SOD脂质体膜组成与细胞膜相似,具有脂溶性,可被肠绒毛膜通过胞饮和融合作用吸收;然后进入血液循环,提高SOD水平,并可透过血脑屏障进入脑组织,因此,认为SOD脂质体可以作为某些食品的添加剂和口服的药物。
, http://www.100md.com
3.2 磷脂不溶于水,在其相变温度TC以上,它能与可溶性兼性分子——去污剂借助于超声结合形成混合微团,然后用缓冲液透析逐渐去除去污剂,只要混合微团内去污剂浓度达到临界值,磷脂就自发性形成脂质体,即在去污剂去除过程中,磷脂分子重新排列,自发形成脂质体。用去污剂去除法制备脂质体的优点是脂质体的大小可根据加去污剂量的比例来控制[1,5],产率高。所形成的脂质体大小均匀,且为单层脂质双分子层组成,而且操作方便,所需设备简单,去污剂透析制备过程各种条件温和,得到的脂质体具有一定的稳定性。缺点是无法消除残留的微量去污剂。
3.3 本实验分析研究了实验条件,得到了制备SOD单层脂质体的最佳条件:①脂质与去污剂的摩尔数比为0.4~0.6最佳,因去污剂的量依赖于脂质的性质和浓度,比例高,形成混合微团需要的时间就长;②脂质和SOD的重量比为10∶1最佳;③SOD溶于PBS(pH7.4磷酸缓冲液)中较为稳定,并能减轻其它溶剂对其活性的影响,同样,在均匀单层脂质体形成过程中,也以PBS作为透析液为好;④曾有实验结果表明,超声时间为6min时,包封率最佳[6],但超声处理也会使SOD失活。如果处理时间小于5min,对SOD活性影响很小,酶活性可保持90%以上。故制备混合微团时超声处理5min为佳。在制备过程中若采用间歇超声处理(每处理0.5min,间歇0.5min)还可以减少SOD的失活,且有利于提高包封率。
, 百拇医药
3.4 SOD脂质体除了本身作为药物剂型,改善药效外,还由于SOD抗自由基的能力强,可抑制脂质体膜的氧化过程,提高稳定性。因此,SOD若与其它分子(如:还原型谷胱甘肽、L-精氨酸、COQ10、某些抗体、酶等等)同时包埋,可以增强其他药物的作用时间和疗效。这还有待于进一步研究。
致谢:承苏州医学院江家贵教授提供SOD,本院电镜室王琳老师、方周溪老师支持和协助
*本院科研基金资助项目
4 参考文献
[1] 张灵芝,汤健,唐朝枢等.均匀单层脂质体的制备方法.基础医学与临床,1992,12(4)∶61
[2] Zumbuehl O,Weder HG.Liposomes of controllable size in the range of 40 to 180nm by defined dialysis of Lipid/detergent mixed micelles.Biochim.Biophys Acta,1981,640∶252
, http://www.100md.com
[3] 张健,张天民.超氧化物歧化酶脂质体的制备及其药物动力学.中国医药工业杂志,1991,22(7)∶296
[4] Frans J.Walther,Remedios David-CU,Medardo C.Supnet,et al.Uptake of antioxidants in surfactant liposomes by cultured alveolar type Ⅱ cells is enhanced by SP-A.Am J physiology,1993,265∶330
[5] 谢静平.单层脂质体与脂酶体的制备方法及应用.生物化学与生物物理进展,1998,15(2)∶82
[6] 赵健,王富军,周玲等.冻融法制备SOD脂质体.中国医药工业杂志,1996,27(8)∶346
(收稿:1997-06-25,修回:1998-10-24), 百拇医药
单位:温州医学院生化教研室(325027)
关键词:脂质体;超氧化物歧化酶;制备
温州医学院学报990119 摘 要 目的 摸索超氧化物歧化酶(SOD)单层脂质体制备的最佳条件,为进一步研究SOD脂质体对人类的抗老防病的药理作用打下基础。方法 采用去污剂去除法制备SOD单层脂质体。结果 SOD单层脂质体大小为40~100nm。SOD包封率为59.3%,将脂质体中SOD与溶液中SOD稳定性作了比较,两者差异有显著性。结论 本法操作方便,所需设备简单,操作过程各种条件温和,而且产率高。
超氧化物歧化酶(SOD)是催化超氧阴离子歧化反应的金属酶,在解氧毒、抗辐射损伤以及预防衰老等方面具有重要作用。但因其在体内半衰期短,且可能产生过敏反应,故在临床和营养保健方面的应用受到限制。而脂质体可将SOD包封于脂质双分子层中,可促使SOD进入细胞,并使SOD与生物体内环境隔绝,减轻SOD的破坏而延长其半衰期,同时可避免引起免疫反应。本实验采用去污剂去除法制备SOD单层脂质体,并测定其包封率、稳定性、形态大小以及分析研究实验条件,为进一步对SOD脂质体作为药物剂型,改善药剂,以及作为化妆品、食品添加剂等的研究打下基础。
, 百拇医药
1 材料和方法
1.1 材料
1.1.1 主要药品试剂和材料:SOD由苏州医学院江家贵教授提供,比活力为6000邻苯三酚单位/mg.p.;SOD活力测定试剂盒。由南京聚力生物医学工程研究所生产,批号960618;卵磷脂:由上海禽蛋二厂生产,批号950202;脱氧胆酸钠:Serva进口分装,上海化学试剂站分装厂,批号940519;葡聚糖凝胶G-75(Sephadex G-75):Pharmacia进口分装,上海化学试剂采购供应站试剂厂,批号881101;透析袋:截流分子量为5000,用法见参考文献[1]。
1.1.2 主要仪器:超声清洗机由无锡超声电子设备厂生产,(SALAN GID)H66025 T型;电子微量泵由浙江新昌国康仪器厂生产,WLB-78-A型、B型;恒温磁力搅拌器由温州市医疗电器厂生产,HWCB-2型。
, 百拇医药
1.2 方法
1.2.1 脂质/去污剂混合微团的设备:参照文献[1,2],稍加改进。将100mg脂质(卵磷脂)与去污剂脱氧胆酸钠105.4mg一起溶于5ml氯仿/甲醇液(3∶1)的小烧杯中,充分混匀,持续通氮气干燥成脂质薄膜, 再加入溶有10mg SOD的pH7.4的PBS(磷酸缓冲液)10ml。 在磷脂相变温度(TC)以上温度,经超声波振荡处理5min(每处理0.5min,间歇0.5
min)[3],变清,即形成混合微团液。
1.2.2 去除去污剂——透析[1]:将6ml脂质/去污剂混合微团液注入透析袋,透析袋悬吊于盛有200ml PBS透析液的烧杯中(如附图)。磁力恒温搅拌控制搅拌速度在75~100n/min,温度在TC以上,用蠕动泵控制透析液的流速在0.3~3.0ml/ml,持续透析24hrs,形成脂质体。
 附图 制作脂质体的透析装置
附图 制作脂质体的透析装置, 百拇医药
A:恒温磁力搅拌器,B:透析缓冲液(PBS),C:废液,D:透析袋,E:蠕动泵。
1.2.3 分离去除未包裹的游离SOD——凝胶过滤[4]:先用与样品相同材料组成的空白脂质体液通过1cm×30cm的Sephadex G-75的层析柱子,以预饱和柱子(避免SOD脂质体与柱子相结合)再将上述制作的SOD脂质体混合液灌入层析柱,用PBS液洗脱,收集SOD脂质体。
1.2.4 SOD脂质体直径和形态的检查:采用电镜负染技术。
1.2.5 SOD活力测定:采用黄嘌呤氧化酶法测定SOD活力。试剂盒由南京聚力生物医学工程研究所提供,原理、操作见说明书。
SOD活力计算:

, 百拇医药
单位为NU/ml
SOD包封率计算:

SOD稳定性测定:SOD脂质体4℃过夜放置24h,比较前后的脂质体SOD活力。
2 结果
2.1 SOD脂质体的直径和形态:SOD脂质体呈球状,大小均匀,其直径在40~100nm之间,与参考文献[1]报道相一致。
2.2 SOD脂质体的包封率:重复三次,第一次包封率60.4%,第二次59.8%,第三次57.7%,平均数为59.3%。
2.3 脂质体中SOD与溶液中SOD稳定性比较:将制备好的SOD脂质体与SOD溶液贮存于4℃冰箱,24hrs取样(各取三份样品,每份100μl)测定SOD的剩余活力。重复三次,取均数值计算:
, 百拇医药
SOD溶液4℃放置24hrs,其活力从59.85NU/ml降到34.85NU/ml, 差值为25NU/ml, 即下降率为41.77%。而SOD脂质体(经层析分离去除游离SOD)经4℃放置24hrs后,SOD活力从19.53NU/ml降到13.33NU/ml,差值为6.2NU/ml,即下降率为31.74%。脂质体中SOD与溶液中SOD的活力下降率有非常显著性差异(P<0.01)。结果说明由脂质体包埋的SOD稳定性比未经脂质体包埋的游离存在的SOD的稳定性好得多。(见附表)
附表 脂质体中SOD与溶液中SOD稳定性比较 SOD活力:NU/ml
n
4℃过夜前
4℃过夜后
差值
, 百拇医药 下降率(%)
均值
均值
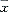 ±s
±s
SOD溶液
3
59.85
34.85
25.00±1.34***
41.77
SOD脂质体
, 百拇医药
3
19.53
13.33
6.20±0.45***
31.74
***P<0.001
3 讨论
3.1 SOD脂质体可作为SOD的载体将SOD输送到特定的组织细胞以减少SOD降解,降低SOD的毒副作用,提高SOD疗效。由于SOD脂质体膜组成与细胞膜相似,具有脂溶性,可被肠绒毛膜通过胞饮和融合作用吸收;然后进入血液循环,提高SOD水平,并可透过血脑屏障进入脑组织,因此,认为SOD脂质体可以作为某些食品的添加剂和口服的药物。
, http://www.100md.com
3.2 磷脂不溶于水,在其相变温度TC以上,它能与可溶性兼性分子——去污剂借助于超声结合形成混合微团,然后用缓冲液透析逐渐去除去污剂,只要混合微团内去污剂浓度达到临界值,磷脂就自发性形成脂质体,即在去污剂去除过程中,磷脂分子重新排列,自发形成脂质体。用去污剂去除法制备脂质体的优点是脂质体的大小可根据加去污剂量的比例来控制[1,5],产率高。所形成的脂质体大小均匀,且为单层脂质双分子层组成,而且操作方便,所需设备简单,去污剂透析制备过程各种条件温和,得到的脂质体具有一定的稳定性。缺点是无法消除残留的微量去污剂。
3.3 本实验分析研究了实验条件,得到了制备SOD单层脂质体的最佳条件:①脂质与去污剂的摩尔数比为0.4~0.6最佳,因去污剂的量依赖于脂质的性质和浓度,比例高,形成混合微团需要的时间就长;②脂质和SOD的重量比为10∶1最佳;③SOD溶于PBS(pH7.4磷酸缓冲液)中较为稳定,并能减轻其它溶剂对其活性的影响,同样,在均匀单层脂质体形成过程中,也以PBS作为透析液为好;④曾有实验结果表明,超声时间为6min时,包封率最佳[6],但超声处理也会使SOD失活。如果处理时间小于5min,对SOD活性影响很小,酶活性可保持90%以上。故制备混合微团时超声处理5min为佳。在制备过程中若采用间歇超声处理(每处理0.5min,间歇0.5min)还可以减少SOD的失活,且有利于提高包封率。
, 百拇医药
3.4 SOD脂质体除了本身作为药物剂型,改善药效外,还由于SOD抗自由基的能力强,可抑制脂质体膜的氧化过程,提高稳定性。因此,SOD若与其它分子(如:还原型谷胱甘肽、L-精氨酸、COQ10、某些抗体、酶等等)同时包埋,可以增强其他药物的作用时间和疗效。这还有待于进一步研究。
致谢:承苏州医学院江家贵教授提供SOD,本院电镜室王琳老师、方周溪老师支持和协助
*本院科研基金资助项目
4 参考文献
[1] 张灵芝,汤健,唐朝枢等.均匀单层脂质体的制备方法.基础医学与临床,1992,12(4)∶61
[2] Zumbuehl O,Weder HG.Liposomes of controllable size in the range of 40 to 180nm by defined dialysis of Lipid/detergent mixed micelles.Biochim.Biophys Acta,1981,640∶252
, http://www.100md.com
[3] 张健,张天民.超氧化物歧化酶脂质体的制备及其药物动力学.中国医药工业杂志,1991,22(7)∶296
[4] Frans J.Walther,Remedios David-CU,Medardo C.Supnet,et al.Uptake of antioxidants in surfactant liposomes by cultured alveolar type Ⅱ cells is enhanced by SP-A.Am J physiology,1993,265∶330
[5] 谢静平.单层脂质体与脂酶体的制备方法及应用.生物化学与生物物理进展,1998,15(2)∶82
[6] 赵健,王富军,周玲等.冻融法制备SOD脂质体.中国医药工业杂志,1996,27(8)∶346
(收稿:1997-06-25,修回:1998-10-24), 百拇医药