稳定表达GDNF的MN9D/GDNF工程细胞可明显改善帕金森病模型大鼠的旋转行为*
作者:经兴军 马端端 高红 王晓民△ 韩济生
单位:北京医科大学神经科学研究所,北京 100083
关键词:胶质细胞源性神经营养因子☆;帕金森病;旋转;行为;MN9D;GDNF工程细胞☆
990306 摘 要 目的:观察稳定表达GDNF的MN9D/GDNF工程细胞对6-羟基多巴胺损毁所致帕金森病(Parkinson disease, PD)模型大鼠旋转行为有无治疗作用。方法:用6-羟基多巴胺损毁大鼠单侧中脑黑质多巴胺能神经元、2周后腹腔注射阿朴吗啡诱导大鼠出现偏侧旋转行为的方法制备PD模型大鼠。通过脑立体定位技术,将稳定表达GDNF的MN9D/GDNF工程细胞注入模型鼠损毁侧纹状体,1周后观察阿朴吗啡诱导的旋转行为有无改善。结果:稳定表达GDNF的MN9D/GDNF工程细胞可明显降低PD模型大鼠的异常旋转行为,治疗作用达10周之久。结论:运用ex vivo方法和防治兼顾的策略对于PD基因治疗的基础研究及临床应用具有重要意义。
, 百拇医药
中国图书资料分类法分类号 R742.5-332
GDNF engineered MN9D cells can improve the rotational behavior
on a rat model of Parkinson disease
JING Xing-Jun, MA Duan-Duan, GAO Hong, WANG Xiao-Min, HAN Ji-Sheng
(Neuroscience Research Institute, Beijing Medical University, Beijing 100083)
MeSH Glial-cell-line-derived neurotrophic factor☆Parkinson'sdisease Rotation Behavior MN9D/GDNF engineered cell☆
, 百拇医药
ABSTRACT Objective: To observe whether engineered MN9D/GDNF cells stably expressing GDNF and secreting dopamine can improve the APO-induced rotational behavior on a rat model of Parkinson disease. Methods: By mircroinjecting 6-OHDA into rat unilateral medial forebrain bundle to induce the damage of unilateral mesencephalic dopamine neurons, a well-known PD rat model was established. After transplanting MN9D/GDNF engineered cells into the lesioned striatum by stereotaxic technique, the rotational behavior was measured on an automatic locomoter. Results: Engineered MN9D/GDNF cells steadily expressing GDNF could significantly reduce the rotational behavior of PD rat model for ten weeks. Conclusion: Combination of prevention and treatment for PD by ex vivo method may play an important role in the basic research and clinical utility of gene therapy on Parkinson disease in the future.
, 百拇医药
(J Beijing Med Univ, 1999,31:212-215)
帕金森病(Parkinson disease, PD)是以中脑黑质多巴胺(dopamine, DA)能神经元发生退变从而导致纹状体内DA含量显著降低为主要病理特征的中枢神经系统退行性疾病。因其病理改变基本明确,有恰当的动物模型,且相关基因已经克隆,定点转基因的解剖学位置清楚,便于立体定位注射,故PD成为中枢神经系统退行性疾病基因治疗的首选疾病。目前用于PD基因治疗的目的基因主要有两大类,即与纹状体内DA合成、代谢有关的基因和对中脑黑质DA能神经元具有营养活性的神经营养因子基因。尽管酪氨酸羟化酶基因(tyrosine hydroxylase, TH)是PD基因治疗中应用最早的基因之一,实验研究也已证明了其治疗效果[1,2],但此基因不能逆转PD的病程进展。目前已发现多种神经营养因子对中脑黑质DA能神经元具有不同程度的营养活性,如脑源性神经营养因子(brain derived neurotrophic factor, BDNF)[3,4]、神经营养素3和4/5(neurotrophin 3,4/5)[4]、胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor, GDNF)等。GDNF是近年来发现的一种转化生长因子β(transforming growth factor, TGF-β)超家族的新成员,它可特异性地促进体外培养的DA能神经元的存活及突起生长,并增加其对DA的摄取[5],在体研究也证实了GDNF对DA能神经元的营养作用[6,7]。本室近来的研究表明,稳定表达GDNF基因的MN9D工程细胞可保护原代培养的中脑DA能神经元对抗神经毒素MPP+的损伤[8]。本研究将稳定表达GDNF的MN9D工程细胞植入PD大鼠的纹状体,用行为学测试的方法,从整体水平上观察此工程细胞对PD的治疗作用。
, 百拇医药
1 材料与方法
1.1 材料
仪器:大鼠旋转行为自动记录分析仪购自德国;脑立体定位仪购自日本NARISHIGE公司;超净工作台为Labconco Ltd. 产品。
动物:选用成年Wistar大鼠,雄性,体重200~250g,由北京医科大学动物部提供。
试剂:6-羟基多巴胺(6-hydroxydopamine, 6-OHDA),阿朴吗啡(apomorphine, APO)为Sigma公司产品;RMPI1640、DMEM培养基为GIBCO公司产品;胎牛血清为北郊奶牛公司二分厂(北京医科大学监制)产品。
细胞株:MN9D细胞是14 d胎龄的C57BL/6J小鼠胚胎中脑神经元与N18TG2细胞系融合产生的杂交瘤细胞系,可分泌DA,由本室提供;SH-SY-5Y细胞为人神经母细胞瘤细胞,由本室提供;MN9D/GDNF工程细胞由本所构建[8]。
, 百拇医药
1.2 方法
PD大鼠模型的建立[9]:Wistar大鼠在350mg.kg-1 (i.p.)的水合氯醛麻醉下,将头部俯卧位固定于大鼠脑立体定位仪。根据Paxson 《The Rat Brain》图谱,用微量注射器向左侧内侧前脑束注入6-OHDA。注射部位的坐标为:第1点,门齿棒高于耳杆3.4mm,前囟后4.0mm,中线左旁开0.8mm,颅骨表面下8.0mm;第2点,门齿棒低于耳杆2.3mm,前囟后4.4mm,中线左旁开1.2mm,颅骨表面下7.8mm。每点注射6-OHDA溶液4μl(2g.L-1),注射速度为1μl.min-1,留针10min,缓慢拔针,缝合皮肤。注射后第2周开始,每周1次腹腔注射APO(0.25mg.kg-1)诱发其向右侧旋转,连续测定4周。每次记录30min内的旋转圈数,平均每分7圈以上者为合格的PD大鼠模型。
, http://www.100md.com
移植细胞的制备:用1ml含有0.5g.L-1胰蛋白酶、2g.L-1EDTA的消化液处理培养细胞3~5min,加入10ml含10%(体积分数)血清的RPMI1640培养基收获(SH-SY-5Y细胞)或DMEM培养基(收获MN9D、MN9D/GDNF细胞)悬浮细胞,细胞计数,离心600r.min-1,5min,弃上清,按105 μl-1的细胞浓度重悬细胞,4g.L-1台盼蓝检查细胞活率,活率高于85%时,用于PD大鼠模型纹状体内移植。
脑纹状体内移植:将筛选合格的18只PD模型大鼠随机分为3组,每组6只,分别向6-OHDA损毁侧纹状体内植入SH-SY-5Y细胞、MN9D细胞、MN9D/GDNF工程细胞。选择二点注射,坐标分别为:第1点,前囟前0.5mm,中线左旁开3mm,颅骨表面下6mm;第2点,前囟前0.8mm,中线左旁开2.5mm,颅骨表面下4.5mm。每个位点用Hamilton微量注射器注射细胞悬液5μl,使每只大鼠接受的细胞数为5×105,注射速度为1μl.min-1,留针10min,缓慢拔针,缝合皮肤。将术后的大鼠置于温暖安静处直至清醒,大鼠自由进食饮水。术后1周,开始测转,方法同前。
, 百拇医药
统计学分析:用平均每分钟向右旋转的圈数进行ANOVA分析继之以Newman-Keuls检验,比较各组之间及每组大鼠移植细胞前后有无统计学差异。
2 结果
2.1 PD模型大鼠的建立
PD在动物界并不自然发生。为探讨PD的发病机制及防治方法,必须建立合适的PD模型。我们选用Wistar大鼠,依国际通用标准,用6-OHDA损毁左侧黑质致密部和内侧前脑束[9]。2周后,腹腔注射APO诱导大鼠向右旋转,每周测1次,连续测3周,每次测30min,30min内向右旋转210圈以上(7圈.min-1)为模型成功。以此标准,我们筛选出PD鼠,其成功率为40%左右,与其它报道结果基本相同,表明我们已成功建立了PD大鼠模型(图1)。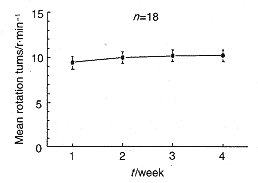
, 百拇医药
图1 用APO诱发6-OHDA损毁大鼠的旋转行为来筛选PD模型鼠
Figure 1 Selection of PD rats by APO-induced rotational behavior
of rats after 6-OHDA lesion
2.2 MN9D细胞及MN9D/GDNF工程细胞对PD大鼠旋转行为的影响
将筛选合格的18只PD模型大鼠随机分为A、B、C3组,每组6只,A组左侧纹状体内移植SH-SY-5Y细胞,B组左侧纹状体内移植MN9D细胞,C组纹状体内则移植MN9D/GDNF工程细胞。从移植细胞后第1周开始,每周检测一次各组PD大鼠的旋转行为。从图2可以看出,A组,移植细胞前后大鼠的旋转行为无变化。B组,移植细胞后第1周开始,旋转行为明显改善,每分旋转圈数减少50%~55%,与A组相比或与移植细胞前相比,均有显著性差异(P<0.05),并持续2周。从第3周开始,旋转行为恢复至移植细胞前水平。C组,在移植MN9D/GDNF工程细胞后第1周开始,旋转行为明显改善,每分旋转圈数减少55%~60%,一直持续到移植细胞后的第10周,与移植细胞前相比及与A组、B组相比,均有显著差异(P<0.05)。从移植细胞后第11周开始,旋转行为逐渐恢复至移植细胞前水平。本结果表明,能分泌DA的MN9D细胞能改善PD鼠的异常旋转行为,但持续时间短,只有2周。而既能分泌DA、又能分泌GDNF的MN9D/GDNF工程细胞可长时间(10周)改善PD鼠的异常旋转行为。
, http://www.100md.com
图2 PD大鼠在接受细胞移植前后不同时间的平均旋转圈数
Figure 2 Mean rotation turns per minute of PD rats at different times
before and after receiving implants of SH-SY-5Y cells, MN9D cells
and MN9D/GDNF engineered cells, respectively
3 讨论
目前从事PD基因治疗基础研究的工作者们主要的研究思路有两条:一是转入TH基因,弥补已丧失的DA;二是转入各种神经营养因子基因,保护未退变的DA能神经元。尽管两者均取得了一定的疗效,但都存在着局限性。例如应用TH,虽可提高黑质-纹状体系统的DA水平,起到改善行为的作用,却不能阻止DA能神经元进一步退变,病情仍会不断加重。单纯应用神经营养因子,可防止DA能神经元的退变以及挽救已经开始退变的DA能神经元,却不能挽回已经死亡的DA能神经元,使之恢复分泌DA的能力,故难以使DA回升至正常水平。那么是否存在标本兼治的措施呢?我们的策略是选用具有分泌DA能力的细胞系MN9D作为载体细胞,转入GDNF cDNA,从而把合成和分泌DA与GDNF的能力结合起来。依靠MN9D细胞自身的TH基因表达补充缺失的DA,又借助GDNF的表达保护存活的DA能神经元,防止其进一步退变,这是一种防治兼顾的策略。
, 百拇医药
在PD基因治疗的研究中,起步最早、应用最广、且较为成熟的手段应属ex vivo方法。ex vivo法是将表达目的基因的工程细胞移植至靶器官进行基因治疗的一种方法。PD是源于细胞的病变,用适合的工程细胞替代病变细胞, 是PD治疗较为理想的途径。但至今为止尚未见到用GDNF的ex vivo法改善PD动物模型行为的正式报道。这说明迫切需要一种理想的能表达GDNF的工程细胞。MN9D细胞是14 d胎龄的C57BL/6J小鼠中脑神经元与N18TG2细胞系融合产生的杂交瘤细胞系[10],此种细胞具有明显的中脑DA能神经元的特性。高效液相检测表明它可以分泌较高水平的DA,组织化学与免疫组化分析表明细胞内有大量的儿茶酚胺。我们用脂质体转染的方法将重组质粒pcDNA3/GDNF转入MN9D细胞中,得到MN9D/GDNF工程细胞。体外实验证实,此工程细胞可促进原代DA能神经元的存活,并能保护DA能神经元抵抗MPP+损伤[8]。在本研究中,我们把MN9D细胞、MN9D/GDNF工程细胞、SH-SY-5Y细胞分别移植到PD大鼠模型的纹状体内,观察旋转行为的变化。SH-SY-5Y细胞由于不能分泌DA及GDNF,移植到PD大鼠脑内后对旋转行为无任何影响是不难理解的。MN9D组及MN9D/GDNF组PD大鼠模型的旋转行为均得到改善,旋转圈数分别减少55%和60%。其原因为这两种细胞由于均可分泌多巴胺,升高了6-OHDA损毁侧纹状体内的DA含量,使超敏的DA受体功能有所恢复,故使旋转行为得到改善。但MN9D组改善旋转行为的作用只持续2周,从移植细胞的第3周开始,旋转行为逐渐恢复到移植细胞前的水平,而MN9D/GDNF工程细胞改善旋转行为的作用可持续10周。这是目前为止在PD ex vivo法研究中,移植细胞存活时间最长或疗效最长的报道。
, http://www.100md.com
MN9D/GDNF工程细胞能明显改善PD大鼠异常旋转行为达10周的原因可能是此工程细胞产生了GDNF,促进工程细胞自身的存活并不断产生DA而引起的。但欲得出真正的结论,尚需对纹状体内DA含量的变化及工程细胞存活情况进一步研究。为什么MN9D/GDNF工程细胞在体内发挥作用的时间仅为10周,这可能是机体对移植细胞发生排斥作用所致。为延长工程细胞治疗作用的时间,可用微囊包裹技术将工程细胞包裹起来,使工程细胞与宿主细胞不发生直接接触,但宿主体内的养分可通过微囊壁进入囊内被工程细胞利用,同时工程细胞的产物可通过微囊壁从囊内逸出以发挥治疗作用,这样可隔断宿主对工程细胞产生的排斥反应,使工程细胞存活时间延长,同时又不影响工程细胞对宿主的治疗作用。基因修饰的工程细胞与微囊包裹技术结合将是今后治疗PD颇有希望的方向。
* 国家自然科学基金(39480008)及跨世纪优秀人材国家“九*五”攻关(969060508)资助项目;
△ 通讯联系人; ☆ 自由词。
, 百拇医药
参考文献
1 Wolff JA, Fisher LJ, Xu L, et al. Grafting fibroblasts genetically modified to produced L-dopa in a rat model of Parkinson’s disease. Proc Natl Acad Sci USA, 1989, 86: 9011-9014
2 During MJ, Naegele JR, O’Malley KL, et al. Long-term behavioral recovery in parkinsonian rats by an HSV vector expressing tyrosine hydroxylase. Science, 1994, 266: 1399-1403
3 Altar CA, Boylan CB, Fritsche M, et al. Efficacy of brain-derived neurotrophic factor and neurotrophin-3 on neurochemical and behavioral deficits associated with partial nigrostriatal dopamine lesions. J Neurochem, 1994, 63: 1021-1032
, http://www.100md.com
4 Hyman C, Juhasz M, Jackson C, et al. Overlapping and distinct actions of the neurotrophins BDNF, NT-3, and NT-4/5 on cultured dopaminergic and GABAergic neurons of the ventral mesencephalon.. J Neurosci, 1994, 14: 335-347
5 Lin LH, Doherty DH, Lile JD, et al. GDNF-A glial cell line derived neurotrophic factor for midbrain dopaminergic neurons. Science, 1993, 260: 1130-1132
6 Tomac A, Lindqvist E, Lin LH, et al. Protection and repair of the nigrostriatal dopaminergic system by GDNF in vivo. Nature, 1995, 373: 335-339
, 百拇医药
7 Gash DM, Zhang ZM, Ovadia A, et al. Functional recovery in Parkinsonian monkeys treated with GDNF. Nature, 1995, 380: 252-255
8 王晓民,马端端,陈光惠,等. 稳定表达GDNF基因的MN9D细胞可保护多巴胺能神经元. 北京医科大学学报, 1997, 29 (4): 299-302
9 Hudson JL, vanHorner CG, Stromberg OI, et al. Correlation of apomorphine- and amphetamine-induced turning with nigrostriatal dopamine content in unilateral 6-hydroxydopamine lesioned rats. Brain Res, 1993, 626: 167-174
10 Choi HK, Won LA, Kontur PJ, et al. Immortalization of embryonic mesencephalic dopaminergic neurons by somatic cell fusion. Brain Res, 1991, 552: 67-76
(1999-03-02收稿), http://www.100md.com
单位:北京医科大学神经科学研究所,北京 100083
关键词:胶质细胞源性神经营养因子☆;帕金森病;旋转;行为;MN9D;GDNF工程细胞☆
990306 摘 要 目的:观察稳定表达GDNF的MN9D/GDNF工程细胞对6-羟基多巴胺损毁所致帕金森病(Parkinson disease, PD)模型大鼠旋转行为有无治疗作用。方法:用6-羟基多巴胺损毁大鼠单侧中脑黑质多巴胺能神经元、2周后腹腔注射阿朴吗啡诱导大鼠出现偏侧旋转行为的方法制备PD模型大鼠。通过脑立体定位技术,将稳定表达GDNF的MN9D/GDNF工程细胞注入模型鼠损毁侧纹状体,1周后观察阿朴吗啡诱导的旋转行为有无改善。结果:稳定表达GDNF的MN9D/GDNF工程细胞可明显降低PD模型大鼠的异常旋转行为,治疗作用达10周之久。结论:运用ex vivo方法和防治兼顾的策略对于PD基因治疗的基础研究及临床应用具有重要意义。
, 百拇医药
中国图书资料分类法分类号 R742.5-332
GDNF engineered MN9D cells can improve the rotational behavior
on a rat model of Parkinson disease
JING Xing-Jun, MA Duan-Duan, GAO Hong, WANG Xiao-Min, HAN Ji-Sheng
(Neuroscience Research Institute, Beijing Medical University, Beijing 100083)
MeSH Glial-cell-line-derived neurotrophic factor☆Parkinson'sdisease Rotation Behavior MN9D/GDNF engineered cell☆
, 百拇医药
ABSTRACT Objective: To observe whether engineered MN9D/GDNF cells stably expressing GDNF and secreting dopamine can improve the APO-induced rotational behavior on a rat model of Parkinson disease. Methods: By mircroinjecting 6-OHDA into rat unilateral medial forebrain bundle to induce the damage of unilateral mesencephalic dopamine neurons, a well-known PD rat model was established. After transplanting MN9D/GDNF engineered cells into the lesioned striatum by stereotaxic technique, the rotational behavior was measured on an automatic locomoter. Results: Engineered MN9D/GDNF cells steadily expressing GDNF could significantly reduce the rotational behavior of PD rat model for ten weeks. Conclusion: Combination of prevention and treatment for PD by ex vivo method may play an important role in the basic research and clinical utility of gene therapy on Parkinson disease in the future.
, 百拇医药
(J Beijing Med Univ, 1999,31:212-215)
帕金森病(Parkinson disease, PD)是以中脑黑质多巴胺(dopamine, DA)能神经元发生退变从而导致纹状体内DA含量显著降低为主要病理特征的中枢神经系统退行性疾病。因其病理改变基本明确,有恰当的动物模型,且相关基因已经克隆,定点转基因的解剖学位置清楚,便于立体定位注射,故PD成为中枢神经系统退行性疾病基因治疗的首选疾病。目前用于PD基因治疗的目的基因主要有两大类,即与纹状体内DA合成、代谢有关的基因和对中脑黑质DA能神经元具有营养活性的神经营养因子基因。尽管酪氨酸羟化酶基因(tyrosine hydroxylase, TH)是PD基因治疗中应用最早的基因之一,实验研究也已证明了其治疗效果[1,2],但此基因不能逆转PD的病程进展。目前已发现多种神经营养因子对中脑黑质DA能神经元具有不同程度的营养活性,如脑源性神经营养因子(brain derived neurotrophic factor, BDNF)[3,4]、神经营养素3和4/5(neurotrophin 3,4/5)[4]、胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor, GDNF)等。GDNF是近年来发现的一种转化生长因子β(transforming growth factor, TGF-β)超家族的新成员,它可特异性地促进体外培养的DA能神经元的存活及突起生长,并增加其对DA的摄取[5],在体研究也证实了GDNF对DA能神经元的营养作用[6,7]。本室近来的研究表明,稳定表达GDNF基因的MN9D工程细胞可保护原代培养的中脑DA能神经元对抗神经毒素MPP+的损伤[8]。本研究将稳定表达GDNF的MN9D工程细胞植入PD大鼠的纹状体,用行为学测试的方法,从整体水平上观察此工程细胞对PD的治疗作用。
, 百拇医药
1 材料与方法
1.1 材料
仪器:大鼠旋转行为自动记录分析仪购自德国;脑立体定位仪购自日本NARISHIGE公司;超净工作台为Labconco Ltd. 产品。
动物:选用成年Wistar大鼠,雄性,体重200~250g,由北京医科大学动物部提供。
试剂:6-羟基多巴胺(6-hydroxydopamine, 6-OHDA),阿朴吗啡(apomorphine, APO)为Sigma公司产品;RMPI1640、DMEM培养基为GIBCO公司产品;胎牛血清为北郊奶牛公司二分厂(北京医科大学监制)产品。
细胞株:MN9D细胞是14 d胎龄的C57BL/6J小鼠胚胎中脑神经元与N18TG2细胞系融合产生的杂交瘤细胞系,可分泌DA,由本室提供;SH-SY-5Y细胞为人神经母细胞瘤细胞,由本室提供;MN9D/GDNF工程细胞由本所构建[8]。
, 百拇医药
1.2 方法
PD大鼠模型的建立[9]:Wistar大鼠在350mg.kg-1 (i.p.)的水合氯醛麻醉下,将头部俯卧位固定于大鼠脑立体定位仪。根据Paxson 《The Rat Brain》图谱,用微量注射器向左侧内侧前脑束注入6-OHDA。注射部位的坐标为:第1点,门齿棒高于耳杆3.4mm,前囟后4.0mm,中线左旁开0.8mm,颅骨表面下8.0mm;第2点,门齿棒低于耳杆2.3mm,前囟后4.4mm,中线左旁开1.2mm,颅骨表面下7.8mm。每点注射6-OHDA溶液4μl(2g.L-1),注射速度为1μl.min-1,留针10min,缓慢拔针,缝合皮肤。注射后第2周开始,每周1次腹腔注射APO(0.25mg.kg-1)诱发其向右侧旋转,连续测定4周。每次记录30min内的旋转圈数,平均每分7圈以上者为合格的PD大鼠模型。
, http://www.100md.com
移植细胞的制备:用1ml含有0.5g.L-1胰蛋白酶、2g.L-1EDTA的消化液处理培养细胞3~5min,加入10ml含10%(体积分数)血清的RPMI1640培养基收获(SH-SY-5Y细胞)或DMEM培养基(收获MN9D、MN9D/GDNF细胞)悬浮细胞,细胞计数,离心600r.min-1,5min,弃上清,按105 μl-1的细胞浓度重悬细胞,4g.L-1台盼蓝检查细胞活率,活率高于85%时,用于PD大鼠模型纹状体内移植。
脑纹状体内移植:将筛选合格的18只PD模型大鼠随机分为3组,每组6只,分别向6-OHDA损毁侧纹状体内植入SH-SY-5Y细胞、MN9D细胞、MN9D/GDNF工程细胞。选择二点注射,坐标分别为:第1点,前囟前0.5mm,中线左旁开3mm,颅骨表面下6mm;第2点,前囟前0.8mm,中线左旁开2.5mm,颅骨表面下4.5mm。每个位点用Hamilton微量注射器注射细胞悬液5μl,使每只大鼠接受的细胞数为5×105,注射速度为1μl.min-1,留针10min,缓慢拔针,缝合皮肤。将术后的大鼠置于温暖安静处直至清醒,大鼠自由进食饮水。术后1周,开始测转,方法同前。
, 百拇医药
统计学分析:用平均每分钟向右旋转的圈数进行ANOVA分析继之以Newman-Keuls检验,比较各组之间及每组大鼠移植细胞前后有无统计学差异。
2 结果
2.1 PD模型大鼠的建立
PD在动物界并不自然发生。为探讨PD的发病机制及防治方法,必须建立合适的PD模型。我们选用Wistar大鼠,依国际通用标准,用6-OHDA损毁左侧黑质致密部和内侧前脑束[9]。2周后,腹腔注射APO诱导大鼠向右旋转,每周测1次,连续测3周,每次测30min,30min内向右旋转210圈以上(7圈.min-1)为模型成功。以此标准,我们筛选出PD鼠,其成功率为40%左右,与其它报道结果基本相同,表明我们已成功建立了PD大鼠模型(图1)。

, 百拇医药
图1 用APO诱发6-OHDA损毁大鼠的旋转行为来筛选PD模型鼠
Figure 1 Selection of PD rats by APO-induced rotational behavior
of rats after 6-OHDA lesion
2.2 MN9D细胞及MN9D/GDNF工程细胞对PD大鼠旋转行为的影响
将筛选合格的18只PD模型大鼠随机分为A、B、C3组,每组6只,A组左侧纹状体内移植SH-SY-5Y细胞,B组左侧纹状体内移植MN9D细胞,C组纹状体内则移植MN9D/GDNF工程细胞。从移植细胞后第1周开始,每周检测一次各组PD大鼠的旋转行为。从图2可以看出,A组,移植细胞前后大鼠的旋转行为无变化。B组,移植细胞后第1周开始,旋转行为明显改善,每分旋转圈数减少50%~55%,与A组相比或与移植细胞前相比,均有显著性差异(P<0.05),并持续2周。从第3周开始,旋转行为恢复至移植细胞前水平。C组,在移植MN9D/GDNF工程细胞后第1周开始,旋转行为明显改善,每分旋转圈数减少55%~60%,一直持续到移植细胞后的第10周,与移植细胞前相比及与A组、B组相比,均有显著差异(P<0.05)。从移植细胞后第11周开始,旋转行为逐渐恢复至移植细胞前水平。本结果表明,能分泌DA的MN9D细胞能改善PD鼠的异常旋转行为,但持续时间短,只有2周。而既能分泌DA、又能分泌GDNF的MN9D/GDNF工程细胞可长时间(10周)改善PD鼠的异常旋转行为。

, http://www.100md.com
图2 PD大鼠在接受细胞移植前后不同时间的平均旋转圈数
Figure 2 Mean rotation turns per minute of PD rats at different times
before and after receiving implants of SH-SY-5Y cells, MN9D cells
and MN9D/GDNF engineered cells, respectively
3 讨论
目前从事PD基因治疗基础研究的工作者们主要的研究思路有两条:一是转入TH基因,弥补已丧失的DA;二是转入各种神经营养因子基因,保护未退变的DA能神经元。尽管两者均取得了一定的疗效,但都存在着局限性。例如应用TH,虽可提高黑质-纹状体系统的DA水平,起到改善行为的作用,却不能阻止DA能神经元进一步退变,病情仍会不断加重。单纯应用神经营养因子,可防止DA能神经元的退变以及挽救已经开始退变的DA能神经元,却不能挽回已经死亡的DA能神经元,使之恢复分泌DA的能力,故难以使DA回升至正常水平。那么是否存在标本兼治的措施呢?我们的策略是选用具有分泌DA能力的细胞系MN9D作为载体细胞,转入GDNF cDNA,从而把合成和分泌DA与GDNF的能力结合起来。依靠MN9D细胞自身的TH基因表达补充缺失的DA,又借助GDNF的表达保护存活的DA能神经元,防止其进一步退变,这是一种防治兼顾的策略。
, 百拇医药
在PD基因治疗的研究中,起步最早、应用最广、且较为成熟的手段应属ex vivo方法。ex vivo法是将表达目的基因的工程细胞移植至靶器官进行基因治疗的一种方法。PD是源于细胞的病变,用适合的工程细胞替代病变细胞, 是PD治疗较为理想的途径。但至今为止尚未见到用GDNF的ex vivo法改善PD动物模型行为的正式报道。这说明迫切需要一种理想的能表达GDNF的工程细胞。MN9D细胞是14 d胎龄的C57BL/6J小鼠中脑神经元与N18TG2细胞系融合产生的杂交瘤细胞系[10],此种细胞具有明显的中脑DA能神经元的特性。高效液相检测表明它可以分泌较高水平的DA,组织化学与免疫组化分析表明细胞内有大量的儿茶酚胺。我们用脂质体转染的方法将重组质粒pcDNA3/GDNF转入MN9D细胞中,得到MN9D/GDNF工程细胞。体外实验证实,此工程细胞可促进原代DA能神经元的存活,并能保护DA能神经元抵抗MPP+损伤[8]。在本研究中,我们把MN9D细胞、MN9D/GDNF工程细胞、SH-SY-5Y细胞分别移植到PD大鼠模型的纹状体内,观察旋转行为的变化。SH-SY-5Y细胞由于不能分泌DA及GDNF,移植到PD大鼠脑内后对旋转行为无任何影响是不难理解的。MN9D组及MN9D/GDNF组PD大鼠模型的旋转行为均得到改善,旋转圈数分别减少55%和60%。其原因为这两种细胞由于均可分泌多巴胺,升高了6-OHDA损毁侧纹状体内的DA含量,使超敏的DA受体功能有所恢复,故使旋转行为得到改善。但MN9D组改善旋转行为的作用只持续2周,从移植细胞的第3周开始,旋转行为逐渐恢复到移植细胞前的水平,而MN9D/GDNF工程细胞改善旋转行为的作用可持续10周。这是目前为止在PD ex vivo法研究中,移植细胞存活时间最长或疗效最长的报道。
, http://www.100md.com
MN9D/GDNF工程细胞能明显改善PD大鼠异常旋转行为达10周的原因可能是此工程细胞产生了GDNF,促进工程细胞自身的存活并不断产生DA而引起的。但欲得出真正的结论,尚需对纹状体内DA含量的变化及工程细胞存活情况进一步研究。为什么MN9D/GDNF工程细胞在体内发挥作用的时间仅为10周,这可能是机体对移植细胞发生排斥作用所致。为延长工程细胞治疗作用的时间,可用微囊包裹技术将工程细胞包裹起来,使工程细胞与宿主细胞不发生直接接触,但宿主体内的养分可通过微囊壁进入囊内被工程细胞利用,同时工程细胞的产物可通过微囊壁从囊内逸出以发挥治疗作用,这样可隔断宿主对工程细胞产生的排斥反应,使工程细胞存活时间延长,同时又不影响工程细胞对宿主的治疗作用。基因修饰的工程细胞与微囊包裹技术结合将是今后治疗PD颇有希望的方向。
* 国家自然科学基金(39480008)及跨世纪优秀人材国家“九*五”攻关(969060508)资助项目;
△ 通讯联系人; ☆ 自由词。
, 百拇医药
参考文献
1 Wolff JA, Fisher LJ, Xu L, et al. Grafting fibroblasts genetically modified to produced L-dopa in a rat model of Parkinson’s disease. Proc Natl Acad Sci USA, 1989, 86: 9011-9014
2 During MJ, Naegele JR, O’Malley KL, et al. Long-term behavioral recovery in parkinsonian rats by an HSV vector expressing tyrosine hydroxylase. Science, 1994, 266: 1399-1403
3 Altar CA, Boylan CB, Fritsche M, et al. Efficacy of brain-derived neurotrophic factor and neurotrophin-3 on neurochemical and behavioral deficits associated with partial nigrostriatal dopamine lesions. J Neurochem, 1994, 63: 1021-1032
, http://www.100md.com
4 Hyman C, Juhasz M, Jackson C, et al. Overlapping and distinct actions of the neurotrophins BDNF, NT-3, and NT-4/5 on cultured dopaminergic and GABAergic neurons of the ventral mesencephalon.. J Neurosci, 1994, 14: 335-347
5 Lin LH, Doherty DH, Lile JD, et al. GDNF-A glial cell line derived neurotrophic factor for midbrain dopaminergic neurons. Science, 1993, 260: 1130-1132
6 Tomac A, Lindqvist E, Lin LH, et al. Protection and repair of the nigrostriatal dopaminergic system by GDNF in vivo. Nature, 1995, 373: 335-339
, 百拇医药
7 Gash DM, Zhang ZM, Ovadia A, et al. Functional recovery in Parkinsonian monkeys treated with GDNF. Nature, 1995, 380: 252-255
8 王晓民,马端端,陈光惠,等. 稳定表达GDNF基因的MN9D细胞可保护多巴胺能神经元. 北京医科大学学报, 1997, 29 (4): 299-302
9 Hudson JL, vanHorner CG, Stromberg OI, et al. Correlation of apomorphine- and amphetamine-induced turning with nigrostriatal dopamine content in unilateral 6-hydroxydopamine lesioned rats. Brain Res, 1993, 626: 167-174
10 Choi HK, Won LA, Kontur PJ, et al. Immortalization of embryonic mesencephalic dopaminergic neurons by somatic cell fusion. Brain Res, 1991, 552: 67-76
(1999-03-02收稿), http://www.100md.com