质粒DNA对大鼠骨骼肌肌质网Ca2+-ATPase活性及ryanodine受体结合反应的影响*
作者:赵文 姜志胜 佟利家 郝胜利 刘乃奎 贾弘 唐朝枢 汤健
单位:北京医科大学心血管基础研究所 贾弘礻是 生物化学与分子生物学系;北京 100083 姜志胜 唐朝枢 第一医院心血管病研究所
关键词:质粒;药理学;Ca(2+)转运ATP酶;代谢;兰尼碱;代谢;肌;代谢;钙;代谢
北京医科大学学报990604 摘 要 目的:观察质粒DNA对离体大鼠骨骼肌肌质网Ca2+-ATPase活性及ryanodine受体结合反应的影响。方法:参照Jones等的方法比色测定肌质网Ca2+-ATPase活性;以3H-ryanodine作为配基,液闪测定肌质网Ca2+释放通道ryanodine受体与配体的结合。质粒DNA处理组预先将肌质网蛋白与质粒DNA 37℃共同孵育30min,而后再测定肌质网Ca2+-ATPase活性和ryanodine结合反应。结果:预先用10、20和30 μg pcDNA3及pcDNA3/ANF处理后,肌质网Ca2+-ATPase活性分别较对照组升高45%(P<0.05),68%(P<0.01)和109%(P<0.01)及109%,118%和145%(P值均小于0.01);质粒pcDNA3可明显降低ryanodine受体的亲和力,并使Bmax增强。结论:质粒DNA可能通过增强肌质网Ca2+-ATPase的活性促进肌质网对Ca2+的摄入,通过影响ryanodine 受体而调控肌质网Ca2+释放。
, http://www.100md.com
中国图书资料分类法分类号 R337-332
Effect of plasmid DNA on Ca2+-ATPase activity and ryanodine receptors bound activity in rat skeletal muscle sarcoplasmic reticulum
ZHAO Wen#, JIANG Zhi-Sheng, TONG Li-Jia, HAO Sheng-Li LIU Nai-Kui, JIA Hong-Ti, et al
(#Institute of Cardiovascular Research, Beijing Medical University, Beijing 100083)
MeSH Plasmid/pharmacol Ca(2+)-Transporting ATPase/metab Ryanodine/metab Muscles/metab Calcium/metab
, 百拇医药
ABSTRACT Objective: To observe the effect of plasmid DNA on Ca2+-ATPase activity and ryanodine receptors bound activity in rat skeletal muscle sarcoplasmic reticulum(SR). Methods: Ca2+-ATPase activity was detected according to Jones' methods.3H-ryanodines were used as ligands to investigate SR Ca2+ release channel ryanodine receptors bound activity. In the groups which were treated by plasmid DNA, the SR proteins were preincubated 30min at 37℃ with plasmid DNA : pcDNA3 and pcDNA3/ANF, respectively. Results: After SR proteins were treated by 10, 20 and 30 μg pcDNA3, the Ca2+-ATPase activity was increased significantly 45%(P<0.05),68%(P<0.01) and 109% compared with control(P<0.01); After the SR proteins were treated by 10,20 and 30μg pcDNA3/ANF, the Ca2+-ATPase activity was increased significantly 109%,118%, 145% (all P<0.01)compared with control. Plasmid pcDNA3 could decrease the affinity of SR ryanodine receptors and ryanodine (P<0.01) and increase the Bmax of ryanodine bound to ryanodine receptors(P<0.01). Conclusion: Plasmid DNAs can increase SR Ca2+ uptake by improving SR Ca2+-ATPase activity and regulate Ca2+ release by influencing ryanodine receptors bound activity.
, http://www.100md.com
(J Beijing Med Unvi, 1999,31:493-496)
已知DNA结合蛋白主要存在于核内作为转录调控因子,调节基因的转录与表达。Hagstrom等[1]首次发现家兔骨骼肌肌质网(sarcoplasmic reticulum, SR)上存在特异的DNA结合蛋白,相对分子质量分别为95 000,60 000和28 000[1],但其功能意义尚不清楚; 最近本室在大鼠骨骼肌SR上也发现存在有两种DNA结合蛋白,相对分子质量分别为83000和58000[2],并进一步发现质粒DNA与SR上DNA结合蛋白结合后可明显增强SR对Ca2+的摄入及释放能力[3]。但其作用机制尚不清楚。本实验在分离的大鼠骨骼肌SR上,观察质粒DNA与DNA结合蛋白结合后对SR Ca2+-ATPase活性及ryanodine受体结合反应的影响,以探讨质粒DNA影响SR Ca2+转运的机制。
, 百拇医药
1 材料与方法
1.1 动物及试剂
SD大鼠,体重150~250g。随机分组,每组5~6只,由北京医科大学动物部提供。实验试剂PEP,pyruvate kinase,A23187及ATP-Na2由Sigma公司提供,3H-ryanodine购自New England Nuclear (Boston, MA), ryanodine 购自Penick Corp.(Lindhurst, NJ),其余试剂为国产及进口分析纯。
1.2 大鼠骨骼肌肌质网膜囊泡的制备
参照Ohlendieck等[4]的方法,取Wistar大鼠后肢骨骼肌组织20g,冰浴中剪碎后匀浆,差速离心10000r.min-1, 15 min; 16 000 r.min-1, 30 min;30 000 r.min-1, 30 min, 4 ℃, 沉淀即为SR膜囊泡粗提物,用考马斯亮蓝法进行蛋白定量,并贮存于-80℃备用。
, 百拇医药
1.3 质粒DNA的制备
质粒pcDNA3购自Invitrogen公司。质粒pcDNA3/ANF为本室构建,即在pcDNA3的多克隆位点插入心钠素(atrial natriuretic peptide, ANF)全长cDNA,质粒经转化大肠杆菌进行扩增,用聚乙二醇纯化,获得闭合环状DNA,贮存于-20℃备用。
1.4 骨骼肌肌质网膜纯度鉴定
应用Jones[5]的方法分别测定肌肉匀浆及SR膜制备的Ca2+-ATPase(肌质网标志酶),Na+-K+-ATPase(质膜标志酶) 及azide-ATPase(线粒体标志酶)的活性,以鉴定SR制备的纯度。
1.5 骨骼肌肌质网膜Ca2+-ATPase活性测定及实验分组
, http://www.100md.com
参照Jones等[5]的方法测定SR膜Ca2+-ATPase活性。即每个样品分别测定SR 总ATPase活性(a)及非Ca2+依赖性ATPase活性(b),而后计算其差值(a-b)即为SR Ca2+依赖性ATPase活性。a管反应介质为(mmol.L-1):组氨酸 50,MgCl2 5, KCl 111, CaCl2 1μmol.L-1; b管反应介质为(mmol.L-1):组氨酸 50,MgCl2 5, KCl 111, EGTA 418.4mg.L-1, A23187 3.33mg.L-1。临用前加入新鲜制备的PEP 3.33 mmol.L-1, pyruvate kinase 15U/ml。每管加SR蛋白50μg, 反应总体积1ml, 37℃孵育10min, 加入100μl ATP起始液,37℃孵育20min,每管加终止液2.5ml终止反应,650nm比色测定SR膜Ca2+-ATPase活性。质粒DNA处理组预先分别用10,20和30μg pcDNA3及pcDNA3/ANF与SR膜蛋白共同孵育30min后,再同法测SR膜Ca2+-ATPase活性。
, http://www.100md.com
1.6 3H-ryanodine配体结合实验
按改进的McGrew[6]方法行3H-ryanodine配体结合实验。反应缓冲液:1mol.L-1 KCl,10mmol.L-1 HEPES,25μmol.L-1 CaCl2,每实验管含0.1mg SR膜蛋白,反应总体积200μl,3H-ryanodine的浓度分别为5~100nmol.L-1,非特异结合组加入50μmol.L-1未标记的ryanodine,37℃孵育2h,加入预冷的缓冲液冲洗3次,用Millipore抽滤,待滤膜干燥后,加入闪烁液,在液闪计数仪上测定3H放射活性,特异性结合为总结合与非特异结合之差,结合率以每毫克蛋白pmol表示。质粒DNA实验组每管预先加入20μg pcDNA3与SR膜蛋白室温共同孵育30min,其余处理同上。
, http://www.100md.com
1.7 统计学处理
结果用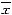 ±s表示,应用one-way ANOVA 进行统计学分析,P<0.05认为差异有显著性。
±s表示,应用one-way ANOVA 进行统计学分析,P<0.05认为差异有显著性。
2 结果
2.1 骨骼肌肌质网膜纯度鉴定
SR膜制备的Ca2+-ATPase的含量较骨骼肌组织匀浆升高6.5倍 (每毫克蛋白每分nmol∶300±38 vs 40±14,P<0.01); SR膜制备的Na+-K+-ATPase及azide-ATPase的含量与骨骼肌组织匀浆相比含量均较低(每毫克蛋白每分nmol: 14±3 vs 18±6, P>0.05; 56±14 vs 115±21, P<0.05)。提示此制备的SR膜纯度较高,线粒体及质膜的污染较低。
, http://www.100md.com
2.2 质粒pcDNA3及pcDNA3/ANF对肌质网Ca2+-ATPase活性的影响
SR的Ca2+摄入主要依赖SR Ca2+-ATPase对Ca2+的主动摄取,因此我们观察了质粒DNA对SR Ca2+-ATPase活性的影响。10、20和30μg pcDNA3与50μg SR蛋白共同孵育后,SR Ca2+-ATPase活性较对照组分别升高45%,68%和109%(P<0.05,P<0.01,P<0.01); 10、20、30μg pcDNA3/ANF与50μg SR蛋白共同孵育后,SR Ca2+-ATPase活性较对照组分别升高109%,118%和145%(P<0.01, P<0.01, P<0.01)。结果如图1所示。
, http://www.100md.com
*P<0.05,**P<0.01, compared with control, n=5.
图1 质粒pcDNA3和pcDNA3/ANF对大鼠骨骼肌肌质网
Ca2+-ATPase活性的影响
Figure 1 Effect of plasmid pcDNA3 and pcDNA3/ANF
on Ca2+-ATPase activity in rat skeletal muscle sarcoplasmic reticulum
2.3 质粒pcDNA3对肌质网Ca2+释放通道ryanodine受体的影响
SR的Ca2+释放调节主要通过ryanodine受体起作用,为了进一步分析质粒DNA对SR Ca2+释放作用机制,本工作观察了质粒pcDNA3对肌质网Ca2+释放通道ryanodine受体的影响,结果发现对照组大鼠骨骼肌SR与3H-ryanodine共同孵育后,配体与受体结合反应的解离常数(Kd)为(31±5)nmol.L-1,最大结合力(Bmax)为每毫克蛋白(1 802±194) fmol; pcDNA3预处理组3H-ryanodine结合反应Kd及Bmax分别为(132±18)nmol.L-1,每毫克蛋白(3213±459)fmol,较对照组升高323.7%(P<0.01)及78.3%(P<0.01)(图2A、B)。提示质粒DNA与SR膜蛋白结合后,SR上ryanodine受体的性质发生了改变,受体功能上调,Ca2+释放能力增强。

, 百拇医药
B, ryanodine bound (fmol per mg protein); F, total ryanodine-ryanodine(fmol per mg protein), n=5
图2A,B [3H]-ryanodine与大鼠骨骼肌肌质网ryanodine受体结合的饱和曲线(A)和Scatchard plot(B)以及质粒 pcDNA3对其作用
Figure 2A,B A saturation curve (A)and a scatchard plot(B) for [3H]-ryanodine binding to SR and effects of plasmid pcDNA3
on [3H]-ryanodine binding to SR in rat skeletal muscle
, 百拇医药
3 讨论
1996年,Hagstrom等[1]首次发现家兔骨骼肌SR上存在特异的DNA结合蛋白,并证实其具有双链DNA特异性。本实验室也发现大鼠骨骼肌SR上存在特异的DNA结合蛋白[2]。骨骼肌SR在肌肉兴奋收缩耦联及调控胞浆钙稳态方面起重要作用,因此,我们进一步调查了质粒DNA与SR蛋白结合后对骨骼肌SR的主要功能-钙转运的影响,结果发现质粒DNA与SR上DNA结合蛋白结合后可以明显增加SR对钙的摄入与释放[3];SR摄取Ca2+主要依赖SR膜上Ca2+-ATPase对Ca2+的主动摄取,本研究发现质粒DNA与SR上DNA结合蛋白结合后可引起SR Ca2+-ATPase的活性明显增强,提示质粒DNA对SR钙摄入的增强作用可能是通过其增加SR Ca2+-ATPase的活性引起的。本实验随机选用两种质粒:pcDNA3作为空载体的代表,pcDNA3/ANF作为插入外源基因的嵌合质粒的代表,结果两种质粒对SR Ca2+-ATPase活性的影响相似,因此提示这种作用是DNA序列非依赖性的。
, http://www.100md.com
Ryanodine受体是位于骨骼肌肌质网终末池的足结构,一种中性植物碱ryanodine可与之结合,已经发现ryanodine受体是骨骼肌兴奋收缩耦联中Ca2+释放通道的主要结构及功能单位,它位于三联体部位,调节肌质网终末池Ca2+释放[7],本实验发现质粒DNA可使骨骼肌肌质网Ca2+释放通道ryanodine受体的亲和力下降,最大结合力升高。推测质粒DNA作用于肌质网上非核DNA结合蛋白后,可能通过某种机制影响了ryanodine受体的活性,使配基受体亲和力下降,提示受体对配基的浓度敏感性降低,受体性质发生改变;Bmax增加,ryanodine受体结合位点增多,释放能力增强,受体功能上调,这说明质粒DNA可能导致受体蛋白被修饰,从而使肌质网Ca2+释放能力增强。
Hagstrom等[1]认为,SR上存在的DNA结合蛋白实际上就是位于三联体部位的Triadin,质粒DNA是否通过与Triadin相互结合后再进一步影响SR Ca2+-ATPase及ryanodine受体的功能,有待进一步证实。
, 百拇医药
目前有关直接基因转移及基因治疗的研究报道较多,骨骼肌因其容量大,血流量丰富等优势已经成为直接基因转移并进行基因治疗的主要运载体,本室发现质粒DNA增强SR钙摄入与释放[3],刺激SR Ca2+-ATPase的活性,并可改变ryanodine受体的结合活性,这些发现提示质粒DNA进入细胞后的非目的基因表达的生物学作用,值得重视。
* 国家“八六三”高技术项目基因治疗重大课题(BH-03);国家自然科学基金(39900057)资助项目。
参考文献
1 Hagstrom JE, Rybakova IN, Wolff JA, et al. Nonnucleaer DNA binding proteins in striated muscle. Biochem Mol Med, 1996,58:113-121
, 百拇医药
2 赵 文,倪菊华,汤 健,等.大鼠骨骼肌肌质网序列非依赖性DNA结合蛋白,北京医科大学学报,1999,31(1):5-8,297-299
3 赵 文,李载权,汤 健,等.质粒DNA对大鼠骨骼肌肌质网钙转运的影响.北京医科大学学报,1999,31(4):297-299
4 Ohlendieck K, Ervasti JM, Snook JB, et al. Dystrophin-glycoprotein complex is highly enriched in isolated skeletal muscle sarcolemma. J Cell Biol ,1991,112:135-148
5 Jones LR, Besch HR Jr. Isolation of canine sarcolemmal vesicles. Meth Pharma, 1984,5:1-12
, 百拇医药
6 McGrew SG,Wolleben C, Siegl P, et al. Positive cooperativity of ryanodine binding to eh calcium release channel of sarcoplasmic reticulum from heart and skeletal muscle. Biochemistry, 1989,28:1686-1691
7 Inui M, Saito A, Fleischer S. Purification of the ryanodine receptor and identity with feet structures of junctional terminal cisternae of sarcoplasmic retuculum from fast skeletal muscle. J Biol Chem,1987, 262(4):1740-1747
(1998-11-20收稿), 百拇医药
单位:北京医科大学心血管基础研究所 贾弘礻是 生物化学与分子生物学系;北京 100083 姜志胜 唐朝枢 第一医院心血管病研究所
关键词:质粒;药理学;Ca(2+)转运ATP酶;代谢;兰尼碱;代谢;肌;代谢;钙;代谢
北京医科大学学报990604 摘 要 目的:观察质粒DNA对离体大鼠骨骼肌肌质网Ca2+-ATPase活性及ryanodine受体结合反应的影响。方法:参照Jones等的方法比色测定肌质网Ca2+-ATPase活性;以3H-ryanodine作为配基,液闪测定肌质网Ca2+释放通道ryanodine受体与配体的结合。质粒DNA处理组预先将肌质网蛋白与质粒DNA 37℃共同孵育30min,而后再测定肌质网Ca2+-ATPase活性和ryanodine结合反应。结果:预先用10、20和30 μg pcDNA3及pcDNA3/ANF处理后,肌质网Ca2+-ATPase活性分别较对照组升高45%(P<0.05),68%(P<0.01)和109%(P<0.01)及109%,118%和145%(P值均小于0.01);质粒pcDNA3可明显降低ryanodine受体的亲和力,并使Bmax增强。结论:质粒DNA可能通过增强肌质网Ca2+-ATPase的活性促进肌质网对Ca2+的摄入,通过影响ryanodine 受体而调控肌质网Ca2+释放。
, http://www.100md.com
中国图书资料分类法分类号 R337-332
Effect of plasmid DNA on Ca2+-ATPase activity and ryanodine receptors bound activity in rat skeletal muscle sarcoplasmic reticulum
ZHAO Wen#, JIANG Zhi-Sheng, TONG Li-Jia, HAO Sheng-Li LIU Nai-Kui, JIA Hong-Ti, et al
(#Institute of Cardiovascular Research, Beijing Medical University, Beijing 100083)
MeSH Plasmid/pharmacol Ca(2+)-Transporting ATPase/metab Ryanodine/metab Muscles/metab Calcium/metab
, 百拇医药
ABSTRACT Objective: To observe the effect of plasmid DNA on Ca2+-ATPase activity and ryanodine receptors bound activity in rat skeletal muscle sarcoplasmic reticulum(SR). Methods: Ca2+-ATPase activity was detected according to Jones' methods.3H-ryanodines were used as ligands to investigate SR Ca2+ release channel ryanodine receptors bound activity. In the groups which were treated by plasmid DNA, the SR proteins were preincubated 30min at 37℃ with plasmid DNA : pcDNA3 and pcDNA3/ANF, respectively. Results: After SR proteins were treated by 10, 20 and 30 μg pcDNA3, the Ca2+-ATPase activity was increased significantly 45%(P<0.05),68%(P<0.01) and 109% compared with control(P<0.01); After the SR proteins were treated by 10,20 and 30μg pcDNA3/ANF, the Ca2+-ATPase activity was increased significantly 109%,118%, 145% (all P<0.01)compared with control. Plasmid pcDNA3 could decrease the affinity of SR ryanodine receptors and ryanodine (P<0.01) and increase the Bmax of ryanodine bound to ryanodine receptors(P<0.01). Conclusion: Plasmid DNAs can increase SR Ca2+ uptake by improving SR Ca2+-ATPase activity and regulate Ca2+ release by influencing ryanodine receptors bound activity.
, http://www.100md.com
(J Beijing Med Unvi, 1999,31:493-496)
已知DNA结合蛋白主要存在于核内作为转录调控因子,调节基因的转录与表达。Hagstrom等[1]首次发现家兔骨骼肌肌质网(sarcoplasmic reticulum, SR)上存在特异的DNA结合蛋白,相对分子质量分别为95 000,60 000和28 000[1],但其功能意义尚不清楚; 最近本室在大鼠骨骼肌SR上也发现存在有两种DNA结合蛋白,相对分子质量分别为83000和58000[2],并进一步发现质粒DNA与SR上DNA结合蛋白结合后可明显增强SR对Ca2+的摄入及释放能力[3]。但其作用机制尚不清楚。本实验在分离的大鼠骨骼肌SR上,观察质粒DNA与DNA结合蛋白结合后对SR Ca2+-ATPase活性及ryanodine受体结合反应的影响,以探讨质粒DNA影响SR Ca2+转运的机制。
, 百拇医药
1 材料与方法
1.1 动物及试剂
SD大鼠,体重150~250g。随机分组,每组5~6只,由北京医科大学动物部提供。实验试剂PEP,pyruvate kinase,A23187及ATP-Na2由Sigma公司提供,3H-ryanodine购自New England Nuclear (Boston, MA), ryanodine 购自Penick Corp.(Lindhurst, NJ),其余试剂为国产及进口分析纯。
1.2 大鼠骨骼肌肌质网膜囊泡的制备
参照Ohlendieck等[4]的方法,取Wistar大鼠后肢骨骼肌组织20g,冰浴中剪碎后匀浆,差速离心10000r.min-1, 15 min; 16 000 r.min-1, 30 min;30 000 r.min-1, 30 min, 4 ℃, 沉淀即为SR膜囊泡粗提物,用考马斯亮蓝法进行蛋白定量,并贮存于-80℃备用。
, 百拇医药
1.3 质粒DNA的制备
质粒pcDNA3购自Invitrogen公司。质粒pcDNA3/ANF为本室构建,即在pcDNA3的多克隆位点插入心钠素(atrial natriuretic peptide, ANF)全长cDNA,质粒经转化大肠杆菌进行扩增,用聚乙二醇纯化,获得闭合环状DNA,贮存于-20℃备用。
1.4 骨骼肌肌质网膜纯度鉴定
应用Jones[5]的方法分别测定肌肉匀浆及SR膜制备的Ca2+-ATPase(肌质网标志酶),Na+-K+-ATPase(质膜标志酶) 及azide-ATPase(线粒体标志酶)的活性,以鉴定SR制备的纯度。
1.5 骨骼肌肌质网膜Ca2+-ATPase活性测定及实验分组
, http://www.100md.com
参照Jones等[5]的方法测定SR膜Ca2+-ATPase活性。即每个样品分别测定SR 总ATPase活性(a)及非Ca2+依赖性ATPase活性(b),而后计算其差值(a-b)即为SR Ca2+依赖性ATPase活性。a管反应介质为(mmol.L-1):组氨酸 50,MgCl2 5, KCl 111, CaCl2 1μmol.L-1; b管反应介质为(mmol.L-1):组氨酸 50,MgCl2 5, KCl 111, EGTA 418.4mg.L-1, A23187 3.33mg.L-1。临用前加入新鲜制备的PEP 3.33 mmol.L-1, pyruvate kinase 15U/ml。每管加SR蛋白50μg, 反应总体积1ml, 37℃孵育10min, 加入100μl ATP起始液,37℃孵育20min,每管加终止液2.5ml终止反应,650nm比色测定SR膜Ca2+-ATPase活性。质粒DNA处理组预先分别用10,20和30μg pcDNA3及pcDNA3/ANF与SR膜蛋白共同孵育30min后,再同法测SR膜Ca2+-ATPase活性。
, http://www.100md.com
1.6 3H-ryanodine配体结合实验
按改进的McGrew[6]方法行3H-ryanodine配体结合实验。反应缓冲液:1mol.L-1 KCl,10mmol.L-1 HEPES,25μmol.L-1 CaCl2,每实验管含0.1mg SR膜蛋白,反应总体积200μl,3H-ryanodine的浓度分别为5~100nmol.L-1,非特异结合组加入50μmol.L-1未标记的ryanodine,37℃孵育2h,加入预冷的缓冲液冲洗3次,用Millipore抽滤,待滤膜干燥后,加入闪烁液,在液闪计数仪上测定3H放射活性,特异性结合为总结合与非特异结合之差,结合率以每毫克蛋白pmol表示。质粒DNA实验组每管预先加入20μg pcDNA3与SR膜蛋白室温共同孵育30min,其余处理同上。
, http://www.100md.com
1.7 统计学处理
结果用
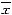 ±s表示,应用one-way ANOVA 进行统计学分析,P<0.05认为差异有显著性。
±s表示,应用one-way ANOVA 进行统计学分析,P<0.05认为差异有显著性。2 结果
2.1 骨骼肌肌质网膜纯度鉴定
SR膜制备的Ca2+-ATPase的含量较骨骼肌组织匀浆升高6.5倍 (每毫克蛋白每分nmol∶300±38 vs 40±14,P<0.01); SR膜制备的Na+-K+-ATPase及azide-ATPase的含量与骨骼肌组织匀浆相比含量均较低(每毫克蛋白每分nmol: 14±3 vs 18±6, P>0.05; 56±14 vs 115±21, P<0.05)。提示此制备的SR膜纯度较高,线粒体及质膜的污染较低。
, http://www.100md.com
2.2 质粒pcDNA3及pcDNA3/ANF对肌质网Ca2+-ATPase活性的影响
SR的Ca2+摄入主要依赖SR Ca2+-ATPase对Ca2+的主动摄取,因此我们观察了质粒DNA对SR Ca2+-ATPase活性的影响。10、20和30μg pcDNA3与50μg SR蛋白共同孵育后,SR Ca2+-ATPase活性较对照组分别升高45%,68%和109%(P<0.05,P<0.01,P<0.01); 10、20、30μg pcDNA3/ANF与50μg SR蛋白共同孵育后,SR Ca2+-ATPase活性较对照组分别升高109%,118%和145%(P<0.01, P<0.01, P<0.01)。结果如图1所示。

, http://www.100md.com
*P<0.05,**P<0.01, compared with control, n=5.
图1 质粒pcDNA3和pcDNA3/ANF对大鼠骨骼肌肌质网
Ca2+-ATPase活性的影响
Figure 1 Effect of plasmid pcDNA3 and pcDNA3/ANF
on Ca2+-ATPase activity in rat skeletal muscle sarcoplasmic reticulum
2.3 质粒pcDNA3对肌质网Ca2+释放通道ryanodine受体的影响
SR的Ca2+释放调节主要通过ryanodine受体起作用,为了进一步分析质粒DNA对SR Ca2+释放作用机制,本工作观察了质粒pcDNA3对肌质网Ca2+释放通道ryanodine受体的影响,结果发现对照组大鼠骨骼肌SR与3H-ryanodine共同孵育后,配体与受体结合反应的解离常数(Kd)为(31±5)nmol.L-1,最大结合力(Bmax)为每毫克蛋白(1 802±194) fmol; pcDNA3预处理组3H-ryanodine结合反应Kd及Bmax分别为(132±18)nmol.L-1,每毫克蛋白(3213±459)fmol,较对照组升高323.7%(P<0.01)及78.3%(P<0.01)(图2A、B)。提示质粒DNA与SR膜蛋白结合后,SR上ryanodine受体的性质发生了改变,受体功能上调,Ca2+释放能力增强。


, 百拇医药
B, ryanodine bound (fmol per mg protein); F, total ryanodine-ryanodine(fmol per mg protein), n=5
图2A,B [3H]-ryanodine与大鼠骨骼肌肌质网ryanodine受体结合的饱和曲线(A)和Scatchard plot(B)以及质粒 pcDNA3对其作用
Figure 2A,B A saturation curve (A)and a scatchard plot(B) for [3H]-ryanodine binding to SR and effects of plasmid pcDNA3
on [3H]-ryanodine binding to SR in rat skeletal muscle
, 百拇医药
3 讨论
1996年,Hagstrom等[1]首次发现家兔骨骼肌SR上存在特异的DNA结合蛋白,并证实其具有双链DNA特异性。本实验室也发现大鼠骨骼肌SR上存在特异的DNA结合蛋白[2]。骨骼肌SR在肌肉兴奋收缩耦联及调控胞浆钙稳态方面起重要作用,因此,我们进一步调查了质粒DNA与SR蛋白结合后对骨骼肌SR的主要功能-钙转运的影响,结果发现质粒DNA与SR上DNA结合蛋白结合后可以明显增加SR对钙的摄入与释放[3];SR摄取Ca2+主要依赖SR膜上Ca2+-ATPase对Ca2+的主动摄取,本研究发现质粒DNA与SR上DNA结合蛋白结合后可引起SR Ca2+-ATPase的活性明显增强,提示质粒DNA对SR钙摄入的增强作用可能是通过其增加SR Ca2+-ATPase的活性引起的。本实验随机选用两种质粒:pcDNA3作为空载体的代表,pcDNA3/ANF作为插入外源基因的嵌合质粒的代表,结果两种质粒对SR Ca2+-ATPase活性的影响相似,因此提示这种作用是DNA序列非依赖性的。
, http://www.100md.com
Ryanodine受体是位于骨骼肌肌质网终末池的足结构,一种中性植物碱ryanodine可与之结合,已经发现ryanodine受体是骨骼肌兴奋收缩耦联中Ca2+释放通道的主要结构及功能单位,它位于三联体部位,调节肌质网终末池Ca2+释放[7],本实验发现质粒DNA可使骨骼肌肌质网Ca2+释放通道ryanodine受体的亲和力下降,最大结合力升高。推测质粒DNA作用于肌质网上非核DNA结合蛋白后,可能通过某种机制影响了ryanodine受体的活性,使配基受体亲和力下降,提示受体对配基的浓度敏感性降低,受体性质发生改变;Bmax增加,ryanodine受体结合位点增多,释放能力增强,受体功能上调,这说明质粒DNA可能导致受体蛋白被修饰,从而使肌质网Ca2+释放能力增强。
Hagstrom等[1]认为,SR上存在的DNA结合蛋白实际上就是位于三联体部位的Triadin,质粒DNA是否通过与Triadin相互结合后再进一步影响SR Ca2+-ATPase及ryanodine受体的功能,有待进一步证实。
, 百拇医药
目前有关直接基因转移及基因治疗的研究报道较多,骨骼肌因其容量大,血流量丰富等优势已经成为直接基因转移并进行基因治疗的主要运载体,本室发现质粒DNA增强SR钙摄入与释放[3],刺激SR Ca2+-ATPase的活性,并可改变ryanodine受体的结合活性,这些发现提示质粒DNA进入细胞后的非目的基因表达的生物学作用,值得重视。
* 国家“八六三”高技术项目基因治疗重大课题(BH-03);国家自然科学基金(39900057)资助项目。
参考文献
1 Hagstrom JE, Rybakova IN, Wolff JA, et al. Nonnucleaer DNA binding proteins in striated muscle. Biochem Mol Med, 1996,58:113-121
, 百拇医药
2 赵 文,倪菊华,汤 健,等.大鼠骨骼肌肌质网序列非依赖性DNA结合蛋白,北京医科大学学报,1999,31(1):5-8,297-299
3 赵 文,李载权,汤 健,等.质粒DNA对大鼠骨骼肌肌质网钙转运的影响.北京医科大学学报,1999,31(4):297-299
4 Ohlendieck K, Ervasti JM, Snook JB, et al. Dystrophin-glycoprotein complex is highly enriched in isolated skeletal muscle sarcolemma. J Cell Biol ,1991,112:135-148
5 Jones LR, Besch HR Jr. Isolation of canine sarcolemmal vesicles. Meth Pharma, 1984,5:1-12
, 百拇医药
6 McGrew SG,Wolleben C, Siegl P, et al. Positive cooperativity of ryanodine binding to eh calcium release channel of sarcoplasmic reticulum from heart and skeletal muscle. Biochemistry, 1989,28:1686-1691
7 Inui M, Saito A, Fleischer S. Purification of the ryanodine receptor and identity with feet structures of junctional terminal cisternae of sarcoplasmic retuculum from fast skeletal muscle. J Biol Chem,1987, 262(4):1740-1747
(1998-11-20收稿), 百拇医药