大鼠心肌缺血的血管内皮生长因子基因治疗*
作者:刘艳秋 周爱儒 朱小君 牛大地 陈光慧 汤健
单位:刘艳秋 周爱儒 北京医科大学生物化学与分子生物学系;朱小君 牛大地 陈光慧 汤健 心血管基础研究所,北京 100083
关键词:内皮生长因子;心肌缺血;治疗;基因疗法;内皮;血管
北京医科大学学报990603 摘 要 目的:应用血管内皮生长因子(vascular endothelial growth factor, VEGF)基因治疗心肌缺血。方法:雄性Wistar大鼠20只,结扎冠状动脉前降支造成心肌梗死模型。心脏多点注射构建的pcD2/VEGF真核表达质粒。应用逆转录聚合酶链反应,VEGF免疫组织化学染色,心肌碱性磷酸酶染色及血管计数等方法检测 VEGF基因在缺血心肌中的表达及生物学作用。结果:转移VEGF基因后在大鼠缺血心肌中有VEGF mRNA高表达, VEGF 免疫组化染色可见VEGF蛋白表达水平升高。心肌碱性磷酸酶染色显示,转移VEGF基因能够促进缺血心肌新生血管的形成。结论:VEGF基因能够在大鼠缺血心肌中获得表达,并发挥其促进新血管形成的作用。为VEGF基因治疗心肌缺血奠定基础。
, http://www.100md.com
中国图书资料分类法分类号 R542.6-332
Direct gene transfer of naked DNA encoding vascular endothelial growth factor
into ischemic rat myocardium
LIU Yan-Qiu#, ZHOU Ai-Ru, ZHU Xiao-Jun, NIU Da-Di, CHEN Guang-Hui, TANG Jian
(#Department of Biochemistry and Molecular Biology, Beijing Medical University, Beijing 100083)
MeSH Endothelial growth factor Myocardial ischemia/ther Gene therapy Endothelium, vascular
, 百拇医药
ABSTRACT Objective: To investigate the efficacy of vascular endothelial growth factor (VEGF) gene therapy in the myocardial ischemia. Methods: Twenty wistar rats underwent left thoracotomy followed by the ligation of left anterior descending coronary artery. Constructed pcD2/VEGF eukaryotic expression plasmid 30 μl (10g.L-1) was directly injected into the ischemic myocardium. RT-PCR, immunohistochemistry, alkaline phosphatase staining were used to detect VEGF gene expression and biological effect. Results: High levels of VEGF mRNA and protein expression were detected. There was a significant increase in the number of vessels when compared with control group (P<0.01). Conclusion: VEGF gene application can transfect the ischemic myocardium and express VEGF protein. The VEGF gene product enhances angiogenesis and increases vessel numbers.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:489-492)
血管内皮生长因子(vascular endothelial growth factor, VEGF)是血管内皮细胞特异性的促有丝分裂原,属分泌性的糖蛋白。有促进内皮增生,增强血管通透性,加速新血管形成作用[1]。研究表明VEGF蛋白对多种组织缺血性疾病(包括肢体、心肌、脑缺血等)均具有促进侧枝循环建立,增加缺血组织血流量,改善缺血组织的功能作用[2~4]。但是VEGF蛋白价格昂贵,且在体内不稳定,极易被降解。本室与国外的研究报道,VEGF基因局部应用治疗外周梗塞性血管病已获成功[5]。而且我室的研究证实,体外培养的大鼠原代心肌细胞能被VEGF基因转染,并能表达出有活性的VEGF蛋白。这为在体动物实验奠定了基础。本实验应用pcD2/VEGF真核表达质粒直接注射入大鼠缺血心肌,探讨VEGF基因对心肌缺血的治疗作用。
, 百拇医药
1 材料与方法
1.1 pcD2/VEGF真核表达质粒的构建、提取及酶切鉴定
将我室构建的pcDNA3/VEGF真核表达质粒经BamHⅠ和XbaⅠ双酶切后与经过相同酶切的pcD2 高效真核表达载体连接,构建成pcD2/VEGF真核表达质粒。其目的基因编码121个氨基酸的VEGF121,其上游含CMV启动子,下游为多聚腺苷酸尾。将构建的pcD2/VEGF转化大肠杆菌DH5α,扩增,碱裂解法大量提取质粒,QUAGEN tip10000柱纯化。紫外分光光度计测定D260/D280在1.8以上。BamHⅠ和XbaⅠ酶切鉴定。
1.2 动物模型的制作及基因的导入
, http://www.100md.com
雄性Wistar大鼠体重约200 g(北京医科大学动物中心提供) 20只,乙醚麻醉,在心尖搏动最强处剪开皮肤,用止血钳扩开胸廓,中指按压在胸骨上,拇指和食指同时用力挤出心脏。在距冠状动脉(冠脉)前降支根部1 cm处结扎冠脉前降支,心前区立即变紫。大鼠分为注射pcD2/VEGF 质粒组和注射pcD2空载质粒组,前者立即在缺血区分3点注射pcD2/VEGF 质粒30 μl (10 g.L-1),后者立即注射同等体积及(质量)浓度的pcD2空载质粒。所有这些操作要迅速,应尽可能减少心脏暴露在体外的时间。迅速将心脏纳入胸腔,按压胸部,使其恢复自主呼吸后逐层缝合。放回笼中,精心饲养。
1.3 检测VEGF基因mRNA水平的表达
术后分别在3,7,14 d将大鼠断头处死取出心脏,Trizol 试剂盒提取RNA,紫外分光光度计定量,凝胶电泳判断无降解。取5 μl进行逆转录后各取2.5 μl进行PCR反应,GAPDH为内参照。VEGF正义引物序列为:5′-GGGGGATCCGCCTCCGA-
, http://www.100md.com
AACCATGAACTT-3′,反义引物序列为:5′-CCCGAATTCTCCTGGTGAGAGATCTGGTT-3′,扩增长度为550 bp 。GAPDH的正义引物序列为:5′-TCCCTCAAGATTGTCAGCAA-3′,反义引物序列为:5′-AGATCCACAACGGATACATT-3′,扩增长度为309 bp。PCR反应体系为50 μl。反应条件为:94℃,预变性5min,然后94℃, 30s;55℃,45s;72℃,55s,35个循环;72℃,延伸5min。取10μl PCR产物上样,8 g.L-1的琼脂糖凝胶电泳。
1.4 VEGF蛋白表达的免疫组织化学染色
大鼠术后7、14 d,分别给予6 g.L-1戊巴比妥钠麻醉,取出心脏,剪下注射部位组织,OCT包埋,液氮速冻1 min。恒冷切片机切片,冰冻切片厚8 μm,行免疫组织化学染色。VEGF多克隆抗体及免疫组化检测试剂盒购自中山生物技术有限公司,免疫组化步骤按试剂盒说明书进行。
, 百拇医药
1.5 心肌碱性磷酸酶染色
大鼠术后7、14 d分别取材,方法同步骤1.4。冰冻切片厚8 μm,放入碱性磷酸酶染液中37℃,5 min后镜下可见黑色颗粒出现,自来水冲洗终止染色,伊红复染,此时心肌呈粉红色,血管呈紫蓝色。镜下观察,每组标本随机选取10个高倍视野(10×40)计数血管数。所用试剂均购自北京经科化学试剂经营公司。
1.6 统计分析
两组样本的比较采用双侧t检验,数据用( ±s)表示。
±s)表示。
2 结果
2.1 pcD2/VEGF真核表达质粒的酶切鉴定
pcD2/VEGF真核表达质粒经双酶切后在λDNA/HindⅢ markers的564 bp处有一清晰条带出现,此即为约550 bp的VEGF cDNA条带,而pcD2空载质粒经双酶切后则无此条带出现。
, 百拇医药
2.2 VEGF基因在大鼠缺血心肌中的表达
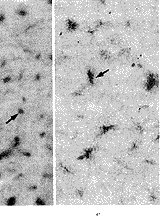
转基因后3、7、14 d时RT-PCR结果证实VEGF基因成功转染大鼠缺血心肌。注射VEGF基因的大鼠3 d即有VEGF mRNA表达,7 d表达升高,14 d表达最高。相比之下,注射空载质粒的大鼠3 d未检测出mRNA水平的表达,7 d有少量表达,14 d较7 d稍增加(图1)。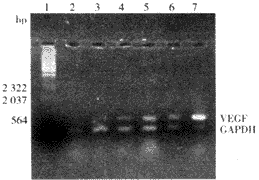
1,λDNA/HindⅢ markers; 2, rat transfceted with pcD2 vector at 3 days; 3, rat transfceted with pcD2/VEGF at 3 days; 4, rat transfceted with pcD2 vector at 7 days; 5, rat transfceted with pcD2/VEGF at 7 days; 6, rat transfceted with pcD2 vector at 14 days; 7, rat transfceted with pcD2/VEGF at 14 days.
, 百拇医药
图1 RT-PCR显示转基因后3、7、14 d时缺血心肌VEGF mRNA表达水平
Figure 1 Time course of human VEGF gene expression
at mRNA level from day 3 through day 14 after transfection
2.3 VEGF蛋白表达水平
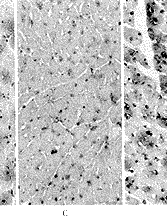
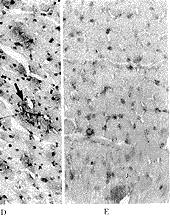
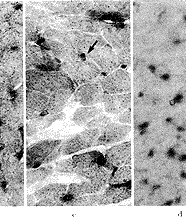
VEGF蛋白的免疫组织化学结果显示,正常心肌细胞中几乎检测不到VEGF免疫反应阳性颗粒。转移VEGF基因7 d的大鼠心肌细胞胞浆中出现棕黄色VEGF免疫反应阳性颗粒,而转移pcD2空载质粒的心肌细胞中很少有免疫反应阳性颗粒。转VEGF基因14 d的大鼠心肌细胞中VEGF免疫反应阳性更强,而转pcD2空载质粒的心肌细胞VEGF免疫反应阳性仍很弱(图2)。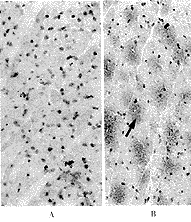
, 百拇医药
A, In normal rat myocardium, weak immunoreactivity for VEGF was observed; B, At 7 days after transfected with pcD2/VEGF, significant immunoreactivity for VEGF was observed; C, At 7 days after transfected with pcD2 vector, only slight staining for VEGF was observed; D, At 14 days after transfected with pcD2/VEGF, strong immunoreactivity for VEGF was observed; E, At 14 days after transfected with pcD2 vector, only slight staining for VEGF was observed.
, 百拇医药
图2 转基因后7 d、14 d时缺血心肌中VEGF蛋白(棕色颗粒表明VEGF蛋白免疫反应阳性)×50
Figure 2 Immunohistochemical detection of VEGF in the ischemic myocardium
at 7 days and 14 days after transfection. Brown staining indicates the presence of VEGF-positive myocardial fibers ×50
2.4 VEGF基因促进缺血心肌中新生血管的形成
正常大鼠心肌碱性磷酸酶染色可见心肌形态规则,呈紫蓝色颗粒的血管均匀分布。转移pcD2空载质粒7 d的缺血心肌中血管明显较少,而且分布不均,14 d稍有改善;转移VEGF基因7 d的缺血心肌血管数明显高于转移pcD2空载质粒组,14 d血管数进一步增加(图3)。毛细血管计数也可见这一差别。正常心肌的毛细血管计数为每高倍视野380个,转空载质粒7 d为100个,转VEGF基因7 d为150个,转空载质粒14 d为120个,转VEGF基因14 d为280个。可见7 d、14 d时转VEGF基因组毛细血管计数值均明显高于转空载质粒组,并具有统计学意义(n=10, P<0.01)。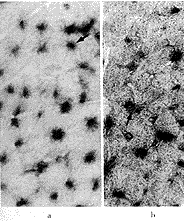
, 百拇医药
a, normal rat myocardium; b, rat transfceted with pcD2/VEGF at 7 days; c, rat transfceted with pcD2 vector at 7 days; d, rat transfceted with pcD2/VEGF at 14 days; e, rat transfceted with pcD2 vector at 14 days.
图3 转基因后7 d、14 d时缺血心肌的碱性磷酸酶染色显示新生血管形成(深蓝色颗粒显示毛细血管)×100
Figure 3 Alkaline phosphatase staining of ischemic myocardium. Dark-blue-stained dots indicate capillaries(counterstained with eosin)×100
, 百拇医药
3 讨论
血管内皮生长因子是内皮细胞特异性的促有丝分裂原,属分泌性的糖蛋白。有促进内皮增生,增强血管通透性,加速新血管形成作用[1]。VEGF通过与其受体flt-1和KDR结合而发挥生物学作用。内皮细胞增生是新血管形成的始动因素。体外培养的原代心肌细胞在缺氧时VEGF mRNA和蛋白表达水平上调。在体实验研究发现心肌缺血时VEGF表达也上调。可见VEGF不仅在正常生理条件下对新血管形成起调节作用,而且对病理状态下的新血管形成起调节作用。
Hariawala等[3]用导管将VEGF蛋白注入慢性心肌缺血的狗或猪冠脉内,能够观察到供应缺血心肌的侧枝血流量的改善。虽然VEGF蛋白能增加缺血心肌血供、改善心功能,但是VEGF蛋白价格昂贵,且在体内不稳定,极易被降解,不具备临床应用的可行性。我室及国外研究报道,VEGF基因治疗外周肢体梗塞性血管病已获成功[5]。近来我室应用VEGF基因治疗大鼠实验性脑缺血也获得理想效果[6]。因此,探讨VEGF基因治疗心肌缺血可行性将非常有意义。
, 百拇医药
美国Isner实验室给5例不同程度心肌缺血病人心肌直接注射编码VEGF165的单纯质粒,病人心绞痛均有改善[7]。但是未见其有完整的动物实验报道。目前,心脏基因治疗中,除目的基因的选择外,载体的选择及基因转移途径仍是关键问题。Aoki等[8]用HVJ(Hemagglutinating Virus of Japan)-Liposome 介导报告基因注射入大鼠缺血心肌,获得基因表达。Kaplitt等[9]将含LacZ基因的AAV(腺病毒辅助病毒)直接注射入大鼠心脏,在注射后2个月仍有表达。将此病毒经导管注入狗冠脉,在心肌细胞中获得基因表达,并持续了6个月。有研究者将携带VEGF165cDNA的Ⅰ型HSV(单纯疱疹病毒)体外转染成纤维细胞后,将转染细胞植入小鼠皮下,可见促进新生血管形成作用。Mack等[10]采用开胸直接注射法将带有VEGF121的复制缺陷型腺病毒直接注射入缺血猪心肌中,起到促进侧枝形成,改善心功能的作用。但这些方法都不可避免地存在病毒播散可能性,免疫原性及潜在的毒副作用。
, 百拇医药
本研究使用单纯pcD2/VEGF121真核表达质粒直接注射入大鼠的缺血心肌中,这就克服了上述各种载体的缺点,加之VEGF121蛋白为完全分泌性糖蛋白,细胞中表达的VEGF蛋白能分泌到胞外与其特异性受体结合发挥生物学作用。因此即使只能表达少量VEGF蛋白也能取得理想的生物学效应。本研究的结果证实单纯pcD2/VEGF真核表达质粒能够在大鼠缺血心肌中表达出VEGF蛋白,并起到促进缺血心肌新生血管形成作用。
* 国家863计划生物技术资助项目(BH-03),高等学校博士点专项科研资金资助课题。
参考文献
1 Leung DW, Cachiance G, Kuang WJ, et al. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science, 1989, 246:1306-1309
, 百拇医药
2 Takeshita S, Zheng LP, Brogi E, et al. Therapeautic angiogenesis: A single intraartery blous of vascular endothelial growth factor augments revascularization in a rabbit ischemic hind limb model. J Clin Invest, 1994,93:662-670
3 Hariawala MD, Horowitz JR, Esakof D, et al. VEGF improves myocardial blood flow but produces EDRF-mediated hypotension in porcine hearts. J Surg Res, 1996,63:77-82
4 Hayashi T, Abe K, Itoyama Y. Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia. J Cereb Blood Flow Metab, 1998,18:887-895
, 百拇医药
5 Isner JM, Piecezk A, Schainfeld R, et al. Clinical evidence of angiogenesis after arterial gene transfer of phVEGF165 in patients with ischemic limb. Lancet, 1996,348:370-374
6 刘艳秋,周爱儒,牛大地,等.血管内皮生长因子基因治疗大鼠脑缺血的实验研究.中国生物化学与分子生物学报,1999,15(5):681-686
7 Losordo DW, Vale PR, Symes JM, et al. Gene therapy for myocardial angiogenesis, initial clinical results with direct myocardial injection of phVEGF165 as sole therapy for myocardial ischemia. Circulation, 1998,98:2800-2804
, 百拇医药
8 Aoki M, Morishita R, Muraishi A, et al. Efficient in vivo gene transfer into the heart in the rat myocardial infarction model using the HVJ (Hemagglutinating Virus of Japan)-Liposome method. J Mol Cell Cardiol,1997,29:949-959
9 Kaplitt MG, Xiao X, Samulski RJ, et al. Long-term gene transfer in porcine myocardium after coronary infusion of an adeno-asssociated virus vector. Ann Thorac Surg, 1996,62:1669-1672
10 Mack CA, Patel SR, Schwarz EA, et al. Biological bypass with the use of adenovirus-mediated gene transfer of the complementary deoxyribonucleic acid for vascular endothelial growth factor121 improves myocardial perfusion and function in the ischemic porcine heart. J Thorac Cardiovasc Surg, 1998,115:168-177
(1999-07-20收稿), 百拇医药
单位:刘艳秋 周爱儒 北京医科大学生物化学与分子生物学系;朱小君 牛大地 陈光慧 汤健 心血管基础研究所,北京 100083
关键词:内皮生长因子;心肌缺血;治疗;基因疗法;内皮;血管
北京医科大学学报990603 摘 要 目的:应用血管内皮生长因子(vascular endothelial growth factor, VEGF)基因治疗心肌缺血。方法:雄性Wistar大鼠20只,结扎冠状动脉前降支造成心肌梗死模型。心脏多点注射构建的pcD2/VEGF真核表达质粒。应用逆转录聚合酶链反应,VEGF免疫组织化学染色,心肌碱性磷酸酶染色及血管计数等方法检测 VEGF基因在缺血心肌中的表达及生物学作用。结果:转移VEGF基因后在大鼠缺血心肌中有VEGF mRNA高表达, VEGF 免疫组化染色可见VEGF蛋白表达水平升高。心肌碱性磷酸酶染色显示,转移VEGF基因能够促进缺血心肌新生血管的形成。结论:VEGF基因能够在大鼠缺血心肌中获得表达,并发挥其促进新血管形成的作用。为VEGF基因治疗心肌缺血奠定基础。
, http://www.100md.com
中国图书资料分类法分类号 R542.6-332
Direct gene transfer of naked DNA encoding vascular endothelial growth factor
into ischemic rat myocardium
LIU Yan-Qiu#, ZHOU Ai-Ru, ZHU Xiao-Jun, NIU Da-Di, CHEN Guang-Hui, TANG Jian
(#Department of Biochemistry and Molecular Biology, Beijing Medical University, Beijing 100083)
MeSH Endothelial growth factor Myocardial ischemia/ther Gene therapy Endothelium, vascular
, 百拇医药
ABSTRACT Objective: To investigate the efficacy of vascular endothelial growth factor (VEGF) gene therapy in the myocardial ischemia. Methods: Twenty wistar rats underwent left thoracotomy followed by the ligation of left anterior descending coronary artery. Constructed pcD2/VEGF eukaryotic expression plasmid 30 μl (10g.L-1) was directly injected into the ischemic myocardium. RT-PCR, immunohistochemistry, alkaline phosphatase staining were used to detect VEGF gene expression and biological effect. Results: High levels of VEGF mRNA and protein expression were detected. There was a significant increase in the number of vessels when compared with control group (P<0.01). Conclusion: VEGF gene application can transfect the ischemic myocardium and express VEGF protein. The VEGF gene product enhances angiogenesis and increases vessel numbers.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:489-492)
血管内皮生长因子(vascular endothelial growth factor, VEGF)是血管内皮细胞特异性的促有丝分裂原,属分泌性的糖蛋白。有促进内皮增生,增强血管通透性,加速新血管形成作用[1]。研究表明VEGF蛋白对多种组织缺血性疾病(包括肢体、心肌、脑缺血等)均具有促进侧枝循环建立,增加缺血组织血流量,改善缺血组织的功能作用[2~4]。但是VEGF蛋白价格昂贵,且在体内不稳定,极易被降解。本室与国外的研究报道,VEGF基因局部应用治疗外周梗塞性血管病已获成功[5]。而且我室的研究证实,体外培养的大鼠原代心肌细胞能被VEGF基因转染,并能表达出有活性的VEGF蛋白。这为在体动物实验奠定了基础。本实验应用pcD2/VEGF真核表达质粒直接注射入大鼠缺血心肌,探讨VEGF基因对心肌缺血的治疗作用。
, 百拇医药
1 材料与方法
1.1 pcD2/VEGF真核表达质粒的构建、提取及酶切鉴定
将我室构建的pcDNA3/VEGF真核表达质粒经BamHⅠ和XbaⅠ双酶切后与经过相同酶切的pcD2 高效真核表达载体连接,构建成pcD2/VEGF真核表达质粒。其目的基因编码121个氨基酸的VEGF121,其上游含CMV启动子,下游为多聚腺苷酸尾。将构建的pcD2/VEGF转化大肠杆菌DH5α,扩增,碱裂解法大量提取质粒,QUAGEN tip10000柱纯化。紫外分光光度计测定D260/D280在1.8以上。BamHⅠ和XbaⅠ酶切鉴定。
1.2 动物模型的制作及基因的导入
, http://www.100md.com
雄性Wistar大鼠体重约200 g(北京医科大学动物中心提供) 20只,乙醚麻醉,在心尖搏动最强处剪开皮肤,用止血钳扩开胸廓,中指按压在胸骨上,拇指和食指同时用力挤出心脏。在距冠状动脉(冠脉)前降支根部1 cm处结扎冠脉前降支,心前区立即变紫。大鼠分为注射pcD2/VEGF 质粒组和注射pcD2空载质粒组,前者立即在缺血区分3点注射pcD2/VEGF 质粒30 μl (10 g.L-1),后者立即注射同等体积及(质量)浓度的pcD2空载质粒。所有这些操作要迅速,应尽可能减少心脏暴露在体外的时间。迅速将心脏纳入胸腔,按压胸部,使其恢复自主呼吸后逐层缝合。放回笼中,精心饲养。
1.3 检测VEGF基因mRNA水平的表达
术后分别在3,7,14 d将大鼠断头处死取出心脏,Trizol 试剂盒提取RNA,紫外分光光度计定量,凝胶电泳判断无降解。取5 μl进行逆转录后各取2.5 μl进行PCR反应,GAPDH为内参照。VEGF正义引物序列为:5′-GGGGGATCCGCCTCCGA-
, http://www.100md.com
AACCATGAACTT-3′,反义引物序列为:5′-CCCGAATTCTCCTGGTGAGAGATCTGGTT-3′,扩增长度为550 bp 。GAPDH的正义引物序列为:5′-TCCCTCAAGATTGTCAGCAA-3′,反义引物序列为:5′-AGATCCACAACGGATACATT-3′,扩增长度为309 bp。PCR反应体系为50 μl。反应条件为:94℃,预变性5min,然后94℃, 30s;55℃,45s;72℃,55s,35个循环;72℃,延伸5min。取10μl PCR产物上样,8 g.L-1的琼脂糖凝胶电泳。
1.4 VEGF蛋白表达的免疫组织化学染色
大鼠术后7、14 d,分别给予6 g.L-1戊巴比妥钠麻醉,取出心脏,剪下注射部位组织,OCT包埋,液氮速冻1 min。恒冷切片机切片,冰冻切片厚8 μm,行免疫组织化学染色。VEGF多克隆抗体及免疫组化检测试剂盒购自中山生物技术有限公司,免疫组化步骤按试剂盒说明书进行。
, 百拇医药
1.5 心肌碱性磷酸酶染色
大鼠术后7、14 d分别取材,方法同步骤1.4。冰冻切片厚8 μm,放入碱性磷酸酶染液中37℃,5 min后镜下可见黑色颗粒出现,自来水冲洗终止染色,伊红复染,此时心肌呈粉红色,血管呈紫蓝色。镜下观察,每组标本随机选取10个高倍视野(10×40)计数血管数。所用试剂均购自北京经科化学试剂经营公司。
1.6 统计分析
两组样本的比较采用双侧t检验,数据用(
 ±s)表示。
±s)表示。2 结果
2.1 pcD2/VEGF真核表达质粒的酶切鉴定
pcD2/VEGF真核表达质粒经双酶切后在λDNA/HindⅢ markers的564 bp处有一清晰条带出现,此即为约550 bp的VEGF cDNA条带,而pcD2空载质粒经双酶切后则无此条带出现。
, 百拇医药
2.2 VEGF基因在大鼠缺血心肌中的表达
转基因后3、7、14 d时RT-PCR结果证实VEGF基因成功转染大鼠缺血心肌。注射VEGF基因的大鼠3 d即有VEGF mRNA表达,7 d表达升高,14 d表达最高。相比之下,注射空载质粒的大鼠3 d未检测出mRNA水平的表达,7 d有少量表达,14 d较7 d稍增加(图1)。

1,λDNA/HindⅢ markers; 2, rat transfceted with pcD2 vector at 3 days; 3, rat transfceted with pcD2/VEGF at 3 days; 4, rat transfceted with pcD2 vector at 7 days; 5, rat transfceted with pcD2/VEGF at 7 days; 6, rat transfceted with pcD2 vector at 14 days; 7, rat transfceted with pcD2/VEGF at 14 days.
, 百拇医药
图1 RT-PCR显示转基因后3、7、14 d时缺血心肌VEGF mRNA表达水平
Figure 1 Time course of human VEGF gene expression
at mRNA level from day 3 through day 14 after transfection
2.3 VEGF蛋白表达水平
VEGF蛋白的免疫组织化学结果显示,正常心肌细胞中几乎检测不到VEGF免疫反应阳性颗粒。转移VEGF基因7 d的大鼠心肌细胞胞浆中出现棕黄色VEGF免疫反应阳性颗粒,而转移pcD2空载质粒的心肌细胞中很少有免疫反应阳性颗粒。转VEGF基因14 d的大鼠心肌细胞中VEGF免疫反应阳性更强,而转pcD2空载质粒的心肌细胞VEGF免疫反应阳性仍很弱(图2)。



, 百拇医药
A, In normal rat myocardium, weak immunoreactivity for VEGF was observed; B, At 7 days after transfected with pcD2/VEGF, significant immunoreactivity for VEGF was observed; C, At 7 days after transfected with pcD2 vector, only slight staining for VEGF was observed; D, At 14 days after transfected with pcD2/VEGF, strong immunoreactivity for VEGF was observed; E, At 14 days after transfected with pcD2 vector, only slight staining for VEGF was observed.
, 百拇医药
图2 转基因后7 d、14 d时缺血心肌中VEGF蛋白(棕色颗粒表明VEGF蛋白免疫反应阳性)×50
Figure 2 Immunohistochemical detection of VEGF in the ischemic myocardium
at 7 days and 14 days after transfection. Brown staining indicates the presence of VEGF-positive myocardial fibers ×50
2.4 VEGF基因促进缺血心肌中新生血管的形成
正常大鼠心肌碱性磷酸酶染色可见心肌形态规则,呈紫蓝色颗粒的血管均匀分布。转移pcD2空载质粒7 d的缺血心肌中血管明显较少,而且分布不均,14 d稍有改善;转移VEGF基因7 d的缺血心肌血管数明显高于转移pcD2空载质粒组,14 d血管数进一步增加(图3)。毛细血管计数也可见这一差别。正常心肌的毛细血管计数为每高倍视野380个,转空载质粒7 d为100个,转VEGF基因7 d为150个,转空载质粒14 d为120个,转VEGF基因14 d为280个。可见7 d、14 d时转VEGF基因组毛细血管计数值均明显高于转空载质粒组,并具有统计学意义(n=10, P<0.01)。



, 百拇医药
a, normal rat myocardium; b, rat transfceted with pcD2/VEGF at 7 days; c, rat transfceted with pcD2 vector at 7 days; d, rat transfceted with pcD2/VEGF at 14 days; e, rat transfceted with pcD2 vector at 14 days.
图3 转基因后7 d、14 d时缺血心肌的碱性磷酸酶染色显示新生血管形成(深蓝色颗粒显示毛细血管)×100
Figure 3 Alkaline phosphatase staining of ischemic myocardium. Dark-blue-stained dots indicate capillaries(counterstained with eosin)×100
, 百拇医药
3 讨论
血管内皮生长因子是内皮细胞特异性的促有丝分裂原,属分泌性的糖蛋白。有促进内皮增生,增强血管通透性,加速新血管形成作用[1]。VEGF通过与其受体flt-1和KDR结合而发挥生物学作用。内皮细胞增生是新血管形成的始动因素。体外培养的原代心肌细胞在缺氧时VEGF mRNA和蛋白表达水平上调。在体实验研究发现心肌缺血时VEGF表达也上调。可见VEGF不仅在正常生理条件下对新血管形成起调节作用,而且对病理状态下的新血管形成起调节作用。
Hariawala等[3]用导管将VEGF蛋白注入慢性心肌缺血的狗或猪冠脉内,能够观察到供应缺血心肌的侧枝血流量的改善。虽然VEGF蛋白能增加缺血心肌血供、改善心功能,但是VEGF蛋白价格昂贵,且在体内不稳定,极易被降解,不具备临床应用的可行性。我室及国外研究报道,VEGF基因治疗外周肢体梗塞性血管病已获成功[5]。近来我室应用VEGF基因治疗大鼠实验性脑缺血也获得理想效果[6]。因此,探讨VEGF基因治疗心肌缺血可行性将非常有意义。
, 百拇医药
美国Isner实验室给5例不同程度心肌缺血病人心肌直接注射编码VEGF165的单纯质粒,病人心绞痛均有改善[7]。但是未见其有完整的动物实验报道。目前,心脏基因治疗中,除目的基因的选择外,载体的选择及基因转移途径仍是关键问题。Aoki等[8]用HVJ(Hemagglutinating Virus of Japan)-Liposome 介导报告基因注射入大鼠缺血心肌,获得基因表达。Kaplitt等[9]将含LacZ基因的AAV(腺病毒辅助病毒)直接注射入大鼠心脏,在注射后2个月仍有表达。将此病毒经导管注入狗冠脉,在心肌细胞中获得基因表达,并持续了6个月。有研究者将携带VEGF165cDNA的Ⅰ型HSV(单纯疱疹病毒)体外转染成纤维细胞后,将转染细胞植入小鼠皮下,可见促进新生血管形成作用。Mack等[10]采用开胸直接注射法将带有VEGF121的复制缺陷型腺病毒直接注射入缺血猪心肌中,起到促进侧枝形成,改善心功能的作用。但这些方法都不可避免地存在病毒播散可能性,免疫原性及潜在的毒副作用。
, 百拇医药
本研究使用单纯pcD2/VEGF121真核表达质粒直接注射入大鼠的缺血心肌中,这就克服了上述各种载体的缺点,加之VEGF121蛋白为完全分泌性糖蛋白,细胞中表达的VEGF蛋白能分泌到胞外与其特异性受体结合发挥生物学作用。因此即使只能表达少量VEGF蛋白也能取得理想的生物学效应。本研究的结果证实单纯pcD2/VEGF真核表达质粒能够在大鼠缺血心肌中表达出VEGF蛋白,并起到促进缺血心肌新生血管形成作用。
* 国家863计划生物技术资助项目(BH-03),高等学校博士点专项科研资金资助课题。
参考文献
1 Leung DW, Cachiance G, Kuang WJ, et al. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science, 1989, 246:1306-1309
, 百拇医药
2 Takeshita S, Zheng LP, Brogi E, et al. Therapeautic angiogenesis: A single intraartery blous of vascular endothelial growth factor augments revascularization in a rabbit ischemic hind limb model. J Clin Invest, 1994,93:662-670
3 Hariawala MD, Horowitz JR, Esakof D, et al. VEGF improves myocardial blood flow but produces EDRF-mediated hypotension in porcine hearts. J Surg Res, 1996,63:77-82
4 Hayashi T, Abe K, Itoyama Y. Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia. J Cereb Blood Flow Metab, 1998,18:887-895
, 百拇医药
5 Isner JM, Piecezk A, Schainfeld R, et al. Clinical evidence of angiogenesis after arterial gene transfer of phVEGF165 in patients with ischemic limb. Lancet, 1996,348:370-374
6 刘艳秋,周爱儒,牛大地,等.血管内皮生长因子基因治疗大鼠脑缺血的实验研究.中国生物化学与分子生物学报,1999,15(5):681-686
7 Losordo DW, Vale PR, Symes JM, et al. Gene therapy for myocardial angiogenesis, initial clinical results with direct myocardial injection of phVEGF165 as sole therapy for myocardial ischemia. Circulation, 1998,98:2800-2804
, 百拇医药
8 Aoki M, Morishita R, Muraishi A, et al. Efficient in vivo gene transfer into the heart in the rat myocardial infarction model using the HVJ (Hemagglutinating Virus of Japan)-Liposome method. J Mol Cell Cardiol,1997,29:949-959
9 Kaplitt MG, Xiao X, Samulski RJ, et al. Long-term gene transfer in porcine myocardium after coronary infusion of an adeno-asssociated virus vector. Ann Thorac Surg, 1996,62:1669-1672
10 Mack CA, Patel SR, Schwarz EA, et al. Biological bypass with the use of adenovirus-mediated gene transfer of the complementary deoxyribonucleic acid for vascular endothelial growth factor121 improves myocardial perfusion and function in the ischemic porcine heart. J Thorac Cardiovasc Surg, 1998,115:168-177
(1999-07-20收稿), 百拇医药