人宫颈癌传代细胞Ig样蛋白的纯化分析
作者:王东升 邱晓彦 朱晓辉 吕蓬 姜南 吕平 张玲 张岩 高晓明
单位:北京大学基础医学院免疫学系,北京 100083
关键词:HeLa细胞;Ig样蛋白;IGG;宫颈肿瘤;分子结构
北京医科大学学报000407 [摘 要] 目的:探讨非造血系统来源的恶性肿瘤细胞内Ig样蛋白与Ig分子在抗原性及分子结构上的关系。方法:应用亲和层析的方法将HeLa MR(人宫颈癌传代细胞)细胞内Ig样蛋白进行了纯化;并以SDS-PAGE及Western Blot方法将Ig样蛋白与IgG进行比较分析。结果:SDS-PAGE结果显示Ig样蛋白既有与IgG相近的轻、重链泳带,同时又分别在相对分子质量6 600、7 000左右出现两条泳带,此两条泳带与人IgG具有高度一致的抗原性。Western Blot结果显示,Ig样蛋白与IgG相同,不但可与抗人IgG多克隆抗体、单克隆抗体反应而且可与Protein A蛋白发生反应。结论:Ig样蛋白与IgG比较在抗原性上具有明显的一致性,而在分子结构上也表现明显相似性,但二者不完全相同。
, 百拇医药
[中图分类号] R737.33 [文献标识码] A [文章编号] 1000-1530(2000)04-0310-03
Purification and Western -blot analysis of Ig-like protein
from cervical cancer cell line
WANG Dong-Sheng
(Department of Immunology, Peking University, Beijing 100083, China)
QIU Xiao-Yan
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHU Xiao-Hui
(Department of Immunology, Peking University, Beijing 100083, China)
LU Peng
(Department of Immunology, Peking University, Beijing 100083, China)
JIANG Nan
(Department of Immunology, Peking University, Beijing 100083, China)
LV Ping
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHANG Ling
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Yan
(Department of Immunology, Peking University, Beijing 100083, China)
GAO Xiao-Ming
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
, 百拇医药
To characterise the Ig-like protein in non-hematopietic tumor cell lines. Methods: Western-blot and affinity chromatography methods were used to purify and analyze the proteins in cytoplasm of tumor cell lines. The Ig-like protein was purified by affinity chromatography using staphylococal protein G and goat anti-human IgG column. Results: SDS-PAGE indicated that Ig-like protein had not only the counterpart of the IgG heavy and light chain but also some specific bands molecular weight of 4 500, 6 600, 7 000. Western Blot analysis indicated that all the bands especially the 6 600 and 7 000 bands could react to anti-human IgG polyantibodies, anti-human IgG Mab and protein A. Conclusion: Protein purified by affinity chromatography showed high likeness with Ig protein. A conclusion can be drawn that Ig-like protein did exist in non-hematopietic tumor cell line.
, 百拇医药
KEY WORDS HeLa cells; Ig-like protein; IgG; Cervix neoplasms; Molecular structure
(J Beijing Med Univ, 2000,32:310-312)
在前期工作中,我们发现在多种上皮性肿瘤细胞内存在一种与Ig抗原性相同的物质[1~3],为了探讨这种Ig样物质在结构上是否与Ig相同,还是与Ig具有相同抗原性的另一种物质。我们首先筛选出一个Ig样蛋白高表达的上皮性肿瘤传代细胞系HeLa MR,对其大量培养后,提取、纯化其Ig样蛋白,并将其同IgG进行比较分析。
1 材料与方法
1.1 材料
HeLa MR为本实验室传代培养细胞;Protein G-Sepharose4B 购自Pharmacia公司;羊抗人IgG(解放军农牧大学赠送;血清双扩散效价1∶128)Sepharose 4B购自SIGMA公司;羊抗人IgG-HRP、Protein A-HRP、 羊抗鼠-HRP购自Pharmacia公司。 抗人IgG重、轻链单克隆抗体购自北京邦定公司;羊抗人IgG-Sepharose4B亲和层析柱由本室制备。BSA购自SIGMA公司。
, 百拇医药
1.2 方法
细胞培养: HeLa MR肿瘤传代细胞培养于含10%(体积分数)小牛血清的DMEM培养基,5%(体积分数)CO2、37℃培养。
HeLa MR胞浆蛋白的提取及Ig样蛋白的纯化:收集6×108~8×108细胞,以0.1 mol.L-1 PBS洗两遍,以三去污缓冲液裂解法于冰浴中30 min裂解细胞、释放胞浆蛋白,15 000×g、于4℃离心30 min,取上清,测蛋白浓度后进行纯化。Ig样蛋白的纯化按常规方法。
SDS-PAGE及Western Blot分析:以IgG做为阳性对照,将各样品用100 g.L-1的聚丙烯酰胺凝胶进行不连续的SDS-PAGE,然后进行考马斯亮蓝染色;或在SDS-PAGE 后,用电转移系统于电压100 V,在1.5 h内将蛋白转移到硝酸纤维素膜上,经1%(质量分数)BSA封闭1 h后分别用羊抗人IgG-HRP、Protein A-HRP进行直接法染色;用抗人IgG重,轻链单克隆抗体做为一抗、羊抗鼠-HRP作为二抗进行间接法染色。即用Western-blot方法对Ig样蛋白与人IgG进行比较分析。
, 百拇医药
2 结果
亲和层析纯化Ig样蛋白的结果:以羊抗人IgG-Sepharose 4B亲和层析柱及Protein G-Sepharose4B亲和层析柱纯化HeLa MR Ig样蛋白,在以甘氨酸缓冲液洗脱时发现,两种亲和柱都在洗脱约5 min,pH降至5.0左右时出现一个较明显的蛋白吸收峰(图 1)。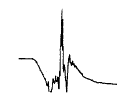
图1 Protein-G蛋白层析柱纯化蛋白的吸收光谱(280 nm)
Figure 1 Absorption spectrum of purified protein
from protein-G column
SDS-PAGE分析结果:纯化后的蛋白经SDS-PAGE、考马斯亮蓝染色发现,Ig样蛋白既有与IgG重链(5 500)、轻链(2 500)相对分子质量相似的两条泳带,也有相对分子质量在4 500、6 600及7 000左右的3条泳带。未变性样品与人IgG未变性样品在相同位置出现条带。Western Blot分析表明:(1)羊抗人IgG-HRP染色发现,与IgG分子比较,Ig样蛋白样品除在5 500、2 500位置上与IgG一样出现阳性反应外,在相对分子质量4 500、6 600和7 000左右的位置均发生阳性反应(图2);(2)Protein A-HRP检测发现,Ig样蛋白与IgG一样,只在部分尚存的完整IgG 分子位置出现明显的阳性信号,而轻、重链位置均未见阳性反应(图3);(3)以抗人IgG轻、重链单克隆抗体进行间接法检测,则可在相对分子质量2 500、6 600、9 000左右出现清楚的阳性泳带(图4)。用Non-denature聚丙烯酰胺电泳后转膜,进行Western Blot检验,其反应特性与IgG高度一致(图5)。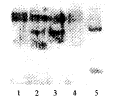
, 百拇医药
1,2,3,4, purified protein from protein-G column; 5, human IgG.
图2 Westem-blot以HRP标记羊抗人IgG多抗染色
Figure 2 Western-blot stained with HRP labeled goat anti human IgG
1, human IgG; 2,3, purified protein from protein-G column;
4, rotein purified with goat anti human IgG.
图3 Western-blot以HRP-SPA染色
, 百拇医药
Figure 3 Western-blot stained with HRP-SPA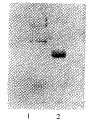
1, purified protein from protein-G column; 2, human IgG.
图4 Western-blot以抗人IgG单抗为第一抗体,以HRP标记羊抗鼠IgG为第二抗体进行间接法染色
Figure 4 Western-blot use anti human IgG Mab as the first
antibody and stained with HRP labeled goat
anti mice IgG as the second antibody
, http://www.100md.com
1, human IgG; 2, protein purified with protein-G column.
图5 非变性电泳后以HRP标记的羊抗人
IgG染色做Western-blot
Figure 5 Western-blot after non-denature electrophoresis
stained with goat anti human IgG
3 讨论
我们曾用免疫组织化学方法发现在多种上皮性恶性肿瘤细胞内存在一种与Ig抗原性相同的物质[1,2],并通过无血清培养HeLa MR细胞,检测培养上清中及胞浆内这种Ig样蛋白,证实了Ig样蛋白来源于肿瘤细胞[3]。本实验又用亲和层析的方法将HeLa MR(人宫颈癌传代细胞)这一上皮性恶性肿瘤传代细胞内Ig样蛋白进行了纯化;经过多次反复实验证明了在非造血系统来源的肿瘤传代细胞中确实存在一种Ig样的蛋白质;并以SDS-PAGE及Western-blot方法,证明Ig样蛋白与IgG比较,在抗原性上具有明显的一致性,在分子结构上表现出明显的相似性,但二者不完全相同。并且在实验中发现,二者在理化特性上也不完全相同。
, 百拇医药
Ig样蛋白与IgG比较在分子结构上具有明显的相似性,主要表现为二者均有5 500、2 500这一IgG分子特有的泳带。为了排除羊抗人IgG-Sepharose 4B亲和柱中羊抗人IgG对实验结果的影响,本实验用Protein G-Sepharose4B亲和柱与羊抗人IgG-Sepharose 4B亲和柱对比,对Ig样蛋白进行纯化,两种亲和柱纯化样品的分析结果显示明显的一致性。但用Protein G亲合层析柱纯化的蛋白,在SDS-PAGE时其在IgG轻链位置不出现明显条带,在5 500处其条带信号也较弱,但Weatern-blot方法则可清晰地检测出这两条带。另外,Protein A-HRP检测发现,Ig样蛋白与IgG一样,只在部分尚存的完整IgG 分子位置出现明显的阳性信号,而轻、重链位置均未见阳性反应,这一结果也显示与IgG的一致性。
Ig样蛋白与IgG相比在分子结构及理化特性上又不完全相同,主要表现为Ig样蛋白有相对分子质量在6 600及7 000左右两条泳带,而这两条带在IgG样品中并不是优势带。而且用羊抗人IgG-HRP染色时发现,这两条泳带的抗原性非常强,同时在4 500左右的位置也出现阳性反应。此外,用抗人IgG轻、重链单克隆抗体进行间接法检测时发现,该结果既不与羊抗人IgG-HRP检测结果相同,也不与IgG 分子相同。在理化特性上,Ig样蛋白极易降解,即使在-20℃条件下也发生降解;其次,Ig样蛋白与IgG比较发现,当用羊抗人IgG多抗进行检测时,往往因加热其抗原性明显降低甚至消失,而IgG的结果不受影响。另外,从其电泳条带来看,尚不能排除其为偶合蛋白的可能性。也不能确认该蛋白为同聚体还是异聚体,或是同一蛋白的不同断裂片段。
, 百拇医药
综合上述结果,还不能确认Ig样蛋白与Ig的关系,但用于我们实验的IgG分子,是已知的B-2细胞分泌的,不能代表Ig分子的全部。目前已经明确在B细胞群中尚存在另一群非骨髓来源的B-1细胞,其所表达的Ig是由Ig胚系基因编码的,以IgM类为主,多为天然抗体,称为超抗体(superantibody)[6]。Ig样蛋白与这类Ig的关系有必要进一步探讨。我们曾用PCR及Southern blot方法证明了Ig基因在非淋巴细胞来源的恶性肿瘤细胞内存在重排后结构[4,5],1998年Kimoto[7]也在多种非造血系统细胞来源的肿瘤传代细胞中证明了免疫球蛋白(IgG1 、IgM、 IgD 、IgG3)恒定区基因的转录。这些结果都为肿瘤传代细胞中可能表达Ig提供了有力的证据。
基金项目:国家自然科学基金重点资助课题(39830410)
参考文献
, 百拇医药
1,邱晓彦,杨贵贞. 上皮性恶性肿瘤细胞内存在Ig样物质[J].白求恩医科大学学报, 1996,6:572-575
2,邱晓彦,杨贵贞. 恶性肿瘤细胞内呈现的Ig样蛋白特性及Ig基因结构分析[J].中国免疫学杂志,1996,5:296
3,侯春梅,邱晓彦,孙建民,等.无血清培养的HeLa MR细胞内Ig样蛋白的检测[J]. 军事医学科学院院刊, 1998,22:240
4,邱晓彦,杨贵贞.上皮性恶性肿瘤细胞内Ig基因结构分析[J]. 中国肿瘤生物治疗杂志,1997,4(2):157-158
5,邱晓彦,侯春梅,沈继铭,等.HL-60细胞Ig样蛋白的表达及IgH V-D-J序列分析[J]. 中华血液学杂志 , 1999,20(6):319
6,Kohler,et al. Superantibody activity:new players in innate and adapive immune response[J]. Immunol Today,1998 ,19(5):221-227
7,Yasuhiko Kimoto. Expression of heavy-chain constant region of immunoglobulin and T-cell receptor gene transcripts in human non-hematopoietic tumor cell lines[J]. Genes Chromosomes Cancer, 1998,22: 83-86
(2000-03-30收稿), 百拇医药
单位:北京大学基础医学院免疫学系,北京 100083
关键词:HeLa细胞;Ig样蛋白;IGG;宫颈肿瘤;分子结构
北京医科大学学报000407 [摘 要] 目的:探讨非造血系统来源的恶性肿瘤细胞内Ig样蛋白与Ig分子在抗原性及分子结构上的关系。方法:应用亲和层析的方法将HeLa MR(人宫颈癌传代细胞)细胞内Ig样蛋白进行了纯化;并以SDS-PAGE及Western Blot方法将Ig样蛋白与IgG进行比较分析。结果:SDS-PAGE结果显示Ig样蛋白既有与IgG相近的轻、重链泳带,同时又分别在相对分子质量6 600、7 000左右出现两条泳带,此两条泳带与人IgG具有高度一致的抗原性。Western Blot结果显示,Ig样蛋白与IgG相同,不但可与抗人IgG多克隆抗体、单克隆抗体反应而且可与Protein A蛋白发生反应。结论:Ig样蛋白与IgG比较在抗原性上具有明显的一致性,而在分子结构上也表现明显相似性,但二者不完全相同。
, 百拇医药
[中图分类号] R737.33 [文献标识码] A [文章编号] 1000-1530(2000)04-0310-03
Purification and Western -blot analysis of Ig-like protein
from cervical cancer cell line
WANG Dong-Sheng
(Department of Immunology, Peking University, Beijing 100083, China)
QIU Xiao-Yan
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHU Xiao-Hui
(Department of Immunology, Peking University, Beijing 100083, China)
LU Peng
(Department of Immunology, Peking University, Beijing 100083, China)
JIANG Nan
(Department of Immunology, Peking University, Beijing 100083, China)
LV Ping
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
ZHANG Ling
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Yan
(Department of Immunology, Peking University, Beijing 100083, China)
GAO Xiao-Ming
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
, 百拇医药
To characterise the Ig-like protein in non-hematopietic tumor cell lines. Methods: Western-blot and affinity chromatography methods were used to purify and analyze the proteins in cytoplasm of tumor cell lines. The Ig-like protein was purified by affinity chromatography using staphylococal protein G and goat anti-human IgG column. Results: SDS-PAGE indicated that Ig-like protein had not only the counterpart of the IgG heavy and light chain but also some specific bands molecular weight of 4 500, 6 600, 7 000. Western Blot analysis indicated that all the bands especially the 6 600 and 7 000 bands could react to anti-human IgG polyantibodies, anti-human IgG Mab and protein A. Conclusion: Protein purified by affinity chromatography showed high likeness with Ig protein. A conclusion can be drawn that Ig-like protein did exist in non-hematopietic tumor cell line.
, 百拇医药
KEY WORDS HeLa cells; Ig-like protein; IgG; Cervix neoplasms; Molecular structure
(J Beijing Med Univ, 2000,32:310-312)
在前期工作中,我们发现在多种上皮性肿瘤细胞内存在一种与Ig抗原性相同的物质[1~3],为了探讨这种Ig样物质在结构上是否与Ig相同,还是与Ig具有相同抗原性的另一种物质。我们首先筛选出一个Ig样蛋白高表达的上皮性肿瘤传代细胞系HeLa MR,对其大量培养后,提取、纯化其Ig样蛋白,并将其同IgG进行比较分析。
1 材料与方法
1.1 材料
HeLa MR为本实验室传代培养细胞;Protein G-Sepharose4B 购自Pharmacia公司;羊抗人IgG(解放军农牧大学赠送;血清双扩散效价1∶128)Sepharose 4B购自SIGMA公司;羊抗人IgG-HRP、Protein A-HRP、 羊抗鼠-HRP购自Pharmacia公司。 抗人IgG重、轻链单克隆抗体购自北京邦定公司;羊抗人IgG-Sepharose4B亲和层析柱由本室制备。BSA购自SIGMA公司。
, 百拇医药
1.2 方法
细胞培养: HeLa MR肿瘤传代细胞培养于含10%(体积分数)小牛血清的DMEM培养基,5%(体积分数)CO2、37℃培养。
HeLa MR胞浆蛋白的提取及Ig样蛋白的纯化:收集6×108~8×108细胞,以0.1 mol.L-1 PBS洗两遍,以三去污缓冲液裂解法于冰浴中30 min裂解细胞、释放胞浆蛋白,15 000×g、于4℃离心30 min,取上清,测蛋白浓度后进行纯化。Ig样蛋白的纯化按常规方法。
SDS-PAGE及Western Blot分析:以IgG做为阳性对照,将各样品用100 g.L-1的聚丙烯酰胺凝胶进行不连续的SDS-PAGE,然后进行考马斯亮蓝染色;或在SDS-PAGE 后,用电转移系统于电压100 V,在1.5 h内将蛋白转移到硝酸纤维素膜上,经1%(质量分数)BSA封闭1 h后分别用羊抗人IgG-HRP、Protein A-HRP进行直接法染色;用抗人IgG重,轻链单克隆抗体做为一抗、羊抗鼠-HRP作为二抗进行间接法染色。即用Western-blot方法对Ig样蛋白与人IgG进行比较分析。
, 百拇医药
2 结果
亲和层析纯化Ig样蛋白的结果:以羊抗人IgG-Sepharose 4B亲和层析柱及Protein G-Sepharose4B亲和层析柱纯化HeLa MR Ig样蛋白,在以甘氨酸缓冲液洗脱时发现,两种亲和柱都在洗脱约5 min,pH降至5.0左右时出现一个较明显的蛋白吸收峰(图 1)。

图1 Protein-G蛋白层析柱纯化蛋白的吸收光谱(280 nm)
Figure 1 Absorption spectrum of purified protein
from protein-G column
SDS-PAGE分析结果:纯化后的蛋白经SDS-PAGE、考马斯亮蓝染色发现,Ig样蛋白既有与IgG重链(5 500)、轻链(2 500)相对分子质量相似的两条泳带,也有相对分子质量在4 500、6 600及7 000左右的3条泳带。未变性样品与人IgG未变性样品在相同位置出现条带。Western Blot分析表明:(1)羊抗人IgG-HRP染色发现,与IgG分子比较,Ig样蛋白样品除在5 500、2 500位置上与IgG一样出现阳性反应外,在相对分子质量4 500、6 600和7 000左右的位置均发生阳性反应(图2);(2)Protein A-HRP检测发现,Ig样蛋白与IgG一样,只在部分尚存的完整IgG 分子位置出现明显的阳性信号,而轻、重链位置均未见阳性反应(图3);(3)以抗人IgG轻、重链单克隆抗体进行间接法检测,则可在相对分子质量2 500、6 600、9 000左右出现清楚的阳性泳带(图4)。用Non-denature聚丙烯酰胺电泳后转膜,进行Western Blot检验,其反应特性与IgG高度一致(图5)。

, 百拇医药
1,2,3,4, purified protein from protein-G column; 5, human IgG.
图2 Westem-blot以HRP标记羊抗人IgG多抗染色
Figure 2 Western-blot stained with HRP labeled goat anti human IgG

1, human IgG; 2,3, purified protein from protein-G column;
4, rotein purified with goat anti human IgG.
图3 Western-blot以HRP-SPA染色
, 百拇医药
Figure 3 Western-blot stained with HRP-SPA

1, purified protein from protein-G column; 2, human IgG.
图4 Western-blot以抗人IgG单抗为第一抗体,以HRP标记羊抗鼠IgG为第二抗体进行间接法染色
Figure 4 Western-blot use anti human IgG Mab as the first
antibody and stained with HRP labeled goat
anti mice IgG as the second antibody

, http://www.100md.com
1, human IgG; 2, protein purified with protein-G column.
图5 非变性电泳后以HRP标记的羊抗人
IgG染色做Western-blot
Figure 5 Western-blot after non-denature electrophoresis
stained with goat anti human IgG
3 讨论
我们曾用免疫组织化学方法发现在多种上皮性恶性肿瘤细胞内存在一种与Ig抗原性相同的物质[1,2],并通过无血清培养HeLa MR细胞,检测培养上清中及胞浆内这种Ig样蛋白,证实了Ig样蛋白来源于肿瘤细胞[3]。本实验又用亲和层析的方法将HeLa MR(人宫颈癌传代细胞)这一上皮性恶性肿瘤传代细胞内Ig样蛋白进行了纯化;经过多次反复实验证明了在非造血系统来源的肿瘤传代细胞中确实存在一种Ig样的蛋白质;并以SDS-PAGE及Western-blot方法,证明Ig样蛋白与IgG比较,在抗原性上具有明显的一致性,在分子结构上表现出明显的相似性,但二者不完全相同。并且在实验中发现,二者在理化特性上也不完全相同。
, 百拇医药
Ig样蛋白与IgG比较在分子结构上具有明显的相似性,主要表现为二者均有5 500、2 500这一IgG分子特有的泳带。为了排除羊抗人IgG-Sepharose 4B亲和柱中羊抗人IgG对实验结果的影响,本实验用Protein G-Sepharose4B亲和柱与羊抗人IgG-Sepharose 4B亲和柱对比,对Ig样蛋白进行纯化,两种亲和柱纯化样品的分析结果显示明显的一致性。但用Protein G亲合层析柱纯化的蛋白,在SDS-PAGE时其在IgG轻链位置不出现明显条带,在5 500处其条带信号也较弱,但Weatern-blot方法则可清晰地检测出这两条带。另外,Protein A-HRP检测发现,Ig样蛋白与IgG一样,只在部分尚存的完整IgG 分子位置出现明显的阳性信号,而轻、重链位置均未见阳性反应,这一结果也显示与IgG的一致性。
Ig样蛋白与IgG相比在分子结构及理化特性上又不完全相同,主要表现为Ig样蛋白有相对分子质量在6 600及7 000左右两条泳带,而这两条带在IgG样品中并不是优势带。而且用羊抗人IgG-HRP染色时发现,这两条泳带的抗原性非常强,同时在4 500左右的位置也出现阳性反应。此外,用抗人IgG轻、重链单克隆抗体进行间接法检测时发现,该结果既不与羊抗人IgG-HRP检测结果相同,也不与IgG 分子相同。在理化特性上,Ig样蛋白极易降解,即使在-20℃条件下也发生降解;其次,Ig样蛋白与IgG比较发现,当用羊抗人IgG多抗进行检测时,往往因加热其抗原性明显降低甚至消失,而IgG的结果不受影响。另外,从其电泳条带来看,尚不能排除其为偶合蛋白的可能性。也不能确认该蛋白为同聚体还是异聚体,或是同一蛋白的不同断裂片段。
, 百拇医药
综合上述结果,还不能确认Ig样蛋白与Ig的关系,但用于我们实验的IgG分子,是已知的B-2细胞分泌的,不能代表Ig分子的全部。目前已经明确在B细胞群中尚存在另一群非骨髓来源的B-1细胞,其所表达的Ig是由Ig胚系基因编码的,以IgM类为主,多为天然抗体,称为超抗体(superantibody)[6]。Ig样蛋白与这类Ig的关系有必要进一步探讨。我们曾用PCR及Southern blot方法证明了Ig基因在非淋巴细胞来源的恶性肿瘤细胞内存在重排后结构[4,5],1998年Kimoto[7]也在多种非造血系统细胞来源的肿瘤传代细胞中证明了免疫球蛋白(IgG1 、IgM、 IgD 、IgG3)恒定区基因的转录。这些结果都为肿瘤传代细胞中可能表达Ig提供了有力的证据。
基金项目:国家自然科学基金重点资助课题(39830410)
参考文献
, 百拇医药
1,邱晓彦,杨贵贞. 上皮性恶性肿瘤细胞内存在Ig样物质[J].白求恩医科大学学报, 1996,6:572-575
2,邱晓彦,杨贵贞. 恶性肿瘤细胞内呈现的Ig样蛋白特性及Ig基因结构分析[J].中国免疫学杂志,1996,5:296
3,侯春梅,邱晓彦,孙建民,等.无血清培养的HeLa MR细胞内Ig样蛋白的检测[J]. 军事医学科学院院刊, 1998,22:240
4,邱晓彦,杨贵贞.上皮性恶性肿瘤细胞内Ig基因结构分析[J]. 中国肿瘤生物治疗杂志,1997,4(2):157-158
5,邱晓彦,侯春梅,沈继铭,等.HL-60细胞Ig样蛋白的表达及IgH V-D-J序列分析[J]. 中华血液学杂志 , 1999,20(6):319
6,Kohler,et al. Superantibody activity:new players in innate and adapive immune response[J]. Immunol Today,1998 ,19(5):221-227
7,Yasuhiko Kimoto. Expression of heavy-chain constant region of immunoglobulin and T-cell receptor gene transcripts in human non-hematopoietic tumor cell lines[J]. Genes Chromosomes Cancer, 1998,22: 83-86
(2000-03-30收稿), 百拇医药