人TFAR19的定点突变及其重组蛋白的表达、纯化和功能分析
作者:曹志敏 张颖妹 陈英玉 马大龙
单位:北京大学基础医学院免疫学系,北京 100083
关键词:TFAR19;点突变;凋亡;氧化磷酸化;重组蛋白质类;代谢
北京医科大学学报000406 [摘 要] 目的:了解凋亡相关新基因TFAR19编码蛋白分子中潜在的Ser100磷酸化位点与其促凋亡效应的关系。方法:利用重叠延伸PCR定点突变技术构建TFAR19 Ser100→Ala100突变体,用DNA测序技术验证,大肠杆菌表达,离子交换技术纯化重组突变蛋白,将其加入培养的白血病细胞株HL-60,通过PI染色,流式细胞仪分析,观察突变重组蛋白的促凋亡效应。结果:构建成TFAR19 Ala100突变体,并经DNA测序所证实,在大肠杆菌中获得了高水平表达,Western blot表明突变型重组蛋白与野生型具有相同的免疫学活性,流式细胞仪分析发现突变蛋白对撤除血清的HL-60细胞具有与野生蛋白相似的剂量依赖性促凋亡效应。 结论:TFAR19 分子中潜在的Ser100磷酸化位点对其促凋亡效应无影响,提示TFAR19发挥其生物学活性时无需cAMP和cGMP依赖的蛋白激酶活化。
, 百拇医药
[中图分类号] Q343.13 [文献标识码] A [文章编号] 1000-1530(2000)04-0306-04
Site-directed mutagenesis of human TFAR19 and its expression,purification and functional analysis
CAO Zhi-Min
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Ying-Mei
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
CHEN Ying-Yu
(Department of Immunology, Peking University, Beijing 100083, China)
MA Da-Long
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To explore the relation between the potential phosphorylation site Ser100 in the novel apoptosis-related molecule TFAR19 and the apoptosis-accelerating effect of the TFAR19 protein. Methods: Site-directed mutagenesis was used to create TFAR19 Ser100→Ala100 mutant. The mutant was expressed in E.coli and the recombinant protein purified by ion exchange chromatography. Cell apoptosis was analyzed by PI labeled FACS assay. Results: High level expression of TFAR19 Ala100 mutant protein was achieved in E.coli. The mutant TFAR19 was demonstrated by western blot using mAb against TFAR19. The purified mutant TFAR19's apoptosis-accelerating effect on HL-60 cells induced by serum deprivation was dose-dependent, comparable to the wild type TFAR19. Conclusion: The potential phosphorylation site Ser100 in the TFAR19 protein does not play an important role in its apoptosis-accelerating effect, implying that TFAR19 does not rely on cAMP and cGMP-dependent protein kinase's activation for its biological function.
, 百拇医药
KEY WORDS TFAR19; Point mutation; Apoptosis; Oxidative phosphorylation; Recombinant proteins/metab
(J Beijing Med Univ, 2000,32:306-309)
TFAR19基因(TF-1 cell apoptosis related gene)是本研究组利用cDNA-RDA技术从人红白血病细胞株TF-1细胞中克隆到的凋亡相关新基因之一(GenBank登记号AF014955)[1,2]。研究发现该基因的表达产物具有抑制肿瘤生长和促进凋亡作用。计算机结构分析表明,TFAR19 蛋白分子中的Ser100为可能的cAMP和cGMP依赖性蛋白激酶的磷酸化位点[3]。为了解该潜在的磷酸化位点与TFAR19分子促凋亡效应的关系,进而了解TFAR19的作用途径与可能的作用机制,本研究对该位点进行了定点突变,并对重组TFAR19 突变体进行了原核表达、纯化与初步的功能分析。
, 百拇医药
1 材料与方法
1.1材料
pMTY4-TFAR19质粒为本室构建[2,3],含PL启动子,可在大肠杆菌表达MS2-凝血酶接头-TFAR19融合蛋白,经凝血酶切割可收获非融合的重组TFAR19蛋白。pGEM-T easy质粒购自Promega 公司。大肠杆菌pop2136(CI857温度敏感)为C600衍生菌,编码温度敏感λ阻遏蛋白,由Raiband博士馈赠。HL-60细胞株为人早幼粒细胞系,本室保存。抗TFAR19单抗为本室自制。HRP标记的羊抗鼠IgG购自Promega 公司。BioTrace PVDF杂交膜购自Gelman Science公司; Supersignal Western Blotting化学发光底物购自Pierce 公司。
1.2 PCR 引物
TFAR19 编码区上游引物从起始密码子下游第一个氨基酸编码序列开始,序列为5′-GCG GAC GAG GAG CTT GAG GC-3′;下游引物含终止密码子和HindⅢ酶切点, 序列为5′-G CGA AGC TTA ATA ATC GTC ATC TTC ATC AG-3′。突变引物中含有定点突变氨基酸Ala(GCC)的编码序列,其上、下游引物序列彼此重叠且互补,分别为5′-C CTT AAA AAA GTA GCC CAA CAA ACA G-3′与5′-C TGT TTG TTG GGC TAC TTT TTT AAG G-3′。这些引物均由GIBCO BRL 公司合成。
, http://www.100md.com
1.3 TFAR19 Ser100→Ala100的定点突变
按照文献记载的重叠延伸PCR法进行[4]。先分别用编码区上游引物与突变下游引物;突变上游引物与编码区下游引物进行第1次PCR。然后将纯化后的两管PCR产物混合,再用编码区上、下游引物进行第2次PCR。纯化PCR产物,直接克隆到pGEM-T easy质粒中进行测序。
1.4 DNA序列分析
用Amersham Pharmacia Biotech公司的ALF express II自动DNA测序仪,在本实验室进行TFAR19 定点突变产物的DNA序列测定。
1.5 TFAR19突变体原核表达质粒pMTY4-mTFAR19的构建
, 百拇医药 用BamH I与Hind III双酶消化,从测序后的pGEM-mTFAR19质粒中将TFAR19突变cDNA片段切下,与经同样双酶消化的pMTY4-TFAR19质粒大片段进行置换亚克隆,得到定点突变的TFAR19原核表达质粒pMTY4-mTFAR19。
1.6 重组TFAR19突变蛋白在原核细胞中表达和纯化[5]
pMTY4-mTFAR19可在pop2136菌株中以包涵体的形式经42℃诱导表达融合蛋白。离心收集细菌,经超声裂解洗涤制备成包涵体。在8 mol.L-1尿素,20 mmol.L-1 Glysine-NaOH (pH 10.0)中,37℃变性30min,再将变性液稀释至尿素为1mol.L-1进行复性,以HAc/ NaAc(pH 4.5)调复性液pH为8.5,加凝血酶27℃孵育过夜,利用DEAE离子交换层析进行蛋白质纯化,20 mmol.L-1 Glysine-NaOH/HAc NaAc pH 8.5条件下上样,50 mmol.L-1 Tris-HCl (pH 8.9) NaCl梯度洗脱,在0.06 mol.L-1 NaCl洗脱下目的蛋白,SDS-PAGE分析重组突变蛋白的表达和纯度。野生型蛋白的纯化方法与之相同。
, 百拇医药
1.7 重组TFAR19突变蛋白的Western blot
将纯化的TFAR19突变蛋白与野生型蛋白进行150 g.L-1 SDS-PAGE电泳,按常规方法在Bio-Rad电转移系统中将凝胶蛋白带转移到BioTrace PVDF膜上。经50 g.L-1脱脂奶粉封闭后,依次加抗TFAR19单抗(一抗),HRP标记的羊抗鼠IgG(二抗),最后用Supersignal Western Blotting 化学发光底物进行显影,观察结果。每步反应结束均用TBS-T(0.05 mol.L-1 Tris-HCl pH 7.5, 0.15 mol.L-1 NaCl, l ml.L-1 Tween-20)洗涤3次,每次15 min。
1.8 重组TFAR19突变蛋白对HL-60细胞促凋亡效应的检测
, 百拇医药
HL-60细胞在含100 ml.L-1小牛血清RPMI/1640培养液中培养2 d后,离心收集细胞,用无血清1640洗涤细胞2次,以无血清1640调整细胞浓度为1.2×106 ml-1,放入24孔培养板中,实验孔分别加入纯化的mTFAR19蛋白15、7.5、3.75μg及突变与野生蛋白各7.5 μg,野生型对照孔加入重组TFAR19蛋白15 μg,阴性对照孔加入与其实验孔等体积的PBS,放入37℃培养箱5%(体积分数)CO2,16 h后收获,对凋亡细胞进行检测。
1.9 凋亡细胞DNA含量的流式细胞仪分析
将突变型及野生型TFAR19蛋白处理过的HL-60细胞经PBS洗涤2次,溶于PBS中加入RNAse(10g.L-1)5μl,37℃作用30 min,加入(10g.L-1)碘化丙啶(propidium iodide, PI)10μl。用流式细胞仪测定细胞DNA结合PI的荧光强度,在DNA的荧光直方图中,分析前向角散射光强度和侧向散射光强度,以确定凋亡细胞的百分数。
, http://www.100md.com
2 结果
2.1 TFAR19 Ser100→Ala100的定点突变与DNA测序结果
用重叠延伸PCR 法获得了TFAR19 的定点突变cDNA。测序结果(图略)表明:野生型TFAR19核酸序列中编码Ser100的密码子AGC, 已成功地被突变为编码Ala100的密码子GCC, 与预期的结果完全一致。图1示DNAsis软件对测序结果与野生型TFAR19DNA序列所作的同源性比较。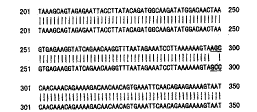
图1 野生型(上)与突变型(下)TFAR19 DNA
序列同源性比较
Figure 1 Homologous match between wild type (up)
, http://www.100md.com
and mutant (down) TFAR19 DNA sequences
2.2 重组TFAR19突变蛋白在原核细胞中的表达与纯化
亚克隆于原核表达质粒pMTY4中的突变型TFAR19基因,诱导后以包涵体形式在大肠杆菌中得到高效表达,表达量占菌体蛋白总量的30%左右。表达产物经包涵体洗涤、变性、复性、凝血酶切、阴离子交换层析后,可获得95%以上纯度的突变蛋白,图2A为重组TFAR19突变体诱导表达与蛋白纯化的结果。
2.3 重组TFAR19突变蛋白的Western blot
Western blot结果(图2B)表明,重组TFAR19突变蛋白具有与野生型蛋白相同的免疫学活性。
, 百拇医药
A:1, bacteria before inducdtion; 2, induced bacteria;
3, the inclusion bodies; 4, renaturation sample;
5, sample digested by thrombin; 6, the purified mut TFAR19 protein;
7, protein molecular weight marker;
B:1, wild type TFAR19; 2, mutant TFAR19.
图2 A. TFAR19突变体的诱导表达与蛋白纯化;
B. 野生型与突变型TFAR19蛋白的Western blot
, 百拇医药
Figure 2 A, induced expression and protein purification of mutant
TFAR19; B, western blot of wild type and mutant TFAR19
2.4 重组TFAR19突变蛋白对HL-60细胞的促凋亡效应
用流式细胞仪测定TFAR19突变蛋白及野生蛋白作用后的HL-60 细胞DNA结合PI的荧光强度,在DNA的荧光直方图中,凋亡细胞表现为G1/G0峰前的低宽的亚二倍体峰。检测结果(图3)表明:重组TFAR19突变蛋白对HL-60细胞具有与野生型蛋白相似的促凋亡活性,且活性的高低也呈现出一定程度的剂量依赖性。
A, wTFAR19 control (15 mg.L-1); B, mTFAR19 (15 mg.L-1);
, 百拇医药
C, wTFAR19 &mTFAR19(each 7.5 mg.L-1); D, mTFAR19 (7.5 mg.L-1);
E, mTFAR19 (3.75 mg.L-1); F, PBS control;
the percentage of apoptotic cells marked in each picture.
图3 TFAR19突变蛋白对HL-60细胞促凋亡作用的
流式细胞仪检测结果
Figure 3 Apoptosis-accelerating effect of
, 百拇医药
TFAR19 mutant on HL-60 cells analyzed by FACS
3 讨论
蛋白质的可逆磷酸化是机体调节蛋白质生物功能的重要方式之一,这种调节影响着生命活动的方方面面,不仅涉及细胞的生长、代谢、运动、增殖及分化,在细胞凋亡过程中同样也起着举足轻重的作用[6]。
TFAR19是我们从撤除细胞因子诱导凋亡的人红白血病细胞株TF-1中克隆到的一个凋亡相关的新基因。初步研究发现,TFAR19是一种具有抑制肿瘤生长与促进凋亡的重要蛋白分子。重组的人TFAR19蛋白对撤除细胞因子的HL-60细胞具有明显的促凋亡效应,且这种效应能部分被Caspase-3的抑制剂所阻断,提示TFAR19的促凋亡效应至少部分与Caspase-3通路有关[5]。利用Prosite软件分析TFAR19的氨基酸序列,发现Ser100为可能的cAMP和cGMP依赖的蛋白激酶磷酸化位点[3]。已知cAMP与cGMP依赖的蛋白激酶具有活化转录等多种功能,在凋亡的信号传导中发挥着重要作用[6]。具有Ser100这一潜在作用位点的凋亡相关分子TFAR19,是否为cAMP和cGMP依赖的蛋白激酶的作用底物呢?若是的话,该位点的磷酸化与其促凋亡活性是否有关?为了回答这些问题,我们对这一可能的磷酸化位点进行了定点突变(Ser100→Ala100),并对重组的突变蛋白进行了促凋亡活性检测。
, http://www.100md.com
Ala100突变蛋白的促凋亡活性与野生型Ser100蛋白相比无明显改变,且也具有与野生蛋白相似的剂量依赖性[5]。
表明Ser100磷酸化位点的存在与否对TFAR19发挥促凋亡效应并无明显影响作用。对此有两种可能的解释:一是该位点的磷酸化与TFAR19的促凋亡活性无关;另一可能是Ser100并非真正的cAMP和cGMP依赖的蛋白激酶磷酸化位点,或者说TFAR19可能不是该蛋白激酶的作用底物。无论是何种情形,均提示TFAR19发挥其生物学活性时不需要cAMP和cGMP依赖的蛋白激酶活化。
尽管TFAR19的促凋亡活性可能不受cAMP和cGMP依赖的蛋白激酶调节,但并不排除它受其他蛋白激酶调节的可能。计算机分析发现,TFAR19分子中还存在有4个可能的蛋白激酶C(PKC)磷酸化位点(Ser51,Ser84,Thr103,Thr108)[3],通过这些或另外一些潜在的作用位点,磷酸化仍有可能调节它的功能发挥。磷酸化在TFAR19功能发挥中的作用如何?与其促凋亡活性之间存在何种关系?通过什么途径来实现调节?是令人感兴趣且有待于进一步深入研究才能回答的问题。
, http://www.100md.com
(陶家平、马士良、韩梅、狄春辉、茹远斌、钟英成同志参加本研究部分工作,特此致谢。)
基金项目:国家自然科学基金(39870427)资助项目。
参考文献
1,Hubank M, Schatz DG. Identifying differences in mRNA expression by representational difference analysis of cDNA[J]. Nucleic Acids Res, 1994,22:5640-5648
2,刘红涛,王玉刚,张颖妹,等. 凋亡相关新基因TFAR19的cDNA克隆、表达和功能研究[J]. 高技术通讯,1998,8(5):6-10
3,Liu HT, Wang YG, Zhang YM, et al. TFAR19, a novel apoptosis-related gene cloned from human leukemia cell line TF-1, could enhance apoptosis of some tumor cells induced by growth factor withdrawal[J]. Biochem Biophy Res Commun ,1999, 254:203-210
, 百拇医药
4,Pogulis RJ, Vallejo AN , Pease LR. In vitro recombination and mutagenesis by overlap extension PCR[A]. In: Trower MK, ed. Methods in molecular biology, Vol. 57: In vitro mutagenesis protocols[M]. Totowa , NJ: Humana press Inc, 1995.167-176
5,张颖妹,徐秀珍,刘红涛,等. 人重组TFAR19蛋白对白血病细胞株HL-60的促凋亡效应[J]. 中国免疫学杂志, 2000,16(1):8-11
6,Anderson P. Kinase cascades regulating entry into apoptosis. Microbiol[J]. Mol Biol Rev, 1997, 61(1):33-46
(2000-04-03 收稿), 百拇医药
单位:北京大学基础医学院免疫学系,北京 100083
关键词:TFAR19;点突变;凋亡;氧化磷酸化;重组蛋白质类;代谢
北京医科大学学报000406 [摘 要] 目的:了解凋亡相关新基因TFAR19编码蛋白分子中潜在的Ser100磷酸化位点与其促凋亡效应的关系。方法:利用重叠延伸PCR定点突变技术构建TFAR19 Ser100→Ala100突变体,用DNA测序技术验证,大肠杆菌表达,离子交换技术纯化重组突变蛋白,将其加入培养的白血病细胞株HL-60,通过PI染色,流式细胞仪分析,观察突变重组蛋白的促凋亡效应。结果:构建成TFAR19 Ala100突变体,并经DNA测序所证实,在大肠杆菌中获得了高水平表达,Western blot表明突变型重组蛋白与野生型具有相同的免疫学活性,流式细胞仪分析发现突变蛋白对撤除血清的HL-60细胞具有与野生蛋白相似的剂量依赖性促凋亡效应。 结论:TFAR19 分子中潜在的Ser100磷酸化位点对其促凋亡效应无影响,提示TFAR19发挥其生物学活性时无需cAMP和cGMP依赖的蛋白激酶活化。
, 百拇医药
[中图分类号] Q343.13 [文献标识码] A [文章编号] 1000-1530(2000)04-0306-04
Site-directed mutagenesis of human TFAR19 and its expression,purification and functional analysis
CAO Zhi-Min
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Ying-Mei
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
CHEN Ying-Yu
(Department of Immunology, Peking University, Beijing 100083, China)
MA Da-Long
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To explore the relation between the potential phosphorylation site Ser100 in the novel apoptosis-related molecule TFAR19 and the apoptosis-accelerating effect of the TFAR19 protein. Methods: Site-directed mutagenesis was used to create TFAR19 Ser100→Ala100 mutant. The mutant was expressed in E.coli and the recombinant protein purified by ion exchange chromatography. Cell apoptosis was analyzed by PI labeled FACS assay. Results: High level expression of TFAR19 Ala100 mutant protein was achieved in E.coli. The mutant TFAR19 was demonstrated by western blot using mAb against TFAR19. The purified mutant TFAR19's apoptosis-accelerating effect on HL-60 cells induced by serum deprivation was dose-dependent, comparable to the wild type TFAR19. Conclusion: The potential phosphorylation site Ser100 in the TFAR19 protein does not play an important role in its apoptosis-accelerating effect, implying that TFAR19 does not rely on cAMP and cGMP-dependent protein kinase's activation for its biological function.
, 百拇医药
KEY WORDS TFAR19; Point mutation; Apoptosis; Oxidative phosphorylation; Recombinant proteins/metab
(J Beijing Med Univ, 2000,32:306-309)
TFAR19基因(TF-1 cell apoptosis related gene)是本研究组利用cDNA-RDA技术从人红白血病细胞株TF-1细胞中克隆到的凋亡相关新基因之一(GenBank登记号AF014955)[1,2]。研究发现该基因的表达产物具有抑制肿瘤生长和促进凋亡作用。计算机结构分析表明,TFAR19 蛋白分子中的Ser100为可能的cAMP和cGMP依赖性蛋白激酶的磷酸化位点[3]。为了解该潜在的磷酸化位点与TFAR19分子促凋亡效应的关系,进而了解TFAR19的作用途径与可能的作用机制,本研究对该位点进行了定点突变,并对重组TFAR19 突变体进行了原核表达、纯化与初步的功能分析。
, 百拇医药
1 材料与方法
1.1材料
pMTY4-TFAR19质粒为本室构建[2,3],含PL启动子,可在大肠杆菌表达MS2-凝血酶接头-TFAR19融合蛋白,经凝血酶切割可收获非融合的重组TFAR19蛋白。pGEM-T easy质粒购自Promega 公司。大肠杆菌pop2136(CI857温度敏感)为C600衍生菌,编码温度敏感λ阻遏蛋白,由Raiband博士馈赠。HL-60细胞株为人早幼粒细胞系,本室保存。抗TFAR19单抗为本室自制。HRP标记的羊抗鼠IgG购自Promega 公司。BioTrace PVDF杂交膜购自Gelman Science公司; Supersignal Western Blotting化学发光底物购自Pierce 公司。
1.2 PCR 引物
TFAR19 编码区上游引物从起始密码子下游第一个氨基酸编码序列开始,序列为5′-GCG GAC GAG GAG CTT GAG GC-3′;下游引物含终止密码子和HindⅢ酶切点, 序列为5′-G CGA AGC TTA ATA ATC GTC ATC TTC ATC AG-3′。突变引物中含有定点突变氨基酸Ala(GCC)的编码序列,其上、下游引物序列彼此重叠且互补,分别为5′-C CTT AAA AAA GTA GCC CAA CAA ACA G-3′与5′-C TGT TTG TTG GGC TAC TTT TTT AAG G-3′。这些引物均由GIBCO BRL 公司合成。
, http://www.100md.com
1.3 TFAR19 Ser100→Ala100的定点突变
按照文献记载的重叠延伸PCR法进行[4]。先分别用编码区上游引物与突变下游引物;突变上游引物与编码区下游引物进行第1次PCR。然后将纯化后的两管PCR产物混合,再用编码区上、下游引物进行第2次PCR。纯化PCR产物,直接克隆到pGEM-T easy质粒中进行测序。
1.4 DNA序列分析
用Amersham Pharmacia Biotech公司的ALF express II自动DNA测序仪,在本实验室进行TFAR19 定点突变产物的DNA序列测定。
1.5 TFAR19突变体原核表达质粒pMTY4-mTFAR19的构建
, 百拇医药 用BamH I与Hind III双酶消化,从测序后的pGEM-mTFAR19质粒中将TFAR19突变cDNA片段切下,与经同样双酶消化的pMTY4-TFAR19质粒大片段进行置换亚克隆,得到定点突变的TFAR19原核表达质粒pMTY4-mTFAR19。
1.6 重组TFAR19突变蛋白在原核细胞中表达和纯化[5]
pMTY4-mTFAR19可在pop2136菌株中以包涵体的形式经42℃诱导表达融合蛋白。离心收集细菌,经超声裂解洗涤制备成包涵体。在8 mol.L-1尿素,20 mmol.L-1 Glysine-NaOH (pH 10.0)中,37℃变性30min,再将变性液稀释至尿素为1mol.L-1进行复性,以HAc/ NaAc(pH 4.5)调复性液pH为8.5,加凝血酶27℃孵育过夜,利用DEAE离子交换层析进行蛋白质纯化,20 mmol.L-1 Glysine-NaOH/HAc NaAc pH 8.5条件下上样,50 mmol.L-1 Tris-HCl (pH 8.9) NaCl梯度洗脱,在0.06 mol.L-1 NaCl洗脱下目的蛋白,SDS-PAGE分析重组突变蛋白的表达和纯度。野生型蛋白的纯化方法与之相同。
, 百拇医药
1.7 重组TFAR19突变蛋白的Western blot
将纯化的TFAR19突变蛋白与野生型蛋白进行150 g.L-1 SDS-PAGE电泳,按常规方法在Bio-Rad电转移系统中将凝胶蛋白带转移到BioTrace PVDF膜上。经50 g.L-1脱脂奶粉封闭后,依次加抗TFAR19单抗(一抗),HRP标记的羊抗鼠IgG(二抗),最后用Supersignal Western Blotting 化学发光底物进行显影,观察结果。每步反应结束均用TBS-T(0.05 mol.L-1 Tris-HCl pH 7.5, 0.15 mol.L-1 NaCl, l ml.L-1 Tween-20)洗涤3次,每次15 min。
1.8 重组TFAR19突变蛋白对HL-60细胞促凋亡效应的检测
, 百拇医药
HL-60细胞在含100 ml.L-1小牛血清RPMI/1640培养液中培养2 d后,离心收集细胞,用无血清1640洗涤细胞2次,以无血清1640调整细胞浓度为1.2×106 ml-1,放入24孔培养板中,实验孔分别加入纯化的mTFAR19蛋白15、7.5、3.75μg及突变与野生蛋白各7.5 μg,野生型对照孔加入重组TFAR19蛋白15 μg,阴性对照孔加入与其实验孔等体积的PBS,放入37℃培养箱5%(体积分数)CO2,16 h后收获,对凋亡细胞进行检测。
1.9 凋亡细胞DNA含量的流式细胞仪分析
将突变型及野生型TFAR19蛋白处理过的HL-60细胞经PBS洗涤2次,溶于PBS中加入RNAse(10g.L-1)5μl,37℃作用30 min,加入(10g.L-1)碘化丙啶(propidium iodide, PI)10μl。用流式细胞仪测定细胞DNA结合PI的荧光强度,在DNA的荧光直方图中,分析前向角散射光强度和侧向散射光强度,以确定凋亡细胞的百分数。
, http://www.100md.com
2 结果
2.1 TFAR19 Ser100→Ala100的定点突变与DNA测序结果
用重叠延伸PCR 法获得了TFAR19 的定点突变cDNA。测序结果(图略)表明:野生型TFAR19核酸序列中编码Ser100的密码子AGC, 已成功地被突变为编码Ala100的密码子GCC, 与预期的结果完全一致。图1示DNAsis软件对测序结果与野生型TFAR19DNA序列所作的同源性比较。

图1 野生型(上)与突变型(下)TFAR19 DNA
序列同源性比较
Figure 1 Homologous match between wild type (up)
, http://www.100md.com
and mutant (down) TFAR19 DNA sequences
2.2 重组TFAR19突变蛋白在原核细胞中的表达与纯化
亚克隆于原核表达质粒pMTY4中的突变型TFAR19基因,诱导后以包涵体形式在大肠杆菌中得到高效表达,表达量占菌体蛋白总量的30%左右。表达产物经包涵体洗涤、变性、复性、凝血酶切、阴离子交换层析后,可获得95%以上纯度的突变蛋白,图2A为重组TFAR19突变体诱导表达与蛋白纯化的结果。
2.3 重组TFAR19突变蛋白的Western blot
Western blot结果(图2B)表明,重组TFAR19突变蛋白具有与野生型蛋白相同的免疫学活性。

, 百拇医药
A:1, bacteria before inducdtion; 2, induced bacteria;
3, the inclusion bodies; 4, renaturation sample;
5, sample digested by thrombin; 6, the purified mut TFAR19 protein;
7, protein molecular weight marker;
B:1, wild type TFAR19; 2, mutant TFAR19.
图2 A. TFAR19突变体的诱导表达与蛋白纯化;
B. 野生型与突变型TFAR19蛋白的Western blot
, 百拇医药
Figure 2 A, induced expression and protein purification of mutant
TFAR19; B, western blot of wild type and mutant TFAR19
2.4 重组TFAR19突变蛋白对HL-60细胞的促凋亡效应
用流式细胞仪测定TFAR19突变蛋白及野生蛋白作用后的HL-60 细胞DNA结合PI的荧光强度,在DNA的荧光直方图中,凋亡细胞表现为G1/G0峰前的低宽的亚二倍体峰。检测结果(图3)表明:重组TFAR19突变蛋白对HL-60细胞具有与野生型蛋白相似的促凋亡活性,且活性的高低也呈现出一定程度的剂量依赖性。

A, wTFAR19 control (15 mg.L-1); B, mTFAR19 (15 mg.L-1);
, 百拇医药
C, wTFAR19 &mTFAR19(each 7.5 mg.L-1); D, mTFAR19 (7.5 mg.L-1);
E, mTFAR19 (3.75 mg.L-1); F, PBS control;
the percentage of apoptotic cells marked in each picture.
图3 TFAR19突变蛋白对HL-60细胞促凋亡作用的
流式细胞仪检测结果
Figure 3 Apoptosis-accelerating effect of
, 百拇医药
TFAR19 mutant on HL-60 cells analyzed by FACS
3 讨论
蛋白质的可逆磷酸化是机体调节蛋白质生物功能的重要方式之一,这种调节影响着生命活动的方方面面,不仅涉及细胞的生长、代谢、运动、增殖及分化,在细胞凋亡过程中同样也起着举足轻重的作用[6]。
TFAR19是我们从撤除细胞因子诱导凋亡的人红白血病细胞株TF-1中克隆到的一个凋亡相关的新基因。初步研究发现,TFAR19是一种具有抑制肿瘤生长与促进凋亡的重要蛋白分子。重组的人TFAR19蛋白对撤除细胞因子的HL-60细胞具有明显的促凋亡效应,且这种效应能部分被Caspase-3的抑制剂所阻断,提示TFAR19的促凋亡效应至少部分与Caspase-3通路有关[5]。利用Prosite软件分析TFAR19的氨基酸序列,发现Ser100为可能的cAMP和cGMP依赖的蛋白激酶磷酸化位点[3]。已知cAMP与cGMP依赖的蛋白激酶具有活化转录等多种功能,在凋亡的信号传导中发挥着重要作用[6]。具有Ser100这一潜在作用位点的凋亡相关分子TFAR19,是否为cAMP和cGMP依赖的蛋白激酶的作用底物呢?若是的话,该位点的磷酸化与其促凋亡活性是否有关?为了回答这些问题,我们对这一可能的磷酸化位点进行了定点突变(Ser100→Ala100),并对重组的突变蛋白进行了促凋亡活性检测。
, http://www.100md.com
Ala100突变蛋白的促凋亡活性与野生型Ser100蛋白相比无明显改变,且也具有与野生蛋白相似的剂量依赖性[5]。
表明Ser100磷酸化位点的存在与否对TFAR19发挥促凋亡效应并无明显影响作用。对此有两种可能的解释:一是该位点的磷酸化与TFAR19的促凋亡活性无关;另一可能是Ser100并非真正的cAMP和cGMP依赖的蛋白激酶磷酸化位点,或者说TFAR19可能不是该蛋白激酶的作用底物。无论是何种情形,均提示TFAR19发挥其生物学活性时不需要cAMP和cGMP依赖的蛋白激酶活化。
尽管TFAR19的促凋亡活性可能不受cAMP和cGMP依赖的蛋白激酶调节,但并不排除它受其他蛋白激酶调节的可能。计算机分析发现,TFAR19分子中还存在有4个可能的蛋白激酶C(PKC)磷酸化位点(Ser51,Ser84,Thr103,Thr108)[3],通过这些或另外一些潜在的作用位点,磷酸化仍有可能调节它的功能发挥。磷酸化在TFAR19功能发挥中的作用如何?与其促凋亡活性之间存在何种关系?通过什么途径来实现调节?是令人感兴趣且有待于进一步深入研究才能回答的问题。
, http://www.100md.com
(陶家平、马士良、韩梅、狄春辉、茹远斌、钟英成同志参加本研究部分工作,特此致谢。)
基金项目:国家自然科学基金(39870427)资助项目。
参考文献
1,Hubank M, Schatz DG. Identifying differences in mRNA expression by representational difference analysis of cDNA[J]. Nucleic Acids Res, 1994,22:5640-5648
2,刘红涛,王玉刚,张颖妹,等. 凋亡相关新基因TFAR19的cDNA克隆、表达和功能研究[J]. 高技术通讯,1998,8(5):6-10
3,Liu HT, Wang YG, Zhang YM, et al. TFAR19, a novel apoptosis-related gene cloned from human leukemia cell line TF-1, could enhance apoptosis of some tumor cells induced by growth factor withdrawal[J]. Biochem Biophy Res Commun ,1999, 254:203-210
, 百拇医药
4,Pogulis RJ, Vallejo AN , Pease LR. In vitro recombination and mutagenesis by overlap extension PCR[A]. In: Trower MK, ed. Methods in molecular biology, Vol. 57: In vitro mutagenesis protocols[M]. Totowa , NJ: Humana press Inc, 1995.167-176
5,张颖妹,徐秀珍,刘红涛,等. 人重组TFAR19蛋白对白血病细胞株HL-60的促凋亡效应[J]. 中国免疫学杂志, 2000,16(1):8-11
6,Anderson P. Kinase cascades regulating entry into apoptosis. Microbiol[J]. Mol Biol Rev, 1997, 61(1):33-46
(2000-04-03 收稿), 百拇医药