HBV 感染与IgA肾病肾小管-间质病变的关系
作者:
马学玲 张月娥 方利君 张秀荣 杜卫东 闫惠平 赵仲华 郭慕依
单位:
关键词:肾小球肾炎;IGA;肝炎病毒;乙型;T淋巴细胞
New Page 1 【摘要】 目的 探讨IgA肾病HBV感染与肾小管间质病变的关系。方法 利用原位分子杂交(HBV DNA)、免疫组化(HBAg、CD3、CD8)以及HBV DNA-HBAg和HBAg-CD43双标记技术,对91例IgA肾病肾穿刺标本进行研究。结果 肾组织内HBAg阳性率为69.2%。HBV DNA原位杂交阳性率为42.9%。HBV DNA阳性的病例,双重标记染色发现HBV DNA阳性的肾小管上皮细胞可表达HBcAg或/和HBsAg。HBV感染标记 (HBV DNA、HBcAg、HBsAg)阳性组CD3阳性细胞和CD8阳性细胞数明显高于阴性组(P<0.01),并可见数量不等的T淋巴细胞入侵HBcAg及HBsAg阳性肾小管管壁或围绕其周围。结论 感染HBV的肾组织细胞能够表达HBAg,并诱导CD3阳性细胞和CD8阳性细胞浸润,从而加重肾小管、间质损害。HBV感染对IgA肾病的发生发展可能起着重要作用。
, 百拇医药
The relationship between HBV infection and injury of tubuli and interstitium in IgA nephropathy Ma Xueling*, Zhang Yue′e, Fang Lijun,et al. *Department of Pathology, Shanghai Medical University, Shanghai 200032
【Abstract】 Objective To clarify the correlation between HBV infection and the injury of tubuli and interstitium of IgA nephropathy. Methods Renal biopsy specimens from 91 patients with primary IgA nephropathy were investigated by use of in situ hybridization (HBV DNA),immunohistochemistry (HBsAg, HBcAg, CD3, CD8) and HBV DNA,HBAg-CD43 double staining techniques. Results The positive rate of HBAg in renal tissue as detected by immunohistochemistry was 69.2% and that of HBV DNA detected by in situ hybridization was 42.9%. Double staining showed that HBV DNA positive tubular epithelial cells might coexpress HBsAg and/or HBcAg. The numbers of the infiltrated CD3+ cells and CD8+ cells in cases with positive HBV infections markers were significantly higher than those of cases without infection (P<0.01). In addition, CD43+ T lymphocytes infiltrated around or invaded into the tubuli walls which had positive HBcAg or HBsAg expression. Conclusion After HBV infection, the renal cells could express HBAg and induce infiltration of CD3+ cells and CD8+ cells, resulting in aggravation of the injury of tubuli and interstitium. Therefore, it is considered that HBV infection might play an important role in the occurence and progress of IgA nephropathy.
, 百拇医药
【Key words】 Glomerulonephritis, IGA Hepatitis B virus T-lymphocytes
IgA肾病是我国较常见的一种肾脏疾病,其明显的肾小管间质损害是影响预后的重要因素。近年来的研究提示肾小管间质损害常与单个核细胞浸润有关,已有迹象表明HBV感染与IgA肾病发病可能有一定的关系[1,2]。我们对91例IgA肾病进行研究,探讨HBV感染与IgA肾病肾小管间质病变的关系,旨在为相应的临床治疗提供理论依据。
材料与方法
91例IgA肾病肾穿刺组织标本选自1994年~1996年上海医科大学附属儿科医院(6例儿童)、华山医院和中山医院(85例成人)。选用同时期血清及组织HBV感染标志物阴性的30例肾小球肾炎 (系膜增生性肾炎25例,局灶节段性肾炎3例,膜增生性肾炎2例)作为对照组,标本来源同IgA肾病。作如下观察:
, 百拇医药
1.肾组织HBsAg、HBcAg及T淋巴细胞标志(CD3、CD8、CD43)免疫组化染色:将石蜡切片用PAP免疫酶法进行HBsAg、HBcAg单标记及HBAg (HBsAg、HBcAg)-CD43双标记染色。于冰冻切片上用间接免疫荧光法检测CD3、CD8,羊抗HBs、兔抗HBc、鼠抗CD43及荧光抗体羊抗鼠-FITC购自DAKO公司。鼠抗CD3、鼠抗CD8、专一特异兔抗羊IgG、羊抗兔IgG和羊PAP、兔PAP由本教研室自制。分别以正常羊血清及兔血清代替一抗作阴性对照。每张肾穿刺组织切片在荧光显微镜下连续计数10个高倍视野中阳性细胞数,分别计算平均值。对IgA肾病肾小球硬化、肾小管病变、肾间质炎症和纤维化程度进行半定量分级。其分级标准:(1)肾小球硬化: 0级,肾小球无硬化;Ⅰ级,<20%肾小球硬化;Ⅱ级,>21%肾小球硬化。(2)肾小管病变:0级,肾小管无明显病理改变;Ⅰ级,肾小管上皮细胞变性、坏死,萎缩轻,范围小;Ⅱ级,肾小管上皮细胞变性、坏死,萎缩重,范围大。(3)肾间质炎症:0级,间质中无或极少见炎症细胞浸润;Ⅰ级,少量散在的炎症细胞浸润;Ⅱ级,多量弥漫或聚集成灶的炎症细胞浸润。(4)间质纤维化:0级,无纤维组织增生;Ⅰ级,纤维组织增生呈小灶状,散在,少量;Ⅱ级,纤维组织增生呈束状、多灶性或网连成片。
, 百拇医药
2.肾组织HBV DNA检测:于石蜡切片上进行HBV DNA原位分子杂交以及HBV DNA原位分子杂交-HBAg (HBsAg、HBcAg)双标记染色,HBAg用DAB显色(棕黄色),HBV DNA用NBT-BCIP显色(紫蓝色),方法同以往报道[3]。
3.HBV感染指标的检测以阳性率表示,用χ2检验;T淋巴细胞的检测结果以平均数表示,用t检验。
结果
HBAg总的阳性率为69.2%(HBsAg 42.9%;HBcAg 38.5%)主要定位于肾小球系膜区、毛细血管襻和球囊壁,以及肾小管上皮细胞(近曲小管、远曲小管及集合管等)胞浆或/和胞膜,呈棕黄色。少数病例HBAg亦可见于肾间质内,呈较弱的灶性弥散性染色。 HBV DNA原位杂交阳性率为42.9%,阳性信号表现为紫蓝色细小颗粒,主要位于肾小球系膜细胞、内皮细胞、脏层和壁层上皮细胞以及肾小管上皮细胞(近曲小管、远曲小管和集合管等)细胞核内,且不同细胞HBV DNA杂交信号强弱不一(图1)。此外,有11例肾间质病变明显的病例,部分浸润的炎症细胞亦显示 HBV DNA阳性信号。HBN DNA阳性的病例,HBV DNA原位杂交-HBAg免疫组化双标记染色发现肾小管HBV DNA阳性细胞内可以表达HBcAg或/和HBsAg(图2)。
, http://www.100md.com
CD3阳性细胞和CD8阳性细胞主要分布于肾小球系膜区、肾小管周围间质内,二种阳性细胞浸润的数量变化是平行的。结合HE染色来看,HBcAg阳性的肾小管病变 (变性、坏死、萎缩)更为明显,部分病例管壁破坏严重,甚至结构消失,而代之以数目不等的以淋巴细胞为主的单个核细胞浸润以及程度不同的间质纤维结缔组织增生。双重酶标技术显示HBcAg阳性和/或HBsAg阳性肾小管上皮细胞周围常绕以较多CD43阳性淋巴细胞,在呈胞膜型HBAg表达及退行性变的肾小管周围尤为如此,并可见数量不等的T淋巴细胞直接入侵管壁。与免疫荧光观察CD3阳性细胞和CD8阳性细胞的结果相符。值得一提的是即使在同一病例,T淋巴细胞在HBAg阳性肾小管附近的分布亦呈不均一性,往往在结构较好,HBAg呈浆型染色的肾小管周围,T淋巴细胞浸润的数量不多,而在T淋巴细胞浸润较为密集的区域,往往是肾小管HBAg呈胞膜型及浆膜型染色或管壁已有明显的破坏乃至结构消失,后者HBAg染色呈弱阳性或阴性反应。根据肾组织HBV DNA原位杂交和/或HBAg (HBsAg、HBcAg)免疫组化染色结果,可总的将IgA肾病分为HBV感染标志阳性组和阴性组,比较二组CD3阳性细胞(总T细胞,91例)和CD8阳性细胞(杀伤T细胞,85例)间的差异,发现HBV感染标志阳性组CD3阳性细胞和CD8阳性细胞数高于阴性组(P<0.01,表1)。
, http://www.100md.com
表1 肾组织内HBV DNA、HBAg的存在与
CD3阳性细胞和CD8阳性细胞浸润的关系
分组
CD3阳性细胞
CD8阳性细胞
例数
±s
例数
±s
HBV DNA
+
39
, http://www.100md.com
7.98±6.43**
35
6.95±5.25**
-
52
2.88±3.88
50
2.34±4.38
HBcAg
+
35
8.15±6.56**
, 百拇医药
33
7.25±5.32**
-
56
3.16±4.07
52
2.32±4.27
HBsAg
+
39
7.14±7.55*
37
, 百拇医药
6.25±6.35*
-
52
3.31±3.73
48
2.59±3.61
IgA肾病
91
4.95±5.97**
85
4.24±5.26*
对照组
, http://www.100md.com
30
1.10±2.28
13
1.62±1.89
* P<0.01;** P<0.001
比较IgA肾病HBV DNA和/或HBAg阳性组、阴性组与肾组织病变程度的关系,发现HBV DNA和HBcAg的存在与否与肾小管病变、间质炎症及间质纤维化病变的程度明显相关(P<0.001);HBsAg则表2 IgA肾病病变程度与HBV DNA及HBAg感染的关系(例数)
分组
总例数
肾小球硬化
, http://www.100md.com
肾小管病变
肾间质炎症
肾间质纤维化
0
Ⅰ
Ⅱ
0
Ⅰ
Ⅱ
0
Ⅰ
Ⅱ
0
Ⅰ
, 百拇医药
Ⅱ
HBV DNA
+
39
17
7
15
2
18
19**
3
14
22**
, 百拇医药
4
11
24**
-
52
32
11
9
20
23
9
19
26
, 百拇医药 7
21
20
11
HBcAg
+
35
16
6
13
3
15
17**
, 百拇医药 1
14
20**
3
9
23**
-
56
33
12
11
19
26
, http://www.100md.com
11
21
26
9
22
22
12
HBsAg
+
39
19
5
15
7
, http://www.100md.com
18
14
6
14
19*
7
14
18
-
52
30
13
9
, 百拇医药 16
22
14
16
26
10
18
17
17
对照组
30
29
1
0
, 百拇医药
24
4
2
21
9
0
19
7
4
* P<0.01;**P<0.001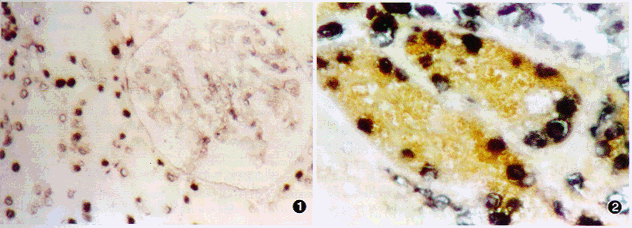
, 百拇医药
图1 大部分肾小管上皮细胞核显示HBV DNA杂交信号(蓝色),但不同上皮细胞杂交信号强弱不均,肾小球内个别系膜细胞核亦阳性,微小病变型IgA肾病 原位杂交×200 图2 示部分肾小管上皮细胞核内HBV DNA杂交信号阳性(蓝色)的胞浆内同时表达HBsAg(棕色),弥漫增生型IgA肾病 HBV DNA原位杂交-HBsAg免疫组化双标记×400
仅与间质炎症的程度明显相关(P<0.01);而肾小球的病变程度与HBV DNA和HBAg存在与否无关(P>0.05,表2)。
讨论
近年来,人们逐渐认识到肾小管-间质病变和T淋巴细胞浸润程度在IgA肾病发病以及预后影响中的价值。因此,细胞免疫学机制在IgA肾病发生、发展中的作用受到普遍关注。文献报道IgA肾病患者肾组织内IgA特异性抑制T淋巴细胞、辅助T淋巴细胞尤其是具有促进IgM合成向IgA转换能力的Tα4数量增多[4,5],CD4/CD8比例增加。国内资料表明IgA肾病患者肾间质内CD4、CD8虽有明显增多,但比值与正常对照差异无显著性。伴有肾性高血压病的患者或肾间质病变严重的病例,肾间质局部细胞毒T细胞活性较辅助T细胞活性相对增加,CD4/CD8比值反而明显降低[6]。肾小管损伤时上皮细胞能够表达MHC-Ⅱ类抗原,CD4阳性细胞识别后可释放多种细胞因子;并且CD8阳性细胞通过识别MHC-Ⅰ类抗原也可以发挥直接细胞毒效应,造成组织损伤。推测IgA肾病时肾小管-肾间质损伤(炎细胞浸润,纤维结缔组织增生,肾小管萎缩,坏死等)主要是由细胞免疫机制所引起[7]。
, http://www.100md.com
但究竟是什么抗原启动了细胞免疫反应,HBV感染及相关抗原(HBAg)与IgA肾病的关系目前国内外尚少报道。我们利用T淋巴细胞特异性单克隆抗体,分别在冰冻切片和石蜡切片上对肾组织内T淋巴细胞的浸润情况及其与HBAg的定位进行了免疫组化 (单标记及双标记)染色,以了解T淋巴细胞浸润与HBAg的存在以及IgA肾病病变之间的关系。结果表明,IgA肾病组肾组织内浸润的T淋巴细胞数量明显高于对照组(P<0.01)。IgA肾病中如以HBV感染标志物的有无分为二组,则CD3阳性细胞和CD8阳性细胞的数量在HBV DNA和HBAg阳性组明显增加(P<0.01),提示IgA肾病肾间质内T淋巴细胞的浸润与HBV感染和HBAg的表达密切相关。由于HBV DNA仅位于核内,不能释放至胞外,即使随着肾小管的破损而释出,也会因间质内核酸酶的存在而迅速降解,因此,HBV DNA本身很难成为T淋巴细胞聚集、识别与攻击的诱因。我们通过原位杂交-免疫组化双标记技术证实HBV DNA阳性细胞可表达HBAg,受损肾小管附近间质内常有HBAg的弥散分布;同时,注意到大量淋巴细胞的浸润常发生于HBAg呈胞膜型及浆膜型染色或结构破坏、HBAg染色渐趋消失的肾小管,而结构相对正常、HBAg染色较强的肾小管上皮细胞周围常仅有少数T淋巴细胞浸润。因而推测,HBV DNA、HBAg阳性组肾组织内T淋巴细胞数量的大量增加可能有一个发展过程,首先是基于肾小管上皮细胞表达HBAg,引起T淋巴细胞的攻击,从而导致肾小管上皮细胞的结构破坏,暴露、释放HBAg增加。后者反过来进一步刺激T淋巴细胞的浸润。同时由于T淋巴细胞释放细胞因子,活化其它免疫活性细胞,通过免疫网络的放大效应,加重了肾小管-间质的免疫损伤过程[8~10]。因此,研究肾间质淋巴细胞的分布与含量变化将有助于进一步阐明IgA肾病的发病机制,对判断病情,估价预后,为临床设计有效的防治方案提供理论依据。
, http://www.100md.com
参考文献
1Nagy J, Baijtai G, Brasch H, et al. The role of hepatitis B surface antigen in the pathogenesis of glomerulopaties. Clin Nephrol, 1979, 12:109-116.
2Zhang Y, Ma X, Fang L, et al. The existence and significance of hepatitis B virus DNA in glomerulonephritis. Nephrology, 1996, 2:119-125.
3马学玲,张秀荣,杜卫东,等.IgA肾病肾组织HBV DNA和HBAg双标记技术.上海医科大学学报,1997,24:293-294.
, http://www.100md.com 4Sakai H, Miyazaki M, Endoh M, et al. Increase of IgA-specific switch T cells in patients with IgA nephropathy. Clin Exp Immunol, 1989, 78:378-382.
5Yasumoto Y, Suga T, Miura M, et al. Subpopulations of T α cells in patients with IgA nephropathy: correlation between T α 4 cells and in vitro IgA production. Clin Immunol Immunopathol, 1989, 51:232-239.
6师锁柱,陈香美,于力方,等.IgA肾病患者肾间质T淋巴细胞亚群变化的意义.解放军医学杂志,1995,20:193-195.
, http://www.100md.com
7Nolasco FEB, Cameron JS, Hartley B, et al. Intraglomerular T cells and monocytes in nephritis: study with monoclonal antibodies. Kid Int, 1987, 31:1160-1166.
8Mondelli M, Vergani GM, Alberti A, et al. Specificity of T lymohocyte cytotoxicity to autologous hepatocytes in chronic hepatitis B virus infection: evidence that T-cell are directed against HBV core antigen expressed on hepatocytes. J Immunol, 1982, 129:2773-2778.
9Yoakum GH, Korba BE, Lechner JF, et al. High frequency transfection and cytopathology of the hepatitis B virus core antigen gene in human cells. Science, 1983, 222:385-389.
10Penna A, Bertoletti A, Cavalli A, et al. Fine specificity of the human T cell response to hepatitis B virus core antigen. Arch Virol, 1992, 4(Suppl):23-28.
(收稿:1997-06-13 修回:1997-11-11)
, http://www.100md.com
马学玲 张月娥 方利君 张秀荣 杜卫东 闫惠平 赵仲华 郭慕依
单位:
关键词:肾小球肾炎;IGA;肝炎病毒;乙型;T淋巴细胞
New Page 1 【摘要】 目的 探讨IgA肾病HBV感染与肾小管间质病变的关系。方法 利用原位分子杂交(HBV DNA)、免疫组化(HBAg、CD3、CD8)以及HBV DNA-HBAg和HBAg-CD43双标记技术,对91例IgA肾病肾穿刺标本进行研究。结果 肾组织内HBAg阳性率为69.2%。HBV DNA原位杂交阳性率为42.9%。HBV DNA阳性的病例,双重标记染色发现HBV DNA阳性的肾小管上皮细胞可表达HBcAg或/和HBsAg。HBV感染标记 (HBV DNA、HBcAg、HBsAg)阳性组CD3阳性细胞和CD8阳性细胞数明显高于阴性组(P<0.01),并可见数量不等的T淋巴细胞入侵HBcAg及HBsAg阳性肾小管管壁或围绕其周围。结论 感染HBV的肾组织细胞能够表达HBAg,并诱导CD3阳性细胞和CD8阳性细胞浸润,从而加重肾小管、间质损害。HBV感染对IgA肾病的发生发展可能起着重要作用。
, 百拇医药
The relationship between HBV infection and injury of tubuli and interstitium in IgA nephropathy Ma Xueling*, Zhang Yue′e, Fang Lijun,et al. *Department of Pathology, Shanghai Medical University, Shanghai 200032
【Abstract】 Objective To clarify the correlation between HBV infection and the injury of tubuli and interstitium of IgA nephropathy. Methods Renal biopsy specimens from 91 patients with primary IgA nephropathy were investigated by use of in situ hybridization (HBV DNA),immunohistochemistry (HBsAg, HBcAg, CD3, CD8) and HBV DNA,HBAg-CD43 double staining techniques. Results The positive rate of HBAg in renal tissue as detected by immunohistochemistry was 69.2% and that of HBV DNA detected by in situ hybridization was 42.9%. Double staining showed that HBV DNA positive tubular epithelial cells might coexpress HBsAg and/or HBcAg. The numbers of the infiltrated CD3+ cells and CD8+ cells in cases with positive HBV infections markers were significantly higher than those of cases without infection (P<0.01). In addition, CD43+ T lymphocytes infiltrated around or invaded into the tubuli walls which had positive HBcAg or HBsAg expression. Conclusion After HBV infection, the renal cells could express HBAg and induce infiltration of CD3+ cells and CD8+ cells, resulting in aggravation of the injury of tubuli and interstitium. Therefore, it is considered that HBV infection might play an important role in the occurence and progress of IgA nephropathy.
, 百拇医药
【Key words】 Glomerulonephritis, IGA Hepatitis B virus T-lymphocytes
IgA肾病是我国较常见的一种肾脏疾病,其明显的肾小管间质损害是影响预后的重要因素。近年来的研究提示肾小管间质损害常与单个核细胞浸润有关,已有迹象表明HBV感染与IgA肾病发病可能有一定的关系[1,2]。我们对91例IgA肾病进行研究,探讨HBV感染与IgA肾病肾小管间质病变的关系,旨在为相应的临床治疗提供理论依据。
材料与方法
91例IgA肾病肾穿刺组织标本选自1994年~1996年上海医科大学附属儿科医院(6例儿童)、华山医院和中山医院(85例成人)。选用同时期血清及组织HBV感染标志物阴性的30例肾小球肾炎 (系膜增生性肾炎25例,局灶节段性肾炎3例,膜增生性肾炎2例)作为对照组,标本来源同IgA肾病。作如下观察:
, 百拇医药
1.肾组织HBsAg、HBcAg及T淋巴细胞标志(CD3、CD8、CD43)免疫组化染色:将石蜡切片用PAP免疫酶法进行HBsAg、HBcAg单标记及HBAg (HBsAg、HBcAg)-CD43双标记染色。于冰冻切片上用间接免疫荧光法检测CD3、CD8,羊抗HBs、兔抗HBc、鼠抗CD43及荧光抗体羊抗鼠-FITC购自DAKO公司。鼠抗CD3、鼠抗CD8、专一特异兔抗羊IgG、羊抗兔IgG和羊PAP、兔PAP由本教研室自制。分别以正常羊血清及兔血清代替一抗作阴性对照。每张肾穿刺组织切片在荧光显微镜下连续计数10个高倍视野中阳性细胞数,分别计算平均值。对IgA肾病肾小球硬化、肾小管病变、肾间质炎症和纤维化程度进行半定量分级。其分级标准:(1)肾小球硬化: 0级,肾小球无硬化;Ⅰ级,<20%肾小球硬化;Ⅱ级,>21%肾小球硬化。(2)肾小管病变:0级,肾小管无明显病理改变;Ⅰ级,肾小管上皮细胞变性、坏死,萎缩轻,范围小;Ⅱ级,肾小管上皮细胞变性、坏死,萎缩重,范围大。(3)肾间质炎症:0级,间质中无或极少见炎症细胞浸润;Ⅰ级,少量散在的炎症细胞浸润;Ⅱ级,多量弥漫或聚集成灶的炎症细胞浸润。(4)间质纤维化:0级,无纤维组织增生;Ⅰ级,纤维组织增生呈小灶状,散在,少量;Ⅱ级,纤维组织增生呈束状、多灶性或网连成片。
, 百拇医药
2.肾组织HBV DNA检测:于石蜡切片上进行HBV DNA原位分子杂交以及HBV DNA原位分子杂交-HBAg (HBsAg、HBcAg)双标记染色,HBAg用DAB显色(棕黄色),HBV DNA用NBT-BCIP显色(紫蓝色),方法同以往报道[3]。
3.HBV感染指标的检测以阳性率表示,用χ2检验;T淋巴细胞的检测结果以平均数表示,用t检验。
结果
HBAg总的阳性率为69.2%(HBsAg 42.9%;HBcAg 38.5%)主要定位于肾小球系膜区、毛细血管襻和球囊壁,以及肾小管上皮细胞(近曲小管、远曲小管及集合管等)胞浆或/和胞膜,呈棕黄色。少数病例HBAg亦可见于肾间质内,呈较弱的灶性弥散性染色。 HBV DNA原位杂交阳性率为42.9%,阳性信号表现为紫蓝色细小颗粒,主要位于肾小球系膜细胞、内皮细胞、脏层和壁层上皮细胞以及肾小管上皮细胞(近曲小管、远曲小管和集合管等)细胞核内,且不同细胞HBV DNA杂交信号强弱不一(图1)。此外,有11例肾间质病变明显的病例,部分浸润的炎症细胞亦显示 HBV DNA阳性信号。HBN DNA阳性的病例,HBV DNA原位杂交-HBAg免疫组化双标记染色发现肾小管HBV DNA阳性细胞内可以表达HBcAg或/和HBsAg(图2)。
, http://www.100md.com
CD3阳性细胞和CD8阳性细胞主要分布于肾小球系膜区、肾小管周围间质内,二种阳性细胞浸润的数量变化是平行的。结合HE染色来看,HBcAg阳性的肾小管病变 (变性、坏死、萎缩)更为明显,部分病例管壁破坏严重,甚至结构消失,而代之以数目不等的以淋巴细胞为主的单个核细胞浸润以及程度不同的间质纤维结缔组织增生。双重酶标技术显示HBcAg阳性和/或HBsAg阳性肾小管上皮细胞周围常绕以较多CD43阳性淋巴细胞,在呈胞膜型HBAg表达及退行性变的肾小管周围尤为如此,并可见数量不等的T淋巴细胞直接入侵管壁。与免疫荧光观察CD3阳性细胞和CD8阳性细胞的结果相符。值得一提的是即使在同一病例,T淋巴细胞在HBAg阳性肾小管附近的分布亦呈不均一性,往往在结构较好,HBAg呈浆型染色的肾小管周围,T淋巴细胞浸润的数量不多,而在T淋巴细胞浸润较为密集的区域,往往是肾小管HBAg呈胞膜型及浆膜型染色或管壁已有明显的破坏乃至结构消失,后者HBAg染色呈弱阳性或阴性反应。根据肾组织HBV DNA原位杂交和/或HBAg (HBsAg、HBcAg)免疫组化染色结果,可总的将IgA肾病分为HBV感染标志阳性组和阴性组,比较二组CD3阳性细胞(总T细胞,91例)和CD8阳性细胞(杀伤T细胞,85例)间的差异,发现HBV感染标志阳性组CD3阳性细胞和CD8阳性细胞数高于阴性组(P<0.01,表1)。
, http://www.100md.com
表1 肾组织内HBV DNA、HBAg的存在与
CD3阳性细胞和CD8阳性细胞浸润的关系
分组
CD3阳性细胞
CD8阳性细胞
例数
±s
例数
±s
HBV DNA
+
39
, http://www.100md.com
7.98±6.43**
35
6.95±5.25**
-
52
2.88±3.88
50
2.34±4.38
HBcAg
+
35
8.15±6.56**
, 百拇医药
33
7.25±5.32**
-
56
3.16±4.07
52
2.32±4.27
HBsAg
+
39
7.14±7.55*
37
, 百拇医药
6.25±6.35*
-
52
3.31±3.73
48
2.59±3.61
IgA肾病
91
4.95±5.97**
85
4.24±5.26*
对照组
, http://www.100md.com
30
1.10±2.28
13
1.62±1.89
* P<0.01;** P<0.001
比较IgA肾病HBV DNA和/或HBAg阳性组、阴性组与肾组织病变程度的关系,发现HBV DNA和HBcAg的存在与否与肾小管病变、间质炎症及间质纤维化病变的程度明显相关(P<0.001);HBsAg则表2 IgA肾病病变程度与HBV DNA及HBAg感染的关系(例数)
分组
总例数
肾小球硬化
, http://www.100md.com
肾小管病变
肾间质炎症
肾间质纤维化
0
Ⅰ
Ⅱ
0
Ⅰ
Ⅱ
0
Ⅰ
Ⅱ
0
Ⅰ
, 百拇医药
Ⅱ
HBV DNA
+
39
17
7
15
2
18
19**
3
14
22**
, 百拇医药
4
11
24**
-
52
32
11
9
20
23
9
19
26
, 百拇医药 7
21
20
11
HBcAg
+
35
16
6
13
3
15
17**
, 百拇医药 1
14
20**
3
9
23**
-
56
33
12
11
19
26
, http://www.100md.com
11
21
26
9
22
22
12
HBsAg
+
39
19
5
15
7
, http://www.100md.com
18
14
6
14
19*
7
14
18
-
52
30
13
9
, 百拇医药 16
22
14
16
26
10
18
17
17
对照组
30
29
1
0
, 百拇医药
24
4
2
21
9
0
19
7
4
* P<0.01;**P<0.001

, 百拇医药
图1 大部分肾小管上皮细胞核显示HBV DNA杂交信号(蓝色),但不同上皮细胞杂交信号强弱不均,肾小球内个别系膜细胞核亦阳性,微小病变型IgA肾病 原位杂交×200 图2 示部分肾小管上皮细胞核内HBV DNA杂交信号阳性(蓝色)的胞浆内同时表达HBsAg(棕色),弥漫增生型IgA肾病 HBV DNA原位杂交-HBsAg免疫组化双标记×400
仅与间质炎症的程度明显相关(P<0.01);而肾小球的病变程度与HBV DNA和HBAg存在与否无关(P>0.05,表2)。
讨论
近年来,人们逐渐认识到肾小管-间质病变和T淋巴细胞浸润程度在IgA肾病发病以及预后影响中的价值。因此,细胞免疫学机制在IgA肾病发生、发展中的作用受到普遍关注。文献报道IgA肾病患者肾组织内IgA特异性抑制T淋巴细胞、辅助T淋巴细胞尤其是具有促进IgM合成向IgA转换能力的Tα4数量增多[4,5],CD4/CD8比例增加。国内资料表明IgA肾病患者肾间质内CD4、CD8虽有明显增多,但比值与正常对照差异无显著性。伴有肾性高血压病的患者或肾间质病变严重的病例,肾间质局部细胞毒T细胞活性较辅助T细胞活性相对增加,CD4/CD8比值反而明显降低[6]。肾小管损伤时上皮细胞能够表达MHC-Ⅱ类抗原,CD4阳性细胞识别后可释放多种细胞因子;并且CD8阳性细胞通过识别MHC-Ⅰ类抗原也可以发挥直接细胞毒效应,造成组织损伤。推测IgA肾病时肾小管-肾间质损伤(炎细胞浸润,纤维结缔组织增生,肾小管萎缩,坏死等)主要是由细胞免疫机制所引起[7]。
, http://www.100md.com
但究竟是什么抗原启动了细胞免疫反应,HBV感染及相关抗原(HBAg)与IgA肾病的关系目前国内外尚少报道。我们利用T淋巴细胞特异性单克隆抗体,分别在冰冻切片和石蜡切片上对肾组织内T淋巴细胞的浸润情况及其与HBAg的定位进行了免疫组化 (单标记及双标记)染色,以了解T淋巴细胞浸润与HBAg的存在以及IgA肾病病变之间的关系。结果表明,IgA肾病组肾组织内浸润的T淋巴细胞数量明显高于对照组(P<0.01)。IgA肾病中如以HBV感染标志物的有无分为二组,则CD3阳性细胞和CD8阳性细胞的数量在HBV DNA和HBAg阳性组明显增加(P<0.01),提示IgA肾病肾间质内T淋巴细胞的浸润与HBV感染和HBAg的表达密切相关。由于HBV DNA仅位于核内,不能释放至胞外,即使随着肾小管的破损而释出,也会因间质内核酸酶的存在而迅速降解,因此,HBV DNA本身很难成为T淋巴细胞聚集、识别与攻击的诱因。我们通过原位杂交-免疫组化双标记技术证实HBV DNA阳性细胞可表达HBAg,受损肾小管附近间质内常有HBAg的弥散分布;同时,注意到大量淋巴细胞的浸润常发生于HBAg呈胞膜型及浆膜型染色或结构破坏、HBAg染色渐趋消失的肾小管,而结构相对正常、HBAg染色较强的肾小管上皮细胞周围常仅有少数T淋巴细胞浸润。因而推测,HBV DNA、HBAg阳性组肾组织内T淋巴细胞数量的大量增加可能有一个发展过程,首先是基于肾小管上皮细胞表达HBAg,引起T淋巴细胞的攻击,从而导致肾小管上皮细胞的结构破坏,暴露、释放HBAg增加。后者反过来进一步刺激T淋巴细胞的浸润。同时由于T淋巴细胞释放细胞因子,活化其它免疫活性细胞,通过免疫网络的放大效应,加重了肾小管-间质的免疫损伤过程[8~10]。因此,研究肾间质淋巴细胞的分布与含量变化将有助于进一步阐明IgA肾病的发病机制,对判断病情,估价预后,为临床设计有效的防治方案提供理论依据。
, http://www.100md.com
参考文献
1Nagy J, Baijtai G, Brasch H, et al. The role of hepatitis B surface antigen in the pathogenesis of glomerulopaties. Clin Nephrol, 1979, 12:109-116.
2Zhang Y, Ma X, Fang L, et al. The existence and significance of hepatitis B virus DNA in glomerulonephritis. Nephrology, 1996, 2:119-125.
3马学玲,张秀荣,杜卫东,等.IgA肾病肾组织HBV DNA和HBAg双标记技术.上海医科大学学报,1997,24:293-294.
, http://www.100md.com 4Sakai H, Miyazaki M, Endoh M, et al. Increase of IgA-specific switch T cells in patients with IgA nephropathy. Clin Exp Immunol, 1989, 78:378-382.
5Yasumoto Y, Suga T, Miura M, et al. Subpopulations of T α cells in patients with IgA nephropathy: correlation between T α 4 cells and in vitro IgA production. Clin Immunol Immunopathol, 1989, 51:232-239.
6师锁柱,陈香美,于力方,等.IgA肾病患者肾间质T淋巴细胞亚群变化的意义.解放军医学杂志,1995,20:193-195.
, http://www.100md.com
7Nolasco FEB, Cameron JS, Hartley B, et al. Intraglomerular T cells and monocytes in nephritis: study with monoclonal antibodies. Kid Int, 1987, 31:1160-1166.
8Mondelli M, Vergani GM, Alberti A, et al. Specificity of T lymohocyte cytotoxicity to autologous hepatocytes in chronic hepatitis B virus infection: evidence that T-cell are directed against HBV core antigen expressed on hepatocytes. J Immunol, 1982, 129:2773-2778.
9Yoakum GH, Korba BE, Lechner JF, et al. High frequency transfection and cytopathology of the hepatitis B virus core antigen gene in human cells. Science, 1983, 222:385-389.
10Penna A, Bertoletti A, Cavalli A, et al. Fine specificity of the human T cell response to hepatitis B virus core antigen. Arch Virol, 1992, 4(Suppl):23-28.
(收稿:1997-06-13 修回:1997-11-11)
, http://www.100md.com