含胸苷激酶的不同细胞对丙氧鸟苷敏感性的差别及死亡途径初探
作者:张雷 刘彤华 崔全才 高洁
单位:张雷(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);刘彤华(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);崔全才(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);高洁(中国医学科学院中国协和医科大学 北京协和医院病理科 100730)
关键词:胰腺肿瘤;胸苷激酶;鸟苷;基因转移;坏死;肿瘤细胞;培养的
摘 要 目的 探讨含单纯疱疹病毒胸腺嘧啶核苷激酶摘 要 目的 探讨含单纯疱疹病毒胸腺嘧啶核苷激酶(HSV-TK)基因细胞对丙氧鸟苷(GCV)敏感度不均一的原因以及在GCV作用下细胞被杀伤的途径——坏死或凋亡。方法 将表达HSV-TK基因的重组逆转录病毒载体,分别直接导入生长速度不同的3个细胞系,胰腺癌细胞系(PC-2, PC-7)和猪肾小管上皮细胞系(LLC-PK1),计算转染前后细胞倍增时间,MTT法检测50%细胞生长受抑制时的GCV浓度(IC50值);流式细胞术检测细胞周期;对GCV作用细胞和(或)移植瘤进行光镜和电镜的形态观察及原位凋亡检测。结果 倍增时间分别为(31.2±0.1)、(48.3±0.1)、(53.9±0.1)h的细胞,其转染细胞IC50值分别为(0.73±0.12)、(0.93±0.16)、(1.22±0.06) μmol/L,呈正相关;细胞被阻滞在S期;经GCV作用的细胞肿胀崩解坏死,个别细胞表现凋亡;经GCV作用的移植瘤显示大片坏死。结论 HSV-TK/GCV系统对增殖旺盛的细胞作用更为显著,GCV作用的3个转染细胞系细胞的死亡途径主要为坏死。
, 百拇医药
Different susceptibility of cell lines to thymidine kinase/ganciclovir-mediated killing effect and the way of cell death
ZHANG Lei LIU Tonghua CUI Quancai GAO Jie
(Department of Pathology, Peking Union Medical College Hospital, Peking Union Medical College, Chinese Academy of Medical Sciences, Beijing 100730, China)
Abstract Objective To investigate the mechanism of variability of herpes simplex virus (HSV) thymidine kinase (TK)/ganciclovir (GCV)-mediated suicide effect obtained in three different cell lines and the ways in which this system-mediated cell killing occurs. Methods Recombinant retroviral vector expressing HSV-TK was transduced into three cell lines known with different growth rate (PC-2, PC-7 and LLC-PK1). The doubling time of the transduced and parental cells was calculated. MTT method was used to detect the concentration of GCV at which cell growth was inhibited by 50% (IC50 value). Cell cycle was analyzed by flow cytometry. Necrosis or apoptosis of cultured cells and/or xenografts was observed under light and electron microscope, and by in situ apoptosis detection. Results The doubling time of the three parental cell lines was (31.2±0.1) h, (48.3±0.1) h, and (53.9±0.1) h, separately. The IC50 values of their HSV-TK-transduced cell lines to GCV were (0.73±0.12) μmol/L, (0.93±0.16) μmol/L and (1.22±0.06) μmol/L, respectively and the IC50 value was correlated with the cell doubling time. Flow cytometry revealed S arrest. The majority of cells under treatment of GCV displayed swelling and collapse, but very few cells showed apoptosis. Large areas of necrosis were observed in the xenografts. Conclusions The cells with high growth rate are more susceptible to HSV-TK/GCV-mediated killing effect. Necrosis is the main way in which cells of the three HSV-TK-transduced cells lines die.
, 百拇医药
Key words Pancreatic neoplasms;Thymidine kinase;Guanosine;Gene transfer;Necrosis;Tumor cells, cultured
单纯疱疹病毒(herpes simples virus, HSV)胸腺嘧啶核苷激酶(thymidine kinase, TK)/丙氧鸟苷(ganciclovir, GCV)自杀基因系统已被证实在多种肿瘤的实验性基因治疗中具有显著疗效,并已用于脑肿瘤的临床实验基因治疗[1]。但在这个系统中还有许多问题尚未解决,如含HSV-TK基因的不同细胞对GCV敏感性不同的原因、受GCV作用的细胞发生凋亡还是坏死、携TK基因肿瘤细胞鼠移植瘤接受GCV治疗后对同源肿瘤细胞产生特异性免疫的机制等[2,3]。我们将TK基因转入多个细胞系,对这些问题进行初步探讨。
材料和方法
, 百拇医药
一、材料
人胰腺癌细胞系PC-2和PC-7为我科自建,猪肾小管上皮细胞系LLC-PK1(简称PK1)由协和医院肾内科实验室提供;含HSV-TK基因全长cDNA的重组逆转录病毒载体新霉素阻抗基因胸腺嘧啶核苷激酶(NTK)由美国Bedford Memorial Veterans医院Dr. Moolten惠赠;含β-半乳糖苷酶基因的对照重组逆转录病毒载体NCMVβ为我科自备。neo基因扩增引物:N1:5′-AGAGGCTATTCGGCTATGAC-3′和 N2:5′-GATACTTTCTCGGCAGGAG-3′由Cybersyn公司合成,扩增产物为292 bp;GCV由美国加州Syntex公司惠赠;原位凋亡检测试剂盒为Boehringer Mannheim公司产品;4周龄雌性Balb/c裸鼠购自中国科学院动物所。
二、方法
1.质粒DNA的转染: PC-2、PC-7及PK1细胞用含10%胎牛血清(Gibco公司)的RPMI 1640培养基,在37℃ 5% CO2条件下培养,当贴壁生长的细胞达50%~60%融合时,用Lipofectin介导的DNA转染方法, 将重组逆转录病毒载体新霉素阻抗基因胸腺嘧啶核苷激酶(NTK)及对照NCMVβ分别直接导入3个靶细胞系, 经G418(600 μg/ml)筛选2~3周后得到抗药性克隆,随机挑取克隆扩大培养,分别命名为PC-2/NTK、PC-7/NTK和PK1/NTK。
, 百拇医药
2.聚合酶链反应(PCR)扩增neo基因:按“分子克隆实验指南”方法[4]提取细胞基因组DNA,50 μl反应体系含:0.5 μg模板DNA,上、下游引物各0.5 μg, 1×PCR缓冲液,1.5 mmol/L MgCl2,2.0 mmol/L dNTP及5 UTaq DNA聚合酶,采用94℃变性1 min,59℃退火1 min;72℃延伸1 min的条件,扩增36个循环,产物行2%琼脂糖凝胶电泳进行分析,以未转染的PC-2细胞作阴性对照,以含neo基因的NTK质粒为阳性对照。
3.Northern blot分析TK基因表达:以NTK载体中的TK cDNA片段为探针,细胞总RNA的提取采用异硫氰酸胍一步法[5],RNA的电泳、转膜及cDNA的标记与杂交参阅文献[4]。
4.β-半乳糖苷酶表达检测:参阅文献[6]。
, http://www.100md.com 5.计算细胞倍增时间[7]:细胞以1.5×104/孔接种24孔板, 每种细胞3孔, 4 d后用锥虫蓝(又称台盼蓝)染料排除法计数活细胞, 倍增时间=时间(h)/细胞分裂次数(n), n=ln(p/x)/ln2(p为n次分裂后的细胞数, x为细胞接种数)。
6.噻唑蓝(MTT)法检测转化细胞对前体药物的敏感度及IC50值:GCV浓度取0、0.1、0.5、1、5、10、100、500、750、1 000 μmol/L,按Osaki等[8]的方法进行检测, 细胞存活率=用药组吸光度(A,曾称光密度OD)值/非用药组A值×100%,细胞生长抑制率=(1-用药组A值/非用药组A值)×100%。经Slide软件处理得出药物剂量-反应曲线,求出50%细胞受抑制时的药物浓度,即IC50值。
7.流式细胞术检测细胞周期: 收集约1×106个细胞, 70%预冷乙醇固定过夜, RNase消化后碘化丙锭(PI)标记,在Coulter公司EPICS流式细胞仪上进行DNA含量分析,检测细胞碎片或凋亡细胞及细胞周期。
, http://www.100md.com
8.药物作用细胞的形态观察与原位凋亡检测:用20 μmol/L GCV对NTK转染细胞作用5 d后,进行形态观察,并按试剂盒介绍的方法进行原位凋亡检测。
9.药物作用裸鼠移植瘤的光镜及电镜观察:6只4周龄雌性Balb/c裸鼠左侧背部皮下接种1×107个PC-2细胞,右侧接种1×107个PC-2/NTK细胞,2周后瘤体可触及时(约0.3 cm~0.4 cm),其中3只腹腔内注射GCV,150 mg/kg,2次/d,共5 d,另3只作为对照腹腔内注射PBS,停药后6~8周比较瘤体大小[9]。取GCV作用组PC-2/NTK细胞移植瘤制成标本,在光镜和电镜下观察细胞形态。
10.统计学处理用方差分析。
结果
1.转染细胞株的建立:G418筛选后所得PC-2/NTK、PC-7/NTK和PK1/NTK细胞株PCR检测,可见292 bp的neo基因扩增产物和154 bp的Ki-ras内参照扩增产物, 未转化的PC-2细胞只见Ki-ras扩增产物, 表明外源基因已进入转化的PC-2细胞(图1)。Northern blot杂交分析可见各转染细胞中均有1.3 kb TK mRNA杂交带, 证实外源TK基因可以有效表达且表达量基本相同(图2)。对NCMVβ转染各细胞进行β-半乳糖苷酶组织化学检测,可见其转染的PC-2、PC-7及PK1细胞均呈蓝色,表明对照NCMVβ载体已进入细胞并表达。
, 百拇医药
2.细胞倍增时间:对各转染前后细胞的倍增时间进行检测,发现(表1)各转染细胞与相应的未转染细胞彼此间差异无显著性(方差分析,P>0.05),表明外源基因的整合与表达对细胞生长速度无影响;但PC-2、PC-7、PK1 3种细胞间则差异有显著性(P<0.05),增殖速度顺序为PK1>PC-2>PC-7。
3.转染细胞对GCV的敏感性及其差异:MTT法检测示(表2),PC-2/NTK、PC-7/NTK、PK1/NTK的IC50值分别为(0.93±0.16)、(1.22±0.06)、(0.73±0.12) μmol/L,均低于相应未转染细胞和对照质粒转染细胞600~800倍,差异有显著性(方差分析,P<0.01),表明含TK基因细胞对GCV的敏感性明显增高。但NTK转染的PC-2、PC-7、PK1细胞之间对GCV的敏感性有所不同,PK1/NTK与PC-2/NTK和PC-7/NTK的IC50值差异有显著性(P<0.05), PC-2/NTK与PC-7/NTK间的IC50值虽无明显差异,但亦是升高趋势,这种IC50值PK1/NTK
, http://www.100md.com
1:pBR322/Hinf I分子量标准;2:NTK质粒;3:PC-2细胞;4:PC-2/NTK细胞;5:PC-7/NTK细胞;6:PK1/NTK细胞,292 bp为neo基因扩增产物,154 bp为Ki-ras基因扩增产物
图1 2%琼脂糖凝胶电泳检测neo基因扩增结果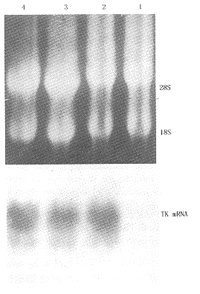
1:PC-2,2:PC-2/NTK,3:PC-7/NTK,4:PK1/NTK。上图:RNA上样量参照;下图:Northern印迹杂交
图2 Northern blot杂交分析转染前后细胞中
HSV-TK mRNA表达
, 百拇医药
表1 转染前后各细胞系细胞倍增时间
细胞系
倍增时间(h)
PK1
31.2±0.1*
PK1/NCMVβ
31.1±0.1
PK1/NTK
32.0±0.1
PC-2
8.3±0.1*
, http://www.100md.com PC-2/NCMVβ
48.2±0.1
PC-2/NTK
48.7±0.3
PC-7
53.9±0.1*
PC-7/NCMVβ
53.8±0.1
PC-7/NTK
53.6±0.3
*3种细胞间差异有显著性(P<0.05)表2 GCV对转染前后细胞的IC50值
, 百拇医药
细胞系
IC50值(μmol/L)
PK1
595.00±93.00*
PK1/NCMVβ
555.00±64.00*
PK1/NTK
0.73± 0.12**
PC-2
563.00±40.00*
, http://www.100md.com
PC-2/NCMVβ
592.00±68.00*
PC-2/NTK
0.93± 0.16**
PC-7
823.00±83.00*
PC-7/NCMVβ
687.00±58.00*
PC-7/NTK
1.22± 0.06**
, 百拇医药
*与PK1/NTK、PC-2/NTK、PC-7/NTK比较差异有非常显著性(P<0.01),**3种细胞间差异亦有显著性(P<0.05) 4.GCV作用细胞坏死与凋亡的分析:从流式细胞术分析结果还可看出,转染细胞经GCV作用后,坏死细胞碎片增多,未见凋亡细胞峰。光镜观察20 μmol/L GCV作用5 d的NTK转染细胞,可见多数细胞肿大,胞质发空,核亦肿胀,趋于溶解,部分细胞已飘浮死亡(图4~6);原位凋亡检测发现个别细胞呈亮绿荧光。裸鼠体内GCV药物敏感试验显示:PC-2/NTK细胞移植瘤在注射GCV后生长停止并逐渐缩小,而处于同种体内环境下的PC-2细胞移植瘤则不受GCV影响,腹腔应用PBS的对照组移植瘤亦是不断生长。将受GCV作用的剩余PC-2/NTK移植瘤取下,HE染色后光镜观察发现为大片坏死组织(图7,8)。电镜观察可见大多数细胞表现为坏死,少数细胞为凋亡。
, 百拇医药
右图S期细胞比例增高
图3 GCV作用的PC-2(左图)与PC-2/NTK(右图)细胞的流式细胞术分析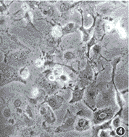
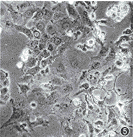
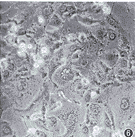
图4~6 PC-2/NTK(图4)、PC-7/NTK(图5)及PK1/NTK(图6)细胞经GCV作用后细胞肿胀,胞质发空、飘浮,趋于死亡
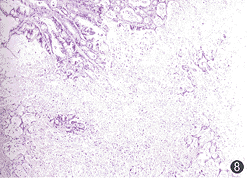
, http://www.100md.com
图7,8 GCV作用的PC-2/NTK细胞移植瘤主要表现为坏死,GCV抑制了PC-2/NTK细胞移植瘤的生长(图7右侧鼠的右侧背部,左鼠为实验对照);PC-2/NTK移植瘤见大片坏死(图8) HE×40讨论
本研究再次证实了HSV-TK/GCV系统对胰腺癌细胞的体外和裸鼠体内的细胞杀伤作用。该系统基因治疗的原理是:导入细胞的HSV-TK基因表达产物可以将核苷类似物GCV磷酸化,生成单磷酸化物,后者再由细胞的磷酸激酶转化成二磷酸或三磷酸化物,抑制DNA聚合酶的功能或竞争性地掺入DNA,造成DNA合成终止,细胞死亡[10],故该系统是将细胞阻滞在S期。
流式细胞术分析结果显示:在GCV作用下,较多细胞被阻滞在S期,证实了这一点。由于增殖旺盛的细胞处于S期的较多,HSV-TK/GCV系统应对增殖旺盛的细胞作用更为明显,我们的药敏试验结果的确体现了这一规律,IC50值随着不同细胞倍增时间的增加而上升,受同一逆转录病毒载体转染的不同细胞对GCV敏感度不同。许多其他研究者亦观察到了该现象[11]。这对HSV-TK/GCV系统应用于临床试验治疗时对病人或肿瘤的选择具有指导意义。
, 百拇医药
在本试验中检测到PC-2/NTK与PC-7/NTK对GCV的敏感性与倍增时间呈正相关,但差异无显著性。这可能是由于PC-2与PC-7细胞倍增时间的差异虽有显著意义,但其差值较PK1细胞与二者倍增时间的差值小,故需扩大试验规模进行再次统计。PK1为猪肾小管上皮细胞,有可能恰恰是种系的不同造成了PK1与PC-2及PC-7细胞倍增时间差异较大,从而对GCV显示出更大的敏感性。
目前认为药物敏感基因导致肿瘤细胞死亡的途径有两种:一是前体药物诱导细胞发生凋亡[12];另一是前体药物导致细胞发生坏死[13]。由于药敏基因治疗的最终目的是杀伤细胞,因此细胞死亡途径开始并未引起重视,但近年有关药敏基因体内治疗可引起机体对同源未转染细胞的长期免疫,以及药敏基因治疗引起局部淋巴细胞浸润,联合应用药敏与免疫基因治疗可以显著提高疗效等报道不断涌现[14,15],而细胞死亡途径的阐明有助于免疫现象的解释,故而引起重视。我们通过流式细胞术、光镜和电镜检测发现,3种NTK转染细胞在GCV作用下均主要表现为坏死,个别细胞为凋亡。这给应用于体内基因治疗时获得对同源肿瘤细胞的长期免疫带来了希望,因为细胞的坏死一方面可以引起非特异性免疫反应,吸引免疫效应细胞至肿瘤所在部位发挥作用,另一方面可以使大量肿瘤抗原突然而有效地呈现于免疫系统,产生特异性抗瘤免疫[3]。
, http://www.100md.com
我们的试验结果表明:HSV-TK/GCV系统对增殖旺盛的细胞作用更为显著,GCV作用的3个转染细胞系细胞的死亡途径主要为坏死。
基金项目:卫生部科学研究基金资助项目(1998-1-010)
通信作者:刘彤华(Email:liuth@csc.pumch.ac.cn)
参考文献:
[1]Rigg A,Sikora K. Genetic prodrug activation therapy. Mol Med Today,1997,3: 359-366.
[2]Beck C, Cayeux S, Lupton SD, et al. The thymidine kinase/ganciclovir-mediated “suicide” effect is variable in different tumor cells. Hum Gene Ther, 1995, 6: 1525-1530.
, 百拇医药
[3]Vile RG, Diaz RM, Castleden S, et al. Targeted gene therapy for cancer: herpes simplex virus thymidine kinase gene-mediated cell killing leads to anti-tumor immunity that can be augmented by co-expression of cytokines in the tumour cells. Biochem Soc Trans, 1997, 25: 717-722.
[4]Sambrook J, Fritsch EF, Maniatis T, et al. Extraction, purification, and analysis of messenger RNA from Eukaryotic Cells. In: Sambrook J, Fritsch EF, Maniatis T , et al, eds. Molecular cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press, 1989, 7.3-7.56.
, 百拇医药
[5]Chomczynski P,Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987, 162: 156-159.
[6]Heike Y, Takahashi M, Kanegae Y, et al. Interleukin-2 gene transduction into freshly isolated lung adenocarcinoma cells with adenoviral vectors. Hum Gene Ther, 1997, 8:1-14.
[7]Vincent AJ, Esandi MC, Avezaat CJ, et al. Preclinical testing of recombinant adenoviral herpes simplex virus-thymidine kinase gene therapy for central nervous system malignancies. Neurosurgery, 1997, 41: 442-452 .
, 百拇医药
[8]Osaki T, Tanio Y, Tachibana I, et al. Gene therapy for carcinoembryonic antigen- producing human lung cancer cells by cell type-specific expression of herpes simplex virus thymidine kinase gene. Cancer Res, 1994, 54: 5258-5261.
[9]Yamamoto S, Suzuki S, Hoshino A , et al. Herpes simplex virus thymidine kinase/ganciclovir-mediated killing of tumor cells induces tumor-specific cytotoxic T cells in mice. Cancer Gene Ther, 1997, 4: 91-96.
, http://www.100md.com
[10]Matthews T, Boehme R. Antiviral activity and mechanism of action of ganciclovir. Rev Infect Dis, 1988,10 (suppl 3): s490-s494.
[11]Shine HD, Trask TW, Perez-Cruet MJ, et al. Adenovirus-mediated gene therapy for CNS tumors. Efficacy and toxicity in experimental models. Cancer Gene Ther, 1995, 2: 309-342.
[12]Denning C, Pitts JD. Bystander effects of different enzyme-prodrug systems for cancer gene therapy depend on different pathways for intercellular transfer of toxic metabolites, a factor that will govern clinical choice of appropriate regimes. Human Gene Ther, 1997, 8: 1825-1835.
, 百拇医药
[13]Vile RG, Castleden S, Marshall J, et al. Generation of an anti-tumour immune response in a non-immunogenic tumour: HSVtk killing in vivo stimulates a mononuclear cell infiltrate and a Th1-like profile of intratumoural cytokine expression. Int J Cancer, 1997, 71: 267-274.
[14]Consalvo M, Mullen CA, Modesti A, et al. 5-Fluorocytosine induced eradication of murine adenocarcinomas engineered to express the cytosine deaminase suicide gene requires host immune competence and leaves an efficient memory. J Immunol, 1995,154: 5302-5312.
[15]Benedetti S, Dimeco F, Pollo B, et al. Limited efficacy of the HSV-TK/GCV system for gene therapy of malignant gliomas and perspectives for the combined transduction of the interleukin-4 gene. Hum Gene Ther, 1997, 8: 1345-1353.
收稿日期:1999-12-20, http://www.100md.com
单位:张雷(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);刘彤华(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);崔全才(中国医学科学院中国协和医科大学 北京协和医院病理科 100730);高洁(中国医学科学院中国协和医科大学 北京协和医院病理科 100730)
关键词:胰腺肿瘤;胸苷激酶;鸟苷;基因转移;坏死;肿瘤细胞;培养的
摘 要 目的 探讨含单纯疱疹病毒胸腺嘧啶核苷激酶摘 要 目的 探讨含单纯疱疹病毒胸腺嘧啶核苷激酶(HSV-TK)基因细胞对丙氧鸟苷(GCV)敏感度不均一的原因以及在GCV作用下细胞被杀伤的途径——坏死或凋亡。方法 将表达HSV-TK基因的重组逆转录病毒载体,分别直接导入生长速度不同的3个细胞系,胰腺癌细胞系(PC-2, PC-7)和猪肾小管上皮细胞系(LLC-PK1),计算转染前后细胞倍增时间,MTT法检测50%细胞生长受抑制时的GCV浓度(IC50值);流式细胞术检测细胞周期;对GCV作用细胞和(或)移植瘤进行光镜和电镜的形态观察及原位凋亡检测。结果 倍增时间分别为(31.2±0.1)、(48.3±0.1)、(53.9±0.1)h的细胞,其转染细胞IC50值分别为(0.73±0.12)、(0.93±0.16)、(1.22±0.06) μmol/L,呈正相关;细胞被阻滞在S期;经GCV作用的细胞肿胀崩解坏死,个别细胞表现凋亡;经GCV作用的移植瘤显示大片坏死。结论 HSV-TK/GCV系统对增殖旺盛的细胞作用更为显著,GCV作用的3个转染细胞系细胞的死亡途径主要为坏死。
, 百拇医药
Different susceptibility of cell lines to thymidine kinase/ganciclovir-mediated killing effect and the way of cell death
ZHANG Lei LIU Tonghua CUI Quancai GAO Jie
(Department of Pathology, Peking Union Medical College Hospital, Peking Union Medical College, Chinese Academy of Medical Sciences, Beijing 100730, China)
Abstract Objective To investigate the mechanism of variability of herpes simplex virus (HSV) thymidine kinase (TK)/ganciclovir (GCV)-mediated suicide effect obtained in three different cell lines and the ways in which this system-mediated cell killing occurs. Methods Recombinant retroviral vector expressing HSV-TK was transduced into three cell lines known with different growth rate (PC-2, PC-7 and LLC-PK1). The doubling time of the transduced and parental cells was calculated. MTT method was used to detect the concentration of GCV at which cell growth was inhibited by 50% (IC50 value). Cell cycle was analyzed by flow cytometry. Necrosis or apoptosis of cultured cells and/or xenografts was observed under light and electron microscope, and by in situ apoptosis detection. Results The doubling time of the three parental cell lines was (31.2±0.1) h, (48.3±0.1) h, and (53.9±0.1) h, separately. The IC50 values of their HSV-TK-transduced cell lines to GCV were (0.73±0.12) μmol/L, (0.93±0.16) μmol/L and (1.22±0.06) μmol/L, respectively and the IC50 value was correlated with the cell doubling time. Flow cytometry revealed S arrest. The majority of cells under treatment of GCV displayed swelling and collapse, but very few cells showed apoptosis. Large areas of necrosis were observed in the xenografts. Conclusions The cells with high growth rate are more susceptible to HSV-TK/GCV-mediated killing effect. Necrosis is the main way in which cells of the three HSV-TK-transduced cells lines die.
, 百拇医药
Key words Pancreatic neoplasms;Thymidine kinase;Guanosine;Gene transfer;Necrosis;Tumor cells, cultured
单纯疱疹病毒(herpes simples virus, HSV)胸腺嘧啶核苷激酶(thymidine kinase, TK)/丙氧鸟苷(ganciclovir, GCV)自杀基因系统已被证实在多种肿瘤的实验性基因治疗中具有显著疗效,并已用于脑肿瘤的临床实验基因治疗[1]。但在这个系统中还有许多问题尚未解决,如含HSV-TK基因的不同细胞对GCV敏感性不同的原因、受GCV作用的细胞发生凋亡还是坏死、携TK基因肿瘤细胞鼠移植瘤接受GCV治疗后对同源肿瘤细胞产生特异性免疫的机制等[2,3]。我们将TK基因转入多个细胞系,对这些问题进行初步探讨。
材料和方法
, 百拇医药
一、材料
人胰腺癌细胞系PC-2和PC-7为我科自建,猪肾小管上皮细胞系LLC-PK1(简称PK1)由协和医院肾内科实验室提供;含HSV-TK基因全长cDNA的重组逆转录病毒载体新霉素阻抗基因胸腺嘧啶核苷激酶(NTK)由美国Bedford Memorial Veterans医院Dr. Moolten惠赠;含β-半乳糖苷酶基因的对照重组逆转录病毒载体NCMVβ为我科自备。neo基因扩增引物:N1:5′-AGAGGCTATTCGGCTATGAC-3′和 N2:5′-GATACTTTCTCGGCAGGAG-3′由Cybersyn公司合成,扩增产物为292 bp;GCV由美国加州Syntex公司惠赠;原位凋亡检测试剂盒为Boehringer Mannheim公司产品;4周龄雌性Balb/c裸鼠购自中国科学院动物所。
二、方法
1.质粒DNA的转染: PC-2、PC-7及PK1细胞用含10%胎牛血清(Gibco公司)的RPMI 1640培养基,在37℃ 5% CO2条件下培养,当贴壁生长的细胞达50%~60%融合时,用Lipofectin介导的DNA转染方法, 将重组逆转录病毒载体新霉素阻抗基因胸腺嘧啶核苷激酶(NTK)及对照NCMVβ分别直接导入3个靶细胞系, 经G418(600 μg/ml)筛选2~3周后得到抗药性克隆,随机挑取克隆扩大培养,分别命名为PC-2/NTK、PC-7/NTK和PK1/NTK。
, 百拇医药
2.聚合酶链反应(PCR)扩增neo基因:按“分子克隆实验指南”方法[4]提取细胞基因组DNA,50 μl反应体系含:0.5 μg模板DNA,上、下游引物各0.5 μg, 1×PCR缓冲液,1.5 mmol/L MgCl2,2.0 mmol/L dNTP及5 UTaq DNA聚合酶,采用94℃变性1 min,59℃退火1 min;72℃延伸1 min的条件,扩增36个循环,产物行2%琼脂糖凝胶电泳进行分析,以未转染的PC-2细胞作阴性对照,以含neo基因的NTK质粒为阳性对照。
3.Northern blot分析TK基因表达:以NTK载体中的TK cDNA片段为探针,细胞总RNA的提取采用异硫氰酸胍一步法[5],RNA的电泳、转膜及cDNA的标记与杂交参阅文献[4]。
4.β-半乳糖苷酶表达检测:参阅文献[6]。
, http://www.100md.com 5.计算细胞倍增时间[7]:细胞以1.5×104/孔接种24孔板, 每种细胞3孔, 4 d后用锥虫蓝(又称台盼蓝)染料排除法计数活细胞, 倍增时间=时间(h)/细胞分裂次数(n), n=ln(p/x)/ln2(p为n次分裂后的细胞数, x为细胞接种数)。
6.噻唑蓝(MTT)法检测转化细胞对前体药物的敏感度及IC50值:GCV浓度取0、0.1、0.5、1、5、10、100、500、750、1 000 μmol/L,按Osaki等[8]的方法进行检测, 细胞存活率=用药组吸光度(A,曾称光密度OD)值/非用药组A值×100%,细胞生长抑制率=(1-用药组A值/非用药组A值)×100%。经Slide软件处理得出药物剂量-反应曲线,求出50%细胞受抑制时的药物浓度,即IC50值。
7.流式细胞术检测细胞周期: 收集约1×106个细胞, 70%预冷乙醇固定过夜, RNase消化后碘化丙锭(PI)标记,在Coulter公司EPICS流式细胞仪上进行DNA含量分析,检测细胞碎片或凋亡细胞及细胞周期。
, http://www.100md.com
8.药物作用细胞的形态观察与原位凋亡检测:用20 μmol/L GCV对NTK转染细胞作用5 d后,进行形态观察,并按试剂盒介绍的方法进行原位凋亡检测。
9.药物作用裸鼠移植瘤的光镜及电镜观察:6只4周龄雌性Balb/c裸鼠左侧背部皮下接种1×107个PC-2细胞,右侧接种1×107个PC-2/NTK细胞,2周后瘤体可触及时(约0.3 cm~0.4 cm),其中3只腹腔内注射GCV,150 mg/kg,2次/d,共5 d,另3只作为对照腹腔内注射PBS,停药后6~8周比较瘤体大小[9]。取GCV作用组PC-2/NTK细胞移植瘤制成标本,在光镜和电镜下观察细胞形态。
10.统计学处理用方差分析。
结果
1.转染细胞株的建立:G418筛选后所得PC-2/NTK、PC-7/NTK和PK1/NTK细胞株PCR检测,可见292 bp的neo基因扩增产物和154 bp的Ki-ras内参照扩增产物, 未转化的PC-2细胞只见Ki-ras扩增产物, 表明外源基因已进入转化的PC-2细胞(图1)。Northern blot杂交分析可见各转染细胞中均有1.3 kb TK mRNA杂交带, 证实外源TK基因可以有效表达且表达量基本相同(图2)。对NCMVβ转染各细胞进行β-半乳糖苷酶组织化学检测,可见其转染的PC-2、PC-7及PK1细胞均呈蓝色,表明对照NCMVβ载体已进入细胞并表达。
, 百拇医药
2.细胞倍增时间:对各转染前后细胞的倍增时间进行检测,发现(表1)各转染细胞与相应的未转染细胞彼此间差异无显著性(方差分析,P>0.05),表明外源基因的整合与表达对细胞生长速度无影响;但PC-2、PC-7、PK1 3种细胞间则差异有显著性(P<0.05),增殖速度顺序为PK1>PC-2>PC-7。
3.转染细胞对GCV的敏感性及其差异:MTT法检测示(表2),PC-2/NTK、PC-7/NTK、PK1/NTK的IC50值分别为(0.93±0.16)、(1.22±0.06)、(0.73±0.12) μmol/L,均低于相应未转染细胞和对照质粒转染细胞600~800倍,差异有显著性(方差分析,P<0.01),表明含TK基因细胞对GCV的敏感性明显增高。但NTK转染的PC-2、PC-7、PK1细胞之间对GCV的敏感性有所不同,PK1/NTK与PC-2/NTK和PC-7/NTK的IC50值差异有显著性(P<0.05), PC-2/NTK与PC-7/NTK间的IC50值虽无明显差异,但亦是升高趋势,这种IC50值PK1/NTK
, http://www.100md.com
1:pBR322/Hinf I分子量标准;2:NTK质粒;3:PC-2细胞;4:PC-2/NTK细胞;5:PC-7/NTK细胞;6:PK1/NTK细胞,292 bp为neo基因扩增产物,154 bp为Ki-ras基因扩增产物
图1 2%琼脂糖凝胶电泳检测neo基因扩增结果

1:PC-2,2:PC-2/NTK,3:PC-7/NTK,4:PK1/NTK。上图:RNA上样量参照;下图:Northern印迹杂交
图2 Northern blot杂交分析转染前后细胞中
HSV-TK mRNA表达
, 百拇医药
表1 转染前后各细胞系细胞倍增时间
细胞系
倍增时间(h)
PK1
31.2±0.1*
PK1/NCMVβ
31.1±0.1
PK1/NTK
32.0±0.1
PC-2
8.3±0.1*
, http://www.100md.com PC-2/NCMVβ
48.2±0.1
PC-2/NTK
48.7±0.3
PC-7
53.9±0.1*
PC-7/NCMVβ
53.8±0.1
PC-7/NTK
53.6±0.3
*3种细胞间差异有显著性(P<0.05)表2 GCV对转染前后细胞的IC50值
, 百拇医药
细胞系
IC50值(μmol/L)
PK1
595.00±93.00*
PK1/NCMVβ
555.00±64.00*
PK1/NTK
0.73± 0.12**
PC-2
563.00±40.00*
, http://www.100md.com
PC-2/NCMVβ
592.00±68.00*
PC-2/NTK
0.93± 0.16**
PC-7
823.00±83.00*
PC-7/NCMVβ
687.00±58.00*
PC-7/NTK
1.22± 0.06**
, 百拇医药
*与PK1/NTK、PC-2/NTK、PC-7/NTK比较差异有非常显著性(P<0.01),**3种细胞间差异亦有显著性(P<0.05) 4.GCV作用细胞坏死与凋亡的分析:从流式细胞术分析结果还可看出,转染细胞经GCV作用后,坏死细胞碎片增多,未见凋亡细胞峰。光镜观察20 μmol/L GCV作用5 d的NTK转染细胞,可见多数细胞肿大,胞质发空,核亦肿胀,趋于溶解,部分细胞已飘浮死亡(图4~6);原位凋亡检测发现个别细胞呈亮绿荧光。裸鼠体内GCV药物敏感试验显示:PC-2/NTK细胞移植瘤在注射GCV后生长停止并逐渐缩小,而处于同种体内环境下的PC-2细胞移植瘤则不受GCV影响,腹腔应用PBS的对照组移植瘤亦是不断生长。将受GCV作用的剩余PC-2/NTK移植瘤取下,HE染色后光镜观察发现为大片坏死组织(图7,8)。电镜观察可见大多数细胞表现为坏死,少数细胞为凋亡。

, 百拇医药
右图S期细胞比例增高
图3 GCV作用的PC-2(左图)与PC-2/NTK(右图)细胞的流式细胞术分析



图4~6 PC-2/NTK(图4)、PC-7/NTK(图5)及PK1/NTK(图6)细胞经GCV作用后细胞肿胀,胞质发空、飘浮,趋于死亡


, http://www.100md.com
图7,8 GCV作用的PC-2/NTK细胞移植瘤主要表现为坏死,GCV抑制了PC-2/NTK细胞移植瘤的生长(图7右侧鼠的右侧背部,左鼠为实验对照);PC-2/NTK移植瘤见大片坏死(图8) HE×40讨论
本研究再次证实了HSV-TK/GCV系统对胰腺癌细胞的体外和裸鼠体内的细胞杀伤作用。该系统基因治疗的原理是:导入细胞的HSV-TK基因表达产物可以将核苷类似物GCV磷酸化,生成单磷酸化物,后者再由细胞的磷酸激酶转化成二磷酸或三磷酸化物,抑制DNA聚合酶的功能或竞争性地掺入DNA,造成DNA合成终止,细胞死亡[10],故该系统是将细胞阻滞在S期。
流式细胞术分析结果显示:在GCV作用下,较多细胞被阻滞在S期,证实了这一点。由于增殖旺盛的细胞处于S期的较多,HSV-TK/GCV系统应对增殖旺盛的细胞作用更为明显,我们的药敏试验结果的确体现了这一规律,IC50值随着不同细胞倍增时间的增加而上升,受同一逆转录病毒载体转染的不同细胞对GCV敏感度不同。许多其他研究者亦观察到了该现象[11]。这对HSV-TK/GCV系统应用于临床试验治疗时对病人或肿瘤的选择具有指导意义。
, 百拇医药
在本试验中检测到PC-2/NTK与PC-7/NTK对GCV的敏感性与倍增时间呈正相关,但差异无显著性。这可能是由于PC-2与PC-7细胞倍增时间的差异虽有显著意义,但其差值较PK1细胞与二者倍增时间的差值小,故需扩大试验规模进行再次统计。PK1为猪肾小管上皮细胞,有可能恰恰是种系的不同造成了PK1与PC-2及PC-7细胞倍增时间差异较大,从而对GCV显示出更大的敏感性。
目前认为药物敏感基因导致肿瘤细胞死亡的途径有两种:一是前体药物诱导细胞发生凋亡[12];另一是前体药物导致细胞发生坏死[13]。由于药敏基因治疗的最终目的是杀伤细胞,因此细胞死亡途径开始并未引起重视,但近年有关药敏基因体内治疗可引起机体对同源未转染细胞的长期免疫,以及药敏基因治疗引起局部淋巴细胞浸润,联合应用药敏与免疫基因治疗可以显著提高疗效等报道不断涌现[14,15],而细胞死亡途径的阐明有助于免疫现象的解释,故而引起重视。我们通过流式细胞术、光镜和电镜检测发现,3种NTK转染细胞在GCV作用下均主要表现为坏死,个别细胞为凋亡。这给应用于体内基因治疗时获得对同源肿瘤细胞的长期免疫带来了希望,因为细胞的坏死一方面可以引起非特异性免疫反应,吸引免疫效应细胞至肿瘤所在部位发挥作用,另一方面可以使大量肿瘤抗原突然而有效地呈现于免疫系统,产生特异性抗瘤免疫[3]。
, http://www.100md.com
我们的试验结果表明:HSV-TK/GCV系统对增殖旺盛的细胞作用更为显著,GCV作用的3个转染细胞系细胞的死亡途径主要为坏死。
基金项目:卫生部科学研究基金资助项目(1998-1-010)
通信作者:刘彤华(Email:liuth@csc.pumch.ac.cn)
参考文献:
[1]Rigg A,Sikora K. Genetic prodrug activation therapy. Mol Med Today,1997,3: 359-366.
[2]Beck C, Cayeux S, Lupton SD, et al. The thymidine kinase/ganciclovir-mediated “suicide” effect is variable in different tumor cells. Hum Gene Ther, 1995, 6: 1525-1530.
, 百拇医药
[3]Vile RG, Diaz RM, Castleden S, et al. Targeted gene therapy for cancer: herpes simplex virus thymidine kinase gene-mediated cell killing leads to anti-tumor immunity that can be augmented by co-expression of cytokines in the tumour cells. Biochem Soc Trans, 1997, 25: 717-722.
[4]Sambrook J, Fritsch EF, Maniatis T, et al. Extraction, purification, and analysis of messenger RNA from Eukaryotic Cells. In: Sambrook J, Fritsch EF, Maniatis T , et al, eds. Molecular cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press, 1989, 7.3-7.56.
, 百拇医药
[5]Chomczynski P,Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987, 162: 156-159.
[6]Heike Y, Takahashi M, Kanegae Y, et al. Interleukin-2 gene transduction into freshly isolated lung adenocarcinoma cells with adenoviral vectors. Hum Gene Ther, 1997, 8:1-14.
[7]Vincent AJ, Esandi MC, Avezaat CJ, et al. Preclinical testing of recombinant adenoviral herpes simplex virus-thymidine kinase gene therapy for central nervous system malignancies. Neurosurgery, 1997, 41: 442-452 .
, 百拇医药
[8]Osaki T, Tanio Y, Tachibana I, et al. Gene therapy for carcinoembryonic antigen- producing human lung cancer cells by cell type-specific expression of herpes simplex virus thymidine kinase gene. Cancer Res, 1994, 54: 5258-5261.
[9]Yamamoto S, Suzuki S, Hoshino A , et al. Herpes simplex virus thymidine kinase/ganciclovir-mediated killing of tumor cells induces tumor-specific cytotoxic T cells in mice. Cancer Gene Ther, 1997, 4: 91-96.
, http://www.100md.com
[10]Matthews T, Boehme R. Antiviral activity and mechanism of action of ganciclovir. Rev Infect Dis, 1988,10 (suppl 3): s490-s494.
[11]Shine HD, Trask TW, Perez-Cruet MJ, et al. Adenovirus-mediated gene therapy for CNS tumors. Efficacy and toxicity in experimental models. Cancer Gene Ther, 1995, 2: 309-342.
[12]Denning C, Pitts JD. Bystander effects of different enzyme-prodrug systems for cancer gene therapy depend on different pathways for intercellular transfer of toxic metabolites, a factor that will govern clinical choice of appropriate regimes. Human Gene Ther, 1997, 8: 1825-1835.
, 百拇医药
[13]Vile RG, Castleden S, Marshall J, et al. Generation of an anti-tumour immune response in a non-immunogenic tumour: HSVtk killing in vivo stimulates a mononuclear cell infiltrate and a Th1-like profile of intratumoural cytokine expression. Int J Cancer, 1997, 71: 267-274.
[14]Consalvo M, Mullen CA, Modesti A, et al. 5-Fluorocytosine induced eradication of murine adenocarcinomas engineered to express the cytosine deaminase suicide gene requires host immune competence and leaves an efficient memory. J Immunol, 1995,154: 5302-5312.
[15]Benedetti S, Dimeco F, Pollo B, et al. Limited efficacy of the HSV-TK/GCV system for gene therapy of malignant gliomas and perspectives for the combined transduction of the interleukin-4 gene. Hum Gene Ther, 1997, 8: 1345-1353.
收稿日期:1999-12-20, http://www.100md.com