细胞凋亡研究进展
作者:沈忠英
单位:沈忠英(汕头大学医学院肿瘤病理学研究室 515031)
关键词:
中华病理学杂志000123 生物体内环境的稳定,不但依赖细胞增殖和分化,也依赖于细胞的凋亡。细胞凋亡(apoptosis)又称编程性死亡,是生物界重要的生命现象之一。从线虫至高等哺乳类动物,从胚胎至成人,从生理到病理,从生到死整个过程,体内不同的细胞多具有此种死亡形式。早在100多年前Carl Vogt 已发现这种死亡形式[1]。1972年Kerr等人重新提出研究,并命名为凋亡(apoptosis)。其后在凋亡的形态学和生物化学等领域取得新的认识。近期的研究在3方面有明确的进展。首先,从研究小线虫(C. elegans)凋亡调节基因,证实凋亡的发展是由遗传基因控制,其中以Ced-9, Ced-3和Ced-4基因的作用最先确定,哺乳动物也有相应的同源基因[2]。其次,阐明凋亡信号传递途径,特殊的死亡信号分子激活半胱氨酸天冬氨酸蛋白酶家族(称为caspases),诱导细胞凋亡。第三,研究了凋亡和一些疾病的关系,了解疾病发病机制及应用凋亡理论和实践来防治疾病。
, http://www.100md.com
一、细胞凋亡的形态学和生物化学改变
细胞凋亡的形态改变[3]是多阶段的,首先是细胞缩小,胞质凝缩,内质网疏松并和胞膜融合,核糖体、线粒体等聚集,但结构无明显改变。染色质逐渐凝集成新月状,附在核膜周边,嗜碱性增强。以后细胞核固缩成均一的致密物,进而核碎裂,胞膜完整。继之核膜出芽,固缩染色质脱落,形成膜包凋亡小体(apoptotic bodies)。最终凋亡小体被周围吞噬细胞吞噬降解。
随着细胞凋亡形态的研究,细胞生化的改变也逐步被阐明。(1)钙离子和蛋白激酶改变:细胞内Ca2+的堆积和重新分布,细胞核内Ca2+的增多[4], 激活核酸内切酶的活性,蛋白激酶C在不同细胞类别和不同周期活性表现不一。(2)核酸内切酶激活[5]把DNA内切成180碱基对倍数的核苷酸片段,呈梯状电泳现象。(3)组织谷氨酰胺转移酶的积累并激活。(4)细胞骨架如肌动蛋白的变化。(5)细胞表面糖链、植物血凝素与玻连蛋白受体增加,磷脂酰丝氨酸的外露改变细胞表面的生化特性。
, 百拇医药
二、凋亡产生的3步骤
凋亡的发生和发展概括为3个阶段[6]:信号传递阶段、中央调控阶段和结构改变阶段。
1.信号传递[7]:诱导凋亡的细胞外因素(包括环境因素和体内因素)众多,进入细胞内是经信号传递阶段。各种诱导凋亡因子进入细胞内的途径是多种多样的,其中主要的是通过受体介导。接受凋亡信号的受体位于细胞表面, 称为死亡受体(death receptors, DR),当死亡配体(death ligands )和它结合激活死亡蛋白酶系统(death caspase)可以在几小时内诱导细胞凋亡。 死亡受体有肿瘤坏死因子受体基因家族,CD95(Fas或Apol)和DR(或APO)系列。死亡受体分为细胞膜外和胞质两区域,前者传导死亡信号,后者称死亡区域(death domain),参与激发蛋白酶系列和细胞产生凋亡调节机制[8]。
, http://www.100md.com 2.中央调控:凋亡激发因子作用在线粒体,使线粒体内死亡基因ced-3/白细胞介素1β转化酶(ICE)和ced-4 (ced为线虫基因,ICE为哺乳类基因)及死亡抑制基因ced-9/bcl-2(ced-9 在线虫体内,哺乳类动物相应基因为bcl-2)激活,两者何居优势,决定细胞存活或凋亡。当ced-9/bcl-2 和ced-4(连接蛋白)和ced-3/ICE相结合,ced-3不能活化,防止一连串caspases 级联反应,细胞存活[9];当ced-9/bcl-2被促凋亡因子EGL-1结合,bcl-2失活,ced-4使ced-3/ICE活化引起细胞凋亡。线粒体释放细胞色素c(Cyto c)亦可使caspases活化,产生蛋白溶解,引起细胞凋亡。
3.细胞结构改变:在前两阶段基础上,凋亡细胞出现特异的形态变化如细胞皱缩,核致密,微绒毛消失。生化特点是多种酶活化。细胞核的改变,认为是caspases活化的DNA酶(CAD)进入细胞核内使染色体的DNA断裂引起细胞死亡[10]。CAD的抑制因子ICAD拮抗CAD[11]。
, 百拇医药
三、凋亡发展的中心问题
最近,凋亡发展过程的研究最关注的是线粒体的作用、蛋白酶系统的级联反应(caspase cascade)和各种死亡基因及其产物的调节作用。
1.线粒体:在原核细胞内线粒体前身是一种小的共生细菌,它控制细胞在有氧环境下的生活和死亡。这种共生菌的存在由不稳定至稳定及参加核基因谱变成专性共生,是细胞进化现象[12]。细胞内氧化磷酸化,能量代谢和抗活性氧化有赖于线粒体的功能。线粒体的早期改变为线粒体膜通透性变化和线粒体转膜电位(mitochondrial transmembrane potential)降低[12],膜间孔开放,离子通过,内膜H+梯度破坏,基质渗透压升高,线粒体体积扩大,外膜破裂。caspases活性蛋白释放至胞质引起caspases连锁反应;线粒体转膜电位降低, 呼吸链解偶联,过氧化阴离子产物增加,基质钙和谷胱甘肽外流,可溶性膜间蛋白,包括Cyto c释放,激发胞质半胱氨酸蛋白酶的连锁反应,产生细胞凋亡或坏死。故线粒体膜间孔大小、线粒体转膜电位调节细胞凋亡。线粒体改变引起细胞死亡已知有3种机制[13]:(1)电子传递、氧化磷酸化和ATP产生的破坏。(2)释放激发caspases家族的蛋白,如Cyto c。(3)改变细胞氧化还原潜能。死亡类型(凋亡和坏死)不同决定于线粒体的改变。例如,当激发因子如Bax、Ca2+、神经酰胺刺激线粒体,结果有二种,一是渗透性不平衡使线粒体肿胀,外膜破裂,电化学梯度破坏和ATP减少使细胞坏死。一是线粒体外膜透性增加,释放Cyto c,激发caspases蛋白溶解酶,产生细胞凋亡。
, 百拇医药
2.caspases蛋白酶[14]:凋亡是一种进化过程中保留下来的细胞自杀,发生的机制是蛋白溶解系统活化,涉及一组半胱氨酸蛋白酶家族,称为caspases。caspases家族具有蛋白酶的生物学特性:如蛋白溶解作用是不可逆的;许多蛋白酶是由其原无或极少催化作用的前体合成,其量虽少,起着催化作用;存在阳性或阴性反馈作用;蛋白酶能调节自身的活性;蛋白酶有其相应的抑制剂;蛋白酶反应是特异性的等。蛋白酶前体可在天冬氨酸位点上被切断成3部份,H2N-端是抑制区域被移去,另一端COOH-端断裂成1大1小亚单位称为死亡区域,2大2小亚单位结合成活化酶,可以作用下游效应caspases,这种级联反应称为caspases cascade[14](图1)。这种连锁反应的进行有赖于caspases的调节蛋白、辅助因子、反馈关系和阈限等控制。如凋亡外界信号只作用于caspases前体(procaspases),前体可活化蛋白酶激发因子(initiator of caspases),激发因子可以活化蛋白酶效应因子(effector of caspases),然后作用于底物蛋白,如核层蛋白(laminine),PARP(poly-ADP-ribos polymerase),DNA碎裂因子(DFF-45)和gelsolin等,蛋白分解引起凋亡。caspases有多种,多数和凋亡有关,少数和炎症有关[14]。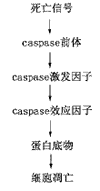
, 百拇医药
图1 蛋白酶级联反应
3.细胞凋亡的基因调控:目前发现的细胞凋亡有关基因有3类,促细胞凋亡基因、抑制细胞凋亡基因和在细胞凋亡过程中协助的基因。(1)ced基因[6]:线虫的ced-3和ced-4为促凋亡基因,哺乳类动物和ced-3相似基因为ICE,是一种半胱氨酸蛋白酶;ced-9是抑制凋亡基因,人的bcl-2和ced-9同源,可以抑制ced-3。ced-4是结合体(adaptor)。(2)bcl-2及其家族:bcl-2家族有Bcl-x,Bax,Bak,Bad等成员,形成Bcl-2-Bax-Bclx和Bax-Bad-Bcl-x 调控系统。bcl-2 可以防止凋亡产生[15],与肿瘤细胞增殖和癌变有关,部分成员如Bax有促进凋亡作用[16]。(3)ICE基因:是哺乳类动物促凋亡基因。ICE作用于Pro-IL-1β底物。抑制ICE的基因有Cowpox病毒的Crm A,能使其失去诱导细胞凋亡作用。Cpp32基因产物可以和ICE协同作用。(4)c-myc和h-ras基因:c-myc促进细胞凋亡,h-ras抑制细胞凋亡[17]。(5)Fas和Fas配体(Fas-L):Fas为死亡受体,Fas-L是T淋巴细胞产物,Fas和Fas-L结合诱导细胞凋亡。(6)p53基因:野生型诱导细胞凋亡,通过细胞凋亡抑制肿瘤的生长[17]。它作用在细胞周期和细胞受损伤时,促使细胞凋亡。(7)Rb有抗凋亡作用,Rb使细胞周期停滞,也可阻断细胞内信息传递。 也有报道放射线诱导细胞凋亡可由Rb蛋白介导[18]。
, 百拇医药
四、凋亡在疾病的防治中应用的可能性[1,8,14]
应用caspases理论及凋亡发生机理探索防治疾病方法,正在从动物实验和临床两方面进行,药物研究也方兴未艾,但治疗成功的人体病例不多,目前用在临床防治的疾病包括如下几类:
1.脑缺血神经细胞凋亡可以用caspases抑制剂防止。如新生儿窒息[19],老年脑缺血,老年痴呆症(如Alzheimers病)[20]可用药物预防神经元凋亡。
2.过度凋亡所致疾病的防治:神经退行性变疾病,视网膜退行性病变,移植排斥,自身免疫性疾病等由于过度凋亡引起细胞缺失,可用caspases抑制剂预防[14]。
3.肿瘤防治:肿瘤细胞常呈凋亡不足,化疗和放疗可诱导肿瘤细胞凋亡,通过活化caspases酶系统或活化死亡受体启动caspases系统,促进凋亡。应了解某种肿瘤细胞启动的caspases酶系统和正常细胞死亡caspases酶系统的差异,以便选择激发肿瘤细胞的caspases系统。另外,肿瘤细胞可能是bcl-2表达过度,p53表达不足或突变使肿瘤细胞死亡减少,也可据此设计治疗策略[8]。
, 百拇医药
4.心肌缺血,心肌梗死:在急性条件下,心肌纤维多为坏死,有些缓慢发展的心肌缺血可产生心肌细胞凋亡,通过了解凋亡的发生过程可以预防和治疗慢性心肌纤维死亡[8]。
5.有些病毒感染可以阻止细胞凋亡,使病毒得以在活细胞繁殖。利用病毒或其蛋白产生抑制caspases系统或利用小分子多肽来防止凋亡[8]。
探索防治与细胞凋亡有关的疾病,目前提出对肿瘤、老年痴呆、艾滋病、自身免疫病等,根据凋亡理论制定治疗策略。需依赖几个领域的研究进步:(1)根据不同疾病细胞凋亡过程特点设计治疗方案;(2)市场上能提供有关药物;(3)基因治疗,ICE/ced-3基因家族产品的应用;(4)凋亡的诊断和研究方法的改善,关键是了解不同caspases活化在细胞凋亡作用及其上、下游的各辅助因子的作用。
五、结束语
, 百拇医药
近年来,有关细胞凋亡的研究飞速发展,并有所突破。对caspases 系列的研究将更深入,caspases 上游基因和下游的作用底物及各种协作因子将一一被阐明。促caspases因子和拮抗因子将制成药品推向市场,由于对有关疾病产生细胞凋亡机制的深入了解,并找出其特异性,可应用于疾病的防治,成为治疗学新领域。因此,细胞凋亡理论和实践的研究将有广阔的天地。
参考文献:
[1]Peter ME, Heufelder AE, Hengartner MO. Advances in apoptosis research. Proc Natl Acad Sci USA, 1997,94:12736-12737.
[2]Conradt B, Horvitz HR. The C. elegans protein EGL-1is required for programmed cell death and interacts with the bcl-2-like protein CED-9. Cell, 1998,93:519-529.
, 百拇医药
[3]赵卫红. 细胞凋亡的生物学特征. 见赵卫红,寿好长,闫福岭,等主编. 细胞凋亡. 郑州: 河南医科大学出版社,1997.7-11.
[4]Fang M, Zhang H, Xue S, et al. Intracellular calcium distribution in apoptosis of HL-60 cells induced by harringtonine: intranuclear accumulation and regionalization. Cancer lett, 1998,127:113-121.
[5]Fan M, Zhang HQ, Xue SB. Differential effects of Ca2+ and Mg2+ on endonuclease activation in isolated promyelocytic HL-60 cell nuclei. Science in China (c) ,1998,41:351-359.
, 百拇医药
[6]Golstein P. Controlling cell death. Science, 1997,275:1081-1082.
[7]Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science,1998,281:1305-1308.
[8]Raff M. Cell suicide for beginners. Nature, 1998,396:119-122.
[9]Adams JM, Cory S.The bcl-2 protein family: arbiters of cell survival. Science,1998,281:1322-1326.
[10]Sakahira H, Enari M, Nagata S. Cleavage of CAD inhibitor in CAD activation and DNA degradation during apoptosis. Nature, 1998,391:96-99.
, 百拇医药
[11]Enari M, Sakahira H, Yokoyama H, et al. A caspases-activated DNase that degrades DNA during apoptosis, and its inhibitor ICAD. Nature ,1998,391:43-50.
[12]Green DR, Reed JC. Mitochondria and apoptosis. Science, 1998,281:1309-1312.
[13]Camilleri Broet S, Vanderwerff H, Caldwell E, et al. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp Cell Res,1998,239:277-292.
, 百拇医药
[14]Thornberry NA, Lazebnik Y. Caspases: enemies within. Science, 1998,281:1312-1316.
[15]Yang J, Liu X, Bhalla K, et al. Prevention of apoptosis by Bcl- 2: release of cytochrome c from mitochondria blocked. Science, 1997, 275:1129-1132.
[16]Cheng EH, Kirsch DG, Clem RJ, et al. Conversion of Bcl-2 to a Bax-like death effector by caspases. Science, 1997,278:1966-1968.
[17]Evan G, Littlewood T. A matter of life and cell death. Science, 1998,281:1317-1322.
, http://www.100md.com
[18]Bowen C, Spiegel S, Gelmann EP. Radiation-induced apoptosis mediated by retinoblastoma protein. Cancer Res, 1998,58:3275-3281.
[19]Barinaga M. Stroke-damaged neurons may commit cellular suicide. Science, 1998,281: 1302-1303.
[20]Barinaga M. Is apoptosis key in Alzheimer′s disease? Science, 1998,281:1303-1304.
收稿日期:1999-07-05, http://www.100md.com
单位:沈忠英(汕头大学医学院肿瘤病理学研究室 515031)
关键词:
中华病理学杂志000123 生物体内环境的稳定,不但依赖细胞增殖和分化,也依赖于细胞的凋亡。细胞凋亡(apoptosis)又称编程性死亡,是生物界重要的生命现象之一。从线虫至高等哺乳类动物,从胚胎至成人,从生理到病理,从生到死整个过程,体内不同的细胞多具有此种死亡形式。早在100多年前Carl Vogt 已发现这种死亡形式[1]。1972年Kerr等人重新提出研究,并命名为凋亡(apoptosis)。其后在凋亡的形态学和生物化学等领域取得新的认识。近期的研究在3方面有明确的进展。首先,从研究小线虫(C. elegans)凋亡调节基因,证实凋亡的发展是由遗传基因控制,其中以Ced-9, Ced-3和Ced-4基因的作用最先确定,哺乳动物也有相应的同源基因[2]。其次,阐明凋亡信号传递途径,特殊的死亡信号分子激活半胱氨酸天冬氨酸蛋白酶家族(称为caspases),诱导细胞凋亡。第三,研究了凋亡和一些疾病的关系,了解疾病发病机制及应用凋亡理论和实践来防治疾病。
, http://www.100md.com
一、细胞凋亡的形态学和生物化学改变
细胞凋亡的形态改变[3]是多阶段的,首先是细胞缩小,胞质凝缩,内质网疏松并和胞膜融合,核糖体、线粒体等聚集,但结构无明显改变。染色质逐渐凝集成新月状,附在核膜周边,嗜碱性增强。以后细胞核固缩成均一的致密物,进而核碎裂,胞膜完整。继之核膜出芽,固缩染色质脱落,形成膜包凋亡小体(apoptotic bodies)。最终凋亡小体被周围吞噬细胞吞噬降解。
随着细胞凋亡形态的研究,细胞生化的改变也逐步被阐明。(1)钙离子和蛋白激酶改变:细胞内Ca2+的堆积和重新分布,细胞核内Ca2+的增多[4], 激活核酸内切酶的活性,蛋白激酶C在不同细胞类别和不同周期活性表现不一。(2)核酸内切酶激活[5]把DNA内切成180碱基对倍数的核苷酸片段,呈梯状电泳现象。(3)组织谷氨酰胺转移酶的积累并激活。(4)细胞骨架如肌动蛋白的变化。(5)细胞表面糖链、植物血凝素与玻连蛋白受体增加,磷脂酰丝氨酸的外露改变细胞表面的生化特性。
, 百拇医药
二、凋亡产生的3步骤
凋亡的发生和发展概括为3个阶段[6]:信号传递阶段、中央调控阶段和结构改变阶段。
1.信号传递[7]:诱导凋亡的细胞外因素(包括环境因素和体内因素)众多,进入细胞内是经信号传递阶段。各种诱导凋亡因子进入细胞内的途径是多种多样的,其中主要的是通过受体介导。接受凋亡信号的受体位于细胞表面, 称为死亡受体(death receptors, DR),当死亡配体(death ligands )和它结合激活死亡蛋白酶系统(death caspase)可以在几小时内诱导细胞凋亡。 死亡受体有肿瘤坏死因子受体基因家族,CD95(Fas或Apol)和DR(或APO)系列。死亡受体分为细胞膜外和胞质两区域,前者传导死亡信号,后者称死亡区域(death domain),参与激发蛋白酶系列和细胞产生凋亡调节机制[8]。
, http://www.100md.com 2.中央调控:凋亡激发因子作用在线粒体,使线粒体内死亡基因ced-3/白细胞介素1β转化酶(ICE)和ced-4 (ced为线虫基因,ICE为哺乳类基因)及死亡抑制基因ced-9/bcl-2(ced-9 在线虫体内,哺乳类动物相应基因为bcl-2)激活,两者何居优势,决定细胞存活或凋亡。当ced-9/bcl-2 和ced-4(连接蛋白)和ced-3/ICE相结合,ced-3不能活化,防止一连串caspases 级联反应,细胞存活[9];当ced-9/bcl-2被促凋亡因子EGL-1结合,bcl-2失活,ced-4使ced-3/ICE活化引起细胞凋亡。线粒体释放细胞色素c(Cyto c)亦可使caspases活化,产生蛋白溶解,引起细胞凋亡。
3.细胞结构改变:在前两阶段基础上,凋亡细胞出现特异的形态变化如细胞皱缩,核致密,微绒毛消失。生化特点是多种酶活化。细胞核的改变,认为是caspases活化的DNA酶(CAD)进入细胞核内使染色体的DNA断裂引起细胞死亡[10]。CAD的抑制因子ICAD拮抗CAD[11]。
, 百拇医药
三、凋亡发展的中心问题
最近,凋亡发展过程的研究最关注的是线粒体的作用、蛋白酶系统的级联反应(caspase cascade)和各种死亡基因及其产物的调节作用。
1.线粒体:在原核细胞内线粒体前身是一种小的共生细菌,它控制细胞在有氧环境下的生活和死亡。这种共生菌的存在由不稳定至稳定及参加核基因谱变成专性共生,是细胞进化现象[12]。细胞内氧化磷酸化,能量代谢和抗活性氧化有赖于线粒体的功能。线粒体的早期改变为线粒体膜通透性变化和线粒体转膜电位(mitochondrial transmembrane potential)降低[12],膜间孔开放,离子通过,内膜H+梯度破坏,基质渗透压升高,线粒体体积扩大,外膜破裂。caspases活性蛋白释放至胞质引起caspases连锁反应;线粒体转膜电位降低, 呼吸链解偶联,过氧化阴离子产物增加,基质钙和谷胱甘肽外流,可溶性膜间蛋白,包括Cyto c释放,激发胞质半胱氨酸蛋白酶的连锁反应,产生细胞凋亡或坏死。故线粒体膜间孔大小、线粒体转膜电位调节细胞凋亡。线粒体改变引起细胞死亡已知有3种机制[13]:(1)电子传递、氧化磷酸化和ATP产生的破坏。(2)释放激发caspases家族的蛋白,如Cyto c。(3)改变细胞氧化还原潜能。死亡类型(凋亡和坏死)不同决定于线粒体的改变。例如,当激发因子如Bax、Ca2+、神经酰胺刺激线粒体,结果有二种,一是渗透性不平衡使线粒体肿胀,外膜破裂,电化学梯度破坏和ATP减少使细胞坏死。一是线粒体外膜透性增加,释放Cyto c,激发caspases蛋白溶解酶,产生细胞凋亡。
, 百拇医药
2.caspases蛋白酶[14]:凋亡是一种进化过程中保留下来的细胞自杀,发生的机制是蛋白溶解系统活化,涉及一组半胱氨酸蛋白酶家族,称为caspases。caspases家族具有蛋白酶的生物学特性:如蛋白溶解作用是不可逆的;许多蛋白酶是由其原无或极少催化作用的前体合成,其量虽少,起着催化作用;存在阳性或阴性反馈作用;蛋白酶能调节自身的活性;蛋白酶有其相应的抑制剂;蛋白酶反应是特异性的等。蛋白酶前体可在天冬氨酸位点上被切断成3部份,H2N-端是抑制区域被移去,另一端COOH-端断裂成1大1小亚单位称为死亡区域,2大2小亚单位结合成活化酶,可以作用下游效应caspases,这种级联反应称为caspases cascade[14](图1)。这种连锁反应的进行有赖于caspases的调节蛋白、辅助因子、反馈关系和阈限等控制。如凋亡外界信号只作用于caspases前体(procaspases),前体可活化蛋白酶激发因子(initiator of caspases),激发因子可以活化蛋白酶效应因子(effector of caspases),然后作用于底物蛋白,如核层蛋白(laminine),PARP(poly-ADP-ribos polymerase),DNA碎裂因子(DFF-45)和gelsolin等,蛋白分解引起凋亡。caspases有多种,多数和凋亡有关,少数和炎症有关[14]。

, 百拇医药
图1 蛋白酶级联反应
3.细胞凋亡的基因调控:目前发现的细胞凋亡有关基因有3类,促细胞凋亡基因、抑制细胞凋亡基因和在细胞凋亡过程中协助的基因。(1)ced基因[6]:线虫的ced-3和ced-4为促凋亡基因,哺乳类动物和ced-3相似基因为ICE,是一种半胱氨酸蛋白酶;ced-9是抑制凋亡基因,人的bcl-2和ced-9同源,可以抑制ced-3。ced-4是结合体(adaptor)。(2)bcl-2及其家族:bcl-2家族有Bcl-x,Bax,Bak,Bad等成员,形成Bcl-2-Bax-Bclx和Bax-Bad-Bcl-x 调控系统。bcl-2 可以防止凋亡产生[15],与肿瘤细胞增殖和癌变有关,部分成员如Bax有促进凋亡作用[16]。(3)ICE基因:是哺乳类动物促凋亡基因。ICE作用于Pro-IL-1β底物。抑制ICE的基因有Cowpox病毒的Crm A,能使其失去诱导细胞凋亡作用。Cpp32基因产物可以和ICE协同作用。(4)c-myc和h-ras基因:c-myc促进细胞凋亡,h-ras抑制细胞凋亡[17]。(5)Fas和Fas配体(Fas-L):Fas为死亡受体,Fas-L是T淋巴细胞产物,Fas和Fas-L结合诱导细胞凋亡。(6)p53基因:野生型诱导细胞凋亡,通过细胞凋亡抑制肿瘤的生长[17]。它作用在细胞周期和细胞受损伤时,促使细胞凋亡。(7)Rb有抗凋亡作用,Rb使细胞周期停滞,也可阻断细胞内信息传递。 也有报道放射线诱导细胞凋亡可由Rb蛋白介导[18]。
, 百拇医药
四、凋亡在疾病的防治中应用的可能性[1,8,14]
应用caspases理论及凋亡发生机理探索防治疾病方法,正在从动物实验和临床两方面进行,药物研究也方兴未艾,但治疗成功的人体病例不多,目前用在临床防治的疾病包括如下几类:
1.脑缺血神经细胞凋亡可以用caspases抑制剂防止。如新生儿窒息[19],老年脑缺血,老年痴呆症(如Alzheimers病)[20]可用药物预防神经元凋亡。
2.过度凋亡所致疾病的防治:神经退行性变疾病,视网膜退行性病变,移植排斥,自身免疫性疾病等由于过度凋亡引起细胞缺失,可用caspases抑制剂预防[14]。
3.肿瘤防治:肿瘤细胞常呈凋亡不足,化疗和放疗可诱导肿瘤细胞凋亡,通过活化caspases酶系统或活化死亡受体启动caspases系统,促进凋亡。应了解某种肿瘤细胞启动的caspases酶系统和正常细胞死亡caspases酶系统的差异,以便选择激发肿瘤细胞的caspases系统。另外,肿瘤细胞可能是bcl-2表达过度,p53表达不足或突变使肿瘤细胞死亡减少,也可据此设计治疗策略[8]。
, 百拇医药
4.心肌缺血,心肌梗死:在急性条件下,心肌纤维多为坏死,有些缓慢发展的心肌缺血可产生心肌细胞凋亡,通过了解凋亡的发生过程可以预防和治疗慢性心肌纤维死亡[8]。
5.有些病毒感染可以阻止细胞凋亡,使病毒得以在活细胞繁殖。利用病毒或其蛋白产生抑制caspases系统或利用小分子多肽来防止凋亡[8]。
探索防治与细胞凋亡有关的疾病,目前提出对肿瘤、老年痴呆、艾滋病、自身免疫病等,根据凋亡理论制定治疗策略。需依赖几个领域的研究进步:(1)根据不同疾病细胞凋亡过程特点设计治疗方案;(2)市场上能提供有关药物;(3)基因治疗,ICE/ced-3基因家族产品的应用;(4)凋亡的诊断和研究方法的改善,关键是了解不同caspases活化在细胞凋亡作用及其上、下游的各辅助因子的作用。
五、结束语
, 百拇医药
近年来,有关细胞凋亡的研究飞速发展,并有所突破。对caspases 系列的研究将更深入,caspases 上游基因和下游的作用底物及各种协作因子将一一被阐明。促caspases因子和拮抗因子将制成药品推向市场,由于对有关疾病产生细胞凋亡机制的深入了解,并找出其特异性,可应用于疾病的防治,成为治疗学新领域。因此,细胞凋亡理论和实践的研究将有广阔的天地。
参考文献:
[1]Peter ME, Heufelder AE, Hengartner MO. Advances in apoptosis research. Proc Natl Acad Sci USA, 1997,94:12736-12737.
[2]Conradt B, Horvitz HR. The C. elegans protein EGL-1is required for programmed cell death and interacts with the bcl-2-like protein CED-9. Cell, 1998,93:519-529.
, 百拇医药
[3]赵卫红. 细胞凋亡的生物学特征. 见赵卫红,寿好长,闫福岭,等主编. 细胞凋亡. 郑州: 河南医科大学出版社,1997.7-11.
[4]Fang M, Zhang H, Xue S, et al. Intracellular calcium distribution in apoptosis of HL-60 cells induced by harringtonine: intranuclear accumulation and regionalization. Cancer lett, 1998,127:113-121.
[5]Fan M, Zhang HQ, Xue SB. Differential effects of Ca2+ and Mg2+ on endonuclease activation in isolated promyelocytic HL-60 cell nuclei. Science in China (c) ,1998,41:351-359.
, 百拇医药
[6]Golstein P. Controlling cell death. Science, 1997,275:1081-1082.
[7]Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science,1998,281:1305-1308.
[8]Raff M. Cell suicide for beginners. Nature, 1998,396:119-122.
[9]Adams JM, Cory S.The bcl-2 protein family: arbiters of cell survival. Science,1998,281:1322-1326.
[10]Sakahira H, Enari M, Nagata S. Cleavage of CAD inhibitor in CAD activation and DNA degradation during apoptosis. Nature, 1998,391:96-99.
, 百拇医药
[11]Enari M, Sakahira H, Yokoyama H, et al. A caspases-activated DNase that degrades DNA during apoptosis, and its inhibitor ICAD. Nature ,1998,391:43-50.
[12]Green DR, Reed JC. Mitochondria and apoptosis. Science, 1998,281:1309-1312.
[13]Camilleri Broet S, Vanderwerff H, Caldwell E, et al. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp Cell Res,1998,239:277-292.
, 百拇医药
[14]Thornberry NA, Lazebnik Y. Caspases: enemies within. Science, 1998,281:1312-1316.
[15]Yang J, Liu X, Bhalla K, et al. Prevention of apoptosis by Bcl- 2: release of cytochrome c from mitochondria blocked. Science, 1997, 275:1129-1132.
[16]Cheng EH, Kirsch DG, Clem RJ, et al. Conversion of Bcl-2 to a Bax-like death effector by caspases. Science, 1997,278:1966-1968.
[17]Evan G, Littlewood T. A matter of life and cell death. Science, 1998,281:1317-1322.
, http://www.100md.com
[18]Bowen C, Spiegel S, Gelmann EP. Radiation-induced apoptosis mediated by retinoblastoma protein. Cancer Res, 1998,58:3275-3281.
[19]Barinaga M. Stroke-damaged neurons may commit cellular suicide. Science, 1998,281: 1302-1303.
[20]Barinaga M. Is apoptosis key in Alzheimer′s disease? Science, 1998,281:1303-1304.
收稿日期:1999-07-05, http://www.100md.com