137Cs γ射线诱发CHL细胞遗传不稳定性
作者:岳井银 刘炳辰 吴红英 周继文 穆传杰
单位:300192 天津,中国医学科学院中国协和医科大学放射医学研究所
关键词:基因组不稳定性;HGPRT位点突变;微核;细胞凋亡
中华放射医学与防护杂志990212 摘要 目的 研究辐射诱发的CHL细胞遗传不稳定性在基因、染色体及细胞水平上的传递及表达情况。方法 不同剂量一次照射CHL细胞,于不同时间点分析受照存活细胞的HGPRT位点突变、微核及细胞凋亡。结果 CHL细胞照射3?Gy后53天,其后代仍表达出显著升高的HGPRT位点突变率。细胞照射3 Gy后6小时的双核细胞微核率达(41.51±3.61)%,3天后下降为(14.47±2.39)%,56天后为(10.51±0.87)%,显著高于对照组(P<0.01);而受照细胞子代双核率无显著变化,接种效率明显降低(3 Gy剂量以上P<0.01)。细胞受照射3、4、6、9、10 Gy后,第2天细胞凋亡率达最大值,10 Gy剂量组为(24.90±6.72)%,之后各剂量组细胞凋亡率迅速下降,但直到照射后12天细胞凋亡率仍维持在10%左右,显著高于对照组(P<0.01)。结论 辐射诱发的细胞基因组不稳定性可以表现在基因、染色体及细胞等不同水平上,推测在其产生和传递过程中可能伴随着某些基因的改变。
, 百拇医药
Genomic Instability induced by 137Cs γ-ray irradiation in CHL surviving cells.
YUE Jingyin,LIU Bingchen,WU Hongying,et al.
Institute of Radiation Medicine,Chinese Academy of Medical Sciences,Peking Union Medical College,Tianjin 300192,China.
Abstract Objective To study in parallel several possible manifestations of instability of surviving CHL cells after irradiation,namely the frequencies of mutation at locus,micronuclei and apoptosis.Methods The frequencies of mutation at hgprt locus,micronuclei and apoptosis were assayed at various times in surviving cells irradiated with γ-rays.Results The surviving cells showed a persistently increased frequency of mutation at the hgprt locus after irradiation until 53 days.Mutant fraction as high as 10-4 was scored,tens of times higher than those assayed in control cells studied in parallel.The frequency of binucleated cells with micronuclei determined within 24 hours after irradiation increased with dose and reached a peak value of (26.58±2.48)% at 3Gy,decreasing at higher doses to a plateau around 20%.The micronucleus frequency decreased steeply to about(14.47±2.39)% within the first 3 days post-irradiation,and fluctuated at around 10% up to 56 days post-irradiation.The delayed efficiency of irradiated cells was significantly decreased.The frequency of apoptosis peaked about(24.90±4.72)% at 10 Gy 48 h post-irradiation(γ-ray dose between 3-10 Gy)and then decreased to about 12% within 3 days.It was significantly higher than in control cells until 14 days.Conclusions It shows that genomic instability induced by radiation can be transmitted to the progeny of surviving cells and may take many forms of expression such as lethal mutation,chromosome aberrations,gene mutation,etc.
, 百拇医药
Key words Genomic instability Mutation hgprt locus Micronuclei Apoptosis
辐射诱发细胞死亡可以在受照存活细胞后代中延迟表达这种现象被发现以来,基因组不稳定性研究成为了一个倍受关注的研究领域[1]。导致基因组不稳定性产生的因素很多,包括物理的、化学的或生物的等许多方面[2]。大量研究表明,辐射可以诱发细胞基因组不稳定性的产生,表现形式多样,而且可以随细胞分裂而传递下去,在其后代中出现延迟表达[3-5]。基因组不稳定性的产生是细胞癌变的早期阶段,其传递的最终结果是使细胞内稳定性突变不断积累而导致癌变。因此,通过这方面的研究可能会深入揭示癌变的本质。
作者采用不同剂量137Csγ射线一次照射CHL细胞,于照后不同时间点平行分析细胞HGPRT位点突变、CB微核及细胞凋亡的表达情况,以期探讨辐射诱发细胞遗传不稳定性产生的规律。
, http://www.100md.com
材料和方法
1.细胞培养和照射:中国仓鼠肺细胞(CHL)培养于RPMI-1640培养基(GIBCO),贴壁生长,其中含15%CFS、100 U/ml青霉素和100 μg/ml链霉素。细胞在对数生长期以适当密度传代接种,3小时后用γ射线源照射。
2.HGPRT位点突变率(MF)测定:CHL细胞受3 Gy γ射线照射后,立即加入HAT条件培养基(终浓度分别为100 μmol/L、0.4 μmol/L、16 μmol/L),培养5~7天后,筛选出HGPRT野生型细胞,除去HAT培养基。经过不同时间表达后,使用6-TG条件培养基(终浓度3μmol/L)测定MF。然后进行第二次、第三次HAT筛选,并测定MF。细胞接种率及对照组细胞MF测定同步进行,MF计算采用下面的公式:
3.双核细胞率(BN)及双核细胞微核率(MN)测定:CHL细胞照射0、0.5、1.0、2.0、3.0、4.0、5.0 Gy后24小时和照射3 Gy后6小时、1、2、3、4、5、6、7、13、56天,分别测定BN和MN,平行测定三组。按照Jamali和Trott[3]的方法,测定前向培养基中加入Cyt-B,终浓度为0.5μg/L,继续培养18小时,细胞即可进行收集、固定、染色。BN测定每一剂量点和时间点各分析500个细胞;MN测定每一剂量点和时间点各分析1 000个双核细胞。
, http://www.100md.com
4.细胞凋亡测定:CHL细胞照射3.0、4.0、6.0、9.0、10.0 Gy后4小时、1、2、3、5、7、12天,按照Kerr[6]的形态学方法测定各组细胞凋亡率,各剂量点分析500个细胞。
5.以上各组实验细胞接种效率(PE)测定均采用同一方法,接种100个细胞,培养7~9天后,镜下细胞克隆计数,平行测定6组。
6.统计方法:本资料数据表示为平均值±标准差( ±s),以χ2检验进行显著性测定。
±s),以χ2检验进行显著性测定。
结果
1.HGPRT位点突变:CHL细胞3 Gy照射后13、20、27、34天(经过一次HAT筛选)的HGPRT位点突变率,平均值为54.8×10-6,细胞接种效率平均值为(62±5)%;44、53天(经过两次HAT筛选)的HGPRT位点突变率平均值为49.8×10-6,细胞接种效率平均值为(59±5)%。而各对照组的突变率平均值为1.48×10-6,细胞接种效率平均值为(81±5)%(见表1)。
, http://www.100md.com
表1 CHL细胞3 Gy γ射线照射后不同时间点
的HGPRT位点突变率比较 照射后培养
时间(d)
筛选后培
养时间
(d)
照射组
对照组
PE
(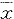 ±s)%
±s)%
MF
, 百拇医药
(×10-6)
PE
(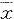 ±s)%
±s)%
MF
(×10-6)
第一次HAT筛选a
7
0
58±6
<0.1
86±5
, 百拇医药
<0.2
13
6
63±10
45.3
80±8
0.9
20
13
60±8
52.8
89±3
2.3
, http://www.100md.com
27
20
59±5
63.4
76±9
0.8
34
27
70±7
57.7
83±4
1.9
第二次HAT筛选b
, 百拇医药
37
0
55±6
<0.2
79±4
<0.3
44
7
59±8
49.4
81±5
1.7
53
, 百拇医药
16
64±11
50.1
75±4
1.3
第三次HAT选b
56
0
60±5
<0.1
83±4
<0.1
注:a 细胞于HAT培养基中培养5天,b 细胞于HAT培养基中培养3天 2.BN和MN:MN随剂量升高而增加,在3 Gy时达最大值,为(26.58±2.48)%,当剂量超过3Gy时,MN随剂量升高而降低(见图1)。细胞受照射3 Gy后6小时的MN为(41.51±3.61)%,而在照后3天内即下降为(14.47±2.39)%,5天后降低为(10.12±1.49)%,并在照后56天内维持在这个水平,明显高于对照组(P<0.01,见图2)。由表2可知细胞受照后,其后代BN无明显变化(P>0.05),而PE显著降低(3 Gy剂量以上P<0.01)。
, 百拇医药
表2 CHL细胞γ射线照射后接种效率(PE)、双核细胞率(BN)的变化[( ±s)%] 照后培养时间
±s)%] 照后培养时间
(d)
0 Gy
1 Gy
3 Gy
5 Gy
PE
BN
PE
BN
PE
, http://www.100md.com
BN
PE
BN
6h
79±7
62±4
73±3
57±4
47±8
60±5
30±6
53±4
1
, 百拇医药
80±5
—
65±4
61±3
55±7
47±9
49±7
48±5
3
86±5
60±10
—
—
, http://www.100md.com
49±6
50±4
35±5
63±4
5
—
—
76±5
—
59±5
55±4
—
—
, http://www.100md.com 13
73±4
57±5
72±5
52±5
73±5
50±7
56±8
59±10
56
83±4
53±6
—
, http://www.100md.com
—
68±4
58±5
—
—
合计
80±6
58±4
72±5
56±4*
59±10**
53±5*
, http://www.100md.com
42±12**
56±7*
注:各实验点分析500个细胞,与对照组比较:* P>0.05,** P<0.01
图1 CHL细胞不同剂量γ射线照射后
24小时,双核细胞微核率的变化
图中各点为三组平行实验结果平均值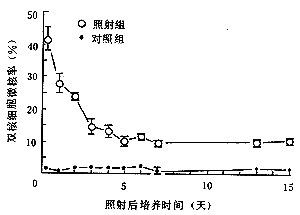
图2 CHL细胞3Gy γ射线照射后
双核细胞微核率随时间的变化
, 百拇医药
图中各点为三组平行实验结果平均值
3.细胞凋亡:细胞受照射48小时后,凋亡率达最大值,且随剂量增加而升高,10Gy时为(24.90±4.72)%,在随后的3天内凋亡率迅速下降为10%左右,并在照射后12天维持在这个水平,明显高于对照组(P<0.01,见图3)。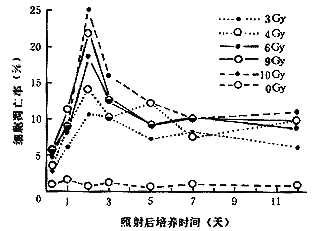
图3 CHL细胞不同剂量γ射线照射后
细胞凋亡率随时间的变化
图中各点为两组平行实验结果平均值
讨论 Chang和Little[5]在他们的研究中发现,用X射线照射CHO细胞,其克隆子代均表现出高频率的HGPRT位点突变率,且与细胞的克隆形成率成显著的负相关。在我们的实验中(见表1),CHL细胞经过HAT条件培养基筛选,筛选出未发生突变的细胞,培养一段时间后,其中受照存活细胞的后代均表现出高的位点突变率,显著高于对照细胞,同时伴随着细胞接种率的持续降低,直到照射后53天仍然没有恢复。显然,它不能简单的解释为DNA残留损伤的结果,这说明CHL细胞经过γ射线处理,在HGPRT位点上可能已经产生了杂合突变,能够随细胞的分裂而传递,使细胞获得了一种基因组不稳定性,从而在受照存活细胞中持续表达出显著升高的位点突变率。
, 百拇医药
在γ射线照射小鼠骨髓干细胞[7]的研究中发现,γ射线可以诱发染色体畸变的延迟表达,而且这种染色体不稳定性既可以表现在体内,也可以表现在体外。微核可以看作是染色体畸变的一种表现形式,它主要来源于染色体片段,为不稳定性畸变,在细胞分裂过程中被稀释而容易丢失。我们的微核实验结果表明,细胞照射后立即表达出高的微核率,并在随后的两天内迅速下降,这说明γ射线处理引起了细胞染色体损伤,并产生染色体片段使细胞立即表达出高的微核率,在细胞进行分裂的过程中染色体片段不断丢失,从而使微核率迅速下降。但在第3天以后微核率下降速度变慢并趋于稳定,直到56天仍然维持在这个水平,显著高于对照细胞(P<0.01),说明细胞内DNA损伤已经基本被稀释或不能再被稀释,从而微核进入稳定表达阶段。同时实验结果还显示CHL细胞受照前后双核率无显著性差异(P>0.05),表明受照存活细胞的增殖活性没有改变,而且细胞在表达高频率位点突变率和微核率的同时均伴随着细胞接种率的明显降低(见表1和2)。由此可见,受照存活细胞后代其基因组可能通过某种途径产生了稳定的改变,即基因组不稳定性。它在细胞分裂过程中得以传递,并且不断表现为某个或某些基因的改变以及染色体畸变等,从而导致这些细胞的生存能力降低,甚至使细胞失活。
, 百拇医药
细胞凋亡是细胞在一定条件下通过激活其自身的代谢机制而导致细胞死亡的过程。近年来大量研究表明,大多数细胞凋亡过程中都需要有新的基因表达,并在此基础上发现了一些与细胞凋亡有关的基因。由图3可以看出,直到照射后12天存活细胞子代的凋亡率仍然显著高于对照细胞(P<0.01),这说明由于γ射线的作用可能使控制细胞凋亡的一个或几个基因发生了改变,从而导致这些细胞出现凋亡的延迟表达。
基因能够通过自身的调控及修复等机制来维持基因组的稳定性是其群体遗传连续性的保证,受照存活细胞所表现出的基因组不稳定性意味着DNA复制过程中容错性的增加以及修复功能的总体缺陷;或者是由于细胞周期调控机制被破坏,使受损DNA得以顺利通过G1/S关卡并发生错误复制。基因组不稳定性在其后代中的传递和表达的最终结果将使细胞内稳定性突变不断积累而有可能导致细胞癌变。因此,进一步探讨基因组不稳定性产生的机理有可能揭示癌发生的机理,这将具有深远意义。
本课题受国家自然科学基金资助(项目号:39470182)
, http://www.100md.com
参考文献
1 Mothersill C,Seymour C.Lethal mutations and genomic instability.Int J Radiat Biol,1997,71:751-758.
2 刘炳辰.辐射诱发的遗传不稳定性传递及分子机制.国外医学放射医学核医学分册,1997,21(1):33-38.
3 Jamali M,Trott KR.Increased micronucleus frequency in the progeny of irradiated Chinese hamster cells.Int J Radiat Biol,1996,69(3):301-307.
4 Jamali M,Trott KR.Persistent increase in the rates of apoptosis and dicentric chromosomes in surviving V79 cells after X-irradiation.Int J Radiat Biol,1996,70:705-709.
, 百拇医药
5 Chang WP,Little JB.Persistently elevated frequency of spontaneous mutation in progeny of CHO clones surviving X-irradiation:association with delayed reproductive death phenotype.Mutat Res,1992,270:191-199.
6 Kerr JFR,Cairens J,Little J B.Timing of the steps in transformation of C3H 10T1/2 cells by X-irradiation.Nature,1984,307:85-86.
7 刘炳辰,董连锴,金虎林,等.γ射线诱发鼠骨髓干细胞染色体不稳定性传递及时相分析.癌变.畸变.突变,1998,10(2):69-72.
(收稿:1998-05-10 修回:1998-10-05), 百拇医药
单位:300192 天津,中国医学科学院中国协和医科大学放射医学研究所
关键词:基因组不稳定性;HGPRT位点突变;微核;细胞凋亡
中华放射医学与防护杂志990212 摘要 目的 研究辐射诱发的CHL细胞遗传不稳定性在基因、染色体及细胞水平上的传递及表达情况。方法 不同剂量一次照射CHL细胞,于不同时间点分析受照存活细胞的HGPRT位点突变、微核及细胞凋亡。结果 CHL细胞照射3?Gy后53天,其后代仍表达出显著升高的HGPRT位点突变率。细胞照射3 Gy后6小时的双核细胞微核率达(41.51±3.61)%,3天后下降为(14.47±2.39)%,56天后为(10.51±0.87)%,显著高于对照组(P<0.01);而受照细胞子代双核率无显著变化,接种效率明显降低(3 Gy剂量以上P<0.01)。细胞受照射3、4、6、9、10 Gy后,第2天细胞凋亡率达最大值,10 Gy剂量组为(24.90±6.72)%,之后各剂量组细胞凋亡率迅速下降,但直到照射后12天细胞凋亡率仍维持在10%左右,显著高于对照组(P<0.01)。结论 辐射诱发的细胞基因组不稳定性可以表现在基因、染色体及细胞等不同水平上,推测在其产生和传递过程中可能伴随着某些基因的改变。
, 百拇医药
Genomic Instability induced by 137Cs γ-ray irradiation in CHL surviving cells.
YUE Jingyin,LIU Bingchen,WU Hongying,et al.
Institute of Radiation Medicine,Chinese Academy of Medical Sciences,Peking Union Medical College,Tianjin 300192,China.
Abstract Objective To study in parallel several possible manifestations of instability of surviving CHL cells after irradiation,namely the frequencies of mutation at locus,micronuclei and apoptosis.Methods The frequencies of mutation at hgprt locus,micronuclei and apoptosis were assayed at various times in surviving cells irradiated with γ-rays.Results The surviving cells showed a persistently increased frequency of mutation at the hgprt locus after irradiation until 53 days.Mutant fraction as high as 10-4 was scored,tens of times higher than those assayed in control cells studied in parallel.The frequency of binucleated cells with micronuclei determined within 24 hours after irradiation increased with dose and reached a peak value of (26.58±2.48)% at 3Gy,decreasing at higher doses to a plateau around 20%.The micronucleus frequency decreased steeply to about(14.47±2.39)% within the first 3 days post-irradiation,and fluctuated at around 10% up to 56 days post-irradiation.The delayed efficiency of irradiated cells was significantly decreased.The frequency of apoptosis peaked about(24.90±4.72)% at 10 Gy 48 h post-irradiation(γ-ray dose between 3-10 Gy)and then decreased to about 12% within 3 days.It was significantly higher than in control cells until 14 days.Conclusions It shows that genomic instability induced by radiation can be transmitted to the progeny of surviving cells and may take many forms of expression such as lethal mutation,chromosome aberrations,gene mutation,etc.
, 百拇医药
Key words Genomic instability Mutation hgprt locus Micronuclei Apoptosis
辐射诱发细胞死亡可以在受照存活细胞后代中延迟表达这种现象被发现以来,基因组不稳定性研究成为了一个倍受关注的研究领域[1]。导致基因组不稳定性产生的因素很多,包括物理的、化学的或生物的等许多方面[2]。大量研究表明,辐射可以诱发细胞基因组不稳定性的产生,表现形式多样,而且可以随细胞分裂而传递下去,在其后代中出现延迟表达[3-5]。基因组不稳定性的产生是细胞癌变的早期阶段,其传递的最终结果是使细胞内稳定性突变不断积累而导致癌变。因此,通过这方面的研究可能会深入揭示癌变的本质。
作者采用不同剂量137Csγ射线一次照射CHL细胞,于照后不同时间点平行分析细胞HGPRT位点突变、CB微核及细胞凋亡的表达情况,以期探讨辐射诱发细胞遗传不稳定性产生的规律。
, http://www.100md.com
材料和方法
1.细胞培养和照射:中国仓鼠肺细胞(CHL)培养于RPMI-1640培养基(GIBCO),贴壁生长,其中含15%CFS、100 U/ml青霉素和100 μg/ml链霉素。细胞在对数生长期以适当密度传代接种,3小时后用γ射线源照射。
2.HGPRT位点突变率(MF)测定:CHL细胞受3 Gy γ射线照射后,立即加入HAT条件培养基(终浓度分别为100 μmol/L、0.4 μmol/L、16 μmol/L),培养5~7天后,筛选出HGPRT野生型细胞,除去HAT培养基。经过不同时间表达后,使用6-TG条件培养基(终浓度3μmol/L)测定MF。然后进行第二次、第三次HAT筛选,并测定MF。细胞接种率及对照组细胞MF测定同步进行,MF计算采用下面的公式:

3.双核细胞率(BN)及双核细胞微核率(MN)测定:CHL细胞照射0、0.5、1.0、2.0、3.0、4.0、5.0 Gy后24小时和照射3 Gy后6小时、1、2、3、4、5、6、7、13、56天,分别测定BN和MN,平行测定三组。按照Jamali和Trott[3]的方法,测定前向培养基中加入Cyt-B,终浓度为0.5μg/L,继续培养18小时,细胞即可进行收集、固定、染色。BN测定每一剂量点和时间点各分析500个细胞;MN测定每一剂量点和时间点各分析1 000个双核细胞。
, http://www.100md.com
4.细胞凋亡测定:CHL细胞照射3.0、4.0、6.0、9.0、10.0 Gy后4小时、1、2、3、5、7、12天,按照Kerr[6]的形态学方法测定各组细胞凋亡率,各剂量点分析500个细胞。
5.以上各组实验细胞接种效率(PE)测定均采用同一方法,接种100个细胞,培养7~9天后,镜下细胞克隆计数,平行测定6组。
6.统计方法:本资料数据表示为平均值±标准差(
 ±s),以χ2检验进行显著性测定。
±s),以χ2检验进行显著性测定。结果
1.HGPRT位点突变:CHL细胞3 Gy照射后13、20、27、34天(经过一次HAT筛选)的HGPRT位点突变率,平均值为54.8×10-6,细胞接种效率平均值为(62±5)%;44、53天(经过两次HAT筛选)的HGPRT位点突变率平均值为49.8×10-6,细胞接种效率平均值为(59±5)%。而各对照组的突变率平均值为1.48×10-6,细胞接种效率平均值为(81±5)%(见表1)。
, http://www.100md.com
表1 CHL细胞3 Gy γ射线照射后不同时间点
的HGPRT位点突变率比较 照射后培养
时间(d)
筛选后培
养时间
(d)
照射组
对照组
PE
(
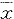 ±s)%
±s)%MF
, 百拇医药
(×10-6)
PE
(
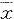 ±s)%
±s)%MF
(×10-6)
第一次HAT筛选a
7
0
58±6
<0.1
86±5
, 百拇医药
<0.2
13
6
63±10
45.3
80±8
0.9
20
13
60±8
52.8
89±3
2.3
, http://www.100md.com
27
20
59±5
63.4
76±9
0.8
34
27
70±7
57.7
83±4
1.9
第二次HAT筛选b
, 百拇医药
37
0
55±6
<0.2
79±4
<0.3
44
7
59±8
49.4
81±5
1.7
53
, 百拇医药
16
64±11
50.1
75±4
1.3
第三次HAT选b
56
0
60±5
<0.1
83±4
<0.1
注:a 细胞于HAT培养基中培养5天,b 细胞于HAT培养基中培养3天 2.BN和MN:MN随剂量升高而增加,在3 Gy时达最大值,为(26.58±2.48)%,当剂量超过3Gy时,MN随剂量升高而降低(见图1)。细胞受照射3 Gy后6小时的MN为(41.51±3.61)%,而在照后3天内即下降为(14.47±2.39)%,5天后降低为(10.12±1.49)%,并在照后56天内维持在这个水平,明显高于对照组(P<0.01,见图2)。由表2可知细胞受照后,其后代BN无明显变化(P>0.05),而PE显著降低(3 Gy剂量以上P<0.01)。
, 百拇医药
表2 CHL细胞γ射线照射后接种效率(PE)、双核细胞率(BN)的变化[(
 ±s)%] 照后培养时间
±s)%] 照后培养时间(d)
0 Gy
1 Gy
3 Gy
5 Gy
PE
BN
PE
BN
PE
, http://www.100md.com
BN
PE
BN
6h
79±7
62±4
73±3
57±4
47±8
60±5
30±6
53±4
1
, 百拇医药
80±5
—
65±4
61±3
55±7
47±9
49±7
48±5
3
86±5
60±10
—
—
, http://www.100md.com
49±6
50±4
35±5
63±4
5
—
—
76±5
—
59±5
55±4
—
—
, http://www.100md.com 13
73±4
57±5
72±5
52±5
73±5
50±7
56±8
59±10
56
83±4
53±6
—
, http://www.100md.com
—
68±4
58±5
—
—
合计
80±6
58±4
72±5
56±4*
59±10**
53±5*
, http://www.100md.com
42±12**
56±7*
注:各实验点分析500个细胞,与对照组比较:* P>0.05,** P<0.01

图1 CHL细胞不同剂量γ射线照射后
24小时,双核细胞微核率的变化
图中各点为三组平行实验结果平均值

图2 CHL细胞3Gy γ射线照射后
双核细胞微核率随时间的变化
, 百拇医药
图中各点为三组平行实验结果平均值
3.细胞凋亡:细胞受照射48小时后,凋亡率达最大值,且随剂量增加而升高,10Gy时为(24.90±4.72)%,在随后的3天内凋亡率迅速下降为10%左右,并在照射后12天维持在这个水平,明显高于对照组(P<0.01,见图3)。

图3 CHL细胞不同剂量γ射线照射后
细胞凋亡率随时间的变化
图中各点为两组平行实验结果平均值
讨论 Chang和Little[5]在他们的研究中发现,用X射线照射CHO细胞,其克隆子代均表现出高频率的HGPRT位点突变率,且与细胞的克隆形成率成显著的负相关。在我们的实验中(见表1),CHL细胞经过HAT条件培养基筛选,筛选出未发生突变的细胞,培养一段时间后,其中受照存活细胞的后代均表现出高的位点突变率,显著高于对照细胞,同时伴随着细胞接种率的持续降低,直到照射后53天仍然没有恢复。显然,它不能简单的解释为DNA残留损伤的结果,这说明CHL细胞经过γ射线处理,在HGPRT位点上可能已经产生了杂合突变,能够随细胞的分裂而传递,使细胞获得了一种基因组不稳定性,从而在受照存活细胞中持续表达出显著升高的位点突变率。
, 百拇医药
在γ射线照射小鼠骨髓干细胞[7]的研究中发现,γ射线可以诱发染色体畸变的延迟表达,而且这种染色体不稳定性既可以表现在体内,也可以表现在体外。微核可以看作是染色体畸变的一种表现形式,它主要来源于染色体片段,为不稳定性畸变,在细胞分裂过程中被稀释而容易丢失。我们的微核实验结果表明,细胞照射后立即表达出高的微核率,并在随后的两天内迅速下降,这说明γ射线处理引起了细胞染色体损伤,并产生染色体片段使细胞立即表达出高的微核率,在细胞进行分裂的过程中染色体片段不断丢失,从而使微核率迅速下降。但在第3天以后微核率下降速度变慢并趋于稳定,直到56天仍然维持在这个水平,显著高于对照细胞(P<0.01),说明细胞内DNA损伤已经基本被稀释或不能再被稀释,从而微核进入稳定表达阶段。同时实验结果还显示CHL细胞受照前后双核率无显著性差异(P>0.05),表明受照存活细胞的增殖活性没有改变,而且细胞在表达高频率位点突变率和微核率的同时均伴随着细胞接种率的明显降低(见表1和2)。由此可见,受照存活细胞后代其基因组可能通过某种途径产生了稳定的改变,即基因组不稳定性。它在细胞分裂过程中得以传递,并且不断表现为某个或某些基因的改变以及染色体畸变等,从而导致这些细胞的生存能力降低,甚至使细胞失活。
, 百拇医药
细胞凋亡是细胞在一定条件下通过激活其自身的代谢机制而导致细胞死亡的过程。近年来大量研究表明,大多数细胞凋亡过程中都需要有新的基因表达,并在此基础上发现了一些与细胞凋亡有关的基因。由图3可以看出,直到照射后12天存活细胞子代的凋亡率仍然显著高于对照细胞(P<0.01),这说明由于γ射线的作用可能使控制细胞凋亡的一个或几个基因发生了改变,从而导致这些细胞出现凋亡的延迟表达。
基因能够通过自身的调控及修复等机制来维持基因组的稳定性是其群体遗传连续性的保证,受照存活细胞所表现出的基因组不稳定性意味着DNA复制过程中容错性的增加以及修复功能的总体缺陷;或者是由于细胞周期调控机制被破坏,使受损DNA得以顺利通过G1/S关卡并发生错误复制。基因组不稳定性在其后代中的传递和表达的最终结果将使细胞内稳定性突变不断积累而有可能导致细胞癌变。因此,进一步探讨基因组不稳定性产生的机理有可能揭示癌发生的机理,这将具有深远意义。
本课题受国家自然科学基金资助(项目号:39470182)
, http://www.100md.com
参考文献
1 Mothersill C,Seymour C.Lethal mutations and genomic instability.Int J Radiat Biol,1997,71:751-758.
2 刘炳辰.辐射诱发的遗传不稳定性传递及分子机制.国外医学放射医学核医学分册,1997,21(1):33-38.
3 Jamali M,Trott KR.Increased micronucleus frequency in the progeny of irradiated Chinese hamster cells.Int J Radiat Biol,1996,69(3):301-307.
4 Jamali M,Trott KR.Persistent increase in the rates of apoptosis and dicentric chromosomes in surviving V79 cells after X-irradiation.Int J Radiat Biol,1996,70:705-709.
, 百拇医药
5 Chang WP,Little JB.Persistently elevated frequency of spontaneous mutation in progeny of CHO clones surviving X-irradiation:association with delayed reproductive death phenotype.Mutat Res,1992,270:191-199.
6 Kerr JFR,Cairens J,Little J B.Timing of the steps in transformation of C3H 10T1/2 cells by X-irradiation.Nature,1984,307:85-86.
7 刘炳辰,董连锴,金虎林,等.γ射线诱发鼠骨髓干细胞染色体不稳定性传递及时相分析.癌变.畸变.突变,1998,10(2):69-72.
(收稿:1998-05-10 修回:1998-10-05), 百拇医药