C6鼠胶质瘤模型及表皮生长因子受体反义RNA治疗的MRI动态观察
作者:张云亭 崔建岭 刘旭文 浦佩玉王广秀 白人驹 于铁链 吴恩惠
单位:300052 天津医科大学总医院放射科(张云亭、崔建岭、白人驹、于铁链、吴恩惠),神经外科(刘旭文、浦佩玉、王广秀)
关键词:磁共振成像; 动物,实验; 神经胶质瘤; 基因,抑制,肿瘤
中华放射学杂志980419.htm 本研究为国家自然科学基金资助项目(基金批准号39570715)
【摘要】 目的 用1.5T MR机动态观察C6鼠胶质瘤的变化及表皮生长因子受体(EGFR)反义RNA对其治疗的价值。材料与方法 将43只体重150~200克雄性Wistar大鼠分4组:A组为正常组,7只;B组为右尾状核接种C6细胞组,16只;C组为在接种的胶质瘤内注射EGFR反义RNA组,12只;D组为右尾状核接种经EGFR反义RNA转染的C6细胞组,8只。A组行MR平扫及增强扫描;B~D组动态观察MR平扫和增强扫描的改变,并于各时间点处死大鼠,取脑行病理检查。结果 MRI可清晰显示正常大鼠大脑半球等结构。接种后1周即可显示瘤灶。MRI动态观察可判断C6鼠胶质瘤的变化,C、D组的肿瘤生长比B组明显受到抑制且与病理一致。结论 1.5T MR机可清晰显示C6鼠胶质瘤自然过程及治疗后的变化;EGFR反义RNA可抑制C6鼠胶质瘤的生长。
, 百拇医药
MR imaging in rat glioma model before and after EGFR antisence RNA therapy Zhang Yunting, Cui Jianling, Liu Xuwen, et al. Department of Radiology, the General Hospital of Tianjin Medical University , Tianjin 300052
【Abstract】 Purpose To study the value of 1.5T MRI in long-term follow-up of rat C6 glioma model and the efficacy of EGFR antisence RNA therapy in vivo. Materials and methods Forty-three male Wistar rats, weighing 150 to 200g, were used for this study. They were divided into four groups: group Ⅰ: 7 normal rats; group Ⅱ: 16 rats inoculated with C6 cells in right caudate nucleus; group Ⅲ: 12 rats injected with EGFR antisence RNA in the inoculated tumors; group Ⅳ: 8 rats inoculated with C6 cells transfected by EGFR antisence RNA in right caudate nucleus. Group Ⅰ was examined by plain and enhancement MR scanning. Group Ⅱ~Ⅳ were followed up by plain MR scanning and enhancement MR scanning and were sacrificed in various time points for pathological examination. Results The hemispheres of normal rat could be seen clearly in the MR imaging. The tumor could be seen about 1 week after inoculation. According to findings on the follow-up MR scan, growth of the tumor or its regression after treatment were clearly observable. The tumor growth was significantly inhibited in group Ⅲ and group Ⅳ as compared to those in group Ⅱ. Conclusion The growth of the rat C6 glioma model and its change after treatment could be shown clearly on 1.5T MR imaging; EGFR antisence RNA significantly inhibited the growth of glioma in vivo.
, 百拇医药
【Key words】 Magnetic resonance imaging Animals, laboratory Glioma Genes, suppressor, tumor
近20年,胶质瘤手术、放疗、化疗和免疫疗法虽有一定进展,但预后无明显改善[1]。近年来开始研究基因治疗胶质瘤,其中反义治疗是一个主要方面。表皮生长因子受体(epidermal growth factor receptor,EGFR)是原癌基因C-erb B-1(也称HER-1)的表达产物,研究表明EGFR在胶质瘤的发生、发展中起重要作用[2],将EGFR反义RNA导入肿瘤细胞可封闭其野生型EGFR的表达,于体外实验证明EGFR反义RNA有明显抑制胶质瘤细胞增殖的作用。为研究在活体的治疗效果,本组采用MRI动态观察C6鼠胶质瘤的自然生长过程和EGFR反义RNA治疗后的变化。
材料与方法
, http://www.100md.com
一、C6鼠胶质瘤模型的建立
1.接种细胞:C6细胞来自美国国立卫生研究院。培养方法参照文献[3]进行。利用Lipofectaming(GIBCO,USA)介导,将含EGFR3′端反义RNA的质粒pactQsR3与质粒pSV2-neo按5∶1比例转染C6细胞,经G418(1 000 μg/ml)进行筛选,14天后获抗G418阳性克隆,随机取克隆移到96孔板培养,最终到常规培养传代。
2.实验大鼠:雄性Wistar大鼠体重150~200 g,共43只。分成四组:A组为正常鼠,7只;B组为右尾状核接种C6细胞的16只鼠,为对照组;C组为右尾状核接种C6细胞1周后在接种点注射脂质体包裹的EGFR反义RNA的12只鼠,为治疗组;D组为右尾状核接种经EGFR反义RNA转染C6细胞的8只鼠。
3.接种步骤:C6细胞及已转染EGFR反义RNA的C6细胞在含10%小牛血清的DMEM(dulbecco modified eagle medium)培养液中用单层细胞培养法传代生长。细胞对数生长期时以0.125%胰酶消化液处理,Hank液洗涤2次后制成细胞悬液待接种,接种细胞量为1.5×106/15 μl。大鼠经2%戊巴比妥钠腹腔注射(40 mg/kg体重)麻醉后,固定于江湾Ⅰ型脑立体定向仪头架。手术暴露颅骨标志,在前囟前1.0 mm、矢状缝右旁开3.0~3.5 mm处用牙科钻钻孔,孔径1.2 mm,用微量注射器垂直插入硬膜下6.0 mm,将15 μl细胞悬液缓缓注入(10分钟以上),然后留针5分钟使细胞充分沉积,拔针后用骨蜡封闭骨孔,缝合皮肤。
, 百拇医药
二、治疗
C组分别于接种C6细胞后第7和9天按上述接种步骤麻醉、固定大鼠,在与接种相同部位注入含2 μg EGFR反义RNA的脂质体包裹悬液15 μl。
三、MR成像
用GE公司1.5T Signa MR机,选3 in(1 in=2.54 cm)表面线圈成像。行冠状面和矢状面T1WI平扫及增强扫描(尾静脉注射Gd-DTPA0.2 mmol/kg)。SE序列参数:TR 500毫秒,TE20毫秒,视野为8 cm×4 cm,矩阵512×256,层厚3 mm,3次激励,成像时间为3分20秒。冠状面T2WI采用快速自旋回波(FSE)序列,TR4 000毫秒,TE86毫秒,视野为8 cm×4 cm,矩阵512×256,层厚3 mm,3次激励,成像时间为7分10秒。另外液体衰减翻转恢复(fluid attenuated inversion recovery,FLAIR)扫描序列的参数为:TR 11 000毫秒,TE 20毫秒,反转时间(TI)1 600毫秒。
, 百拇医药
四、病灶体积计算
按MRI增强扫描后强化的范围测量径线,依下式计算体积[3]:肿瘤的体积(mm3)=(短径2×长径)/(2)
五、病理观察
在因麻醉和肿瘤致死及各时间点处死大鼠后,取脑行病理检查。对照组5只鼠脑做冰冻切片,行胶质原纤维酸性蛋白(GFAP)、S-100免疫组织化学染色。其余鼠脑在福尔马林液固定后冠状切片,行大体标本观察及常规HE染色。
结果
1.正常组(A组)大鼠脑MRI表现:矢状面T1WI上可看到嗅球、大脑半球、中脑、桥脑和小脑等结构。在冠状面像上还可看到第三、四脑室和环池呈线状长T1、长T2信号影,侧脑室常显示不清,有时在T2WI可见与脑表面平行的对称弧形脑脊液高信号影。大脑皮质在T2WI上为模糊的略高信号,其内侧的尾状核则表现为略低信号,注射Gd-DTPA后可见大脑镰强化。FLAIR序列显示脑室、脑池更清晰。
, http://www.100md.com
2.对照组:即B组,共16只鼠,每只行1~4次MR检查。表1为每个时间点的MRI表现。
16只均在MR检查后取脑行病理检查,FLAIR成像及T1WI增强扫描显示的病灶与病理切片上病灶大小相一致,且环状强化中的无强化区与坏死灶相对应(图1~3)。皮下生长为接种穿刺部位颅外弧形突起的长T1、长T2肿块影,呈均一强化。
在MR检查中共有4只死于麻醉意外,在第2、3和4周MR检查后分别有2、5和3只,共10只因
肿瘤死亡,另2只分别在2和3周处死。5只脑标本的免疫组织化学染色GRAP和S-100阳性。
3.肿瘤内注射EGFR反义RNA治疗组(C组):共12只,每只行1~6次MR检查。表2为治疗前后MRI表现(图4~6),单侧t检验说明在接种C6细胞后1周及2周治疗组和非治疗组瘤灶大小无显著性差别(t值分别为0.9415和0.5949,P>0.05),第3周和第4周则治疗组明显小于对照组(t值分别为2.4495和1.9924,P<0.05)。12只大鼠的12个瘤灶有7个于不同时期消失,其中4只2次复查未见复发。
, http://www.100md.com
在2、3和4周时各因肿瘤死亡1、2和1只。2只死于麻醉意外。至12周时仍有6只大鼠存活,病理检查仅见室管膜下有肿瘤细胞,而原瘤灶处未发现肿瘤细胞。
4.接种转染EGFR反义RNA的C6细胞组(D组):共8只。病灶均表现为长T1、长T2信号区,接种后1~4周时病灶大小均明显小于对照组。因麻醉过量死亡2只;3、4和6周时各因肿瘤死亡1只;7周时处死3只。
表1 右尾状核接种C6细胞的16只大鼠各接种时间点的MRI表现
检查数
(只)
接种时间
(周)
瘤灶信号
, http://www.100md.com
瘤灶大小
(mm3)
中线移位
脑室扩大
(只)
6
1
均呈较淡长T1、长T2信号,均匀或不均匀强化,边缘不清
89.0
无
0
8
, http://www.100md.com
2
均呈长T1、长T2信号,6只均匀强化,2只环状强化
286.5
3只轻度移位
1
9
3
均呈明显长T1、长T2信号,4只均匀强化,5只环状强化
325.8
5只明显移位
4
, 百拇医药
4
4
均呈长T1、长T2信号及环状强化
310.6
4只轻度移位
4
表2 12只C6鼠胶质瘤内注射EGFR反义RNA治疗的MRI表现
检查数
(只)
接种时间
(周)
瘤灶信号
, 百拇医药
瘤灶大小
(mm3)
中线移位
脑室扩大
(只)
瘤灶消失
(只)
3
1*
均呈较淡长T1、长T2信号,均匀或不均匀强化,边缘不清
78.0
, http://www.100md.com 无
0
0
5
2
均呈长T1、长T2信号,3只均匀强化,2只环状强化
274.0
3只轻度移位
1
1
7
3
长T1、长T2信号变明显,2只均匀强化,5只环状强化
, 百拇医药
255.8
5只轻度移位
4
1
6
4
均呈长T1、长T2信号,2只均匀强化,4只环状强化
246.6
4只轻度移位
4
2
5
, 百拇医药
5
均呈淡的长T1、长T2信号,均呈较轻的环状强化
186.5
均轻度移位
5
1
6
12
均呈长T1、长T2含脑脊液信号的囊腔,强化灶消失
0.0
无
, 百拇医药
6
6
注:*在接种后第7和第9天治疗;EGFR为表皮生长因子受体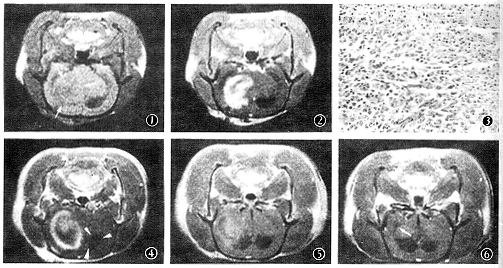
图1~3 同一大鼠右尾状核接种C6细胞后2周的MRI及病理检查。图1示T1WI上肿瘤为长T1占位病变(白箭),中线结构向左移位,左侧脑室扩大;图2为静脉注射Gd-DTPA后,肿瘤呈环状强化;图3为病理图片,图左下方为肿瘤组织,右上方为坏死组织,坏死灶和MR增强扫描中央未强化区相对应,HE ×200 图4~6 同一大鼠右尾状核接种C6细胞后1周,在肿瘤内注射EGFR反义RNA治疗后不同时间T1WI增强扫描。图4示治疗后1周病灶呈环状强化,左侧脑室扩大(白箭头),中线结构向左移位;图5示治疗后3周,瘤灶缩小,强化减轻,两侧侧脑室扩大,中线结构仍向左移位;图6为治疗后12周,肿瘤已形成小囊腔,无强化(白箭),病理显示已无瘤细胞。无中线结构移位,但脑室仍扩大讨论
, 百拇医药
在大鼠脑内接种同种胶质瘤细胞系建立胶质瘤动物模型是检验各种治疗方法的重要手段[4~6]。以前多用接种后或(和)治疗后不同时间点处死大鼠取脑行病理观察,不能在同一模型动态观察和比较治疗前后的变化,浪费了时间、资金和动物。我们用MR成像来动态观察C6鼠胶质瘤模型及治疗后的变化,除克服上述缺点外,还易于观察胶质瘤颅外生长,以便采取措施避免其发生,使模型更稳定。动态观察瘤灶的变化有助于探讨其生长规律和治疗后的改变。目前尚无此课题的影像学研究的报道。
C6鼠胶质瘤模型自然演变的MRI表现为:在接种1周时病灶呈较淡的长T1、长T2信号肿块,边缘不清楚,占位效应较轻,一般无脑室扩大,增强扫描见病灶轻度均匀或不均匀强化,边缘多不清楚;2周时长T1、长T2信号病灶变清晰,占位效应亦明显,增强扫描病灶明显均匀强化,边缘略变清楚,脑室略增大;3周和4周时脑室更大,病灶多为环状强化。有脑室扩大者均可发现室管膜下有一层或数层肿瘤细胞,可能是其成因。皮下生长是接种肿瘤细胞时不慎在穿刺途径上漏出,于皮下形成肿块。MRI表现为接种穿刺部位颅外弧形突起的长T1、长T2肿块影,增强扫描均一强化。
, http://www.100md.com
肿瘤内注射EGFR反义RNA治疗组,在治疗后1周病灶仍继续增大,与对照组无显著性差异。治疗后2周病灶缩小,其体积明显小于同一时间对照组的病灶,强化变浅淡。3~4周时这种差别更明显,中线结构移位亦减轻。12周时病灶变为含脑脊液信号的囊腔,脑室仍扩大,病理上在病灶部位已见不到肿瘤细胞,但室管膜下仍可发现。对照组均在4周内全部死亡,而治疗组在12周时仍有6只存活良好。这些结果说明肿瘤内注射EGFR反义RNA对C6鼠胶质瘤有一定抑制作用。接种EGFR反义RNA转染的胶质瘤细胞组,其肿瘤的生长较对照组生长缓慢,存活期亦延长。
临床用1.5T MR机检查时,选用了3 in表面线圈,小视野(8 cm×4 cm),大矩阵(512×256),可使大鼠脑清晰成像并清楚显示C6鼠胶质瘤病灶。平扫T1WI上,病灶为低信号,边缘多不清楚;T2WI虽显示肿瘤更为敏感,但因瘤体和周围水肿均为高信号而难以区分肿瘤边缘;FLAIR可使脑室显示清楚,有助于了解病灶和脑室的变化;增强T1WI上肿瘤灶明显强化,不仅可清楚显示肿瘤大小、形状和边缘,且可显示平扫T1WI、T2WI和FLAIR无法显示的中心坏死区,为反映肿瘤病理改变的最佳方法,因其显示瘤灶边缘相对清楚且范围和病理切片一致,适宜测定肿瘤体积。各种成像序列均有各自的优势,多种序列成像动态综合观察能更准确地反映肿瘤病理改变和疗效。
, 百拇医药
C6胶质瘤为长T1、长T2信号改变,是因为肿瘤细胞毒性水肿使游离水与结合水的比率增加所致;而边缘不清楚则为肿瘤无胞膜,细胞浸润生长之故;肿瘤发生强化是由于血脑屏障破坏致造影剂外溢,肿瘤生长过快和反义RNA治疗均可发生肿瘤坏死而形成中心低信号无强化区;当肿瘤消失形成囊腔后则肿瘤信号亦随之消失。平扫、增强MRI表现反映了肿瘤生长及治疗后的病理改变。
以上研究表明,用1.5T MR检查时,选用3英寸表面线圈可以清晰显示大鼠脑的大体结构,并能动态观察C6鼠胶质瘤的自然生长过程及经EGFR反义RNA治疗后的变化;肿瘤内注射脂质体包裹的EGFR反义RNA可抑制C6鼠胶质瘤的生长。
参考文献
1 孙林泉.胶质瘤的基因治疗近况(综述).国外医学神经病学神经外科学分册,1996,23:140-143.
, 百拇医药
2 刘旭文.人脑胶质瘤表皮生长因子受体的研究(综述).国外医学神经病学神经外科学分册,1995,22:296-299.
3 潘玉君,惠国桢,胡锦,等.胸苷激酶基因治疗人脑胶质瘤SHG44的研究.中华神经外科杂志,1996,12:299-302.
4 郭品正.脑胶质瘤动物模型的建立(综述).国外医学神经病学神经外科学分册,1996,23:149-152.
5 Peterson DL, Sheridan PJ, Brown WE Jr. Animal models for brain tumors: historical perspectives and future directions. J Neurosurg, 1994,80:865-876.
6 Morreale VM, Herman BH, Der-Minassian V, et al. A brain-tumor model utilizing stereotactic implantation of permanent cannula. J Neurosurg, 1993,78:959-965.
(收稿:1997-06-06 修回:1998-01-18), 百拇医药
单位:300052 天津医科大学总医院放射科(张云亭、崔建岭、白人驹、于铁链、吴恩惠),神经外科(刘旭文、浦佩玉、王广秀)
关键词:磁共振成像; 动物,实验; 神经胶质瘤; 基因,抑制,肿瘤
中华放射学杂志980419.htm 本研究为国家自然科学基金资助项目(基金批准号39570715)
【摘要】 目的 用1.5T MR机动态观察C6鼠胶质瘤的变化及表皮生长因子受体(EGFR)反义RNA对其治疗的价值。材料与方法 将43只体重150~200克雄性Wistar大鼠分4组:A组为正常组,7只;B组为右尾状核接种C6细胞组,16只;C组为在接种的胶质瘤内注射EGFR反义RNA组,12只;D组为右尾状核接种经EGFR反义RNA转染的C6细胞组,8只。A组行MR平扫及增强扫描;B~D组动态观察MR平扫和增强扫描的改变,并于各时间点处死大鼠,取脑行病理检查。结果 MRI可清晰显示正常大鼠大脑半球等结构。接种后1周即可显示瘤灶。MRI动态观察可判断C6鼠胶质瘤的变化,C、D组的肿瘤生长比B组明显受到抑制且与病理一致。结论 1.5T MR机可清晰显示C6鼠胶质瘤自然过程及治疗后的变化;EGFR反义RNA可抑制C6鼠胶质瘤的生长。
, 百拇医药
MR imaging in rat glioma model before and after EGFR antisence RNA therapy Zhang Yunting, Cui Jianling, Liu Xuwen, et al. Department of Radiology, the General Hospital of Tianjin Medical University , Tianjin 300052
【Abstract】 Purpose To study the value of 1.5T MRI in long-term follow-up of rat C6 glioma model and the efficacy of EGFR antisence RNA therapy in vivo. Materials and methods Forty-three male Wistar rats, weighing 150 to 200g, were used for this study. They were divided into four groups: group Ⅰ: 7 normal rats; group Ⅱ: 16 rats inoculated with C6 cells in right caudate nucleus; group Ⅲ: 12 rats injected with EGFR antisence RNA in the inoculated tumors; group Ⅳ: 8 rats inoculated with C6 cells transfected by EGFR antisence RNA in right caudate nucleus. Group Ⅰ was examined by plain and enhancement MR scanning. Group Ⅱ~Ⅳ were followed up by plain MR scanning and enhancement MR scanning and were sacrificed in various time points for pathological examination. Results The hemispheres of normal rat could be seen clearly in the MR imaging. The tumor could be seen about 1 week after inoculation. According to findings on the follow-up MR scan, growth of the tumor or its regression after treatment were clearly observable. The tumor growth was significantly inhibited in group Ⅲ and group Ⅳ as compared to those in group Ⅱ. Conclusion The growth of the rat C6 glioma model and its change after treatment could be shown clearly on 1.5T MR imaging; EGFR antisence RNA significantly inhibited the growth of glioma in vivo.
, 百拇医药
【Key words】 Magnetic resonance imaging Animals, laboratory Glioma Genes, suppressor, tumor
近20年,胶质瘤手术、放疗、化疗和免疫疗法虽有一定进展,但预后无明显改善[1]。近年来开始研究基因治疗胶质瘤,其中反义治疗是一个主要方面。表皮生长因子受体(epidermal growth factor receptor,EGFR)是原癌基因C-erb B-1(也称HER-1)的表达产物,研究表明EGFR在胶质瘤的发生、发展中起重要作用[2],将EGFR反义RNA导入肿瘤细胞可封闭其野生型EGFR的表达,于体外实验证明EGFR反义RNA有明显抑制胶质瘤细胞增殖的作用。为研究在活体的治疗效果,本组采用MRI动态观察C6鼠胶质瘤的自然生长过程和EGFR反义RNA治疗后的变化。
材料与方法
, http://www.100md.com
一、C6鼠胶质瘤模型的建立
1.接种细胞:C6细胞来自美国国立卫生研究院。培养方法参照文献[3]进行。利用Lipofectaming(GIBCO,USA)介导,将含EGFR3′端反义RNA的质粒pactQsR3与质粒pSV2-neo按5∶1比例转染C6细胞,经G418(1 000 μg/ml)进行筛选,14天后获抗G418阳性克隆,随机取克隆移到96孔板培养,最终到常规培养传代。
2.实验大鼠:雄性Wistar大鼠体重150~200 g,共43只。分成四组:A组为正常鼠,7只;B组为右尾状核接种C6细胞的16只鼠,为对照组;C组为右尾状核接种C6细胞1周后在接种点注射脂质体包裹的EGFR反义RNA的12只鼠,为治疗组;D组为右尾状核接种经EGFR反义RNA转染C6细胞的8只鼠。
3.接种步骤:C6细胞及已转染EGFR反义RNA的C6细胞在含10%小牛血清的DMEM(dulbecco modified eagle medium)培养液中用单层细胞培养法传代生长。细胞对数生长期时以0.125%胰酶消化液处理,Hank液洗涤2次后制成细胞悬液待接种,接种细胞量为1.5×106/15 μl。大鼠经2%戊巴比妥钠腹腔注射(40 mg/kg体重)麻醉后,固定于江湾Ⅰ型脑立体定向仪头架。手术暴露颅骨标志,在前囟前1.0 mm、矢状缝右旁开3.0~3.5 mm处用牙科钻钻孔,孔径1.2 mm,用微量注射器垂直插入硬膜下6.0 mm,将15 μl细胞悬液缓缓注入(10分钟以上),然后留针5分钟使细胞充分沉积,拔针后用骨蜡封闭骨孔,缝合皮肤。
, 百拇医药
二、治疗
C组分别于接种C6细胞后第7和9天按上述接种步骤麻醉、固定大鼠,在与接种相同部位注入含2 μg EGFR反义RNA的脂质体包裹悬液15 μl。
三、MR成像
用GE公司1.5T Signa MR机,选3 in(1 in=2.54 cm)表面线圈成像。行冠状面和矢状面T1WI平扫及增强扫描(尾静脉注射Gd-DTPA0.2 mmol/kg)。SE序列参数:TR 500毫秒,TE20毫秒,视野为8 cm×4 cm,矩阵512×256,层厚3 mm,3次激励,成像时间为3分20秒。冠状面T2WI采用快速自旋回波(FSE)序列,TR4 000毫秒,TE86毫秒,视野为8 cm×4 cm,矩阵512×256,层厚3 mm,3次激励,成像时间为7分10秒。另外液体衰减翻转恢复(fluid attenuated inversion recovery,FLAIR)扫描序列的参数为:TR 11 000毫秒,TE 20毫秒,反转时间(TI)1 600毫秒。
, 百拇医药
四、病灶体积计算
按MRI增强扫描后强化的范围测量径线,依下式计算体积[3]:肿瘤的体积(mm3)=(短径2×长径)/(2)
五、病理观察
在因麻醉和肿瘤致死及各时间点处死大鼠后,取脑行病理检查。对照组5只鼠脑做冰冻切片,行胶质原纤维酸性蛋白(GFAP)、S-100免疫组织化学染色。其余鼠脑在福尔马林液固定后冠状切片,行大体标本观察及常规HE染色。
结果
1.正常组(A组)大鼠脑MRI表现:矢状面T1WI上可看到嗅球、大脑半球、中脑、桥脑和小脑等结构。在冠状面像上还可看到第三、四脑室和环池呈线状长T1、长T2信号影,侧脑室常显示不清,有时在T2WI可见与脑表面平行的对称弧形脑脊液高信号影。大脑皮质在T2WI上为模糊的略高信号,其内侧的尾状核则表现为略低信号,注射Gd-DTPA后可见大脑镰强化。FLAIR序列显示脑室、脑池更清晰。
, http://www.100md.com
2.对照组:即B组,共16只鼠,每只行1~4次MR检查。表1为每个时间点的MRI表现。
16只均在MR检查后取脑行病理检查,FLAIR成像及T1WI增强扫描显示的病灶与病理切片上病灶大小相一致,且环状强化中的无强化区与坏死灶相对应(图1~3)。皮下生长为接种穿刺部位颅外弧形突起的长T1、长T2肿块影,呈均一强化。
在MR检查中共有4只死于麻醉意外,在第2、3和4周MR检查后分别有2、5和3只,共10只因
肿瘤死亡,另2只分别在2和3周处死。5只脑标本的免疫组织化学染色GRAP和S-100阳性。
3.肿瘤内注射EGFR反义RNA治疗组(C组):共12只,每只行1~6次MR检查。表2为治疗前后MRI表现(图4~6),单侧t检验说明在接种C6细胞后1周及2周治疗组和非治疗组瘤灶大小无显著性差别(t值分别为0.9415和0.5949,P>0.05),第3周和第4周则治疗组明显小于对照组(t值分别为2.4495和1.9924,P<0.05)。12只大鼠的12个瘤灶有7个于不同时期消失,其中4只2次复查未见复发。
, http://www.100md.com
在2、3和4周时各因肿瘤死亡1、2和1只。2只死于麻醉意外。至12周时仍有6只大鼠存活,病理检查仅见室管膜下有肿瘤细胞,而原瘤灶处未发现肿瘤细胞。
4.接种转染EGFR反义RNA的C6细胞组(D组):共8只。病灶均表现为长T1、长T2信号区,接种后1~4周时病灶大小均明显小于对照组。因麻醉过量死亡2只;3、4和6周时各因肿瘤死亡1只;7周时处死3只。
表1 右尾状核接种C6细胞的16只大鼠各接种时间点的MRI表现
检查数
(只)
接种时间
(周)
瘤灶信号
, http://www.100md.com
瘤灶大小
(mm3)
中线移位
脑室扩大
(只)
6
1
均呈较淡长T1、长T2信号,均匀或不均匀强化,边缘不清
89.0
无
0
8
, http://www.100md.com
2
均呈长T1、长T2信号,6只均匀强化,2只环状强化
286.5
3只轻度移位
1
9
3
均呈明显长T1、长T2信号,4只均匀强化,5只环状强化
325.8
5只明显移位
4
, 百拇医药
4
4
均呈长T1、长T2信号及环状强化
310.6
4只轻度移位
4
表2 12只C6鼠胶质瘤内注射EGFR反义RNA治疗的MRI表现
检查数
(只)
接种时间
(周)
瘤灶信号
, 百拇医药
瘤灶大小
(mm3)
中线移位
脑室扩大
(只)
瘤灶消失
(只)
3
1*
均呈较淡长T1、长T2信号,均匀或不均匀强化,边缘不清
78.0
, http://www.100md.com 无
0
0
5
2
均呈长T1、长T2信号,3只均匀强化,2只环状强化
274.0
3只轻度移位
1
1
7
3
长T1、长T2信号变明显,2只均匀强化,5只环状强化
, 百拇医药
255.8
5只轻度移位
4
1
6
4
均呈长T1、长T2信号,2只均匀强化,4只环状强化
246.6
4只轻度移位
4
2
5
, 百拇医药
5
均呈淡的长T1、长T2信号,均呈较轻的环状强化
186.5
均轻度移位
5
1
6
12
均呈长T1、长T2含脑脊液信号的囊腔,强化灶消失
0.0
无
, 百拇医药
6
6
注:*在接种后第7和第9天治疗;EGFR为表皮生长因子受体

图1~3 同一大鼠右尾状核接种C6细胞后2周的MRI及病理检查。图1示T1WI上肿瘤为长T1占位病变(白箭),中线结构向左移位,左侧脑室扩大;图2为静脉注射Gd-DTPA后,肿瘤呈环状强化;图3为病理图片,图左下方为肿瘤组织,右上方为坏死组织,坏死灶和MR增强扫描中央未强化区相对应,HE ×200 图4~6 同一大鼠右尾状核接种C6细胞后1周,在肿瘤内注射EGFR反义RNA治疗后不同时间T1WI增强扫描。图4示治疗后1周病灶呈环状强化,左侧脑室扩大(白箭头),中线结构向左移位;图5示治疗后3周,瘤灶缩小,强化减轻,两侧侧脑室扩大,中线结构仍向左移位;图6为治疗后12周,肿瘤已形成小囊腔,无强化(白箭),病理显示已无瘤细胞。无中线结构移位,但脑室仍扩大讨论
, 百拇医药
在大鼠脑内接种同种胶质瘤细胞系建立胶质瘤动物模型是检验各种治疗方法的重要手段[4~6]。以前多用接种后或(和)治疗后不同时间点处死大鼠取脑行病理观察,不能在同一模型动态观察和比较治疗前后的变化,浪费了时间、资金和动物。我们用MR成像来动态观察C6鼠胶质瘤模型及治疗后的变化,除克服上述缺点外,还易于观察胶质瘤颅外生长,以便采取措施避免其发生,使模型更稳定。动态观察瘤灶的变化有助于探讨其生长规律和治疗后的改变。目前尚无此课题的影像学研究的报道。
C6鼠胶质瘤模型自然演变的MRI表现为:在接种1周时病灶呈较淡的长T1、长T2信号肿块,边缘不清楚,占位效应较轻,一般无脑室扩大,增强扫描见病灶轻度均匀或不均匀强化,边缘多不清楚;2周时长T1、长T2信号病灶变清晰,占位效应亦明显,增强扫描病灶明显均匀强化,边缘略变清楚,脑室略增大;3周和4周时脑室更大,病灶多为环状强化。有脑室扩大者均可发现室管膜下有一层或数层肿瘤细胞,可能是其成因。皮下生长是接种肿瘤细胞时不慎在穿刺途径上漏出,于皮下形成肿块。MRI表现为接种穿刺部位颅外弧形突起的长T1、长T2肿块影,增强扫描均一强化。
, http://www.100md.com
肿瘤内注射EGFR反义RNA治疗组,在治疗后1周病灶仍继续增大,与对照组无显著性差异。治疗后2周病灶缩小,其体积明显小于同一时间对照组的病灶,强化变浅淡。3~4周时这种差别更明显,中线结构移位亦减轻。12周时病灶变为含脑脊液信号的囊腔,脑室仍扩大,病理上在病灶部位已见不到肿瘤细胞,但室管膜下仍可发现。对照组均在4周内全部死亡,而治疗组在12周时仍有6只存活良好。这些结果说明肿瘤内注射EGFR反义RNA对C6鼠胶质瘤有一定抑制作用。接种EGFR反义RNA转染的胶质瘤细胞组,其肿瘤的生长较对照组生长缓慢,存活期亦延长。
临床用1.5T MR机检查时,选用了3 in表面线圈,小视野(8 cm×4 cm),大矩阵(512×256),可使大鼠脑清晰成像并清楚显示C6鼠胶质瘤病灶。平扫T1WI上,病灶为低信号,边缘多不清楚;T2WI虽显示肿瘤更为敏感,但因瘤体和周围水肿均为高信号而难以区分肿瘤边缘;FLAIR可使脑室显示清楚,有助于了解病灶和脑室的变化;增强T1WI上肿瘤灶明显强化,不仅可清楚显示肿瘤大小、形状和边缘,且可显示平扫T1WI、T2WI和FLAIR无法显示的中心坏死区,为反映肿瘤病理改变的最佳方法,因其显示瘤灶边缘相对清楚且范围和病理切片一致,适宜测定肿瘤体积。各种成像序列均有各自的优势,多种序列成像动态综合观察能更准确地反映肿瘤病理改变和疗效。
, 百拇医药
C6胶质瘤为长T1、长T2信号改变,是因为肿瘤细胞毒性水肿使游离水与结合水的比率增加所致;而边缘不清楚则为肿瘤无胞膜,细胞浸润生长之故;肿瘤发生强化是由于血脑屏障破坏致造影剂外溢,肿瘤生长过快和反义RNA治疗均可发生肿瘤坏死而形成中心低信号无强化区;当肿瘤消失形成囊腔后则肿瘤信号亦随之消失。平扫、增强MRI表现反映了肿瘤生长及治疗后的病理改变。
以上研究表明,用1.5T MR检查时,选用3英寸表面线圈可以清晰显示大鼠脑的大体结构,并能动态观察C6鼠胶质瘤的自然生长过程及经EGFR反义RNA治疗后的变化;肿瘤内注射脂质体包裹的EGFR反义RNA可抑制C6鼠胶质瘤的生长。
参考文献
1 孙林泉.胶质瘤的基因治疗近况(综述).国外医学神经病学神经外科学分册,1996,23:140-143.
, 百拇医药
2 刘旭文.人脑胶质瘤表皮生长因子受体的研究(综述).国外医学神经病学神经外科学分册,1995,22:296-299.
3 潘玉君,惠国桢,胡锦,等.胸苷激酶基因治疗人脑胶质瘤SHG44的研究.中华神经外科杂志,1996,12:299-302.
4 郭品正.脑胶质瘤动物模型的建立(综述).国外医学神经病学神经外科学分册,1996,23:149-152.
5 Peterson DL, Sheridan PJ, Brown WE Jr. Animal models for brain tumors: historical perspectives and future directions. J Neurosurg, 1994,80:865-876.
6 Morreale VM, Herman BH, Der-Minassian V, et al. A brain-tumor model utilizing stereotactic implantation of permanent cannula. J Neurosurg, 1993,78:959-965.
(收稿:1997-06-06 修回:1998-01-18), 百拇医药