热休克蛋白在喉癌中的表达
作者:徐先发 赵玫 施一江 唐平章 李庆宏 黄常志
单位:100021 北京 中国医学科学院 中国协和医科大学肿瘤医院头颈外科(徐先发、唐平章),肿瘤研究所(黄常志、赵玫、施一江)
关键词:喉肿瘤;;热休克蛋白质类;;基因表达
中华耳鼻咽喉科杂志980412 【摘要】 目的 探讨热休克蛋白(heat shock proteins, HSPs)在喉癌组织及其正常喉粘膜中的表达。方法 采用狭缝杂交(Slot blot analysis)技术对21例喉癌组织及其正常喉粘膜的HSP90、HSP70和HSP27mRNA表达水平进行检测。结果 ①HSP90 α和HSP70在喉癌组织中呈过度表达,表达量是自身正常喉粘膜的5倍以上。②HSP27和HSP90 β在喉癌组织及正常喉粘膜中呈低水平表达,其表达量在两种组织中差异无显著性。结论 HSP70和HSP90 α在喉癌的致病过程中起着重要的作用。弄清它们的作用机理,将为HSPs用于喉癌的生物治疗提供理论依据。
, http://www.100md.com
Expression of heat shock proteins in laryngeal carcinoma Xu Xianfa, Zhao Mei, Shi Yijing, et al. Cancer Hospital/Institute, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021
【Abstract 】 Objective To determine the expression of HSPs(HSP90α, HSP90β , HSP70, HSP27) in laryngeal carcinoma and normal laryngeal mucosa. Methods Total RNA were extracted from 21 laryngeal cancer tissue samples and the normal mucosa of the corresponding larynx. The expression of HSPs mRNA was examined by Slot blot analysis. Results ①HSP90 α and HSP70 were selectively overexpressed 5 times more in laryngeal carcinoma than in normal mucosa of larynx. ②HSP90 β and HSP27 were constitutively expressed at low level in these two groups. There was no significant difference between the levels of expression of HSP90 β and HSP27 in laryngeal carcinoma and normal controls. Conclusion The results that HSP90 α and HSP 70 mRNA were selectively overexpressed in laryngeal carcinoma suggested that HSP90α and HSP70 might play a specific role in the pathogenesis of laryngeal cancer.To clarify the mechanism of HSPs action could help to provide theorical basis for the biological therapy of laryngeal cancer.
, http://www.100md.com
【Key words】 Laryngeal neoplasms Heat-shock proteins Gene expression
热休克蛋白(heat shock proteins, HSPs)是生物细胞在受到各种细胞损伤因素刺激时产生的一类高度保守的蛋白质,按分子量的大小和同源程度可分为HSP90、HSP70、小分子HSP及泛素4个家族。不同的HSPs家族不但分子大小不同,而且其生物学功能亦有差异。HSPs与多种蛋白质在细胞中形成复合体并通过其形成或解离而参与有关蛋白质的折叠、组装、细胞内运输及降解等过程,以调节靶蛋白的活性和功能,但不参与靶蛋白的组成。因此,HSPs又被称为“分子伴侣”(molecular chaperone)[1]。细胞系受到癌基因转化后,HSP90和HSP70基因表达增强。一些HSP90和HSP70家族成员与细胞转化的调节过程和肿瘤排斥机制有关[2]。本研究是在mRNA水平检测HSP90、HSP70和HSP27在喉癌组织和正常喉粘膜中的表达及其差异。
, http://www.100md.com
材料与方法
一、 喉癌标本
所选我科21例喉切除标本均符合下列条件:①病理证实为喉鳞状细胞癌,切缘阴性。 ②喉癌组织无溃烂、坏死;正常喉粘膜取自切缘外0.5 cm以上。③未接受过放射或化学治疗。④能同时切取癌组织和正常喉粘膜100 mg左右,以保证能提取足够的RNA量。标本取出后立即液氮速冻,并置-70℃冰箱保存待用。
21例患者,男17例,女4例。年龄38~75岁,中位年龄53.5岁。均为T3或T4 (UICC 1987)高或中分化喉鳞癌。
二、 cDNA探针
HSP90 α(2.9kb)、HSP90 β(3.44kb)、HSP70(2.74kb)和HSP27(2.4kb)的cDNA片段均自备。β-actin(1.0kb)cDNA片段购自北京华美生物公司。
, 百拇医药
三 、主要试剂和仪器
同位素α-32P-dCTP(3 000ci/mmol, 10uci/ul)购自北京福瑞公司,随机引物标记试剂盒购自Promega公司,激光密度扫描仪为瑞典LKB公司产品,多孔过滤加样器为Bio-Rad 公司产品。
四、组织总RNA的提取
按异硫氰酸胍-酚-氯仿一步法稍加改进后提取喉癌和正常喉粘膜组织的总RNA[3]。提取的总RNA溶于DEPC处理好的双蒸去离子水中。用紫外分光光度计测定RNA样品的260/280 nm A值,计算RNA的含量。
五、 cDNA探针的标记
探针标记参照Promega公司随机引物标记试验盒所述方法。取摸板cDNA样品25 ng,于沸水中变性2分钟,立即冰浴。将其加至已有dGTP、dTTP、dATP各20 μl,BSA2 μl,标记缓冲液[250 mmol/L Tris.Cl(PH8.0),20 mmol/L MgCl2,10 mmol/L DTT, 1mol/L HEPES(pH6.6),随机引物]10 μl和α-32P-dCTP50 μci的另一Eppendorf管中。用去离子水补体积至50 μl。加入Klenow酶室温下反应30分钟。加入EDTA(pH8.0)至20 mmol/L终止反应。取1 μl液闪测探针比活性后,用于杂交反应。
, http://www.100md.com
六、 Slot blot杂交[4]
将待测的RNA样品20 μg通过多孔过滤加样器转至Hybond滤膜上,于6×SSC中浸泡滤膜2分钟,装入一杂交袋中,加入预杂交液(0.5%SDS+5×Denhardt+6×SSPE+50%甲酰胺+10%Dexfran Sulfate)20 ml,42℃下预杂交2小时。弃去预杂交液,换上杂交液(同前)约10 ml,加入刚变性已标记的探针,42℃下杂交24小时。SSC/SDS梯度漂洗滤膜。室温晾干。将X光胶片压于膜的两侧置于一带双增感屏的喑盒中,-70℃下曝光3~7天不等。显影、定影、分析杂交强度。以β-actin 探针作内参照。光密度扫描测定杂交带的积分吸光度(峰值)。按某HSP的峰值校正值(=实际某HSP的峰值/实际β-actin 的峰值) ×标准β-actin的峰值,作为某HSPmRNA的相对表达水平,以任意单位表示。
七、 统计方法
, http://www.100md.com
各组峰值以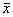 ±s表示,组间比较用t检验。
±s表示,组间比较用t检验。
结果
附图显示HSP70、HSP90 α、HSP90 α、HSP27mRNA和β-actin狭缝杂交放射自显影结果。为了从数量上加以比较,附表列出了4种HSPs在喉癌组织和自身正常喉粘膜中杂交结果的峰值。
附图显示,在喉癌组织中,HSP70和HSP 90α mRNA呈高水平表达,而HSP90 β和HSP 27呈低水
附图 用 α-32P标记的HSPs cDNA和β-actin 作探针狭缝杂交分析喉癌和自身正常喉粘膜HSPs mRNA的表达。Ca:喉癌组织 N:正常喉粘膜
, http://www.100md.com
附表 4种HSPs cDNA作探针在喉癌和正常喉粘膜中
狭缝杂交的激光密度扫描峰值(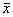 ±s) 探针
±s) 探针
喉癌
正常喉粘膜
HSP70*
3.35±2.22
0.27±0.07
HSP90α*
3.21±0.39
0.97±0.56
, 百拇医药
HSP90β
0.51±0.15
0.54±0.28
HSP27
0.51±0.41
0.56±0.33
注:*HSPs的表达在喉癌组织和正常喉粘膜间差异有显著性(P<0.05)
平表达。喉癌组织的HSP70 mRNA的表达量是HSP90 β的2~21倍,是HSP27的2~11倍;HSP90 αmRNA表达量是HSP90 β的3~9倍,是HSP27的3~23倍。HSP90 α和HSP70 mRNA在喉癌组织中的表达量经t检验差异无显著性(t=0.286,P>0.05)。
, http://www.100md.com
进行每例喉癌组织和自身正常喉粘膜中HSPs表达的比较,发现:喉癌组织HSP70的表达均是正常喉粘膜的5倍以上,喉癌组织HSP90 α的表达量亦是正常喉粘膜的5倍以上,而两种组织HSP90 α和HSP27的表达量差异无显著性(t分别=0.429和1.291,P>0.05)。讨论
已知人类肿瘤细胞具有极大的异质性和抗原多样性,且某一特定瘤体内的细胞是结构和生物学特性均不完全相同的异质性群体。因此,寄希望免疫一种或几种肿瘤相关抗原和类似物,达到对同一肿瘤所有细胞均产生免疫效果的可能性很小。近年来发现,HSPs可通过与某些癌基因和抑癌基因及其蛋白产物的相互作用而调节肿瘤细胞的增殖。肿瘤组织中HSPs多肽复合物含有多种肿瘤相关抗原,用它免疫机体,可在体内诱导多个肿瘤特异的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)克隆,从而实现对同一肿瘤内的所有细胞产生杀伤效果的可能[5]
人类HSP90 依其是否含丰富的谷氨酰胺片段而分为HSP90 α、HSP90 β两类[6]。研究发现,在培养的人类细胞株中,HSP90 β是组成型表达,而HSP90α的表达是由不同的刺激所诱导的,其表达水平可增加10倍以上[7]。在H-ras癌基因转化的细胞和人类恶性肿瘤细胞系(如乳腺癌、卵巢癌和急性白血病细胞系)中,HSP90 α呈选择性过量表达,而HSP90 β的表达变化无明显差异。文献报道与本研究相比,两种HSP90的表达模式是一致的。当肿瘤细胞被诱导分化时,HSP90 α的表达有所下降。因此,认为HSP90 α与肿瘤关系更密切。
, 百拇医药
HSP70家族由位于细胞内不同部位数量极多的成员组成,是细胞内含量最多的HSPs。它在多肽的折叠、解离、转运和在蛋白复合物的装配和分解过程中起着重要的作用。腺病毒E1A基因产物能诱导细胞HSP70表达上升。在用H-ras或c-myc转化培养的细胞或用H-ras/p53共转化培养的细胞,HSP70基因表达均增强。HSP90通过构象的特异性与突变型p53结合,导致突变型p53复合体积聚,半衰期延长,而HSP70在转录后与突变型p53结合能促进此复合体的形成[8]。经HSP70反义脱氧寡核苷酸处理的肿瘤细胞不仅表现出生长抑制,而且诱导该细胞凋亡(apoptosis)[8]。由此,可推测HSP70作为一种重要的基因参与了恶性肿瘤细胞增殖的转录调控过程。因而,HSP70在喉癌组织较正常喉粘膜中的表达高5倍以上。
HSP27分子量较小,在进化上不如HSP70保守,其功能目前不很清楚。对HSP27的转基因的研究表明它与多药耐药( multidrug resitance, MDR)机制有关。在人类肿瘤研究中,也发现HSP27的高表达与肿瘤恶性程度有关。如在原位乳腺癌,有HSP27高表达者较无HSP27高表达者无瘤生存期短[9]。但在神经母细胞瘤细胞系,当用维甲酸诱导分化时,HSP27表达上升;当有c-myc基因扩增时,HSP27表达下降[10]。
, http://www.100md.com
一些证据表明HSPs与细胞转化和肿瘤免疫有关。动物模型表明,HSP70和HSP90家族可诱导肿瘤特异免疫,是肿瘤排斥机制所必须的[2]。因此,喉癌HSP70、HSP90α的过度表达,也许正是通过参与肿瘤细胞增殖的转录调控过程而在喉癌的发生发展过程中起着某种作用。弄清它们的作用机制,将为HSPs用于喉癌的生物治疗提供理论依据。
卫生部医学科学研究基金金资助项目(95-1-052)
参考文献
1Pelham HRB. Speculations on the functions of the major heat shock and glucose-regulated proteins. Cell, 1986,46:959-961.
2Svivastava PK, Maki RG. Stress-induced proteins in immune response to cancer. Curr Top Microbiol, 1991,167:109-123.
, http://www.100md.com
3Chomczynski P, Saachi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenal-chloroform extraction. Anal Biochem, 1987,162:156-159.
4Sambrook J, Fritsch EF, Maniatis T, Molecular cloning, a laboratory manual, 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. 7,53.
5Suto R. A mechanism for the specific immunogenicity of heat shock protein-chaperoned peptid. Science, 1995, 269:1585-1588.
, 百拇医药
6Hickey E, Brondon SE, Smale G, et al. Sequence and regulation of a gene encoding human 89-kilodaton heat shock protein. Mol Cell Biol, 1989,9:2615-2616.
7Bahman S,Benjamin P,Gargi D, et al. Heat shock protein 84 forms a complex with mutant p53 protein predominantly within a cytoplasmic compartment of the cell. J Biol Chem, 1996, 271:15084-15090.
8Wei YQ,Zhao X. Inhibition of proliferation and induction of apoptosis by abrogation HSP70 gene expression in tumor cells.Cancer Immunol Immunother,1995, 40:73.
, 百拇医药
9Huot J, Roy G, Lamber H, et al. Increased survival after treatments with anticancer agents of Chinese hamster cells expression the human Mr 27,000 heat shock protein. Cancer Res, 1991, 51:5245-5252.
10Ungar DR,Hailait KW,Strahler JR, et al.HSP27 expression in neuroblastoma: correlation with disease stage. J Natl Cancer Inst, 1994, 86: 780-784.
(收稿:1997-10-23 修回:1998-02-25), 百拇医药
单位:100021 北京 中国医学科学院 中国协和医科大学肿瘤医院头颈外科(徐先发、唐平章),肿瘤研究所(黄常志、赵玫、施一江)
关键词:喉肿瘤;;热休克蛋白质类;;基因表达
中华耳鼻咽喉科杂志980412 【摘要】 目的 探讨热休克蛋白(heat shock proteins, HSPs)在喉癌组织及其正常喉粘膜中的表达。方法 采用狭缝杂交(Slot blot analysis)技术对21例喉癌组织及其正常喉粘膜的HSP90、HSP70和HSP27mRNA表达水平进行检测。结果 ①HSP90 α和HSP70在喉癌组织中呈过度表达,表达量是自身正常喉粘膜的5倍以上。②HSP27和HSP90 β在喉癌组织及正常喉粘膜中呈低水平表达,其表达量在两种组织中差异无显著性。结论 HSP70和HSP90 α在喉癌的致病过程中起着重要的作用。弄清它们的作用机理,将为HSPs用于喉癌的生物治疗提供理论依据。
, http://www.100md.com
Expression of heat shock proteins in laryngeal carcinoma Xu Xianfa, Zhao Mei, Shi Yijing, et al. Cancer Hospital/Institute, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021
【Abstract 】 Objective To determine the expression of HSPs(HSP90α, HSP90β , HSP70, HSP27) in laryngeal carcinoma and normal laryngeal mucosa. Methods Total RNA were extracted from 21 laryngeal cancer tissue samples and the normal mucosa of the corresponding larynx. The expression of HSPs mRNA was examined by Slot blot analysis. Results ①HSP90 α and HSP70 were selectively overexpressed 5 times more in laryngeal carcinoma than in normal mucosa of larynx. ②HSP90 β and HSP27 were constitutively expressed at low level in these two groups. There was no significant difference between the levels of expression of HSP90 β and HSP27 in laryngeal carcinoma and normal controls. Conclusion The results that HSP90 α and HSP 70 mRNA were selectively overexpressed in laryngeal carcinoma suggested that HSP90α and HSP70 might play a specific role in the pathogenesis of laryngeal cancer.To clarify the mechanism of HSPs action could help to provide theorical basis for the biological therapy of laryngeal cancer.
, http://www.100md.com
【Key words】 Laryngeal neoplasms Heat-shock proteins Gene expression
热休克蛋白(heat shock proteins, HSPs)是生物细胞在受到各种细胞损伤因素刺激时产生的一类高度保守的蛋白质,按分子量的大小和同源程度可分为HSP90、HSP70、小分子HSP及泛素4个家族。不同的HSPs家族不但分子大小不同,而且其生物学功能亦有差异。HSPs与多种蛋白质在细胞中形成复合体并通过其形成或解离而参与有关蛋白质的折叠、组装、细胞内运输及降解等过程,以调节靶蛋白的活性和功能,但不参与靶蛋白的组成。因此,HSPs又被称为“分子伴侣”(molecular chaperone)[1]。细胞系受到癌基因转化后,HSP90和HSP70基因表达增强。一些HSP90和HSP70家族成员与细胞转化的调节过程和肿瘤排斥机制有关[2]。本研究是在mRNA水平检测HSP90、HSP70和HSP27在喉癌组织和正常喉粘膜中的表达及其差异。
, http://www.100md.com
材料与方法
一、 喉癌标本
所选我科21例喉切除标本均符合下列条件:①病理证实为喉鳞状细胞癌,切缘阴性。 ②喉癌组织无溃烂、坏死;正常喉粘膜取自切缘外0.5 cm以上。③未接受过放射或化学治疗。④能同时切取癌组织和正常喉粘膜100 mg左右,以保证能提取足够的RNA量。标本取出后立即液氮速冻,并置-70℃冰箱保存待用。
21例患者,男17例,女4例。年龄38~75岁,中位年龄53.5岁。均为T3或T4 (UICC 1987)高或中分化喉鳞癌。
二、 cDNA探针
HSP90 α(2.9kb)、HSP90 β(3.44kb)、HSP70(2.74kb)和HSP27(2.4kb)的cDNA片段均自备。β-actin(1.0kb)cDNA片段购自北京华美生物公司。
, 百拇医药
三 、主要试剂和仪器
同位素α-32P-dCTP(3 000ci/mmol, 10uci/ul)购自北京福瑞公司,随机引物标记试剂盒购自Promega公司,激光密度扫描仪为瑞典LKB公司产品,多孔过滤加样器为Bio-Rad 公司产品。
四、组织总RNA的提取
按异硫氰酸胍-酚-氯仿一步法稍加改进后提取喉癌和正常喉粘膜组织的总RNA[3]。提取的总RNA溶于DEPC处理好的双蒸去离子水中。用紫外分光光度计测定RNA样品的260/280 nm A值,计算RNA的含量。
五、 cDNA探针的标记
探针标记参照Promega公司随机引物标记试验盒所述方法。取摸板cDNA样品25 ng,于沸水中变性2分钟,立即冰浴。将其加至已有dGTP、dTTP、dATP各20 μl,BSA2 μl,标记缓冲液[250 mmol/L Tris.Cl(PH8.0),20 mmol/L MgCl2,10 mmol/L DTT, 1mol/L HEPES(pH6.6),随机引物]10 μl和α-32P-dCTP50 μci的另一Eppendorf管中。用去离子水补体积至50 μl。加入Klenow酶室温下反应30分钟。加入EDTA(pH8.0)至20 mmol/L终止反应。取1 μl液闪测探针比活性后,用于杂交反应。
, http://www.100md.com
六、 Slot blot杂交[4]
将待测的RNA样品20 μg通过多孔过滤加样器转至Hybond滤膜上,于6×SSC中浸泡滤膜2分钟,装入一杂交袋中,加入预杂交液(0.5%SDS+5×Denhardt+6×SSPE+50%甲酰胺+10%Dexfran Sulfate)20 ml,42℃下预杂交2小时。弃去预杂交液,换上杂交液(同前)约10 ml,加入刚变性已标记的探针,42℃下杂交24小时。SSC/SDS梯度漂洗滤膜。室温晾干。将X光胶片压于膜的两侧置于一带双增感屏的喑盒中,-70℃下曝光3~7天不等。显影、定影、分析杂交强度。以β-actin 探针作内参照。光密度扫描测定杂交带的积分吸光度(峰值)。按某HSP的峰值校正值(=实际某HSP的峰值/实际β-actin 的峰值) ×标准β-actin的峰值,作为某HSPmRNA的相对表达水平,以任意单位表示。
七、 统计方法
, http://www.100md.com
各组峰值以
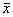 ±s表示,组间比较用t检验。
±s表示,组间比较用t检验。结果
附图显示HSP70、HSP90 α、HSP90 α、HSP27mRNA和β-actin狭缝杂交放射自显影结果。为了从数量上加以比较,附表列出了4种HSPs在喉癌组织和自身正常喉粘膜中杂交结果的峰值。
附图显示,在喉癌组织中,HSP70和HSP 90α mRNA呈高水平表达,而HSP90 β和HSP 27呈低水

附图 用 α-32P标记的HSPs cDNA和β-actin 作探针狭缝杂交分析喉癌和自身正常喉粘膜HSPs mRNA的表达。Ca:喉癌组织 N:正常喉粘膜
, http://www.100md.com
附表 4种HSPs cDNA作探针在喉癌和正常喉粘膜中
狭缝杂交的激光密度扫描峰值(
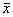 ±s) 探针
±s) 探针喉癌
正常喉粘膜
HSP70*
3.35±2.22
0.27±0.07
HSP90α*
3.21±0.39
0.97±0.56
, 百拇医药
HSP90β
0.51±0.15
0.54±0.28
HSP27
0.51±0.41
0.56±0.33
注:*HSPs的表达在喉癌组织和正常喉粘膜间差异有显著性(P<0.05)
平表达。喉癌组织的HSP70 mRNA的表达量是HSP90 β的2~21倍,是HSP27的2~11倍;HSP90 αmRNA表达量是HSP90 β的3~9倍,是HSP27的3~23倍。HSP90 α和HSP70 mRNA在喉癌组织中的表达量经t检验差异无显著性(t=0.286,P>0.05)。
, http://www.100md.com
进行每例喉癌组织和自身正常喉粘膜中HSPs表达的比较,发现:喉癌组织HSP70的表达均是正常喉粘膜的5倍以上,喉癌组织HSP90 α的表达量亦是正常喉粘膜的5倍以上,而两种组织HSP90 α和HSP27的表达量差异无显著性(t分别=0.429和1.291,P>0.05)。讨论
已知人类肿瘤细胞具有极大的异质性和抗原多样性,且某一特定瘤体内的细胞是结构和生物学特性均不完全相同的异质性群体。因此,寄希望免疫一种或几种肿瘤相关抗原和类似物,达到对同一肿瘤所有细胞均产生免疫效果的可能性很小。近年来发现,HSPs可通过与某些癌基因和抑癌基因及其蛋白产物的相互作用而调节肿瘤细胞的增殖。肿瘤组织中HSPs多肽复合物含有多种肿瘤相关抗原,用它免疫机体,可在体内诱导多个肿瘤特异的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)克隆,从而实现对同一肿瘤内的所有细胞产生杀伤效果的可能[5]
人类HSP90 依其是否含丰富的谷氨酰胺片段而分为HSP90 α、HSP90 β两类[6]。研究发现,在培养的人类细胞株中,HSP90 β是组成型表达,而HSP90α的表达是由不同的刺激所诱导的,其表达水平可增加10倍以上[7]。在H-ras癌基因转化的细胞和人类恶性肿瘤细胞系(如乳腺癌、卵巢癌和急性白血病细胞系)中,HSP90 α呈选择性过量表达,而HSP90 β的表达变化无明显差异。文献报道与本研究相比,两种HSP90的表达模式是一致的。当肿瘤细胞被诱导分化时,HSP90 α的表达有所下降。因此,认为HSP90 α与肿瘤关系更密切。
, 百拇医药
HSP70家族由位于细胞内不同部位数量极多的成员组成,是细胞内含量最多的HSPs。它在多肽的折叠、解离、转运和在蛋白复合物的装配和分解过程中起着重要的作用。腺病毒E1A基因产物能诱导细胞HSP70表达上升。在用H-ras或c-myc转化培养的细胞或用H-ras/p53共转化培养的细胞,HSP70基因表达均增强。HSP90通过构象的特异性与突变型p53结合,导致突变型p53复合体积聚,半衰期延长,而HSP70在转录后与突变型p53结合能促进此复合体的形成[8]。经HSP70反义脱氧寡核苷酸处理的肿瘤细胞不仅表现出生长抑制,而且诱导该细胞凋亡(apoptosis)[8]。由此,可推测HSP70作为一种重要的基因参与了恶性肿瘤细胞增殖的转录调控过程。因而,HSP70在喉癌组织较正常喉粘膜中的表达高5倍以上。
HSP27分子量较小,在进化上不如HSP70保守,其功能目前不很清楚。对HSP27的转基因的研究表明它与多药耐药( multidrug resitance, MDR)机制有关。在人类肿瘤研究中,也发现HSP27的高表达与肿瘤恶性程度有关。如在原位乳腺癌,有HSP27高表达者较无HSP27高表达者无瘤生存期短[9]。但在神经母细胞瘤细胞系,当用维甲酸诱导分化时,HSP27表达上升;当有c-myc基因扩增时,HSP27表达下降[10]。
, http://www.100md.com
一些证据表明HSPs与细胞转化和肿瘤免疫有关。动物模型表明,HSP70和HSP90家族可诱导肿瘤特异免疫,是肿瘤排斥机制所必须的[2]。因此,喉癌HSP70、HSP90α的过度表达,也许正是通过参与肿瘤细胞增殖的转录调控过程而在喉癌的发生发展过程中起着某种作用。弄清它们的作用机制,将为HSPs用于喉癌的生物治疗提供理论依据。
卫生部医学科学研究基金金资助项目(95-1-052)
参考文献
1Pelham HRB. Speculations on the functions of the major heat shock and glucose-regulated proteins. Cell, 1986,46:959-961.
2Svivastava PK, Maki RG. Stress-induced proteins in immune response to cancer. Curr Top Microbiol, 1991,167:109-123.
, http://www.100md.com
3Chomczynski P, Saachi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenal-chloroform extraction. Anal Biochem, 1987,162:156-159.
4Sambrook J, Fritsch EF, Maniatis T, Molecular cloning, a laboratory manual, 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. 7,53.
5Suto R. A mechanism for the specific immunogenicity of heat shock protein-chaperoned peptid. Science, 1995, 269:1585-1588.
, 百拇医药
6Hickey E, Brondon SE, Smale G, et al. Sequence and regulation of a gene encoding human 89-kilodaton heat shock protein. Mol Cell Biol, 1989,9:2615-2616.
7Bahman S,Benjamin P,Gargi D, et al. Heat shock protein 84 forms a complex with mutant p53 protein predominantly within a cytoplasmic compartment of the cell. J Biol Chem, 1996, 271:15084-15090.
8Wei YQ,Zhao X. Inhibition of proliferation and induction of apoptosis by abrogation HSP70 gene expression in tumor cells.Cancer Immunol Immunother,1995, 40:73.
, 百拇医药
9Huot J, Roy G, Lamber H, et al. Increased survival after treatments with anticancer agents of Chinese hamster cells expression the human Mr 27,000 heat shock protein. Cancer Res, 1991, 51:5245-5252.
10Ungar DR,Hailait KW,Strahler JR, et al.HSP27 expression in neuroblastoma: correlation with disease stage. J Natl Cancer Inst, 1994, 86: 780-784.
(收稿:1997-10-23 修回:1998-02-25), 百拇医药