豚鼠壶腹嵴毛细胞内钙离子活动及ATP的影响
作者:韩维举 张素珍 姜泗长 杨伟炎 韩东一
单位:100853 北京 解放军总医院耳鼻咽喉科解放军耳鼻咽喉科研究所
关键词:毛细胞;前庭;钙;腺苷三磷酸;显微镜检查;共焦
中华耳鼻烟喉科杂志990406 摘要 目的 探讨离体前庭毛细胞(vestibular hair cells,VHC)去极化时细胞内钙离子活动特征及内耳活性物质ATP对离体VHC内钙离子浓度的影响及其机制。方法 采用酶孵育后机械分离法分离豚鼠壶腹嵴VHC,6 μmol/L钙荧光探针Fluo-3染色,利用激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)记录静息状态下、加入高K+液及不同浓度ATP时代表VHC内[Ca2+]i的荧光强度相对值的变化。结果 细胞外有Ca2+存在时,75 mmol/L K+可引起所观察5个VHC内[Ca2+]i均升高,细胞体和皮板区的[Ca2+]i变化一致;在细胞外无Ca2+的情况下,所观察的5个VHC中,高K+并不能引起细胞内[Ca2+]i 升高。在细胞外存在Ca2+时,不同浓度(1.0 mmol/L, 0.1 mmol/L)ATP可引起绝大多数(18/19)VHC内[Ca2+]i迅速升高,达高峰后下降,恢复至静息时的水平;细胞外无Ca2+时,ATP仅引起极少数(1/10)VHC内[Ca2+]i升高;而对照组加入与ATP等体积的Hank液,不引起VHC内[Ca2+]i升高。结论 高K+引起VHC去极化时细胞外Ca2+经电压依赖性钙通道流入细胞内,使细胞内[Ca2+]i升高;ATP可引起VHC内[Ca2+]i的升高,以细胞外Ca2+流入为主。
, 百拇医药
Intracellular calcium mobilization and effects of ATP on ampullate crista hair cells of the guinea pig
HAN Weiju, ZHANG Suzhen, JIANG Sichang, et al.
Department of Otorhinolaryngology, General Hospital of PLA, Beijing 100853
Abstract Objective To further understand the intracellular calcium mobilization features of the isolated ampullate crista vestibular hair cells(VHCs) and ATP effects on intracellular free calcium concentration([Ca2+]i) in VHCs of the guinea pig. Methods Vestibular hair cells were isolated from the guinea pig crista ampullaris by enzymatic and mechanical methods. The influence of high K+ solution and ATP on [Ca2+]i was investigated. The [Ca2+]i of VHC was examined using laser scanning confocal microscopy(LSCM) and the Ca2+sensitive dye Fluo-3. Results (1) 75 mmol/L K+ Hank's solution resulted in an increase of [Ca2+]i in both the cytoplasm and the cuticular plate of 5 type I VHCs. In the Ca2+-free medium, however, 75 mmol/L K+ solution could not induce [Ca2+]i an increase in observed 5 type I VHCs. (2) In the presence of 1.0 mmol/L or 0.1 mmol/L of ATP, there was a rapid reversible rise of the [Ca2+]i in 18/19 type I VHCs. A small response of ATP-induced [Ca2+]i was found only in 1/10 of type I VHC in Ca2+-free medium. There was no significant increase in [Ca2+]i when the same volume of Hank′s solution was applied to the chamber containing VHCs.Conclusions The result suggests that high K+ solution led to Ca2+ influx via voltage-dependent calcium channels. Extracellular Ca2+ influx is a major source of the ATP-induced [Ca2+]i increase.
, 百拇医药
Key words Hair cells, vestibule Calcium Adenosine triphosphate Microscopy, confocal
Ca2+作为细胞内第二信使,起着调控细胞反应的重要作用。钙与内耳毛细胞功能的维持、声电转换、内耳的频率选择性、基底膜振动的非对称性及非线性响应、传出神经对内耳的调控等都有密切关系。因此,研究内耳毛细胞的[Ca2+]i及其变化对探讨内耳的生理具有重要意义。高钾引起离体耳蜗毛细胞去极化时,可引起细胞内[Ca2+]i 显著升高[1]。ATP可引起外毛细胞内[Ca2+]i 的升高,ATP可能作为耳蜗活性物质或传出神经递质起作用[2] 。本研究用钙敏荧光染料与激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)技术,记录静息状态、高钾引起去极化及加入ATP后离体前庭毛细胞(vestibular hair cells,VHC)内[Ca2+]i 的空间及时间分布特征,以探讨离体VHC内钙离子活动及ATP对前庭毛细胞[Ca2+]i 的影响及机理。
, http://www.100md.com
材料和方法
一、细胞分离与荧光着色
选用耳廓反射正常,体重200~250 g的健康花色豚鼠22只,雌雄兼用。快速断头,取出双侧听泡放入Hank液中,采用酶孵育后机械分离法[3],解剖显微镜下分离壶腹嵴,0.25 g/L胶原酶Ⅳ(Sigma公司,美国)室温下(22~24 ℃)作用20 min,将壶腹嵴移入经刀豆球蛋白(Sigma公司,美国)处理过的装有Hank液的培养皿中,剪碎,机械吹打分离,制备较多的VHC。6 μmol/L的 Fluo-3(molecular probe)室温下染色40 min。用Hank液浸洗3次,相差显微镜下选取活性良好的VHC,进行实验观察。
二、荧光信号的记录
经Fluo-3染色的活性良好的VHC内[Ca2+]i改变时,VHC的荧光强度相对值(各个时间点的荧光强度与初始荧光强度的比值)即发生改变,用Ultima型LSCM(Meridian公司,美国)可记录到不同时间和空间VHC的荧光强度相对值,未经校正时虽不能得到[Ca2+]i的绝对值,但通过记录荧光强度相对值的变化,可观察到VHC内Ca2+的空间分布及加药后VHC内[Ca2+]i的变化幅度。根据加药后反应的快慢,每隔2~5 s扫描记录一次荧光图像。观察记录静息状态下Ca2+的空间分布特征及加入高钾Hank液、ATP后随时间的动态变化,利用LSCM所配备的计算与图像软件,计算并绘制荧光强度相对值在加药前后随时间的动态变化曲线。
, http://www.100md.com
三、加药方法
相差显微镜下选取附壁良好且活性良好的Ⅰ型VHC,培养皿中原有Hank液1 ml,用微量加样器依所需浓度加入一定体积的实验药液,依药物扩散稀释,持续作用于细胞。观察高钾对VHC内[Ca2+]i 的影响时,加入150 mmol/L的高钾Hank液,K+最终浓度为75 mmol/L。为观察细胞外有钙与无钙2种情况下ATP的作用,实验分3组:有Ca2+组和对照组,细胞外液用Hank液;无Ca2+组,细胞外液用D-Hank液;实验组加入ATP-Na2溶液(Sigma公司,用Hank液配制,pH调至7.4);对照组加入与实验组相同体积的Hank液;各组加药方法相同。实验组依加药的体积计算ATP的最终浓度。
四、溶液
细胞孵育液用Hank液,三蒸水配制,主要盐浓度为(单位:mmol/L):NaCl 137,KCl 5.4,CaCl2 1.3,MgSO4 0.8,Na2HPO4 0.4,KH2PO4 0.4,D-葡萄糖5.5。用1 mmol/L NaOH调节pH至7.4。然后用全自动冰点渗透压计(上海第一医科大学)测量和1.0 mmol/L NaCl调节渗透浓度至(300±2) Osmmol/L。
, http://www.100md.com
D-Hank液:在Hank液成分基础上,去掉CaCl2,MgSO4。
高钾Hank液:KCl 150 mmol/L, NaCl 5 mmol/L, 其它成分及配制方法同Hank液。
ATP溶液:ATP-Na2用三蒸水配制成0.1 mol/L的贮备液,用0.1 mmol/L的NaOH调pH值至7.0,低温保存。实验前用Hank液稀释至所需浓度,pH调至7.4。
A23187(一种钙离子载体,购自Sigma公司)与MnCl2均用三蒸水配制。
结果
一、钙离子载体及Mn2+对离体VHC内[Ca2+]i的影响
, 百拇医药
向离体前庭毛细胞培养皿中加入1 μmol/L的钙离子载体(Ionophore) A23187后,代表细胞内[Ca2+]i的荧光强度相对值迅速升高,20 s内达高峰,并保持在较高水平,之后加入2 mmol/L的MnCl2,其荧光强度相对值逐渐下降,最后降至低于静息时的水平(图1)。以上变化符合A23187及MnCl2的药理特性[1,4],证明分离的毛细胞活性良好,测钙方法可靠。
二、高钾引起VHC去极化时[Ca2+]i 变化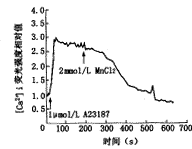
图1 1 μmol/L A23187引起VHC内[Ca2+]i显著升高,并保持在高峰值;加入2 mmol/L MnCl2后逐渐下降,至低于静息时的水平
, 百拇医药
向离体前庭毛细胞培养皿中加入高钾Hank液,K+最终浓度75 mmol/L,细胞内[Ca2+]i 在30 s内迅速升高,并保持在较高水平,无下降趋势。图2显示一个I型VHC在高K+ Hank液中细胞内荧光强度相对值随时间的变化曲线:加入高K+后,细胞体和皮板区的[Ca2+]i 均迅速升高,变化幅度一致。在所观察的5个VHC中,荧光强度的变化趋势基本一致。在细胞外无Ca2+的情况下,所观察的5个VHC中,高K+并不能引起细胞内[Ca2+]i 升高,说明细胞内[Ca2+]i升高为细胞外流入。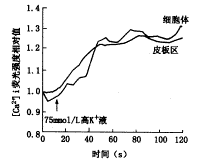
图2 高K+液引起Ⅰ型VHC内[Ca2+]i的变化
, http://www.100md.com
三、ATP对VHC内[Ca2+]i的影响
在细胞外有Ca2+ 的条件下所观察的I型VHC中,加入0.1 mmol/L的ATP-Na2溶液后,9个细胞中的8个其荧光强度迅速升高,20 s以内达到峰值,以后迅速下降至原来的水平,相隔200 s以上再次加入ATP溶液,仍有类似反应。图3显示I型VHC在加入不同浓度 ATP前后游离Ca2+水平随时间变化的动态曲线,可见在加入0.1 mmol/L ATP前VHC荧光强度虽有轻微波动,但2次加药的峰值很明显。图4为加入0.1 mmol/L ATP前后一个VHC的荧光图像。加入1.0 mmol/L ATP溶液后,所观察的10个细胞,其荧光强度均迅速升高,其变化时程及幅度与0.1 mmol/L组相似,但下降至略低于加药前的水平,如果将细胞体与皮板区分开观察,可以发现其[Ca2+]i 的变化主要发生在细胞体。对照实验显示:向10个Ⅰ型VHC培养皿中加入0.1 ml细胞外液,其荧光强度均无明显改变。在细胞外液无Ca2+时,所观察的10个Ⅰ型VHC中加入1.0 mmol/L ATP溶液时,仅一个细胞内荧光强度有轻度升高,其余不变。说明ATP引起VHC内[Ca2+]i的升高以细胞外钙离子流入为主,细胞外无Ca2+时,ATP引起VHC内[Ca2+]i变化不明显。
, 百拇医药
图3 不同浓度ATP引起Ⅰ型VHC内[Ca2+]i的变化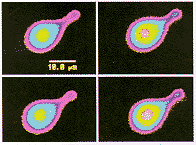
图4 加入1 mmol/L ATP 前后I型VHC的荧光图像。紫色、蓝色、黄色,依次代表[Ca2+]i增加
讨论
一、前庭毛细胞内Ca2+动员
Ca2+在VHC的感觉功能中起着重要作用,VHC的纤毛位移引起机电转换过程及细胞的适应和动性均与Ca2+密切相关[4,5]。Ohtani等[6]报道细胞外高K+可导致豚鼠离体VHC内[Ca2+]i 升高;认为高K+导致毛细胞去极化引起Ca2+通道开放,细胞外钙离子流入到细胞质中。本实验中也观察到高K+引起I型VHC内[Ca2+]i 的迅速升高,并保持在较高水平。关于高K+引起细胞内[Ca2+]i升高的机理,以往认为与去极化引起细胞膜电压依赖性钙通道开放有关[1]。但Griguer等[7]通过同时用全细胞膜片钳和Fura-2荧光染色记录大鼠离体壶腹嵴I型毛细胞的膜电位和细胞内[Ca2+]i,发现膜电位自-70 mV去极化至-20 mV时,未发生细胞内[Ca2+]i变化,而在膜电位复极化过程中有显著[Ca2+]i升高,同时有内向电流;[Ca2+]i增加的幅度及内向电流的大小与膜去极化的幅度和时程有关;在平均静息电位-62 mV,膜去极化超过-55 mV时,随后的复极化可导致细胞内[Ca2+]i升高及内向电流;在细胞外无Ca2+时,高K+不能诱发类似的[Ca2+]i升高及内向电流。本实验中细胞外无Ca2+时,高K+也不能产生VHC内[Ca2+]i升高,因此,高K+引起VHC内[Ca2+]i升高是由细胞外Ca2+流入引起,且[Ca2+]i的升高与细胞去极化有关。
, 百拇医药
二、ATP对VHC内[Ca2+]i的影响
ATP在许多组织中起递质或调质的作用,其受体类型为P2R。离体外毛细胞膜片钳实验表明,ATP引起一个大的非选择性的阳离子内流,从而使外毛细胞去极化[8]。应用Fura-2荧光测定,Ashmore等[9]在豚鼠外毛细胞上观察到ATP引起的[Ca2+]i 上升可分为2个时相,一个快速上升相之后跟随一个慢上升相,当细胞外液无Ca2+时,快速上升相消失,慢上升相的延迟时间加长,提示快相来自Ca2+内流,慢相来自ATP引起的胞内Ca2+动员。Shigemoto等[2]在鸡耳蜗毛细胞也观察到了ATP引起的[Ca2+]i 上升。本实验观察到ATP持续作用时引起[Ca2+]i 的快速上升,而没有慢相成分;在细胞外无Ca2+时,类似的快速上升消失,证实[Ca2+]i 的升高主要是细胞外Ca2+流入引起,Ca2+可能是通过前庭毛细胞上ATP受体控制的阳离子通道流入的。Housley等[10]通过实验观察认为外毛细胞的表皮板端存在可被ATP激活的配体门控的阳离子通道,ATP作用于外毛细胞时,Ca2+从这些通道流入,引起[Ca2+]i 的升高。我们的结果与Yamashita等[11]将ATP作用于离体VHC所得到的结果相似,ATP能迅速引起细胞内[Ca2+]i升高,达高峰后又降至正常,并没有观察到慢相升高,故认为通过ATP激活的离子通道,为Ca2+自细胞外进入细胞内提供了通路。本组未观察到慢相改变,可能由于观测的手段和所观察的细胞不同,文献报道中存在慢上升相者均为离体外毛细胞,而在离体前庭毛细胞中未看到慢上升相。ATP激活的通道引起细胞去极化,并可促进电压门控的Ca2+通道开放而引起Ca2+自细胞外流入[12]。由此可见,ATP的作用方式类似神经递质,有可能起到传出神经递质的作用,但尚需通过在体实验进一步证实。ATP引起的VHC内[Ca2+]i 的升高依赖于细胞外Ca2+的存在,以细胞外Ca2+流入为主。
, 百拇医药
参考文献
1 Yamashita T, Amano H, Harada N,et al. Calcium distribution and mobilization during depolarization in single cochlear hair cells.Imaging microscopy and fura-2. Acta Otolaryngol, 1990, 109:256-262.
2 Shigemoto T, Ohmori H. Muscarinic agonist and ATP increase the intracellular Ca2+ concentration in chick cochlear hair cells. J Physiol, 1990, 420:127-148 .
3 韩维举,张素珍,姜泗长,等.温度变化对离体前庭毛细胞内钙离子浓度的影响.中华耳鼻咽喉科杂志,1998,33:10-13.
, http://www.100md.com
4 Lumpkin EA, Hudspeth AJ. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc Natl Acad Sci USA, 1995,92:10297-10301.
5 Chabbert C, Geleoc G, Lehoulleur J, et al. Intracellular calcium variations evoked by mechanical stimulation of mammalian isolated vestibular type I hair cells. Pflugers Arch, 1994,427:162-168.
6 Ohtani M, Yamashita T, Amano H, et al. Isolation of and calcium moblization in vestibular hair cells of the guinea pig. ORL J Otorhinolaryngol Relat Spec, 1991, 53: 82-85.
, 百拇医药
7 Griguer C, Chabbert C, Sans A, et al. Transient increase in cytosolic free calcium evoked by repolarization in type I vestibular hair cells of rats. Cell Calcium, 1995, 17: 327-334.
8 Nakagawa T, Akaike N, Kimitsuki T, et al. ATP-induced current in isolated outer hair cells of guinea pig cochlea. J Neurophysiol, 1990, 63: 1068-1074.
9 Ashmore JF, Ohmori H. Control intracellular calcium by ATP in isolated outer hair cells of the guinea-pig cochlea. J Physiol, 1990, 428: 109-131.
, http://www.100md.com
10 Housley GD,Greenwood D, Ashmore JF. Localization of cholinergic and purinergic receptors on outer hair cells isolated from the guinea-pig cochlea. Proc R Soc Lond B Biol Sci, 1992, 249: 265-273.
11 Yamashita T, Ohnishi S,Ohtani M, et al. Effects of efferent neurotransmitters on intracellular Ca2+ concentration in vestibular hair cells of the guinea pig. Acta Otolaryngol Suppl, 1993, 500:26-30.
12 Verkhratsky A, Shmigol A. Calcium-induced calcium release in neurones. Cell Calcium, 1996, 19: 1-14.
(收稿:1998-10-13 修回:1999-04-30), http://www.100md.com
单位:100853 北京 解放军总医院耳鼻咽喉科解放军耳鼻咽喉科研究所
关键词:毛细胞;前庭;钙;腺苷三磷酸;显微镜检查;共焦
中华耳鼻烟喉科杂志990406 摘要 目的 探讨离体前庭毛细胞(vestibular hair cells,VHC)去极化时细胞内钙离子活动特征及内耳活性物质ATP对离体VHC内钙离子浓度的影响及其机制。方法 采用酶孵育后机械分离法分离豚鼠壶腹嵴VHC,6 μmol/L钙荧光探针Fluo-3染色,利用激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)记录静息状态下、加入高K+液及不同浓度ATP时代表VHC内[Ca2+]i的荧光强度相对值的变化。结果 细胞外有Ca2+存在时,75 mmol/L K+可引起所观察5个VHC内[Ca2+]i均升高,细胞体和皮板区的[Ca2+]i变化一致;在细胞外无Ca2+的情况下,所观察的5个VHC中,高K+并不能引起细胞内[Ca2+]i 升高。在细胞外存在Ca2+时,不同浓度(1.0 mmol/L, 0.1 mmol/L)ATP可引起绝大多数(18/19)VHC内[Ca2+]i迅速升高,达高峰后下降,恢复至静息时的水平;细胞外无Ca2+时,ATP仅引起极少数(1/10)VHC内[Ca2+]i升高;而对照组加入与ATP等体积的Hank液,不引起VHC内[Ca2+]i升高。结论 高K+引起VHC去极化时细胞外Ca2+经电压依赖性钙通道流入细胞内,使细胞内[Ca2+]i升高;ATP可引起VHC内[Ca2+]i的升高,以细胞外Ca2+流入为主。
, 百拇医药
Intracellular calcium mobilization and effects of ATP on ampullate crista hair cells of the guinea pig
HAN Weiju, ZHANG Suzhen, JIANG Sichang, et al.
Department of Otorhinolaryngology, General Hospital of PLA, Beijing 100853
Abstract Objective To further understand the intracellular calcium mobilization features of the isolated ampullate crista vestibular hair cells(VHCs) and ATP effects on intracellular free calcium concentration([Ca2+]i) in VHCs of the guinea pig. Methods Vestibular hair cells were isolated from the guinea pig crista ampullaris by enzymatic and mechanical methods. The influence of high K+ solution and ATP on [Ca2+]i was investigated. The [Ca2+]i of VHC was examined using laser scanning confocal microscopy(LSCM) and the Ca2+sensitive dye Fluo-3. Results (1) 75 mmol/L K+ Hank's solution resulted in an increase of [Ca2+]i in both the cytoplasm and the cuticular plate of 5 type I VHCs. In the Ca2+-free medium, however, 75 mmol/L K+ solution could not induce [Ca2+]i an increase in observed 5 type I VHCs. (2) In the presence of 1.0 mmol/L or 0.1 mmol/L of ATP, there was a rapid reversible rise of the [Ca2+]i in 18/19 type I VHCs. A small response of ATP-induced [Ca2+]i was found only in 1/10 of type I VHC in Ca2+-free medium. There was no significant increase in [Ca2+]i when the same volume of Hank′s solution was applied to the chamber containing VHCs.Conclusions The result suggests that high K+ solution led to Ca2+ influx via voltage-dependent calcium channels. Extracellular Ca2+ influx is a major source of the ATP-induced [Ca2+]i increase.
, 百拇医药
Key words Hair cells, vestibule Calcium Adenosine triphosphate Microscopy, confocal
Ca2+作为细胞内第二信使,起着调控细胞反应的重要作用。钙与内耳毛细胞功能的维持、声电转换、内耳的频率选择性、基底膜振动的非对称性及非线性响应、传出神经对内耳的调控等都有密切关系。因此,研究内耳毛细胞的[Ca2+]i及其变化对探讨内耳的生理具有重要意义。高钾引起离体耳蜗毛细胞去极化时,可引起细胞内[Ca2+]i 显著升高[1]。ATP可引起外毛细胞内[Ca2+]i 的升高,ATP可能作为耳蜗活性物质或传出神经递质起作用[2] 。本研究用钙敏荧光染料与激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)技术,记录静息状态、高钾引起去极化及加入ATP后离体前庭毛细胞(vestibular hair cells,VHC)内[Ca2+]i 的空间及时间分布特征,以探讨离体VHC内钙离子活动及ATP对前庭毛细胞[Ca2+]i 的影响及机理。
, http://www.100md.com
材料和方法
一、细胞分离与荧光着色
选用耳廓反射正常,体重200~250 g的健康花色豚鼠22只,雌雄兼用。快速断头,取出双侧听泡放入Hank液中,采用酶孵育后机械分离法[3],解剖显微镜下分离壶腹嵴,0.25 g/L胶原酶Ⅳ(Sigma公司,美国)室温下(22~24 ℃)作用20 min,将壶腹嵴移入经刀豆球蛋白(Sigma公司,美国)处理过的装有Hank液的培养皿中,剪碎,机械吹打分离,制备较多的VHC。6 μmol/L的 Fluo-3(molecular probe)室温下染色40 min。用Hank液浸洗3次,相差显微镜下选取活性良好的VHC,进行实验观察。
二、荧光信号的记录
经Fluo-3染色的活性良好的VHC内[Ca2+]i改变时,VHC的荧光强度相对值(各个时间点的荧光强度与初始荧光强度的比值)即发生改变,用Ultima型LSCM(Meridian公司,美国)可记录到不同时间和空间VHC的荧光强度相对值,未经校正时虽不能得到[Ca2+]i的绝对值,但通过记录荧光强度相对值的变化,可观察到VHC内Ca2+的空间分布及加药后VHC内[Ca2+]i的变化幅度。根据加药后反应的快慢,每隔2~5 s扫描记录一次荧光图像。观察记录静息状态下Ca2+的空间分布特征及加入高钾Hank液、ATP后随时间的动态变化,利用LSCM所配备的计算与图像软件,计算并绘制荧光强度相对值在加药前后随时间的动态变化曲线。
, http://www.100md.com
三、加药方法
相差显微镜下选取附壁良好且活性良好的Ⅰ型VHC,培养皿中原有Hank液1 ml,用微量加样器依所需浓度加入一定体积的实验药液,依药物扩散稀释,持续作用于细胞。观察高钾对VHC内[Ca2+]i 的影响时,加入150 mmol/L的高钾Hank液,K+最终浓度为75 mmol/L。为观察细胞外有钙与无钙2种情况下ATP的作用,实验分3组:有Ca2+组和对照组,细胞外液用Hank液;无Ca2+组,细胞外液用D-Hank液;实验组加入ATP-Na2溶液(Sigma公司,用Hank液配制,pH调至7.4);对照组加入与实验组相同体积的Hank液;各组加药方法相同。实验组依加药的体积计算ATP的最终浓度。
四、溶液
细胞孵育液用Hank液,三蒸水配制,主要盐浓度为(单位:mmol/L):NaCl 137,KCl 5.4,CaCl2 1.3,MgSO4 0.8,Na2HPO4 0.4,KH2PO4 0.4,D-葡萄糖5.5。用1 mmol/L NaOH调节pH至7.4。然后用全自动冰点渗透压计(上海第一医科大学)测量和1.0 mmol/L NaCl调节渗透浓度至(300±2) Osmmol/L。
, http://www.100md.com
D-Hank液:在Hank液成分基础上,去掉CaCl2,MgSO4。
高钾Hank液:KCl 150 mmol/L, NaCl 5 mmol/L, 其它成分及配制方法同Hank液。
ATP溶液:ATP-Na2用三蒸水配制成0.1 mol/L的贮备液,用0.1 mmol/L的NaOH调pH值至7.0,低温保存。实验前用Hank液稀释至所需浓度,pH调至7.4。
A23187(一种钙离子载体,购自Sigma公司)与MnCl2均用三蒸水配制。
结果
一、钙离子载体及Mn2+对离体VHC内[Ca2+]i的影响
, 百拇医药
向离体前庭毛细胞培养皿中加入1 μmol/L的钙离子载体(Ionophore) A23187后,代表细胞内[Ca2+]i的荧光强度相对值迅速升高,20 s内达高峰,并保持在较高水平,之后加入2 mmol/L的MnCl2,其荧光强度相对值逐渐下降,最后降至低于静息时的水平(图1)。以上变化符合A23187及MnCl2的药理特性[1,4],证明分离的毛细胞活性良好,测钙方法可靠。
二、高钾引起VHC去极化时[Ca2+]i 变化

图1 1 μmol/L A23187引起VHC内[Ca2+]i显著升高,并保持在高峰值;加入2 mmol/L MnCl2后逐渐下降,至低于静息时的水平
, 百拇医药
向离体前庭毛细胞培养皿中加入高钾Hank液,K+最终浓度75 mmol/L,细胞内[Ca2+]i 在30 s内迅速升高,并保持在较高水平,无下降趋势。图2显示一个I型VHC在高K+ Hank液中细胞内荧光强度相对值随时间的变化曲线:加入高K+后,细胞体和皮板区的[Ca2+]i 均迅速升高,变化幅度一致。在所观察的5个VHC中,荧光强度的变化趋势基本一致。在细胞外无Ca2+的情况下,所观察的5个VHC中,高K+并不能引起细胞内[Ca2+]i 升高,说明细胞内[Ca2+]i升高为细胞外流入。

图2 高K+液引起Ⅰ型VHC内[Ca2+]i的变化
, http://www.100md.com
三、ATP对VHC内[Ca2+]i的影响
在细胞外有Ca2+ 的条件下所观察的I型VHC中,加入0.1 mmol/L的ATP-Na2溶液后,9个细胞中的8个其荧光强度迅速升高,20 s以内达到峰值,以后迅速下降至原来的水平,相隔200 s以上再次加入ATP溶液,仍有类似反应。图3显示I型VHC在加入不同浓度 ATP前后游离Ca2+水平随时间变化的动态曲线,可见在加入0.1 mmol/L ATP前VHC荧光强度虽有轻微波动,但2次加药的峰值很明显。图4为加入0.1 mmol/L ATP前后一个VHC的荧光图像。加入1.0 mmol/L ATP溶液后,所观察的10个细胞,其荧光强度均迅速升高,其变化时程及幅度与0.1 mmol/L组相似,但下降至略低于加药前的水平,如果将细胞体与皮板区分开观察,可以发现其[Ca2+]i 的变化主要发生在细胞体。对照实验显示:向10个Ⅰ型VHC培养皿中加入0.1 ml细胞外液,其荧光强度均无明显改变。在细胞外液无Ca2+时,所观察的10个Ⅰ型VHC中加入1.0 mmol/L ATP溶液时,仅一个细胞内荧光强度有轻度升高,其余不变。说明ATP引起VHC内[Ca2+]i的升高以细胞外钙离子流入为主,细胞外无Ca2+时,ATP引起VHC内[Ca2+]i变化不明显。

, 百拇医药
图3 不同浓度ATP引起Ⅰ型VHC内[Ca2+]i的变化

图4 加入1 mmol/L ATP 前后I型VHC的荧光图像。紫色、蓝色、黄色,依次代表[Ca2+]i增加
讨论
一、前庭毛细胞内Ca2+动员
Ca2+在VHC的感觉功能中起着重要作用,VHC的纤毛位移引起机电转换过程及细胞的适应和动性均与Ca2+密切相关[4,5]。Ohtani等[6]报道细胞外高K+可导致豚鼠离体VHC内[Ca2+]i 升高;认为高K+导致毛细胞去极化引起Ca2+通道开放,细胞外钙离子流入到细胞质中。本实验中也观察到高K+引起I型VHC内[Ca2+]i 的迅速升高,并保持在较高水平。关于高K+引起细胞内[Ca2+]i升高的机理,以往认为与去极化引起细胞膜电压依赖性钙通道开放有关[1]。但Griguer等[7]通过同时用全细胞膜片钳和Fura-2荧光染色记录大鼠离体壶腹嵴I型毛细胞的膜电位和细胞内[Ca2+]i,发现膜电位自-70 mV去极化至-20 mV时,未发生细胞内[Ca2+]i变化,而在膜电位复极化过程中有显著[Ca2+]i升高,同时有内向电流;[Ca2+]i增加的幅度及内向电流的大小与膜去极化的幅度和时程有关;在平均静息电位-62 mV,膜去极化超过-55 mV时,随后的复极化可导致细胞内[Ca2+]i升高及内向电流;在细胞外无Ca2+时,高K+不能诱发类似的[Ca2+]i升高及内向电流。本实验中细胞外无Ca2+时,高K+也不能产生VHC内[Ca2+]i升高,因此,高K+引起VHC内[Ca2+]i升高是由细胞外Ca2+流入引起,且[Ca2+]i的升高与细胞去极化有关。
, 百拇医药
二、ATP对VHC内[Ca2+]i的影响
ATP在许多组织中起递质或调质的作用,其受体类型为P2R。离体外毛细胞膜片钳实验表明,ATP引起一个大的非选择性的阳离子内流,从而使外毛细胞去极化[8]。应用Fura-2荧光测定,Ashmore等[9]在豚鼠外毛细胞上观察到ATP引起的[Ca2+]i 上升可分为2个时相,一个快速上升相之后跟随一个慢上升相,当细胞外液无Ca2+时,快速上升相消失,慢上升相的延迟时间加长,提示快相来自Ca2+内流,慢相来自ATP引起的胞内Ca2+动员。Shigemoto等[2]在鸡耳蜗毛细胞也观察到了ATP引起的[Ca2+]i 上升。本实验观察到ATP持续作用时引起[Ca2+]i 的快速上升,而没有慢相成分;在细胞外无Ca2+时,类似的快速上升消失,证实[Ca2+]i 的升高主要是细胞外Ca2+流入引起,Ca2+可能是通过前庭毛细胞上ATP受体控制的阳离子通道流入的。Housley等[10]通过实验观察认为外毛细胞的表皮板端存在可被ATP激活的配体门控的阳离子通道,ATP作用于外毛细胞时,Ca2+从这些通道流入,引起[Ca2+]i 的升高。我们的结果与Yamashita等[11]将ATP作用于离体VHC所得到的结果相似,ATP能迅速引起细胞内[Ca2+]i升高,达高峰后又降至正常,并没有观察到慢相升高,故认为通过ATP激活的离子通道,为Ca2+自细胞外进入细胞内提供了通路。本组未观察到慢相改变,可能由于观测的手段和所观察的细胞不同,文献报道中存在慢上升相者均为离体外毛细胞,而在离体前庭毛细胞中未看到慢上升相。ATP激活的通道引起细胞去极化,并可促进电压门控的Ca2+通道开放而引起Ca2+自细胞外流入[12]。由此可见,ATP的作用方式类似神经递质,有可能起到传出神经递质的作用,但尚需通过在体实验进一步证实。ATP引起的VHC内[Ca2+]i 的升高依赖于细胞外Ca2+的存在,以细胞外Ca2+流入为主。
, 百拇医药
参考文献
1 Yamashita T, Amano H, Harada N,et al. Calcium distribution and mobilization during depolarization in single cochlear hair cells.Imaging microscopy and fura-2. Acta Otolaryngol, 1990, 109:256-262.
2 Shigemoto T, Ohmori H. Muscarinic agonist and ATP increase the intracellular Ca2+ concentration in chick cochlear hair cells. J Physiol, 1990, 420:127-148 .
3 韩维举,张素珍,姜泗长,等.温度变化对离体前庭毛细胞内钙离子浓度的影响.中华耳鼻咽喉科杂志,1998,33:10-13.
, http://www.100md.com
4 Lumpkin EA, Hudspeth AJ. Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proc Natl Acad Sci USA, 1995,92:10297-10301.
5 Chabbert C, Geleoc G, Lehoulleur J, et al. Intracellular calcium variations evoked by mechanical stimulation of mammalian isolated vestibular type I hair cells. Pflugers Arch, 1994,427:162-168.
6 Ohtani M, Yamashita T, Amano H, et al. Isolation of and calcium moblization in vestibular hair cells of the guinea pig. ORL J Otorhinolaryngol Relat Spec, 1991, 53: 82-85.
, 百拇医药
7 Griguer C, Chabbert C, Sans A, et al. Transient increase in cytosolic free calcium evoked by repolarization in type I vestibular hair cells of rats. Cell Calcium, 1995, 17: 327-334.
8 Nakagawa T, Akaike N, Kimitsuki T, et al. ATP-induced current in isolated outer hair cells of guinea pig cochlea. J Neurophysiol, 1990, 63: 1068-1074.
9 Ashmore JF, Ohmori H. Control intracellular calcium by ATP in isolated outer hair cells of the guinea-pig cochlea. J Physiol, 1990, 428: 109-131.
, http://www.100md.com
10 Housley GD,Greenwood D, Ashmore JF. Localization of cholinergic and purinergic receptors on outer hair cells isolated from the guinea-pig cochlea. Proc R Soc Lond B Biol Sci, 1992, 249: 265-273.
11 Yamashita T, Ohnishi S,Ohtani M, et al. Effects of efferent neurotransmitters on intracellular Ca2+ concentration in vestibular hair cells of the guinea pig. Acta Otolaryngol Suppl, 1993, 500:26-30.
12 Verkhratsky A, Shmigol A. Calcium-induced calcium release in neurones. Cell Calcium, 1996, 19: 1-14.
(收稿:1998-10-13 修回:1999-04-30), http://www.100md.com