新生大鼠脑细胞凋亡与缺氧、缺血两因素析因研究
作者:蒋犁 汤云珍 黄晓明 陈平圣 胡向阳
单位:210009 南京铁道医学院附属医院儿科(蒋犁、汤云珍);南京铁道医学院科研所分子生物学研究室(黄晓明、胡向阳);南京铁道医学院病理学教研室(陈平圣)
关键词:脑缺氧;脑缺血;动物;新生;脱噬作用
中华儿科杂志/980708 【摘要】 目的 探讨新生动物缺氧缺血性脑病(HIE)中脑细胞损伤时是否存在细胞凋亡(apoptosis,Apo),探索在HIE发病机制中缺氧、缺血两因素与凋亡是否存在相关关系。方法 通过建立HIE标准化动物模型,应用HE染色、电镜、组织切片原位末端标记技术(Tunel)等手段,分别对缺氧、缺血、缺氧缺血和对照四组动物的实验侧脑皮质、海马中凋亡细胞的形态、特点、密度进行观察和比较。结果 光镜和电镜显示细胞皱缩、染色质断片、Apo小体;原位标记显示在脑皮质、海马回、丘脑均有裂解的DNA存在;四组凋亡指数:脑皮质区域、海马区域两因素及其交互作用均有统计学意义(F=356.34,P<0.01,F=417.44,P<0.01)。结论 缺氧、缺血两因素均可引起脑细胞凋亡,联合作用与脑细胞凋亡有明显相关性,在HIE中细胞死亡不仅是传统的坏死结果,而且存在着凋亡机制的作用。
, http://www.100md.com
A study on apoptosis in neonatal rats with cerebral hypoxia-ischemia
Jiang Li*, Tang Yunzhen, Huang Xiaoming, et al. *
Nanjing Railway Medical College, Nanjing 210009
【Abstract】 Objective To determine whether or not apoptosis occurs in neonatal hypoxia-ischemia (HIE), and assess the relationship between apoptosis and hypoxia or ischemia. Method Using HE staining and electronmicroscope technique, terminal deoxynuleotidyl transferase-mediated dUTP nick end labelling (Tunel), the authors observed the histological features, densities of apoptotic cells in the cerebral cortex, hippocampus at ipsilateral hemisphere in neonatal rat models of hypoxia, ischemia, hypoxia-ischemia, and normal controls. Result Light and electron microscopy exhibited cell shrinkage, internucleosomal cleavage, apoptosis bodies in rats with HIE. Cells containing cleaved DNA were also identified by in situ labelling in the cortex, hippocampus of the ipsilateral hemisphere. Quantitative analysis of the groups showed that apoptosis occurred in the cortex (F=356.34, P<0.01) and hippocampus (F=417.44, P<0.01) following HIE. Conclusion Cerebral hypoxia and ischemia may induce apoptosis. The cell death in HIE may result not only from traditional necrosis, but also from apoptosis.
, 百拇医药
【Key words】 Cerebral anoxia Cerebral ischemia Animals, newborn Apoptosis
新生儿缺氧缺血性脑病(HIE)是围产期新生儿常见的中枢神经系统病变,已报道在HIE中神经细胞死亡除了坏死以外,还存在受基因控制的细胞主动死亡过程,即凋亡或程序化死亡[1,2]。国内尚少有类似报道。本研究旨在建立HIE标准动物模型,并通过不同诱导因素的处理,直接观察脑损伤中细胞死亡的另一种形式——凋亡(apoptosis,APO),为进一步探讨HIE的发病机制提供实验依据。
对象和方法
一、动物
1.动物模型:按Rice方法制作[2]:出生7天的SD大鼠,乙醚吸入麻醉后取仰卧位,四肢固定于手术板上,颈正中切口,游离左侧颈总动脉,用1号线结扎,缝合切口,放回原饲养环境中恢复4小时,后置于2 000 ml密闭容器中,该容器置于37℃水浴中,以2~3 L/min的速度输入含8%氧气(O2)、92%氮气(N2)的混合气体,持续3小时。
, http://www.100md.com
2.实验动物分组:将24只新生大鼠随机分为四组,每组6只,分别接受四种不同的实验条件(即缺氧、缺血、缺氧缺血、对照四组),观察18小时后灌注处死。取实验侧脑组织观察测定。
3.实验设计:2×2析因设计:实验条件及分组情况见表1。
二、观测方法
1.脑组织病理学光镜检查:取丘脑中1/3平面
表1 2×2析因实验设计模式 A因素
(缺血状态)
B因素(缺氧状态)
B0(不缺氧)
B1(置8%氧气)
, 百拇医药
A0(不结扎动脉)
A0B0(对照组)
A0B1(单纯缺氧)
A1(结扎动脉)
A1B0(单纯缺血)
A1B1(缺血缺氧)
每组n均为6
行冠状切片,片厚5 μm,石蜡包埋,HE染色,光镜检查。
2.脑组织超微结构的观察:在组织病理学光镜检查的取材部位,取脑皮质、海马回组织,用4%多聚甲醛前固定,1%四氧化锇后固定,饱和醋酸铅块染,618包埋,超薄切片,柠檬酸铅片染,透视电镜下观察、摄片。
, http://www.100md.com
3.原位末端脱氧核苷酸转移酶(TdT)介导生物素化的脱氧尿苷三磷酸(deoxyuridine triphosphate)缺口末端标记(Tunel法)[3]:切片做HE染色,光镜观察后,邻近处的石蜡切片定为标记靶组织,并在对照组取与靶组织相对应的正常组织作为阴性对照。采用Boenriger Mannheimgs公司(德)试剂。具体按TdT介导bio-dUTP 缺口末端标记流程操作。同时加做Tunel法末端标记对照试验:取实验组切片经实验流程时,Tunel反应液中不加TdT酶,仅加dUTP等核苷酸混合液。余步骤Tunel法进行,以检测Tunel法的特异性。
三、观察指标和统计方法
对实验组、对照组的Tunel和HE染色切片进行观察和比较,并用测微网测量,计数HE Tunel片网格中阳性细胞数,40×目镜、6个视野、计数平均1.0 mm2内凋亡细胞数为凋亡指数[4]。进行批间比较。计量数据用Sas-6.11软件进行处理。
, http://www.100md.com
结果
一、光镜
1.在实验各组HE染色后可见凋亡细胞。但在缺氧缺血组有明显细胞水肿伴凋亡,在脑皮质、海马回见到典型的凋亡时三种变化形态:(1)明显的染色质结紧,胞浆浓缩。(2)细胞皱缩,周围空泡形成。(3) 单个圆形凋亡小体。
2.实验各组凋亡细胞分布区域不均匀,脑皮质、丘脑明显多于海马。HE染色后缺血缺氧组凋亡指数:皮质21.34、丘脑24.3、海马10.12。
二、电镜
在实验组脑皮质、海马神经部位,电镜下观察到凋亡细胞死亡核形态特征,尤以缺氧缺血组明显:细胞核膜皱缩、核不规则,染色体边集、核小体(附图)。
, 百拇医药
① 电镜观察:缺氧缺血组:脑皮质核膜皱缩(↑)、染色质凝集,边集于核膜(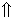 )、胞浆内部分正常细胞结构丧失,可见空泡形成()(×8000)
)、胞浆内部分正常细胞结构丧失,可见空泡形成()(×8000)
② 对照组:脑皮质原位末端DNA标记阴性(Tunel, ×40)
③ 缺氧缺血组:脑皮质原位末端DNA标记阳性细胞明显(↑)(Tunel, ×40)
④ 缺氧缺血组:海马 原位末端DNA标记阳性细胞明显(↑)(Tunel, ×40)
附图 凋亡细胞形态
三、原位TdT缺口末端标记(Tunel法)
在缺氧缺血、单纯缺氧、单纯缺血组动物实验侧脑均可观察到凋亡细胞DNA片段末端标记的阳性细胞,在缺氧缺血标记尤为明显,脑皮质、海马均可见标记阳性细胞(附图)。四组脑皮质、海马凋亡指数分别见表2。
, 百拇医药
四、不同实验因素的效应分析
表2 不同实验条件下脑皮质及海马细胞凋亡指数(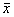 ±s) 实验
±s) 实验
条件
脑皮质*
海马**
B0
B1
交互
效应B
B0
, 百拇医药
B1
交互
效应B
A0
0.8±0.8
8.6±0.7
7.8
0.3±0.5
2.1±0.7
1.8
A1
3.4±1.8
, 百拇医药
44.3±4.8
40.9
0.8±0.8
28.5±3.8
27.7
交互效应A
2.6
35.7
-
0.5
26.4
-
注:交互效应A即A1-A0,交互效应B即B1-B0;A效应:A总1-A总0,脑皮质=38.3,海马=26.9;B效应:B总1-B总0,脑皮质=48.7,海马=29.5;* F=356.34,P<0.01,** F=417.44, P<0.01 1.单因素效应分析:(1)脑缺血(A)效应指数[5](A效应指数=A总1-A总0即总交互效应A):脑皮质为38.3,海马为26.9。(2)缺氧(B)效应指数(B效应指数=B总1-B总0即总交互效应B):脑皮质为48.7,海马为29.5。提示无论是脑皮质还是海马,缺氧或缺血单因素均可诱导神经细胞凋亡,并具有统计学意义(P<0.01)。
, 百拇医药
2.缺氧、缺血两因素交互作用效应分析:(1)由表2可见缺氧存在与否,缺血对细胞凋亡的效应大小明显不同,其效应之比是:脑皮质为35.7/2.6、海马为26.4/0.5;反之,缺血存在与否,对缺氧的效应也有影响,其效应之比分别为:脑皮质40.9/7.8、海马27.7/1.8。上述结果与析因分析结论一致,说明缺氧、缺血两因素存在协同作用,其交互效应明显。
3.缺氧、缺血两因素间效应比较:脑皮质和海马均显示,单纯缺氧比单纯缺血凋亡指数明显高。依据效应指数,可以比较缺血、缺氧效应的大小。对脑皮质而言,缺血因素∶缺氧因素=38.3∶48.7,缺氧比缺血效应大27%。海马缺血因素∶缺氧因素=26.9∶29.5,缺氧比缺血效应大9%。提示缺氧较缺血对新生脑细胞的凋亡作用更明显。
4.同一因素对脑皮质、海马效应比较:(1)缺血:皮质与海马指数之比是38.29∶26.62, 皮质比海马高42%。(2)缺氧:脑皮质与海马指数之比是48.71∶29.42,皮质比海马高66%。提示在18小时内,皮质对缺氧、缺血诱因反应较海马更敏感。
, 百拇医药
讨论
一、细胞凋亡概论
1972年Kerrd等提出细胞凋亡的概念,用以指出一种在形态学上别于细胞坏死(necrosis)的细胞生理性死亡的过程[1]。但目前认为,凋亡的发生与许多病理因素有关。国外心、脑血管专家明确报道缺氧、缺血与凋亡发病机制有密切关系[6~8]。凋亡的细胞以皱缩、染色质断裂和边集、核小体形成为特点,在光镜和电镜下可观察到特异性变化。近来新的实验方法是原位末端标记查DNA片段,是利用分子生物学和免疫组化技术检测到进入细胞凋亡状态的特征性DNA片段,在显微镜下可观察到被着色的细胞阳性信号。该方法标记凋亡细胞裂解的DNA,较一般方法更敏感、可靠[6,7]。
二、新生儿HIE与细胞凋亡
新生儿HIE的发病率高、预后差,其发病机制一直是儿科研究的重点内容。近年来随着缺血性神经细胞病理性研究进展,从分子水平高度研究HIE机制势在必行。1994年已证明成熟动物脑缺血后发生凋亡现象,1995年Hill等[2]首次证明新生大鼠单侧脑缺氧缺血后脑组织有DNA片段和特征性凋亡形态,提示在新生儿HIE脑细胞死亡的过程中,可能有凋亡作用存在[8]。本实验通过HIE的标准化动物模型,利用光镜、电镜和组织切片原位末端标记技术分别对缺氧、缺血、缺氧缺血和对照四组, 实验侧脑皮质、海马中凋亡细胞的形态、特点、密度进行了观察和比较,在光镜和电镜下显示细胞皱缩、染色质断片、Apo小体;原位标记显示在脑皮质、海马回、丘脑均有裂解的DNA存在,证实在HIE有典型的Apo现象,Tunel标记阳性说明有特异的核酸内切酶作用,提示在新生儿HIE发病过程中有分子机制的存在,机体可能启动促进凋亡的基因,使细胞主动的经过凋亡途径进入死亡。
, http://www.100md.com
以往细胞水平发现,在制作HIE动物模型时单纯的吸入低浓度氧或结扎一侧颈总动脉不能形成典型的HIE病变,只有结扎一侧颈总动脉后再吸入8%浓度氧,才能形成明显病变[9]。但本实验通过HE染色观察与Tunel凋亡指数统计发现,缺氧、缺血单因素与脑细胞凋亡有相关性,具有统计学意义,说明在诱发HIE病变中,分子水平的启动机制对单纯缺氧、缺血较细胞水平更敏感。统计结果进一步显示,缺氧缺血交互作用与脑细胞凋亡有明显相关性,其效应指数较单纯缺氧、缺血显著增高,提示在HIE时,缺氧、缺血双重因素的存在,可诱导多个细胞的促进凋亡的基因,从而出现明显的广泛的病理改变。
进一步分析Tunel法标记的DNA片段致密度,脑皮质和海马均示单纯缺氧比单纯缺血组凋亡指数明显高,统计结果显示缺氧的效应大于缺血的效应。提示新生大鼠脑细胞的凋亡是对缺氧较缺血反应更敏感。为儿科、围生期工作者提供了一个临床治疗依据:围生儿窒息抢救时,及时清理呼吸道、及时给氧的必要性。
, 百拇医药 本实验进一步观察到,同样的缺氧缺血联合作用的18小时点,实验侧脑细胞凋亡分布不一。两因素均显示在同样的诱导因素作用下的18小时点脑皮质比海马凋亡明显。光镜下可见脑皮质大部分区域表现为广泛性损伤,其Tunel标记的阳性细胞也明显较海马细胞多。此点与Hill等报道吻合,脑内的不同区域对于损伤的易感性不同,即随着核酸内切酶的活力程度和分布情况而变化。在缺氧缺血早期(18小时内)皮质细胞凋亡率高于海马细胞凋亡。此点对我们判断预后以及进行早期干预性治疗有一定的帮助。
志谢 感谢统计教研室恽振先教授、顾海雁教师对本文的指导和帮助
参考文献
1 Charriaut-Marlangue C, Margaill L, Represa A, et al. Apoptosis and necrosis afterreversible focal ischemia an in situ DNA fragmen-tation analysis. J Cereb Blood Flow Metab, 1996, 16: 186-194.
, http://www.100md.com
2 Hill IE, Macmanus JP, Rasquinha L, et al. DNA fragmentation indicative of apoptosis following unilateral cerebral hypoxia-ischemia in the neonatal rat. Brain Res, 1995, 676:398-403.
3 Wijsman JH, Jonker RR, Keijzer R, et al. A new method to detect apoptosis in paraffin sections: in situ end-labeling of fragmented DNA. J Histochem Cytochem, 1993, 41:7-12.
4 Wijesman JH, Jonker RR, Keijzer R, et al. A new method to detect apoptosis in paraff in sections: in situ end-labeling of fragmened DNA. J Histochem cytochem, 1993, 41:7.
, 百拇医药
5 郭主超,主编.析因实验方差分析.见:医用数理统计方法.第3版.北京:人民卫生出版社.1988.307-341.
6 Iwai T, Hara A, Niwa M ,et al. Temporal profile of nuclear DNA fragmentation in situ in gerbil hippocampus following ransient forebrain ischemia. Brain Res, 1995, 671:305-308.
7 MacManus JP, Hill IE, Huang ZG,et al. DNA damage consistent with apoptosis in transient focal ischamic neocortex. Neuroreport, 1994, 5:493-496.
8 Sei Y, Von Lubitz KJ, Basile AS,et al Internucleosomal DNA fragmentation in gerbil hippocampus following forebrain ischemia. Neurosci Lett,1994, 171:179-182.
9 吴婉芳. 新生儿缺氧缺血性脑病动物实验研究. 中国实用儿科杂志, 1995,10: 69-72., http://www.100md.com
单位:210009 南京铁道医学院附属医院儿科(蒋犁、汤云珍);南京铁道医学院科研所分子生物学研究室(黄晓明、胡向阳);南京铁道医学院病理学教研室(陈平圣)
关键词:脑缺氧;脑缺血;动物;新生;脱噬作用
中华儿科杂志/980708 【摘要】 目的 探讨新生动物缺氧缺血性脑病(HIE)中脑细胞损伤时是否存在细胞凋亡(apoptosis,Apo),探索在HIE发病机制中缺氧、缺血两因素与凋亡是否存在相关关系。方法 通过建立HIE标准化动物模型,应用HE染色、电镜、组织切片原位末端标记技术(Tunel)等手段,分别对缺氧、缺血、缺氧缺血和对照四组动物的实验侧脑皮质、海马中凋亡细胞的形态、特点、密度进行观察和比较。结果 光镜和电镜显示细胞皱缩、染色质断片、Apo小体;原位标记显示在脑皮质、海马回、丘脑均有裂解的DNA存在;四组凋亡指数:脑皮质区域、海马区域两因素及其交互作用均有统计学意义(F=356.34,P<0.01,F=417.44,P<0.01)。结论 缺氧、缺血两因素均可引起脑细胞凋亡,联合作用与脑细胞凋亡有明显相关性,在HIE中细胞死亡不仅是传统的坏死结果,而且存在着凋亡机制的作用。
, http://www.100md.com
A study on apoptosis in neonatal rats with cerebral hypoxia-ischemia
Jiang Li*, Tang Yunzhen, Huang Xiaoming, et al. *
Nanjing Railway Medical College, Nanjing 210009
【Abstract】 Objective To determine whether or not apoptosis occurs in neonatal hypoxia-ischemia (HIE), and assess the relationship between apoptosis and hypoxia or ischemia. Method Using HE staining and electronmicroscope technique, terminal deoxynuleotidyl transferase-mediated dUTP nick end labelling (Tunel), the authors observed the histological features, densities of apoptotic cells in the cerebral cortex, hippocampus at ipsilateral hemisphere in neonatal rat models of hypoxia, ischemia, hypoxia-ischemia, and normal controls. Result Light and electron microscopy exhibited cell shrinkage, internucleosomal cleavage, apoptosis bodies in rats with HIE. Cells containing cleaved DNA were also identified by in situ labelling in the cortex, hippocampus of the ipsilateral hemisphere. Quantitative analysis of the groups showed that apoptosis occurred in the cortex (F=356.34, P<0.01) and hippocampus (F=417.44, P<0.01) following HIE. Conclusion Cerebral hypoxia and ischemia may induce apoptosis. The cell death in HIE may result not only from traditional necrosis, but also from apoptosis.
, 百拇医药
【Key words】 Cerebral anoxia Cerebral ischemia Animals, newborn Apoptosis
新生儿缺氧缺血性脑病(HIE)是围产期新生儿常见的中枢神经系统病变,已报道在HIE中神经细胞死亡除了坏死以外,还存在受基因控制的细胞主动死亡过程,即凋亡或程序化死亡[1,2]。国内尚少有类似报道。本研究旨在建立HIE标准动物模型,并通过不同诱导因素的处理,直接观察脑损伤中细胞死亡的另一种形式——凋亡(apoptosis,APO),为进一步探讨HIE的发病机制提供实验依据。
对象和方法
一、动物
1.动物模型:按Rice方法制作[2]:出生7天的SD大鼠,乙醚吸入麻醉后取仰卧位,四肢固定于手术板上,颈正中切口,游离左侧颈总动脉,用1号线结扎,缝合切口,放回原饲养环境中恢复4小时,后置于2 000 ml密闭容器中,该容器置于37℃水浴中,以2~3 L/min的速度输入含8%氧气(O2)、92%氮气(N2)的混合气体,持续3小时。
, http://www.100md.com
2.实验动物分组:将24只新生大鼠随机分为四组,每组6只,分别接受四种不同的实验条件(即缺氧、缺血、缺氧缺血、对照四组),观察18小时后灌注处死。取实验侧脑组织观察测定。
3.实验设计:2×2析因设计:实验条件及分组情况见表1。
二、观测方法
1.脑组织病理学光镜检查:取丘脑中1/3平面
表1 2×2析因实验设计模式 A因素
(缺血状态)
B因素(缺氧状态)
B0(不缺氧)
B1(置8%氧气)
, 百拇医药
A0(不结扎动脉)
A0B0(对照组)
A0B1(单纯缺氧)
A1(结扎动脉)
A1B0(单纯缺血)
A1B1(缺血缺氧)
每组n均为6
行冠状切片,片厚5 μm,石蜡包埋,HE染色,光镜检查。
2.脑组织超微结构的观察:在组织病理学光镜检查的取材部位,取脑皮质、海马回组织,用4%多聚甲醛前固定,1%四氧化锇后固定,饱和醋酸铅块染,618包埋,超薄切片,柠檬酸铅片染,透视电镜下观察、摄片。
, http://www.100md.com
3.原位末端脱氧核苷酸转移酶(TdT)介导生物素化的脱氧尿苷三磷酸(deoxyuridine triphosphate)缺口末端标记(Tunel法)[3]:切片做HE染色,光镜观察后,邻近处的石蜡切片定为标记靶组织,并在对照组取与靶组织相对应的正常组织作为阴性对照。采用Boenriger Mannheimgs公司(德)试剂。具体按TdT介导bio-dUTP 缺口末端标记流程操作。同时加做Tunel法末端标记对照试验:取实验组切片经实验流程时,Tunel反应液中不加TdT酶,仅加dUTP等核苷酸混合液。余步骤Tunel法进行,以检测Tunel法的特异性。
三、观察指标和统计方法
对实验组、对照组的Tunel和HE染色切片进行观察和比较,并用测微网测量,计数HE Tunel片网格中阳性细胞数,40×目镜、6个视野、计数平均1.0 mm2内凋亡细胞数为凋亡指数[4]。进行批间比较。计量数据用Sas-6.11软件进行处理。
, http://www.100md.com
结果
一、光镜
1.在实验各组HE染色后可见凋亡细胞。但在缺氧缺血组有明显细胞水肿伴凋亡,在脑皮质、海马回见到典型的凋亡时三种变化形态:(1)明显的染色质结紧,胞浆浓缩。(2)细胞皱缩,周围空泡形成。(3) 单个圆形凋亡小体。
2.实验各组凋亡细胞分布区域不均匀,脑皮质、丘脑明显多于海马。HE染色后缺血缺氧组凋亡指数:皮质21.34、丘脑24.3、海马10.12。
二、电镜
在实验组脑皮质、海马神经部位,电镜下观察到凋亡细胞死亡核形态特征,尤以缺氧缺血组明显:细胞核膜皱缩、核不规则,染色体边集、核小体(附图)。

, 百拇医药
① 电镜观察:缺氧缺血组:脑皮质核膜皱缩(↑)、染色质凝集,边集于核膜(
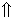 )、胞浆内部分正常细胞结构丧失,可见空泡形成()(×8000)
)、胞浆内部分正常细胞结构丧失,可见空泡形成()(×8000)② 对照组:脑皮质原位末端DNA标记阴性(Tunel, ×40)
③ 缺氧缺血组:脑皮质原位末端DNA标记阳性细胞明显(↑)(Tunel, ×40)
④ 缺氧缺血组:海马 原位末端DNA标记阳性细胞明显(↑)(Tunel, ×40)
附图 凋亡细胞形态
三、原位TdT缺口末端标记(Tunel法)
在缺氧缺血、单纯缺氧、单纯缺血组动物实验侧脑均可观察到凋亡细胞DNA片段末端标记的阳性细胞,在缺氧缺血标记尤为明显,脑皮质、海马均可见标记阳性细胞(附图)。四组脑皮质、海马凋亡指数分别见表2。
, 百拇医药
四、不同实验因素的效应分析
表2 不同实验条件下脑皮质及海马细胞凋亡指数(
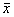 ±s) 实验
±s) 实验条件
脑皮质*
海马**
B0
B1
交互
效应B
B0
, 百拇医药
B1
交互
效应B
A0
0.8±0.8
8.6±0.7
7.8
0.3±0.5
2.1±0.7
1.8
A1
3.4±1.8
, 百拇医药
44.3±4.8
40.9
0.8±0.8
28.5±3.8
27.7
交互效应A
2.6
35.7
-
0.5
26.4
-
注:交互效应A即A1-A0,交互效应B即B1-B0;A效应:A总1-A总0,脑皮质=38.3,海马=26.9;B效应:B总1-B总0,脑皮质=48.7,海马=29.5;* F=356.34,P<0.01,** F=417.44, P<0.01 1.单因素效应分析:(1)脑缺血(A)效应指数[5](A效应指数=A总1-A总0即总交互效应A):脑皮质为38.3,海马为26.9。(2)缺氧(B)效应指数(B效应指数=B总1-B总0即总交互效应B):脑皮质为48.7,海马为29.5。提示无论是脑皮质还是海马,缺氧或缺血单因素均可诱导神经细胞凋亡,并具有统计学意义(P<0.01)。
, 百拇医药
2.缺氧、缺血两因素交互作用效应分析:(1)由表2可见缺氧存在与否,缺血对细胞凋亡的效应大小明显不同,其效应之比是:脑皮质为35.7/2.6、海马为26.4/0.5;反之,缺血存在与否,对缺氧的效应也有影响,其效应之比分别为:脑皮质40.9/7.8、海马27.7/1.8。上述结果与析因分析结论一致,说明缺氧、缺血两因素存在协同作用,其交互效应明显。
3.缺氧、缺血两因素间效应比较:脑皮质和海马均显示,单纯缺氧比单纯缺血凋亡指数明显高。依据效应指数,可以比较缺血、缺氧效应的大小。对脑皮质而言,缺血因素∶缺氧因素=38.3∶48.7,缺氧比缺血效应大27%。海马缺血因素∶缺氧因素=26.9∶29.5,缺氧比缺血效应大9%。提示缺氧较缺血对新生脑细胞的凋亡作用更明显。
4.同一因素对脑皮质、海马效应比较:(1)缺血:皮质与海马指数之比是38.29∶26.62, 皮质比海马高42%。(2)缺氧:脑皮质与海马指数之比是48.71∶29.42,皮质比海马高66%。提示在18小时内,皮质对缺氧、缺血诱因反应较海马更敏感。
, 百拇医药
讨论
一、细胞凋亡概论
1972年Kerrd等提出细胞凋亡的概念,用以指出一种在形态学上别于细胞坏死(necrosis)的细胞生理性死亡的过程[1]。但目前认为,凋亡的发生与许多病理因素有关。国外心、脑血管专家明确报道缺氧、缺血与凋亡发病机制有密切关系[6~8]。凋亡的细胞以皱缩、染色质断裂和边集、核小体形成为特点,在光镜和电镜下可观察到特异性变化。近来新的实验方法是原位末端标记查DNA片段,是利用分子生物学和免疫组化技术检测到进入细胞凋亡状态的特征性DNA片段,在显微镜下可观察到被着色的细胞阳性信号。该方法标记凋亡细胞裂解的DNA,较一般方法更敏感、可靠[6,7]。
二、新生儿HIE与细胞凋亡
新生儿HIE的发病率高、预后差,其发病机制一直是儿科研究的重点内容。近年来随着缺血性神经细胞病理性研究进展,从分子水平高度研究HIE机制势在必行。1994年已证明成熟动物脑缺血后发生凋亡现象,1995年Hill等[2]首次证明新生大鼠单侧脑缺氧缺血后脑组织有DNA片段和特征性凋亡形态,提示在新生儿HIE脑细胞死亡的过程中,可能有凋亡作用存在[8]。本实验通过HIE的标准化动物模型,利用光镜、电镜和组织切片原位末端标记技术分别对缺氧、缺血、缺氧缺血和对照四组, 实验侧脑皮质、海马中凋亡细胞的形态、特点、密度进行了观察和比较,在光镜和电镜下显示细胞皱缩、染色质断片、Apo小体;原位标记显示在脑皮质、海马回、丘脑均有裂解的DNA存在,证实在HIE有典型的Apo现象,Tunel标记阳性说明有特异的核酸内切酶作用,提示在新生儿HIE发病过程中有分子机制的存在,机体可能启动促进凋亡的基因,使细胞主动的经过凋亡途径进入死亡。
, http://www.100md.com
以往细胞水平发现,在制作HIE动物模型时单纯的吸入低浓度氧或结扎一侧颈总动脉不能形成典型的HIE病变,只有结扎一侧颈总动脉后再吸入8%浓度氧,才能形成明显病变[9]。但本实验通过HE染色观察与Tunel凋亡指数统计发现,缺氧、缺血单因素与脑细胞凋亡有相关性,具有统计学意义,说明在诱发HIE病变中,分子水平的启动机制对单纯缺氧、缺血较细胞水平更敏感。统计结果进一步显示,缺氧缺血交互作用与脑细胞凋亡有明显相关性,其效应指数较单纯缺氧、缺血显著增高,提示在HIE时,缺氧、缺血双重因素的存在,可诱导多个细胞的促进凋亡的基因,从而出现明显的广泛的病理改变。
进一步分析Tunel法标记的DNA片段致密度,脑皮质和海马均示单纯缺氧比单纯缺血组凋亡指数明显高,统计结果显示缺氧的效应大于缺血的效应。提示新生大鼠脑细胞的凋亡是对缺氧较缺血反应更敏感。为儿科、围生期工作者提供了一个临床治疗依据:围生儿窒息抢救时,及时清理呼吸道、及时给氧的必要性。
, 百拇医药 本实验进一步观察到,同样的缺氧缺血联合作用的18小时点,实验侧脑细胞凋亡分布不一。两因素均显示在同样的诱导因素作用下的18小时点脑皮质比海马凋亡明显。光镜下可见脑皮质大部分区域表现为广泛性损伤,其Tunel标记的阳性细胞也明显较海马细胞多。此点与Hill等报道吻合,脑内的不同区域对于损伤的易感性不同,即随着核酸内切酶的活力程度和分布情况而变化。在缺氧缺血早期(18小时内)皮质细胞凋亡率高于海马细胞凋亡。此点对我们判断预后以及进行早期干预性治疗有一定的帮助。
志谢 感谢统计教研室恽振先教授、顾海雁教师对本文的指导和帮助
参考文献
1 Charriaut-Marlangue C, Margaill L, Represa A, et al. Apoptosis and necrosis afterreversible focal ischemia an in situ DNA fragmen-tation analysis. J Cereb Blood Flow Metab, 1996, 16: 186-194.
, http://www.100md.com
2 Hill IE, Macmanus JP, Rasquinha L, et al. DNA fragmentation indicative of apoptosis following unilateral cerebral hypoxia-ischemia in the neonatal rat. Brain Res, 1995, 676:398-403.
3 Wijsman JH, Jonker RR, Keijzer R, et al. A new method to detect apoptosis in paraffin sections: in situ end-labeling of fragmented DNA. J Histochem Cytochem, 1993, 41:7-12.
4 Wijesman JH, Jonker RR, Keijzer R, et al. A new method to detect apoptosis in paraff in sections: in situ end-labeling of fragmened DNA. J Histochem cytochem, 1993, 41:7.
, 百拇医药
5 郭主超,主编.析因实验方差分析.见:医用数理统计方法.第3版.北京:人民卫生出版社.1988.307-341.
6 Iwai T, Hara A, Niwa M ,et al. Temporal profile of nuclear DNA fragmentation in situ in gerbil hippocampus following ransient forebrain ischemia. Brain Res, 1995, 671:305-308.
7 MacManus JP, Hill IE, Huang ZG,et al. DNA damage consistent with apoptosis in transient focal ischamic neocortex. Neuroreport, 1994, 5:493-496.
8 Sei Y, Von Lubitz KJ, Basile AS,et al Internucleosomal DNA fragmentation in gerbil hippocampus following forebrain ischemia. Neurosci Lett,1994, 171:179-182.
9 吴婉芳. 新生儿缺氧缺血性脑病动物实验研究. 中国实用儿科杂志, 1995,10: 69-72., http://www.100md.com