低密度脂蛋白对大鼠肾小球系膜细胞分泌系膜基质的影响
作者:宋红梅 李学旺 魏珉 朱传
单位:100730 中国医学科学院中国协和医科大学北京协和医院儿科(宋红梅、魏珉、朱传),肾内科(李学旺)
关键词:肾小球膜;脂蛋白类;LDL;胶原;层粘连蛋白;RNA;信使
中华儿科杂志990209 【摘要】 目的 应用培养的大鼠肾小球系膜细胞(MSC),在体外研究低密度脂蛋白(LDL)对MSC分泌Ⅳ型胶原以及层粘连蛋白(LN)mRNA表达的影响。方法 用不同浓度人血提纯的LDL(0,25,50,100,150,200μg/ml)与第3~10代转种的大鼠MSC共同孵育48小时后,ELISA法测定培养上清液中Ⅳ型胶原的含量,并提取细胞总RNA经Northern杂交检测LN mRNA的表达。结果 LDL在50μg/ml浓度时即可刺激MSC分泌Ⅳ型胶原蛋白,并增加LN mRNA的表达,且随LDL浓度的增加Ⅳ型胶原的分泌及LN mRNA的表达也增加。结论 LDL可能通过刺激MSC产生过多的细胞外基质而在肾小球硬化的过程中起重要作用。
, 百拇医药
The effect of low density lipoproteins on the production of extracellular matrix by cultured rat mesangial cells in vitro SONG Hongmei, LI Xuewang, WEI Min, et al. Department of Pediatrics and Internal Medicine, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730
【Abstract】 Objective Hyperlipidemia and abnormalities in lipid metabolism may contribute to the progression of renal injury, in which increased LDL was proven to be an important factor. The aim of this study was to determine the effect of LDL on the production of type Ⅳ collagen and mRNA expression of laminin (LN) by cultured rat mesangial cells in vitro. Methods LDL was prepared from normal human plasma. Subconfluent mesangial cells monolayers grown in serum-free culture medium for 24 hr were challenged with LDL (0, 25, 50, 100, 150, 200 μg/ml) for 48 hr. Production of type Ⅳ collagen in the culture medium was evaluated with an ELISA kit; total RNA was extracted from mesangial cells treated with all concentrations of LDL, and Northern blotting was performed with cDNA for LN. Results LDL stimulated type Ⅳ collagen production and LN mRNA expression in the concentrtion of 50 μg/ml. Secretion of type Ⅳ collagen and expression of LN mRNA increased as LDL concentration increased. Conclusion LDL may play an important role in the pathogenesis of glomerulosclerosis by stimulating the accumulation of extracellular matrix.
, 百拇医药
【Key words】 Glomerular mesangium Lipoproteins,LDL Collagen Laminin RNA, messenger
在各种肾脏疾病所致的脂代谢紊乱中,低密度脂蛋白(LDL)的异常升高倍受关注。国内外研究结果已表明了LDL与动脉粥样硬化的关系,肾小球硬化与动脉粥样硬化病理生理机制类似,所以最近LDL与肾小球硬化的关系成为肾脏病学领域中的研究热点之一。我们应用体外细胞培养的方法,研究了LDL对肾小球系膜细胞(MSC)分泌系膜基质成分Ⅳ型胶原及层粘连蛋白(LN)的影响,以期进一步从细胞及分子水平探讨LDL导致肾小球损伤的机制。
材料和方法
一、材料
1.所用实验鼠情况:采用解放军总医院动物室提供的SD大鼠,雄性,一级,体重80~100 g。
, 百拇医药
2.MSC的分离、培养与鉴定[1-3]:5只SD大鼠经乙醚麻醉后,分离其肾皮质,混合后剪碎并轻轻碾压,分别过150目(110 μm)、80目(216 μm)及200目(75 μm)细胞分样筛,收集肾小球,用400 μg/ml胶原酶5 ml 37℃消化30分钟,用含20%胎牛血清的RPMI 1640培养液将肾小球悬浮至塑料培养瓶中,CO2恒温培养箱(5% CO2,37℃)孵育,20天左右MSC长满瓶底后进行转种。相差显微镜可见细胞胞体呈梭形、不规则星形及三角形,中央有一清晰的卵圆形核,胞浆中见微丝结构,肌动蛋白间接免疫荧光染色阳性。透射电镜检查可见细胞内微丝结构,扫描电镜可见细胞表面微丝束隆起,用10-8 mmol/L血管加压素Ⅱ刺激可导致MSC收缩。
二、方法
1.MSC分泌Ⅳ型胶原的检测:取第3~10代转种的MSC消化后用含20%FCS的RPMI 1640稀释至细胞数2000个/ml,取1 ml接种于24孔细胞培养板中,待细胞将要铺满孔底后用无血清培养基培养24小时(使细胞表面LDL受体上调),按实验设计用无血清培养基配制不同剂量的LDL(0,25,50,100,150,200 μg/ml)(人血提纯的LDL, 27 mg/ml, 由医科院基础所生化室提供)继续培养48小时,收集上清-20℃贮存待测。Ⅳ型胶原的检测采用日本富士药品工业株式会社生产的Ⅳ型胶原检测试剂盒(ELISA法),以不同浓度的Ⅳ型胶原标准品在450 nm波长的吸光度(A,曾称光密度OD)绘制标准曲线,并根据其公式Y=-40.82+4476.61(A)计算测定样品的浓度。
, http://www.100md.com
2.MSC表达LN mRNA的测定:取第3~10代MSC转种于200ml塑料培养瓶内继续培养,待细胞接近长满瓶底时,换无血清培养基培养24小时,然后加入不同浓度的LDL(0,25,50,100, 150,200 μg/ml)继续培养48小时,收集细胞,用Promega公司的RNA提取试剂盒提取细胞总RNA,经甲醛变性琼脂糖电泳后转移至硝酸纤维素膜,将已转膜烤干的硝酸纤维素膜及预杂交液(5×SSC, 0.1%N-Laurolsarcosine, 0.02%SDS,1%阻断液)装入杂交袋中,68℃预杂交3小时。取Dig标记好的LN探针(由美国NIH Yoshihiko Yamada教授赠送)5μl(约200ng)在沸水中煮沸10分钟后加入预杂交液中,68℃杂交16~18小时。Dig检测试剂盒进行免疫显色16小时,然后用二甲基酰胺清除膜上的探针,待蓝色褪尽后用β-actin探针(基础所神经免疫室赠送)重新杂交。
3.统计分析:试验数据采用均值±标准差(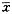 ±s)表示,不同组之间的比较应用StartView统计软件中的单因素方差分析,当P值<0.05时差异有显著意义。
±s)表示,不同组之间的比较应用StartView统计软件中的单因素方差分析,当P值<0.05时差异有显著意义。
, 百拇医药
结 果
一、LDL对MSC分泌Ⅳ型胶原的影响
LDL在50 μg/ml浓度时MSC Ⅳ型胶原的分泌即开始增多,并随着LDL浓度的增加Ⅳ型胶原的分泌也增加(F=18.360,P<0.001)。见(表1)。
二、LDL对MSC LN mRNA表达的影响
用LN(B2链)cDNA探针与经LDL处理的MSC总RNA进行Northern杂交,结果经光密度扫描仪定量分析并以β-actin作为内参照以校正RNA加样量。结果表明,LDL在50μg/ml浓度时即可刺激MSC LN mRNA表达增加,并随着LDL浓度的增加,LN mRNA的表达也增强(表1,图1)
表1 不同浓度的LDL对MSC分必Ⅳ型胶原和对MSC LN mRNA表达的影响 LDL浓度
, 百拇医药
(μg/ml)
Ⅳ型胶原浓度
LN mRNA表达
标本数(只)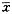 ±s(ng/ml)
±s(ng/ml)
标本数(只)
LN/β-actin吸光度值(A)
0
6
31±6
3
0.38±0.04
, 百拇医药
25
6
33±10
3
0.42±0.04
50
6
60±16*
3
0.62±0.05**△△
100
6
88±23**△
, 百拇医药
3
0.61±0.09**
150
6
102±25**
3
0.92±0.10**△△
200
6
133±34**△
3
1.01±0.03**
, 百拇医药
F值
18.360
49.818
P值
<0.01
<0.01
注:与未加LDL组比较,*P<0.05,**P<0.01;
与前一浓度LDL组比较,△P<0.05,△△P<0.01
图1 MSC LN mRNA表达的Northern杂交结果
, 百拇医药
讨 论
已知LDL及其修饰产物如氧化LDL(OX-LDL)在MSC的增殖及肾小球硬化的过程中起一定作用。LDL不仅可以引起MSC增殖,还可以刺激培养的MSC产生细胞外基质(ECM)。90年代以来对LDL刺激系膜基质合成的体外研究逐渐增多。Kamanna等[4]和Keane等[5]分别报道了LDL和OX-LDL刺激MSC胶原的合成以及Ⅳ型胶原mRNA的表达。Rovim和Tan[6]发现MSC与LDL共同孵育后,上清液中纤维粘连蛋白(FN)含量显著增多并呈时间、剂量依赖性。我院肾内科以前的实验研究也发现LDL及OX-LDL对FN的合成有促进作用并和剂量有关。但目前尚未见关于LDL对MSC产生及分泌LN的报道。
我们的实验结果表明,LDL在50μg/ml浓度即可刺激MSC Ⅳ型胶原的分泌及LN mRNA的表达,而且随着剂量的增加其合成及表达也增加,与国外文献报道基本一致。但本实验与以往研究中LDL的作用浓度略有不同,例如Kamanna等[4]认为LDL在10~20 μg/ml 时即增加胶原的合成;而Kim等[7]的实验结果为LDL在100 μg/ml时刺激MSC Ⅳ型胶原的产生。分析其原因可能有:(1)与LDL的纯度有关;(2)是否及时应用,因为LDL放置后易被氧化形成氧化修饰的LDL;(3)不同的蛋白测定方法测定的LDL浓度也有不同;(4)LDL的作用可能受到细胞周期、受体密度及细胞因子的自分泌等多种因素影响。
, http://www.100md.com
正常大鼠血浆LDL浓度为120μg/ml,但其在正常情况下并不引起肾脏损伤。可能由于(1)血管内皮细胞表面的负电荷可使过滤到系膜区的LDL浓度明显减低[7];(2)在体内有HDL的保护作用,对动脉粥样硬化等心血管疾病的研究表明HDL可以拮抗LDL的损伤作用[8];另外,体内的内环境非常复杂,LDL在体内的作用可能受到各种因素的影响。
LDL导致ECM累积的机制目前认为是由于其肾内基因转录增加导致合成增多以及金属蛋白酶组织抑制因子(TIMP)产生增加导致降解减少而共同作用的结果[9]。Kim等[7]发现LDL刺激Ⅳ型胶原mRNA及TIMP-2 mRNA的表达,但对胶原酶mRNA的表达无作用,所以Ⅳ型胶原合成增加而降解减少。Rovin和Tan[6]的研究也表明LDL导致的FN增多与FN mRNA水平呈正相关并可能通过受体途径介导。本研究未做关于胶原酶及TIMP等的研究,但LN mRNA的表达增加表明LDL可能通过增加基因转录导致系膜基质的合成增多。关于LDL对MSC的作用,可能是LDL通过肾小球滤过至系膜区后直接刺激MSC,或通过刺激血管内皮细胞和浸润的单核细胞分泌一些细胞因子及生长因子而起作用,如血小板源生长因子(PDGF)、白细胞介素1(IL-1)、转代生长因子-β(TGF-β)等,其中TGF-β最为重要,其对多种ECM的基因表达有很强的刺激作用,并能够抑制某些细胞间质降解酶的活性,刺激TIMP-1的活性,最终结果导致ECM累积[10-11]。
, http://www.100md.com
总之,本实验结果表明LDL可以刺激MSC Ⅳ型胶原的产生,增加LN mRNA的表达,并与剂量有关。进一步在体外从细胞及分子水平证实了LDL通过刺激MSC产生过多的ECM而在肾小球硬化的过程中起重要作用。
参考文献
1 Kreisberg JI, Karnovsky MJ. Glomerular cells in culture. Kidney Int, 1983, 23:439-447.
2 Harper PA, Robinson JM, Hoover RL, et al. Improved methods for culture rat glomerular cells. Kidney Int, 1984, 26:875-880.
3 Davies M. The mesangial cells: a tissue culture view. Kidney Int, 1994, 45:320-327.
, 百拇医药
4 Kamanna M, Bui DT, Roh DD, et al. LDL and oxidized IDL stimulate collagen synthesis by mesangial cells (Abstract). J Am Soc Nephrol, 1992, 3:634.
5 Keane WF, Kasiske BL, O′Donnell MP, et al. Oxidized low density lipoprotein increases mesangial cell expression of type Ⅳ collagen mRNA (Abstract). J Am Soc Nephrol, 1992, 3:635.
6 Rovin BH, Tan LC. LDL stimulates mesangial fibronectin production and chemoattractant expression. Kidney Int, 1993, 43:218-225.
, 百拇医药
7 Kim SB, Kang SA, Cho YJ, et al. Effects of low density lipoprotein on type Ⅳ collagen production by cultured rat mesangial cells. Nephron, 1994, 67:327-333.
8 Sokolovskaya Ⅳ, Nikiforova NV. High-density lipoprotein cholesterol in patients with untreated and treated nephrotic syndrome. Nephron, 1984, 37:49-53.
9 Jones CL, Buch S, Post M, et al. Production of extracellular matrix in purine aminonucleoside nephrosis [Abstract]. J Am Soc Nephrol, 1991, 2:550.
, 百拇医药
10 Border WA, Noble NA. Cytokines in kidney disease: the role of transforming growth factor-β. Am J Kidney Dis, 1993, 22:105-113.
11 Kees-Folts D, Diamond JR. Relationship between hyperlipidemia, lipid mediators, and progressive glomerulosclerosis in the nephrotic syndrome. Am J Nephrol, 1993, 13:365-375.
(收稿:1998-03-02 修回:1998-12-25), 百拇医药
单位:100730 中国医学科学院中国协和医科大学北京协和医院儿科(宋红梅、魏珉、朱传),肾内科(李学旺)
关键词:肾小球膜;脂蛋白类;LDL;胶原;层粘连蛋白;RNA;信使
中华儿科杂志990209 【摘要】 目的 应用培养的大鼠肾小球系膜细胞(MSC),在体外研究低密度脂蛋白(LDL)对MSC分泌Ⅳ型胶原以及层粘连蛋白(LN)mRNA表达的影响。方法 用不同浓度人血提纯的LDL(0,25,50,100,150,200μg/ml)与第3~10代转种的大鼠MSC共同孵育48小时后,ELISA法测定培养上清液中Ⅳ型胶原的含量,并提取细胞总RNA经Northern杂交检测LN mRNA的表达。结果 LDL在50μg/ml浓度时即可刺激MSC分泌Ⅳ型胶原蛋白,并增加LN mRNA的表达,且随LDL浓度的增加Ⅳ型胶原的分泌及LN mRNA的表达也增加。结论 LDL可能通过刺激MSC产生过多的细胞外基质而在肾小球硬化的过程中起重要作用。
, 百拇医药
The effect of low density lipoproteins on the production of extracellular matrix by cultured rat mesangial cells in vitro SONG Hongmei, LI Xuewang, WEI Min, et al. Department of Pediatrics and Internal Medicine, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730
【Abstract】 Objective Hyperlipidemia and abnormalities in lipid metabolism may contribute to the progression of renal injury, in which increased LDL was proven to be an important factor. The aim of this study was to determine the effect of LDL on the production of type Ⅳ collagen and mRNA expression of laminin (LN) by cultured rat mesangial cells in vitro. Methods LDL was prepared from normal human plasma. Subconfluent mesangial cells monolayers grown in serum-free culture medium for 24 hr were challenged with LDL (0, 25, 50, 100, 150, 200 μg/ml) for 48 hr. Production of type Ⅳ collagen in the culture medium was evaluated with an ELISA kit; total RNA was extracted from mesangial cells treated with all concentrations of LDL, and Northern blotting was performed with cDNA for LN. Results LDL stimulated type Ⅳ collagen production and LN mRNA expression in the concentrtion of 50 μg/ml. Secretion of type Ⅳ collagen and expression of LN mRNA increased as LDL concentration increased. Conclusion LDL may play an important role in the pathogenesis of glomerulosclerosis by stimulating the accumulation of extracellular matrix.
, 百拇医药
【Key words】 Glomerular mesangium Lipoproteins,LDL Collagen Laminin RNA, messenger
在各种肾脏疾病所致的脂代谢紊乱中,低密度脂蛋白(LDL)的异常升高倍受关注。国内外研究结果已表明了LDL与动脉粥样硬化的关系,肾小球硬化与动脉粥样硬化病理生理机制类似,所以最近LDL与肾小球硬化的关系成为肾脏病学领域中的研究热点之一。我们应用体外细胞培养的方法,研究了LDL对肾小球系膜细胞(MSC)分泌系膜基质成分Ⅳ型胶原及层粘连蛋白(LN)的影响,以期进一步从细胞及分子水平探讨LDL导致肾小球损伤的机制。
材料和方法
一、材料
1.所用实验鼠情况:采用解放军总医院动物室提供的SD大鼠,雄性,一级,体重80~100 g。
, 百拇医药
2.MSC的分离、培养与鉴定[1-3]:5只SD大鼠经乙醚麻醉后,分离其肾皮质,混合后剪碎并轻轻碾压,分别过150目(110 μm)、80目(216 μm)及200目(75 μm)细胞分样筛,收集肾小球,用400 μg/ml胶原酶5 ml 37℃消化30分钟,用含20%胎牛血清的RPMI 1640培养液将肾小球悬浮至塑料培养瓶中,CO2恒温培养箱(5% CO2,37℃)孵育,20天左右MSC长满瓶底后进行转种。相差显微镜可见细胞胞体呈梭形、不规则星形及三角形,中央有一清晰的卵圆形核,胞浆中见微丝结构,肌动蛋白间接免疫荧光染色阳性。透射电镜检查可见细胞内微丝结构,扫描电镜可见细胞表面微丝束隆起,用10-8 mmol/L血管加压素Ⅱ刺激可导致MSC收缩。
二、方法
1.MSC分泌Ⅳ型胶原的检测:取第3~10代转种的MSC消化后用含20%FCS的RPMI 1640稀释至细胞数2000个/ml,取1 ml接种于24孔细胞培养板中,待细胞将要铺满孔底后用无血清培养基培养24小时(使细胞表面LDL受体上调),按实验设计用无血清培养基配制不同剂量的LDL(0,25,50,100,150,200 μg/ml)(人血提纯的LDL, 27 mg/ml, 由医科院基础所生化室提供)继续培养48小时,收集上清-20℃贮存待测。Ⅳ型胶原的检测采用日本富士药品工业株式会社生产的Ⅳ型胶原检测试剂盒(ELISA法),以不同浓度的Ⅳ型胶原标准品在450 nm波长的吸光度(A,曾称光密度OD)绘制标准曲线,并根据其公式Y=-40.82+4476.61(A)计算测定样品的浓度。
, http://www.100md.com
2.MSC表达LN mRNA的测定:取第3~10代MSC转种于200ml塑料培养瓶内继续培养,待细胞接近长满瓶底时,换无血清培养基培养24小时,然后加入不同浓度的LDL(0,25,50,100, 150,200 μg/ml)继续培养48小时,收集细胞,用Promega公司的RNA提取试剂盒提取细胞总RNA,经甲醛变性琼脂糖电泳后转移至硝酸纤维素膜,将已转膜烤干的硝酸纤维素膜及预杂交液(5×SSC, 0.1%N-Laurolsarcosine, 0.02%SDS,1%阻断液)装入杂交袋中,68℃预杂交3小时。取Dig标记好的LN探针(由美国NIH Yoshihiko Yamada教授赠送)5μl(约200ng)在沸水中煮沸10分钟后加入预杂交液中,68℃杂交16~18小时。Dig检测试剂盒进行免疫显色16小时,然后用二甲基酰胺清除膜上的探针,待蓝色褪尽后用β-actin探针(基础所神经免疫室赠送)重新杂交。
3.统计分析:试验数据采用均值±标准差(
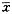 ±s)表示,不同组之间的比较应用StartView统计软件中的单因素方差分析,当P值<0.05时差异有显著意义。
±s)表示,不同组之间的比较应用StartView统计软件中的单因素方差分析,当P值<0.05时差异有显著意义。, 百拇医药
结 果
一、LDL对MSC分泌Ⅳ型胶原的影响
LDL在50 μg/ml浓度时MSC Ⅳ型胶原的分泌即开始增多,并随着LDL浓度的增加Ⅳ型胶原的分泌也增加(F=18.360,P<0.001)。见(表1)。
二、LDL对MSC LN mRNA表达的影响
用LN(B2链)cDNA探针与经LDL处理的MSC总RNA进行Northern杂交,结果经光密度扫描仪定量分析并以β-actin作为内参照以校正RNA加样量。结果表明,LDL在50μg/ml浓度时即可刺激MSC LN mRNA表达增加,并随着LDL浓度的增加,LN mRNA的表达也增强(表1,图1)
表1 不同浓度的LDL对MSC分必Ⅳ型胶原和对MSC LN mRNA表达的影响 LDL浓度
, 百拇医药
(μg/ml)
Ⅳ型胶原浓度
LN mRNA表达
标本数(只)
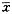 ±s(ng/ml)
±s(ng/ml)标本数(只)
LN/β-actin吸光度值(A)
0
6
31±6
3
0.38±0.04
, 百拇医药
25
6
33±10
3
0.42±0.04
50
6
60±16*
3
0.62±0.05**△△
100
6
88±23**△
, 百拇医药
3
0.61±0.09**
150
6
102±25**
3
0.92±0.10**△△
200
6
133±34**△
3
1.01±0.03**
, 百拇医药
F值
18.360
49.818
P值
<0.01
<0.01
注:与未加LDL组比较,*P<0.05,**P<0.01;
与前一浓度LDL组比较,△P<0.05,△△P<0.01

图1 MSC LN mRNA表达的Northern杂交结果
, 百拇医药
讨 论
已知LDL及其修饰产物如氧化LDL(OX-LDL)在MSC的增殖及肾小球硬化的过程中起一定作用。LDL不仅可以引起MSC增殖,还可以刺激培养的MSC产生细胞外基质(ECM)。90年代以来对LDL刺激系膜基质合成的体外研究逐渐增多。Kamanna等[4]和Keane等[5]分别报道了LDL和OX-LDL刺激MSC胶原的合成以及Ⅳ型胶原mRNA的表达。Rovim和Tan[6]发现MSC与LDL共同孵育后,上清液中纤维粘连蛋白(FN)含量显著增多并呈时间、剂量依赖性。我院肾内科以前的实验研究也发现LDL及OX-LDL对FN的合成有促进作用并和剂量有关。但目前尚未见关于LDL对MSC产生及分泌LN的报道。
我们的实验结果表明,LDL在50μg/ml浓度即可刺激MSC Ⅳ型胶原的分泌及LN mRNA的表达,而且随着剂量的增加其合成及表达也增加,与国外文献报道基本一致。但本实验与以往研究中LDL的作用浓度略有不同,例如Kamanna等[4]认为LDL在10~20 μg/ml 时即增加胶原的合成;而Kim等[7]的实验结果为LDL在100 μg/ml时刺激MSC Ⅳ型胶原的产生。分析其原因可能有:(1)与LDL的纯度有关;(2)是否及时应用,因为LDL放置后易被氧化形成氧化修饰的LDL;(3)不同的蛋白测定方法测定的LDL浓度也有不同;(4)LDL的作用可能受到细胞周期、受体密度及细胞因子的自分泌等多种因素影响。
, http://www.100md.com
正常大鼠血浆LDL浓度为120μg/ml,但其在正常情况下并不引起肾脏损伤。可能由于(1)血管内皮细胞表面的负电荷可使过滤到系膜区的LDL浓度明显减低[7];(2)在体内有HDL的保护作用,对动脉粥样硬化等心血管疾病的研究表明HDL可以拮抗LDL的损伤作用[8];另外,体内的内环境非常复杂,LDL在体内的作用可能受到各种因素的影响。
LDL导致ECM累积的机制目前认为是由于其肾内基因转录增加导致合成增多以及金属蛋白酶组织抑制因子(TIMP)产生增加导致降解减少而共同作用的结果[9]。Kim等[7]发现LDL刺激Ⅳ型胶原mRNA及TIMP-2 mRNA的表达,但对胶原酶mRNA的表达无作用,所以Ⅳ型胶原合成增加而降解减少。Rovin和Tan[6]的研究也表明LDL导致的FN增多与FN mRNA水平呈正相关并可能通过受体途径介导。本研究未做关于胶原酶及TIMP等的研究,但LN mRNA的表达增加表明LDL可能通过增加基因转录导致系膜基质的合成增多。关于LDL对MSC的作用,可能是LDL通过肾小球滤过至系膜区后直接刺激MSC,或通过刺激血管内皮细胞和浸润的单核细胞分泌一些细胞因子及生长因子而起作用,如血小板源生长因子(PDGF)、白细胞介素1(IL-1)、转代生长因子-β(TGF-β)等,其中TGF-β最为重要,其对多种ECM的基因表达有很强的刺激作用,并能够抑制某些细胞间质降解酶的活性,刺激TIMP-1的活性,最终结果导致ECM累积[10-11]。
, http://www.100md.com
总之,本实验结果表明LDL可以刺激MSC Ⅳ型胶原的产生,增加LN mRNA的表达,并与剂量有关。进一步在体外从细胞及分子水平证实了LDL通过刺激MSC产生过多的ECM而在肾小球硬化的过程中起重要作用。
参考文献
1 Kreisberg JI, Karnovsky MJ. Glomerular cells in culture. Kidney Int, 1983, 23:439-447.
2 Harper PA, Robinson JM, Hoover RL, et al. Improved methods for culture rat glomerular cells. Kidney Int, 1984, 26:875-880.
3 Davies M. The mesangial cells: a tissue culture view. Kidney Int, 1994, 45:320-327.
, 百拇医药
4 Kamanna M, Bui DT, Roh DD, et al. LDL and oxidized IDL stimulate collagen synthesis by mesangial cells (Abstract). J Am Soc Nephrol, 1992, 3:634.
5 Keane WF, Kasiske BL, O′Donnell MP, et al. Oxidized low density lipoprotein increases mesangial cell expression of type Ⅳ collagen mRNA (Abstract). J Am Soc Nephrol, 1992, 3:635.
6 Rovin BH, Tan LC. LDL stimulates mesangial fibronectin production and chemoattractant expression. Kidney Int, 1993, 43:218-225.
, 百拇医药
7 Kim SB, Kang SA, Cho YJ, et al. Effects of low density lipoprotein on type Ⅳ collagen production by cultured rat mesangial cells. Nephron, 1994, 67:327-333.
8 Sokolovskaya Ⅳ, Nikiforova NV. High-density lipoprotein cholesterol in patients with untreated and treated nephrotic syndrome. Nephron, 1984, 37:49-53.
9 Jones CL, Buch S, Post M, et al. Production of extracellular matrix in purine aminonucleoside nephrosis [Abstract]. J Am Soc Nephrol, 1991, 2:550.
, 百拇医药
10 Border WA, Noble NA. Cytokines in kidney disease: the role of transforming growth factor-β. Am J Kidney Dis, 1993, 22:105-113.
11 Kees-Folts D, Diamond JR. Relationship between hyperlipidemia, lipid mediators, and progressive glomerulosclerosis in the nephrotic syndrome. Am J Nephrol, 1993, 13:365-375.
(收稿:1998-03-02 修回:1998-12-25), 百拇医药