L-NAME对病毒性心肌炎小鼠心肌保护机制的探讨
作者:刘雪芹 范晓晨 李万镇 杜军保 崔小岱
单位:刘雪芹、范晓晨、李万镇、杜军保 100034 北京医科大学第一医院儿科;崔小岱 首都儿科研究所免疫生化室,范晓晨 为研修生
关键词:一氧化氮合酶;一氧化氮;柯萨奇病毒感染;心肌炎;精氨酸
中华儿科杂志990908 【摘要】 目的 探讨诱导型一氧化氮合酶(iNOS)催化生成的一氧化氮(NO)在实验性病毒性心肌炎小鼠心肌损伤中的作用及一氧化氮合酶(NOS)抑制剂Nω-硝基-L-精氨酸甲酯(L-NAME)对心肌的保护作用。方法 BALB/c鼠22只腹腔感染柯萨奇病毒B3亲心肌细胞株(CVB3m)后随机分为两组:L-NAME组10只(每天给予L-NAME 5 mg/kg)及对照组12只。两组小鼠于病毒接种后第8天留取血液及心肌标本,分别进行血清NO含量的间接测定,心肌病理变化半定量分析及心肌iNOS免疫组织化学染色半定量分析。结果 (1)心肌病变程度:L-NAME组明显轻于对照组,心肌炎性浸润积分,分别为1.00±0.15和2.17±0.32(P<0.01);心肌坏死积分,分别为0.70±0.15和1.83±0.33(P<0.01);(2)心肌iNOS免疫组化染色半定量:L-NAME组心肌iNOS染色阳性信号面密度明显低于对照组(0.106±0.013、0.244±0.025,P<0.01);(3)血清NO含量:L-NAME组明显低于对照组(4.2±0.5 μmol/L、6.4±0.7 μmol/L, P<0.05)。结论 实验性病毒性心肌炎极期心肌组织大量表达iNOS,iNOS催化NO过量产生可能是病毒性心肌炎心肌损伤的重要机制之一,NOS抑制剂L-NAME可减轻心肌损伤,保护心肌。
, 百拇医药
A study on the mechanisms responsible for the protection of myocardium by Nω-nitro-L-arginine methyl ester in murine viral myocarditis
LIU Xueqin*, FAN Xiaochen, LI Wanzhen, et al.
*Department of Pediatrics, First Hospital, Beijing Medical University, Beijing 100034
【Abstract】 Objective To investigate the role of nitric oxide (NO) catalyzed by inducible NO synthase (iNOS) in the development of myocardial damage and the protective effect of Nω-nitro-L-arginine methyl ester (L-NAME), an inhibitor of NOS on myocardium in experimental murine viral myocarditis. Methods Acute viral myocarditis was induced in 22 BALB/c mice by injection of Coxsackievirus B3m (CVB3m) intraperitoneally. Ten of the mice were administered L-NAME (5 mg/kg/day). Blood and heart samples were obtained from all mice on the 8th day after CVB3m infection for indirect measurement of serum NO level, histopathological study and iNOS immunohistochemical examination, respectively. Results (1) extent of myocardial damage: L-NAME-treated mice showed a significant reduction in myocarditic lesion compared with that in untreated mice. The mean histological scores of inflammatory cell infiltration and myocardial necrosis in the two groups were 1.00±0.15 vs 2.17±0.32 (P<0.01) and 0.70±0.15 vs 1.83±0.33 (P<0.05), respectively. (2) myocardial iNOS immunohistochemical hemiquantitative study: The density of positive staining for iNOS in L-NAME-treated mice was much lower than that in L-NAME-untreated mice (0.106±0.013 vs 0.244±0.025, P<0.01). (3) serum level of NO: serum level of NO was significantly low in L-NAME-treated mice compared with that in L-NAME-untreated mice (4.17±0.47 vs 6.37±0.73 μmol/L, P<0.05). Conclusion Aboundance of iNOS protein was expressed in myocardium. Excess amounts of NO catalyzed by iNOS appear to contribute to the progression of myocardial damage. NOS inhibitor L-NAME was likely to protect heart from damage in a murine viral myocarditis model.
, 百拇医药
【Key words】 Nitric-oxide synthase Nitric oxide Coxsackievirus infections Myocarditis Arginine
病毒性心肌炎的发病机制尚未完全阐明,目前认为病毒的直接溶细胞作用及T淋巴细胞介导的免疫损伤在病毒性心肌炎发病中起重要作用[1]。但介导这一免疫过程的细胞内生物化学机制尚不明确。近年研究表明,一氧化氮(NO)这一新型细胞信使分子在炎症反应及免疫调节中起重要作用[2]。国外学者研究发现,实验性病毒性心肌炎小鼠心肌组织中有诱导型一氧化氮合酶(iNOS)mRNA表达,且其在病程极期表达最多[3]。急性病毒性心肌炎患者心内膜心肌活检标本中亦有iNOS mRNA表达[4]。这些结果提示:由iNOS催化合成的NO(iNOS-NO体系)可能在病毒性心肌炎发病中起重要作用。为进一步阐明iNOS-NO体系在病毒性心肌炎发病中的确切作用机制,我们在实验性小鼠柯萨奇B3病毒性心肌炎(CVB3心肌炎)模型中应用一氧化氮合酶(NOS)抑制剂Nω-硝基-L-精氨酸甲酯(L-NAME),探讨iNOS-NO体系与心肌损伤的关系及L-NAME对病毒性心肌炎心肌的保护作用。
, 百拇医药
材料及方法
一、动物模型及实验分组
6~8周龄雄性BALB/c鼠购自中国医学科学院动物中心。柯萨奇病毒B3亲心肌株(CVB3m)Nancy变株由美国Huber教授赠送,首都儿科研究所传代,感染滴度为1.0×103 PFU/ml(PFU为空斑形成单位)。22只小鼠经腹腔注射含上述CVB3m的Eagles液0.3 ml后,随机分为两组,即L-NAME组10只及对照组12只。L-NAME组每天腹腔注射L-NAME(Sigma公司产品)5 mg/kg,对照组每天腹腔注射相同容量的注射用水,两组动物在相同条件下饲养。
二、标本取材
在接种病毒后第8天,将小鼠经眼球后取血约1 ml,立即分离血清,留做NO含量间接测定,然后迅速摘取心脏,沿左室长轴将心脏一分为二,一半置10%甲醛固定,一半置液氮速冻。
, 百拇医药
三、方法
1.心肌组织病理检查及结果半定量:心肌标本经10%甲醛固定、石腊包埋后,沿左室轴线自心尖部起连续切取两张切片,常规HE染色,光镜下观察心肌病理变化,并根据Rezkalla等[5]的方法,计算每个视野中心肌病变积分,即每张切片取5个高倍视野,计算每个视野中炎性细胞浸润及坏死区域面积与整个视野心肌面积之比,无病变计0分,≤25%计1分,>25%≤50%计2分,>50%≤75%计3分,>75%计4分。
2.心肌iNOS免疫组织化学染色及结果半定量:将冰冻的心脏组织在恒冷切片机内进行切片,每个标本沿左室轴线自心尖部连续切取两张,按LSAB法进行免疫组织化学染色。第一抗体兔抗小鼠iNOS多克隆抗体为美国Sata Cruz公司产品,第二抗体及DAB显色试剂盒购自北京中山生物技术公司。免疫组化半定量分析采用真彩色医学图象分析系统(北京空军总医院与北京航空航天大学编制),在显微图象分析仪上,每个切片随机取5个高倍视野,测定一定面积内iNOS染色阳性信号面积与统计场总面积之比,即面密度。
, 百拇医药
3.血清NO含量间接测定:通过测定血清中NO的最终代谢产物亚硝酸盐浓度,了解NO的含量。NO测定试剂盒购自中国人民解放军军事医学科学院,具体操作步骤严格按试剂说明书进行。先以亚硝酸钠标准品配制标准浓度,测定吸光度值,绘制标准曲线,然后测定标本吸光度值,计算标本中亚硝酸盐含量。吸光度值测定使用UV2100电子分光光度计,波长545 nm。
四、统计学分析
实验结果以均数±标准误(
 )表示,组间比较采用t检验。
)表示,组间比较采用t检验。
结果
一、心肌病理改变的比较
在接种CVB3m后第8天,两组小鼠心肌均有不同程度病毒性心肌炎的病理改变。表现为灶性或弥漫性以单个核细胞为主的炎性细胞浸润及炎性灶周围心肌细胞的变性坏死。对照组病变较重,其中1/4小鼠心肌可见大片状及弥漫性炎性细胞浸润及心肌细胞坏死(图1);L-NAME组病变较轻,炎性浸润及心肌细胞坏死病灶少,且均为小灶性(图2);两组小鼠心肌病变积分见表1。
, 百拇医药
表1 L-NAME组与对照组心肌病变积分、iNOS染色阳性信号面密度及血清NO含量的比较(
 ) 组别
) 组别
例数
心肌炎性浸润积分
心肌坏死积分
iNOS染色阳性信号面密度
血清NO含量(μmol/L)
L-NAME组
10
1.00±0.15
, 百拇医药
0.70±0.15
0.106±0.013
4.2±0.5
对照组
12
2.17±0.32
1.83±0.33
0.244±0.025
6.4±0.7
t值
3.112
2.915
, 百拇医药
4.630
2.418
P值
<0.01
<0.01
<0.01
<0.05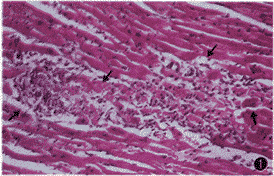
图1 对照组心肌病理变化(HE ×200)
图2 L-NAME组心肌病理变化(HE ×200)
二、心肌组织iNOS免疫组织化学染色的比较
, 百拇医药
iNOS染色阳性信号为黄棕色,对照组小鼠心肌浸润的炎性细胞及炎性灶周围心肌细胞胞浆内可见较强的iNOS染色阳性信号(图3),而L-NAME心肌组织iNOS染色阳性信号较少(图4),两组小鼠心肌iNOS染色阳性信号面密度见表1。
图3 对照组心肌组织iNOS免疫组化(DAB及HE染色 ×400)
图4 L-NAME组心肌组织iNOS免疫组化(DAB及HE染色 ×400)
三、血清NO含量的比较:与对照组相比L-NAME组小鼠血清NO含量明显降低,差异有显著性 (表1)。
讨论
, http://www.100md.com
研究表明,实验性小鼠CVB3心肌炎极期心肌组织中有iNOS表达,应用NOS抑制剂L-NAME(5 mg/kg)可抑制iNOS表达,减少NO生成,并可减轻心肌组织炎性浸润及坏死,提示iNOS-NO体系在病毒性心肌炎发病中起重要作用。
一、CVB3心肌炎心肌中iNOS的表达
近年来,随着人们对NO作用研究的深入,发现NO在机体炎性反应及免疫调节方面起重要作用,许多炎性疾病中均有iNOS-NO体系的参与[2]。De Belder[6]及广江道昭等[4]先后在急性病毒性心肌炎患者心内膜心肌活检标本中发现iNOS活性及其 mRNA及蛋白的表达。广江道昭等[4]通过免疫组化方法及免疫电镜的观察,发现iNOS主要存在于心肌浸润的巨噬细胞及损伤的心肌细胞中。Mikami等[3]在实验性CVB3心肌炎模型中系统研究了心肌中iNOS活性,发现iNOS活性在病毒接种后第8天达高峰。本研究在小鼠CVB3心肌炎极期亦发现心肌中有较强的iNOS表达,表达iNOS的细胞主要为心肌浸润的炎性细胞及炎性灶周围心肌细胞,此与国外学者研究结果基本一致。并且本研究首次通过血清中NO含量间接测定,证实了对NO过量产生的推测[3],从而进一步提示病毒性心肌炎时iNOS可能在心肌组织中诱导NO过量产生,进而参与病毒性心肌炎发病的病理生理过程。
, 百拇医药
体外研究表明,初始炎性细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)等的刺激,可诱导巨噬细胞及多种组织细胞如心肌细胞中iNOS基因的表达,即可催化产生大量NO[2,7]。已证实病毒性心肌炎时,心肌组织可产生TNF-α及IL-1等细胞因子[8],因而推测CVB3心肌炎时这些细胞因子的作用导致了iNOS表达,进而促进NO的产生。
二、iNOS-NO体系在CVB3心肌炎中的作用
已研究证实,病毒性心肌炎时,心肌中有iNOS表达[3,4,6]。但对于iNOS-NO体系在病毒性心肌炎中的确切作用尚缺乏系统研究。我们在实验中于病毒接种后早期给予CVB3心肌炎小鼠NOS抑制剂L-NAME(5 mg/kg),可减少心肌组织iNOS表达,减少NO产生,同时明显减轻心肌炎性浸润及坏死。证明在病毒性心肌炎发病过程中,iNOS-NO体系对心肌造成损伤,而NOS抑制剂可起到保护心肌的作用。L-NAME通过抑制iNOS,减少NO过量生成而保护心肌。其机制可能有以下几方面:首先,抑制NO的过量产生,可减轻NO抑制线粒体呼吸链反应及DNA合成所造成的组织损伤[9];第二,减少NO生成,进而减少自由基生成[10],从而减轻心肌损伤;第三,减少NO产生,还可减轻NO的负性肌力作用[11],从而保护心肌。
, 百拇医药
参考文献
1 Brown CA, O'Connell JB. Myocarditis and idiopathic dilated cardiomyopathy. Am J Med, 1995,99:309-314.
2 Lyons CR. The role of nitric oxide in inflammation. Adv Immunol,1995,60:327-371.
3 Mikami S,Kawashima S, Kanagawak, et al. Expression of nitric oxide synthase in a murine model of viral myocarditis induced by coxsackievirus B3. Biochem Biophys Res Commun,1996,220:983-989.
, 百拇医药
4 广江道昭,平田结喜绪,石山茂,等. 心筋炎とNO. 现代医疗. 1995,27:827-831.
5 Rezkalla S, Kloner RA, Khatib G, et al. Effect of metoprolol in acute coxsackievirus B3 murine myocarditis .J Am Coll Cardiol,1988,12:412-414.
6 De Belder AJ, Radomski MW ,why HJ, et al.Myocardial calcium -independent nitric oxide synthase activity is present in dilated cardiomyopathy, myocarditis, and postpartum cardiomyopathy but not in ischaemic or valvar heart disease. Br Heart J, 1995,74:426-430.
, http://www.100md.com
7 Schulz R, Nava E,Moncada S. Induction and potential biological relevance of a Ca2+-independent nitric oxide synthase in the myocardium. Br J Pharmacol,1992,105:575-580.
8 Matsumori A. Molecular and immune mechanisms in the pathogenesis of cardiomyopathy__role of viruses, cytokines, and nitric oxide. Jpn Circ J, 1997,61:275-291.
9 Stuehr DJ, Nathan CF. Nitric oxide: a macraphage product responsible for cytostasis and respiratory inhibition in tumor target cells. J Exp Med, 1989,169:1543-1555.
, 百拇医药
10 Beckman JS, Beckman TW, Chen J, et al. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide. Proc Natl Acad Sci U S A,1990,87:1620-1624.
11 Brady AJB, Poole- Wilson PA, Harding SE, et al. Nitric oxide production within cardiac myocytes reduces their contractility in endotoxemia. Am J Physiol, 1992,263:H1963-H1966.
(收稿:1998-09-02 修回:1999-03-02), 百拇医药
单位:刘雪芹、范晓晨、李万镇、杜军保 100034 北京医科大学第一医院儿科;崔小岱 首都儿科研究所免疫生化室,范晓晨 为研修生
关键词:一氧化氮合酶;一氧化氮;柯萨奇病毒感染;心肌炎;精氨酸
中华儿科杂志990908 【摘要】 目的 探讨诱导型一氧化氮合酶(iNOS)催化生成的一氧化氮(NO)在实验性病毒性心肌炎小鼠心肌损伤中的作用及一氧化氮合酶(NOS)抑制剂Nω-硝基-L-精氨酸甲酯(L-NAME)对心肌的保护作用。方法 BALB/c鼠22只腹腔感染柯萨奇病毒B3亲心肌细胞株(CVB3m)后随机分为两组:L-NAME组10只(每天给予L-NAME 5 mg/kg)及对照组12只。两组小鼠于病毒接种后第8天留取血液及心肌标本,分别进行血清NO含量的间接测定,心肌病理变化半定量分析及心肌iNOS免疫组织化学染色半定量分析。结果 (1)心肌病变程度:L-NAME组明显轻于对照组,心肌炎性浸润积分,分别为1.00±0.15和2.17±0.32(P<0.01);心肌坏死积分,分别为0.70±0.15和1.83±0.33(P<0.01);(2)心肌iNOS免疫组化染色半定量:L-NAME组心肌iNOS染色阳性信号面密度明显低于对照组(0.106±0.013、0.244±0.025,P<0.01);(3)血清NO含量:L-NAME组明显低于对照组(4.2±0.5 μmol/L、6.4±0.7 μmol/L, P<0.05)。结论 实验性病毒性心肌炎极期心肌组织大量表达iNOS,iNOS催化NO过量产生可能是病毒性心肌炎心肌损伤的重要机制之一,NOS抑制剂L-NAME可减轻心肌损伤,保护心肌。
, 百拇医药
A study on the mechanisms responsible for the protection of myocardium by Nω-nitro-L-arginine methyl ester in murine viral myocarditis
LIU Xueqin*, FAN Xiaochen, LI Wanzhen, et al.
*Department of Pediatrics, First Hospital, Beijing Medical University, Beijing 100034
【Abstract】 Objective To investigate the role of nitric oxide (NO) catalyzed by inducible NO synthase (iNOS) in the development of myocardial damage and the protective effect of Nω-nitro-L-arginine methyl ester (L-NAME), an inhibitor of NOS on myocardium in experimental murine viral myocarditis. Methods Acute viral myocarditis was induced in 22 BALB/c mice by injection of Coxsackievirus B3m (CVB3m) intraperitoneally. Ten of the mice were administered L-NAME (5 mg/kg/day). Blood and heart samples were obtained from all mice on the 8th day after CVB3m infection for indirect measurement of serum NO level, histopathological study and iNOS immunohistochemical examination, respectively. Results (1) extent of myocardial damage: L-NAME-treated mice showed a significant reduction in myocarditic lesion compared with that in untreated mice. The mean histological scores of inflammatory cell infiltration and myocardial necrosis in the two groups were 1.00±0.15 vs 2.17±0.32 (P<0.01) and 0.70±0.15 vs 1.83±0.33 (P<0.05), respectively. (2) myocardial iNOS immunohistochemical hemiquantitative study: The density of positive staining for iNOS in L-NAME-treated mice was much lower than that in L-NAME-untreated mice (0.106±0.013 vs 0.244±0.025, P<0.01). (3) serum level of NO: serum level of NO was significantly low in L-NAME-treated mice compared with that in L-NAME-untreated mice (4.17±0.47 vs 6.37±0.73 μmol/L, P<0.05). Conclusion Aboundance of iNOS protein was expressed in myocardium. Excess amounts of NO catalyzed by iNOS appear to contribute to the progression of myocardial damage. NOS inhibitor L-NAME was likely to protect heart from damage in a murine viral myocarditis model.
, 百拇医药
【Key words】 Nitric-oxide synthase Nitric oxide Coxsackievirus infections Myocarditis Arginine
病毒性心肌炎的发病机制尚未完全阐明,目前认为病毒的直接溶细胞作用及T淋巴细胞介导的免疫损伤在病毒性心肌炎发病中起重要作用[1]。但介导这一免疫过程的细胞内生物化学机制尚不明确。近年研究表明,一氧化氮(NO)这一新型细胞信使分子在炎症反应及免疫调节中起重要作用[2]。国外学者研究发现,实验性病毒性心肌炎小鼠心肌组织中有诱导型一氧化氮合酶(iNOS)mRNA表达,且其在病程极期表达最多[3]。急性病毒性心肌炎患者心内膜心肌活检标本中亦有iNOS mRNA表达[4]。这些结果提示:由iNOS催化合成的NO(iNOS-NO体系)可能在病毒性心肌炎发病中起重要作用。为进一步阐明iNOS-NO体系在病毒性心肌炎发病中的确切作用机制,我们在实验性小鼠柯萨奇B3病毒性心肌炎(CVB3心肌炎)模型中应用一氧化氮合酶(NOS)抑制剂Nω-硝基-L-精氨酸甲酯(L-NAME),探讨iNOS-NO体系与心肌损伤的关系及L-NAME对病毒性心肌炎心肌的保护作用。
, 百拇医药
材料及方法
一、动物模型及实验分组
6~8周龄雄性BALB/c鼠购自中国医学科学院动物中心。柯萨奇病毒B3亲心肌株(CVB3m)Nancy变株由美国Huber教授赠送,首都儿科研究所传代,感染滴度为1.0×103 PFU/ml(PFU为空斑形成单位)。22只小鼠经腹腔注射含上述CVB3m的Eagles液0.3 ml后,随机分为两组,即L-NAME组10只及对照组12只。L-NAME组每天腹腔注射L-NAME(Sigma公司产品)5 mg/kg,对照组每天腹腔注射相同容量的注射用水,两组动物在相同条件下饲养。
二、标本取材
在接种病毒后第8天,将小鼠经眼球后取血约1 ml,立即分离血清,留做NO含量间接测定,然后迅速摘取心脏,沿左室长轴将心脏一分为二,一半置10%甲醛固定,一半置液氮速冻。
, 百拇医药
三、方法
1.心肌组织病理检查及结果半定量:心肌标本经10%甲醛固定、石腊包埋后,沿左室轴线自心尖部起连续切取两张切片,常规HE染色,光镜下观察心肌病理变化,并根据Rezkalla等[5]的方法,计算每个视野中心肌病变积分,即每张切片取5个高倍视野,计算每个视野中炎性细胞浸润及坏死区域面积与整个视野心肌面积之比,无病变计0分,≤25%计1分,>25%≤50%计2分,>50%≤75%计3分,>75%计4分。
2.心肌iNOS免疫组织化学染色及结果半定量:将冰冻的心脏组织在恒冷切片机内进行切片,每个标本沿左室轴线自心尖部连续切取两张,按LSAB法进行免疫组织化学染色。第一抗体兔抗小鼠iNOS多克隆抗体为美国Sata Cruz公司产品,第二抗体及DAB显色试剂盒购自北京中山生物技术公司。免疫组化半定量分析采用真彩色医学图象分析系统(北京空军总医院与北京航空航天大学编制),在显微图象分析仪上,每个切片随机取5个高倍视野,测定一定面积内iNOS染色阳性信号面积与统计场总面积之比,即面密度。
, 百拇医药
3.血清NO含量间接测定:通过测定血清中NO的最终代谢产物亚硝酸盐浓度,了解NO的含量。NO测定试剂盒购自中国人民解放军军事医学科学院,具体操作步骤严格按试剂说明书进行。先以亚硝酸钠标准品配制标准浓度,测定吸光度值,绘制标准曲线,然后测定标本吸光度值,计算标本中亚硝酸盐含量。吸光度值测定使用UV2100电子分光光度计,波长545 nm。
四、统计学分析
实验结果以均数±标准误(

 )表示,组间比较采用t检验。
)表示,组间比较采用t检验。结果
一、心肌病理改变的比较
在接种CVB3m后第8天,两组小鼠心肌均有不同程度病毒性心肌炎的病理改变。表现为灶性或弥漫性以单个核细胞为主的炎性细胞浸润及炎性灶周围心肌细胞的变性坏死。对照组病变较重,其中1/4小鼠心肌可见大片状及弥漫性炎性细胞浸润及心肌细胞坏死(图1);L-NAME组病变较轻,炎性浸润及心肌细胞坏死病灶少,且均为小灶性(图2);两组小鼠心肌病变积分见表1。
, 百拇医药
表1 L-NAME组与对照组心肌病变积分、iNOS染色阳性信号面密度及血清NO含量的比较(

 ) 组别
) 组别例数
心肌炎性浸润积分
心肌坏死积分
iNOS染色阳性信号面密度
血清NO含量(μmol/L)
L-NAME组
10
1.00±0.15
, 百拇医药
0.70±0.15
0.106±0.013
4.2±0.5
对照组
12
2.17±0.32
1.83±0.33
0.244±0.025
6.4±0.7
t值
3.112
2.915
, 百拇医药
4.630
2.418
P值
<0.01
<0.01
<0.01
<0.05

图1 对照组心肌病理变化(HE ×200)

图2 L-NAME组心肌病理变化(HE ×200)
二、心肌组织iNOS免疫组织化学染色的比较
, 百拇医药
iNOS染色阳性信号为黄棕色,对照组小鼠心肌浸润的炎性细胞及炎性灶周围心肌细胞胞浆内可见较强的iNOS染色阳性信号(图3),而L-NAME心肌组织iNOS染色阳性信号较少(图4),两组小鼠心肌iNOS染色阳性信号面密度见表1。

图3 对照组心肌组织iNOS免疫组化(DAB及HE染色 ×400)

图4 L-NAME组心肌组织iNOS免疫组化(DAB及HE染色 ×400)
三、血清NO含量的比较:与对照组相比L-NAME组小鼠血清NO含量明显降低,差异有显著性 (表1)。
讨论
, http://www.100md.com
研究表明,实验性小鼠CVB3心肌炎极期心肌组织中有iNOS表达,应用NOS抑制剂L-NAME(5 mg/kg)可抑制iNOS表达,减少NO生成,并可减轻心肌组织炎性浸润及坏死,提示iNOS-NO体系在病毒性心肌炎发病中起重要作用。
一、CVB3心肌炎心肌中iNOS的表达
近年来,随着人们对NO作用研究的深入,发现NO在机体炎性反应及免疫调节方面起重要作用,许多炎性疾病中均有iNOS-NO体系的参与[2]。De Belder[6]及广江道昭等[4]先后在急性病毒性心肌炎患者心内膜心肌活检标本中发现iNOS活性及其 mRNA及蛋白的表达。广江道昭等[4]通过免疫组化方法及免疫电镜的观察,发现iNOS主要存在于心肌浸润的巨噬细胞及损伤的心肌细胞中。Mikami等[3]在实验性CVB3心肌炎模型中系统研究了心肌中iNOS活性,发现iNOS活性在病毒接种后第8天达高峰。本研究在小鼠CVB3心肌炎极期亦发现心肌中有较强的iNOS表达,表达iNOS的细胞主要为心肌浸润的炎性细胞及炎性灶周围心肌细胞,此与国外学者研究结果基本一致。并且本研究首次通过血清中NO含量间接测定,证实了对NO过量产生的推测[3],从而进一步提示病毒性心肌炎时iNOS可能在心肌组织中诱导NO过量产生,进而参与病毒性心肌炎发病的病理生理过程。
, 百拇医药
体外研究表明,初始炎性细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)等的刺激,可诱导巨噬细胞及多种组织细胞如心肌细胞中iNOS基因的表达,即可催化产生大量NO[2,7]。已证实病毒性心肌炎时,心肌组织可产生TNF-α及IL-1等细胞因子[8],因而推测CVB3心肌炎时这些细胞因子的作用导致了iNOS表达,进而促进NO的产生。
二、iNOS-NO体系在CVB3心肌炎中的作用
已研究证实,病毒性心肌炎时,心肌中有iNOS表达[3,4,6]。但对于iNOS-NO体系在病毒性心肌炎中的确切作用尚缺乏系统研究。我们在实验中于病毒接种后早期给予CVB3心肌炎小鼠NOS抑制剂L-NAME(5 mg/kg),可减少心肌组织iNOS表达,减少NO产生,同时明显减轻心肌炎性浸润及坏死。证明在病毒性心肌炎发病过程中,iNOS-NO体系对心肌造成损伤,而NOS抑制剂可起到保护心肌的作用。L-NAME通过抑制iNOS,减少NO过量生成而保护心肌。其机制可能有以下几方面:首先,抑制NO的过量产生,可减轻NO抑制线粒体呼吸链反应及DNA合成所造成的组织损伤[9];第二,减少NO生成,进而减少自由基生成[10],从而减轻心肌损伤;第三,减少NO产生,还可减轻NO的负性肌力作用[11],从而保护心肌。
, 百拇医药
参考文献
1 Brown CA, O'Connell JB. Myocarditis and idiopathic dilated cardiomyopathy. Am J Med, 1995,99:309-314.
2 Lyons CR. The role of nitric oxide in inflammation. Adv Immunol,1995,60:327-371.
3 Mikami S,Kawashima S, Kanagawak, et al. Expression of nitric oxide synthase in a murine model of viral myocarditis induced by coxsackievirus B3. Biochem Biophys Res Commun,1996,220:983-989.
, 百拇医药
4 广江道昭,平田结喜绪,石山茂,等. 心筋炎とNO. 现代医疗. 1995,27:827-831.
5 Rezkalla S, Kloner RA, Khatib G, et al. Effect of metoprolol in acute coxsackievirus B3 murine myocarditis .J Am Coll Cardiol,1988,12:412-414.
6 De Belder AJ, Radomski MW ,why HJ, et al.Myocardial calcium -independent nitric oxide synthase activity is present in dilated cardiomyopathy, myocarditis, and postpartum cardiomyopathy but not in ischaemic or valvar heart disease. Br Heart J, 1995,74:426-430.
, http://www.100md.com
7 Schulz R, Nava E,Moncada S. Induction and potential biological relevance of a Ca2+-independent nitric oxide synthase in the myocardium. Br J Pharmacol,1992,105:575-580.
8 Matsumori A. Molecular and immune mechanisms in the pathogenesis of cardiomyopathy__role of viruses, cytokines, and nitric oxide. Jpn Circ J, 1997,61:275-291.
9 Stuehr DJ, Nathan CF. Nitric oxide: a macraphage product responsible for cytostasis and respiratory inhibition in tumor target cells. J Exp Med, 1989,169:1543-1555.
, 百拇医药
10 Beckman JS, Beckman TW, Chen J, et al. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide. Proc Natl Acad Sci U S A,1990,87:1620-1624.
11 Brady AJB, Poole- Wilson PA, Harding SE, et al. Nitric oxide production within cardiac myocytes reduces their contractility in endotoxemia. Am J Physiol, 1992,263:H1963-H1966.
(收稿:1998-09-02 修回:1999-03-02), 百拇医药