氧化型低密度脂蛋白诱导U937细胞凋亡及其对p53、p21和Bcl-2表达的影响
作者:杨向东 黎健 田育茜 张彤 杨和平 杨永宗
单位:杨向东 张彤 杨和平 杨永宗(衡阳医学院心血管病研究所,湖南省衡阳市 421001);黎健 田育茜(卫生部北京老年医学研究所, 北京100730)
关键词:氧化修饰;脂蛋白,低密度;U937;细胞凋亡;癌基因
中国动脉硬化杂志000106[摘 要] 为研究单核细胞源性泡沫细胞凋亡机制,以氧化型低密度脂蛋白诱导人髓系白血病细胞U937凋亡,观察p53、p21和Bcl-2的表 达。用流式细胞术和DNA断裂分析检测细胞凋亡;用细胞免疫荧光标记结合流式细胞术检测p 53、p21和Bcl-2蛋白表达,反转录聚合酶链反应显示p53、p21和 Bcl-2 mRNA表达水平。结果表明氧化型低密度脂蛋白可致U937细 胞凋亡,其作用具有浓度效应;氧化型低密度脂蛋白诱导U937细胞凋亡过程中,p53 、p21 mRNA和蛋白表达增加,Bcl-2 mRNA和蛋白表达减少。提示氧化型 低密度脂蛋白可能通过上调p53、p21基因表达,下调Bcl-2基因, 导致U937细胞凋亡。
, 百拇医药
[中图分类号] R329.8+8 [文献标识码] A
[文章编号] 1007-3949(2000)-01-0021-05
Effect of Oxidized Low Density Lipoprotein on Apoptosis and Expression of p53, p21 and Bcl-2 Gene in U937 Cells
YANG Xiang-Dong ZHANG Tong YANG He-Ping YANG Yong-Zong
(Institute of Cardiovascular Disease,Hengyang Medical College,Hengyang 421001)
LI Jian TIAN Yu-Qian
, 百拇医药
(Department of Biochemistry,Beijing Institute of Geriatrics,Beijing 100730,China)
ABSTRATE Aim To investigate the mechanism involved in the ap optosis of human myeloid leukemia U937 cells induced by oxidized low density lip oprotein (ox-LDL). Methods The apoptotic cel ls were determined by flow cytometry and DNA fragmentation assay. The content o f p53, p21 and Bcl-2 protein were analyzed by immunofluo resence staining and flow cytometric analysis. The level of p53,p21 and Bcl-2 mR NA were quantified by reverse transcription-polymerase chain reaction (RT-PCR). Result s Ox-LDL induced apoptosis of U937,which is concentration depe ndent,and upregulate the level of p53 and p21 mRNA and protein as detected by RT -PCR and flow cytometric analysis.However,expression of Bcl-2 was downregulated after treatment with ox-LDL. Conclus ion Ox-LDL upregulated the gene expression of p53, p21 and dow nregulated Bcl-2 expression, which induced apoptosis of U937 cells.
, http://www.100md.com
MeSH Oxidized Modification; Lipoprotein, LDL; U937; Apop tosis; Oncogene
泡沫细胞是动脉粥样硬化(atherosclerosis,As)早期病变的主要病理细胞,由单核细胞/巨 噬细胞或血管平滑肌细胞吞噬并蓄集脂质而形成。As斑块中的泡沫细胞存在凋亡现象,泡沫 细胞的堆积和死亡影响As脂质斑块的稳定[1]。氧化型低密度脂蛋白(oxidized lo w density lipoprotein, ox-LDL)与As有着密切的关系,它可以通过多条途径促进As的发生 、发展。90年代以来,研究发现氧化应激对细胞凋亡的作用与超氧阴离子的产生和脂质过氧 化有关,与控制细胞凋亡的关键基因p53和Bcl-2也有一定关系[2~5] 。我们用氧化型低密度脂蛋白处理人髓系白血病细胞U937,促其向单核细胞分化,发现U937能 吞噬氧化修饰的低密度脂蛋白并蓄集在细胞内,形成泡沫细胞[6]。本实验以U937细胞为研究对象,以氧化型低密度脂蛋白诱导其凋亡,并观察p53、 p21和Bcl-2基因及其编码蛋白在凋亡过程中的变化,初步探讨其在单核细胞源性泡沫细胞凋亡过程中 的调控作用。
, 百拇医药
1 材料和方法
1.1 材料
人髓系白血病细胞U937购自中国科学院上海细胞生物学研究所。RPMI1640培养基、胎牛血清 和Trizol Reagent购自GIBCO公司,Reverse transcription system和PCR core system购自P romega公司。p53、p21、Bcl-2和GAPDH引物由赛百盛公司合成,Bcl-2抗体为兔抗人抗血清,p53和p21抗体为鼠抗人单克隆抗体,二抗为FITC标 记羊抗兔 IgG和FITC标记羊抗鼠IgG,所用抗体均系美国Santa Cruz公司产品。
1.2 细胞培养及分组
U937细胞(4×108/L)用含1×105 u/L青霉素、100 mg/L链霉素和10%胎牛血清的RPMI1 640培养基于37℃、5%CO2条件下培养。对照组不加氧化型低密度脂蛋白,实验组中氧化型 低密度脂蛋白终浓度分别为100 mg/L和200 mg/L,培养48 h。
, 百拇医药
1.3 低密度脂蛋白的分离和氧化
人血浆LDL(d=1.03~1.05)采用超速离心法分离,经琼脂糖电泳 、SDS-聚丙烯酰胺凝胶电泳和免疫电泳,均显示为单一蛋白带。将LDL置于含10 μmol/L Cu SO4的PBS (pH 7.2)中, 37℃温育24 h。氧化修饰后的LDL置于含200 μmol/L EDTA的PBS 中透析24 h,超滤除菌后4℃保存。
1.4 DNA断裂琼脂糖电泳分析
参照文献[7]提取细胞DNA进行琼脂糖电泳分析。
1.5 流式细胞术
1.5.1 分析细胞周期亚G1峰 收集1×106细胞,用PBS洗2次,用冷冻的70%乙醇4℃过夜固定细胞,离心800 r/min × 5 min, 弃乙醇,500 μL PBS重悬,加Rnase A, 终浓度为50 g/L, 37℃水浴45 min,加入碘 化丙啶(promide iodine, PI)50 g/L,混匀,4℃避光放置60 min,尼龙网滤过,流式细 胞仪(美国BD公司,FACS420)上样检测。
, http://www.100md.com
1.5.2 p53、 p21和Bcl-2蛋白的表达 200 mg/L 氧化型低密度脂蛋白温育U937细胞48 h,收集细胞3×106个,用冷PBS 2 mL洗 涤细胞一次,800 r/min×5 min离心; 4%多聚甲醛2 mL室温固定细胞40 min, 800 r/min×5 min离心; PBS 2 mL重悬细胞,800 r/min×5 min离心;用含0.2% Triton-X100和5%血清的 PBS 1 mL重悬细胞,冰上放置20 min,均分为三份,800 r/min×5 min离心去上清。分别将p 53、p21单抗1∶100稀释,Bcl-2多抗1∶40稀释,饱和剂量加入,冰上放置40 min, 800 r/ min×5 min离心,用冷PBS 2 mL重悬细胞,800 r/min×5 min离心,洗去未结合一抗,重复 一次。加入FITC标记的二抗,冰上避光放置40 min后, 800 r/min×5 min离心,去上清, PB S洗涤两次,加入1%多聚甲醛0.5 mL重悬细胞;流式细胞仪检测,计数10 000个细胞。
, 百拇医药
1.6 反转录聚合酶链反应
应用TRIZOL 提取细胞总RNA,反转录合成cDNA,以GAPDH为内对照,进行半定量反转录聚合酶 链反应。GAPDH引物为:正义链5’-TGAAGGTCGGAGTCAACGGATTTT-3’,反义链5’-CATGTGGGCC ATGAGGTCCACCAC-3’,共983 bp。p53引物为:正义链5’-CTAACCGCGGTCCCTTCCCAGAAAACCT-
AC- 3’, 反义链5’-TACAGTCAGAGCCAACCTCAGGCG-3’,共409 bp。p21引物为:正义链5’-GGAATTCATGTCAG AACCG GCTGG-3’),反义链5’-GCGGA TCCTTAGGGCTTCCTCTTG-3’,共500 bp; Bcl-2引物为:正义链5’-ACTTGTGGCCCAGATAG GCACCCAG-3’,为:正义链5’-CGACTTCG CCGAGATGTCCAG CCAG-3’,共382 bp。 首次循环先在94℃变性5 min, 变性、退火、延伸分别为94 ℃ 1 min, 56℃ 1 min,72℃ 1.5 min, 共30个循环,最后一次循环在72℃延伸10 min;聚 合酶链反应产物用1.5%琼脂糖凝胶电泳分析。
, 百拇医药
2 结果
2.1 细胞周期分析
对照组U937细胞经流式细胞仪检测,细胞凋亡率为1.2%, 用1 00 mg/L 氧化型低密度脂蛋白作用48 h后,凋亡率为7.3%, G2期和S期细胞数减少,G1期细 胞增多, G1期前出现亚G1峰,即凋亡峰,氧化型低密度脂蛋白浓度增至200 mg/L时细胞凋亡 率增至22.2%,峰更加明显(图1, Figure 1)。
图1. 氧化型低密度脂蛋白对U937细胞周期的影响
Figure 1. Flow cytometric analysis for apoptosis on U937 cells induced by ox- LDL.
, http://www.100md.com
A: control (1.2%), B: 100 mg/L ox-LDL (7.3%), C: 200 mg/L ox-LDL (22.2%)
2.2 细胞DNA琼脂糖凝胶电泳
分别提取对照组、100 mg/L 氧化型低密度脂蛋白组和200 mg/L 氧化型低密度脂蛋白组细胞 DNA,进行凝胶电泳分析。从图2 (Figure 2)可见100 mg/L 氧化型低密度脂蛋白作用U937 48 h后,DNA电泳出现细胞 凋 亡特有的间隔180~200 bp梯状条带(DNA ladder),但条带较弱;当氧化型低密度脂蛋白浓 度增至200 mg/L时条带更加明显。
图2. DNA凝胶电泳图谱
Figure 2. The apoptosis of U937 induced by ox-LDL were analyzed
, 百拇医药
by agarose gel electrophoresis. M: PBR322/BstNI MW, 1:Control,2:Incubation with 100 mg/L ox-LDL, 3: Incubation with 200 mg/L ox-LDL
2.3 p53、 p21和Bcl-2蛋白的表达
流式细胞术检测10 000个FITC荧光抗体标记的U937,图3 (Figure3)显示氧化型低密度脂蛋 白处理后p53和p21的表达增高,主峰右移, p53阳性的细胞数由 15.7%增至64.2%,p21阳性的细胞数由12.5%增至67.4%;而Bcl-2的表达降低,主峰左移,Bcl-2阳性的细胞数由30.0%减少至5.5%。每组样 本重复3次。
图3. 流式细胞术分析p53、p21和Bcl-2蛋白的表达
, http://www.100md.com
Figure 3. Expression of p53、p21 and Bcl-2 protein were determined by
cytoplasm ic immunofluorescence staining and flow cytometric analysis
after treatment with 200 mg/L ox-LDL. Results are from one representative
experiment( n=3, P<0.01). M: 100 bp DNA marker, C : control group,A: incubation with 200 mg/L ox-LDL gronp
2.4 氧化型低密度脂蛋白对p53、p21和Bcl-2 mRNA表达水平的影响
, 百拇医药
应用反转录聚合酶链反应半定量检测mRNA水平,结果如图4 (Figure 4)所示,对照组和 处理组均检出p53、p21和Bcl-2的mRNA。电泳图谱显示两条区带,一条为 内对照GAPDH的聚合酶链反应产物,其扩增片段长度为983 bp,另一条分别为p53、p21或Bcl -2的扩增产物,其扩增片段长度分别为409 bp、500 bp和382 bp。从图4可以看出,经氧化 型低密度脂蛋白处理的U937细胞, p53和p21 mRNA表达水平增高, Bcl-2 mRNA表达水平降低。反转录聚合酶链反应结果与流式细胞术检测p53、 p21和Bcl-2 蛋白表达结果一致。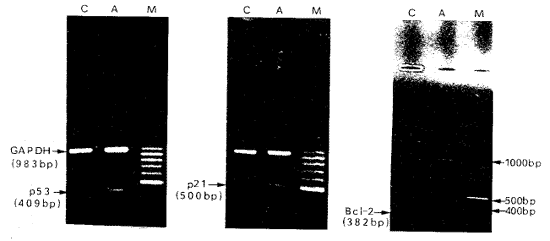
图4. 反转录聚合酶链反应扩增p53、p21和Bcl-2基因的琼脂糖凝胶电泳分析
Figure 4. Expression of p53,p21 and Bcl-2 mRNA on U937 c ells Incubation
, http://www.100md.com
with 200 mg/L ox-LDL. Results of RT-PCR showed that p53 and p21 mRNA level were
upregulated, Bcl-2 mRNA level was downregulated after treatment with 200 mg/L ox-LDL for 48 h
3 讨论
动脉粥样硬化斑块的形成一般经历脂质条纹期、脆性动脉粥样斑块期、纤维斑块期和粥样斑 块期。大量研究证实,临床常见急性冠状动脉事件如心绞痛、急性心肌梗塞和冠状动脉猝死的发生主要取决于斑块的类型(斑块的组成成分及脆性),而与粥样病变狭窄严重程度并无明显的关系。巨噬细胞在脆性或不稳定性脂质丰富斑块的破裂中起很重要的作用,巨噬细胞可吞噬代谢脂质,促进脂质池的形成;可分泌细胞因子促进平滑肌细胞的迁移、增殖;可释放蛋白酶(弹性酶和胶原酶)与巨噬细胞代谢产生的自由基和脂质过氧化物一起加速血管壁的损伤。文献[8]报道氧化型低密度脂蛋白可以诱导内皮细胞、平滑肌细胞和单核细胞凋 亡,其作用机制多样,与氧自由基产生过多、膜脂质过氧化和溶酶体损伤有关。氧化型低密度脂蛋白与 U937孵育,可诱导U937向单核细胞分化并增强其粘附吞噬能力,U937吞噬并大量蓄积脂质形成一 种稳定的、同一性好的泡沫细胞模型[5,9]。我们在研究中通过细胞周期分析和DNA断裂分析发现 较高浓度的ox-LDL可以诱导U937细胞凋亡,且随ox-LDL浓度增高,细胞凋亡增多 。我们还发现ox-LDL在诱导U937凋亡过程中可上调原癌基因c-fos、c-jun和c- myc基因表达(待发表资料)。
, 百拇医药
p53基因是一个重要的抑癌基因,它是细胞基因的“看守卫士”,监视基因的完整性,p53蛋 白是细胞周期阻滞和细胞凋亡的关键介质。物理和化学因素造成的DNA损伤和某些原癌基因的激活和氧化应激(oxidative stress)均可促进p53基因和蛋白表达,p53可通过p21wAf-1途径,既调控G1关卡,也参与G2/M关卡的调控,影响细胞周期的进程。Bcl-2基因家族是凋亡研究中最受重视的癌基因,其成员分为两类:一类能促进细胞的凋亡,有Bax, Bcl -xs, Bad, Bak;一类能抵抗细胞凋亡,有Bcl-2, Bcl-xl, Mcl-1等。Bax能和Bcl-2形成异源 二聚体分子,Bax自身还能形成同源二聚体,细胞内Bcl-2/Bax和Bax/Bax二聚体的 比例决定了细胞对凋亡信号的易感性[10]。我们研究表明ox-LDL诱导U937凋亡过程 中有突变型p53和p21的基因转录及蛋白表达增高,Bcl-2的转录表达下调 。U937源泡沫细胞的脂质蓄积代谢使细胞内氧自由基和脂质过氧化物增多,引起细胞DNA损 伤,促进突变型p53表达增高,启动p21基因表达。p21表达升高导致U937停滞在G1期,U937增 殖受抑,向单核/巨噬细胞分化增多,增强其对ox-LDL 的吞噬。细胞内脂质过氧化物和氧自 由基增多促进突变型p53基因表达进而抑制抗凋亡基因Bcl-2的表达,或是 ox-LDL通过胞内其它途径调节Bcl-2的表达,改变了Bcl-2/Bax[ WTBZ 的比例,增加细胞对凋亡信号敏感性,最终诱导U937凋亡。泡沫细胞的凋亡和裂解降 低了血管壁斑块中脂质的外运,促进脂质核心的形成,增加了斑块的不稳定性。U937细胞 p 53为突变型,一般认为p53突变后失去其抑瘤功能,且能促进细胞增殖,但最近有文献报道 突变型p53亦能诱发某些肿瘤细胞如肝癌细胞Hep3B凋亡,c-myc的表达对H ep3B的凋亡有强的促进作用,我们的实验结果与其一致,突变型p53和c-myc在ox-LDL致U937源泡沫细胞凋亡中的作用机制需进一步深入研究[12,13]。
, http://www.100md.com
[致谢]中国中医研究院基础理论研究所庞大本和池旭生两位老师为 流式检测提供帮助。
[基金项目] 本课题由1997年湖南省科委青年基金资助(199 7-7)
[作者简介] 杨向东,男,29岁,现为湖南医科大学病理生 理学专业97级博士,主要从事动脉粥样硬化性心脑血管疾病的机理研究。
参考文献
[1] Bjorkerud S,Bjorkerud B. Apoptosis is abundant in human atherosclerotic lesions,especially in inflammatory cells (macrophages and T cells),and may contribute to the accumulation of gruel and plaque instability[J]. Am J Pathol,1996,149: 367-380
, http://www.100md.com
[2] Hockenbrey DM, Oltvai ZN, Yin XiaoMing,et al. Bcl-2 function in an antioxidant pathway to prevent apoptosis[J]. Cell, 1993, 75: 241-251
[3] Palinski W, Rosenfeld ME, YlaHettuala S, et al. Low density lipoprotein undergoes oxidative modifacation in vivo[ J]. Proc Natl Acad Sci USA, 1989, 86: 372-376
[4] Kinscherf R, Claus R, Wanger M, et al. Apoptosis caused by oxidized LDL is manganese superoxide dismutase and p53 dependent[J]. FASEB J, 1998, 12: 461-467
, http://www.100md.com
[5] Mariko HS, Mikio K, Hiroshi K, et al. Oxidized low density lipoprotein induces apoptosis in cultured human umbilical vein endothelial cells by common and unique mechanisms[J]. J Biol Chem, 1 998, 273: 9 681-687
[6] 李全忠, 杨永宗, 易光辉, 等. U937泡沫细胞模型的建立[J]. 中国动脉硬化杂志, 1999, 7(2): 152-154
[7] 姜 泊,张亚历,周殿元(主编). 分子生物学常用实验方法[M]. 北京:人民军医出版社,1996;65
[8] Yuan XM, Li W, Olsson AG, et al. The toxicity to macrophages of low-density lipoprotein is mediated through lysosomal damage[J]. Atherosclerosis, 1997, 133(2):153-161
, 百拇医药
[9] Li DY, Yang BC, Mehta JL. ox-LDL induces apoptosis in human co ronary artery endothelial cells:role of PKC,PTK,bcl-2,and Fas[J]. Am J Physiol, 1998, 275(2Pt2): H568-576
[10] Frostegard J, Nilsson J, Haegerstrand A, et al. Oxidized lo w density lipoprotein induces differentiation and adhesion of human monocytes and the monocyte cell line U937[J]. Proc Natl Acad Sci USA, 1990, 87: 904-908
[11] Rosse T, Olivier R, Monney L, et al. Bcl-2 prolongs survival after Bax-induced release of cytochromec[J]. Nature, 1998, 391:496-499
, 百拇医药
[12] Ehinger M, Bergh G, Olofsson T, et al. Expression of the p53 tumor suppressor gene induces differentiation and promotes induction of differentiation by 1,25-Dihydroxycholecalciferol in leukemic U937 cells[J]. Blood, 1996, 87(3): 1 064-074
[13] Stahler F,Roemer K. Mutant p53 can provoke apoptosis in p53-deficient Hep3B cells with delayed kinetics relative to wild-type p53[J]. Oncogene, 1998, 17(26): 3 507-512
(此文1999-07-09收到, 2000-01-20修回), 百拇医药
单位:杨向东 张彤 杨和平 杨永宗(衡阳医学院心血管病研究所,湖南省衡阳市 421001);黎健 田育茜(卫生部北京老年医学研究所, 北京100730)
关键词:氧化修饰;脂蛋白,低密度;U937;细胞凋亡;癌基因
中国动脉硬化杂志000106[摘 要] 为研究单核细胞源性泡沫细胞凋亡机制,以氧化型低密度脂蛋白诱导人髓系白血病细胞U937凋亡,观察p53、p21和Bcl-2的表 达。用流式细胞术和DNA断裂分析检测细胞凋亡;用细胞免疫荧光标记结合流式细胞术检测p 53、p21和Bcl-2蛋白表达,反转录聚合酶链反应显示p53、p21和 Bcl-2 mRNA表达水平。结果表明氧化型低密度脂蛋白可致U937细 胞凋亡,其作用具有浓度效应;氧化型低密度脂蛋白诱导U937细胞凋亡过程中,p53 、p21 mRNA和蛋白表达增加,Bcl-2 mRNA和蛋白表达减少。提示氧化型 低密度脂蛋白可能通过上调p53、p21基因表达,下调Bcl-2基因, 导致U937细胞凋亡。
, 百拇医药
[中图分类号] R329.8+8 [文献标识码] A
[文章编号] 1007-3949(2000)-01-0021-05
Effect of Oxidized Low Density Lipoprotein on Apoptosis and Expression of p53, p21 and Bcl-2 Gene in U937 Cells
YANG Xiang-Dong ZHANG Tong YANG He-Ping YANG Yong-Zong
(Institute of Cardiovascular Disease,Hengyang Medical College,Hengyang 421001)
LI Jian TIAN Yu-Qian
, 百拇医药
(Department of Biochemistry,Beijing Institute of Geriatrics,Beijing 100730,China)
ABSTRATE Aim To investigate the mechanism involved in the ap optosis of human myeloid leukemia U937 cells induced by oxidized low density lip oprotein (ox-LDL). Methods The apoptotic cel ls were determined by flow cytometry and DNA fragmentation assay. The content o f p53, p21 and Bcl-2 protein were analyzed by immunofluo resence staining and flow cytometric analysis. The level of p53,p21 and Bcl-2 mR NA were quantified by reverse transcription-polymerase chain reaction (RT-PCR). Result s Ox-LDL induced apoptosis of U937,which is concentration depe ndent,and upregulate the level of p53 and p21 mRNA and protein as detected by RT -PCR and flow cytometric analysis.However,expression of Bcl-2 was downregulated after treatment with ox-LDL. Conclus ion Ox-LDL upregulated the gene expression of p53, p21 and dow nregulated Bcl-2 expression, which induced apoptosis of U937 cells.
, http://www.100md.com
MeSH Oxidized Modification; Lipoprotein, LDL; U937; Apop tosis; Oncogene
泡沫细胞是动脉粥样硬化(atherosclerosis,As)早期病变的主要病理细胞,由单核细胞/巨 噬细胞或血管平滑肌细胞吞噬并蓄集脂质而形成。As斑块中的泡沫细胞存在凋亡现象,泡沫 细胞的堆积和死亡影响As脂质斑块的稳定[1]。氧化型低密度脂蛋白(oxidized lo w density lipoprotein, ox-LDL)与As有着密切的关系,它可以通过多条途径促进As的发生 、发展。90年代以来,研究发现氧化应激对细胞凋亡的作用与超氧阴离子的产生和脂质过氧 化有关,与控制细胞凋亡的关键基因p53和Bcl-2也有一定关系[2~5] 。我们用氧化型低密度脂蛋白处理人髓系白血病细胞U937,促其向单核细胞分化,发现U937能 吞噬氧化修饰的低密度脂蛋白并蓄集在细胞内,形成泡沫细胞[6]。本实验以U937细胞为研究对象,以氧化型低密度脂蛋白诱导其凋亡,并观察p53、 p21和Bcl-2基因及其编码蛋白在凋亡过程中的变化,初步探讨其在单核细胞源性泡沫细胞凋亡过程中 的调控作用。
, 百拇医药
1 材料和方法
1.1 材料
人髓系白血病细胞U937购自中国科学院上海细胞生物学研究所。RPMI1640培养基、胎牛血清 和Trizol Reagent购自GIBCO公司,Reverse transcription system和PCR core system购自P romega公司。p53、p21、Bcl-2和GAPDH引物由赛百盛公司合成,Bcl-2抗体为兔抗人抗血清,p53和p21抗体为鼠抗人单克隆抗体,二抗为FITC标 记羊抗兔 IgG和FITC标记羊抗鼠IgG,所用抗体均系美国Santa Cruz公司产品。
1.2 细胞培养及分组
U937细胞(4×108/L)用含1×105 u/L青霉素、100 mg/L链霉素和10%胎牛血清的RPMI1 640培养基于37℃、5%CO2条件下培养。对照组不加氧化型低密度脂蛋白,实验组中氧化型 低密度脂蛋白终浓度分别为100 mg/L和200 mg/L,培养48 h。
, 百拇医药
1.3 低密度脂蛋白的分离和氧化
人血浆LDL(d=1.03~1.05)采用超速离心法分离,经琼脂糖电泳 、SDS-聚丙烯酰胺凝胶电泳和免疫电泳,均显示为单一蛋白带。将LDL置于含10 μmol/L Cu SO4的PBS (pH 7.2)中, 37℃温育24 h。氧化修饰后的LDL置于含200 μmol/L EDTA的PBS 中透析24 h,超滤除菌后4℃保存。
1.4 DNA断裂琼脂糖电泳分析
参照文献[7]提取细胞DNA进行琼脂糖电泳分析。
1.5 流式细胞术
1.5.1 分析细胞周期亚G1峰 收集1×106细胞,用PBS洗2次,用冷冻的70%乙醇4℃过夜固定细胞,离心800 r/min × 5 min, 弃乙醇,500 μL PBS重悬,加Rnase A, 终浓度为50 g/L, 37℃水浴45 min,加入碘 化丙啶(promide iodine, PI)50 g/L,混匀,4℃避光放置60 min,尼龙网滤过,流式细 胞仪(美国BD公司,FACS420)上样检测。
, http://www.100md.com
1.5.2 p53、 p21和Bcl-2蛋白的表达 200 mg/L 氧化型低密度脂蛋白温育U937细胞48 h,收集细胞3×106个,用冷PBS 2 mL洗 涤细胞一次,800 r/min×5 min离心; 4%多聚甲醛2 mL室温固定细胞40 min, 800 r/min×5 min离心; PBS 2 mL重悬细胞,800 r/min×5 min离心;用含0.2% Triton-X100和5%血清的 PBS 1 mL重悬细胞,冰上放置20 min,均分为三份,800 r/min×5 min离心去上清。分别将p 53、p21单抗1∶100稀释,Bcl-2多抗1∶40稀释,饱和剂量加入,冰上放置40 min, 800 r/ min×5 min离心,用冷PBS 2 mL重悬细胞,800 r/min×5 min离心,洗去未结合一抗,重复 一次。加入FITC标记的二抗,冰上避光放置40 min后, 800 r/min×5 min离心,去上清, PB S洗涤两次,加入1%多聚甲醛0.5 mL重悬细胞;流式细胞仪检测,计数10 000个细胞。
, 百拇医药
1.6 反转录聚合酶链反应
应用TRIZOL 提取细胞总RNA,反转录合成cDNA,以GAPDH为内对照,进行半定量反转录聚合酶 链反应。GAPDH引物为:正义链5’-TGAAGGTCGGAGTCAACGGATTTT-3’,反义链5’-CATGTGGGCC ATGAGGTCCACCAC-3’,共983 bp。p53引物为:正义链5’-CTAACCGCGGTCCCTTCCCAGAAAACCT-
AC- 3’, 反义链5’-TACAGTCAGAGCCAACCTCAGGCG-3’,共409 bp。p21引物为:正义链5’-GGAATTCATGTCAG AACCG GCTGG-3’),反义链5’-GCGGA TCCTTAGGGCTTCCTCTTG-3’,共500 bp; Bcl-2引物为:正义链5’-ACTTGTGGCCCAGATAG GCACCCAG-3’,为:正义链5’-CGACTTCG CCGAGATGTCCAG CCAG-3’,共382 bp。 首次循环先在94℃变性5 min, 变性、退火、延伸分别为94 ℃ 1 min, 56℃ 1 min,72℃ 1.5 min, 共30个循环,最后一次循环在72℃延伸10 min;聚 合酶链反应产物用1.5%琼脂糖凝胶电泳分析。
, 百拇医药
2 结果
2.1 细胞周期分析
对照组U937细胞经流式细胞仪检测,细胞凋亡率为1.2%, 用1 00 mg/L 氧化型低密度脂蛋白作用48 h后,凋亡率为7.3%, G2期和S期细胞数减少,G1期细 胞增多, G1期前出现亚G1峰,即凋亡峰,氧化型低密度脂蛋白浓度增至200 mg/L时细胞凋亡 率增至22.2%,峰更加明显(图1, Figure 1)。

图1. 氧化型低密度脂蛋白对U937细胞周期的影响
Figure 1. Flow cytometric analysis for apoptosis on U937 cells induced by ox- LDL.
, http://www.100md.com
A: control (1.2%), B: 100 mg/L ox-LDL (7.3%), C: 200 mg/L ox-LDL (22.2%)
2.2 细胞DNA琼脂糖凝胶电泳
分别提取对照组、100 mg/L 氧化型低密度脂蛋白组和200 mg/L 氧化型低密度脂蛋白组细胞 DNA,进行凝胶电泳分析。从图2 (Figure 2)可见100 mg/L 氧化型低密度脂蛋白作用U937 48 h后,DNA电泳出现细胞 凋 亡特有的间隔180~200 bp梯状条带(DNA ladder),但条带较弱;当氧化型低密度脂蛋白浓 度增至200 mg/L时条带更加明显。

图2. DNA凝胶电泳图谱
Figure 2. The apoptosis of U937 induced by ox-LDL were analyzed
, 百拇医药
by agarose gel electrophoresis. M: PBR322/BstNI MW, 1:Control,2:Incubation with 100 mg/L ox-LDL, 3: Incubation with 200 mg/L ox-LDL
2.3 p53、 p21和Bcl-2蛋白的表达
流式细胞术检测10 000个FITC荧光抗体标记的U937,图3 (Figure3)显示氧化型低密度脂蛋 白处理后p53和p21的表达增高,主峰右移, p53阳性的细胞数由 15.7%增至64.2%,p21阳性的细胞数由12.5%增至67.4%;而Bcl-2的表达降低,主峰左移,Bcl-2阳性的细胞数由30.0%减少至5.5%。每组样 本重复3次。

图3. 流式细胞术分析p53、p21和Bcl-2蛋白的表达
, http://www.100md.com
Figure 3. Expression of p53、p21 and Bcl-2 protein were determined by
cytoplasm ic immunofluorescence staining and flow cytometric analysis
after treatment with 200 mg/L ox-LDL. Results are from one representative
experiment( n=3, P<0.01). M: 100 bp DNA marker, C : control group,A: incubation with 200 mg/L ox-LDL gronp
2.4 氧化型低密度脂蛋白对p53、p21和Bcl-2 mRNA表达水平的影响
, 百拇医药
应用反转录聚合酶链反应半定量检测mRNA水平,结果如图4 (Figure 4)所示,对照组和 处理组均检出p53、p21和Bcl-2的mRNA。电泳图谱显示两条区带,一条为 内对照GAPDH的聚合酶链反应产物,其扩增片段长度为983 bp,另一条分别为p53、p21或Bcl -2的扩增产物,其扩增片段长度分别为409 bp、500 bp和382 bp。从图4可以看出,经氧化 型低密度脂蛋白处理的U937细胞, p53和p21 mRNA表达水平增高, Bcl-2 mRNA表达水平降低。反转录聚合酶链反应结果与流式细胞术检测p53、 p21和Bcl-2 蛋白表达结果一致。

图4. 反转录聚合酶链反应扩增p53、p21和Bcl-2基因的琼脂糖凝胶电泳分析
Figure 4. Expression of p53,p21 and Bcl-2 mRNA on U937 c ells Incubation
, http://www.100md.com
with 200 mg/L ox-LDL. Results of RT-PCR showed that p53 and p21 mRNA level were
upregulated, Bcl-2 mRNA level was downregulated after treatment with 200 mg/L ox-LDL for 48 h
3 讨论
动脉粥样硬化斑块的形成一般经历脂质条纹期、脆性动脉粥样斑块期、纤维斑块期和粥样斑 块期。大量研究证实,临床常见急性冠状动脉事件如心绞痛、急性心肌梗塞和冠状动脉猝死的发生主要取决于斑块的类型(斑块的组成成分及脆性),而与粥样病变狭窄严重程度并无明显的关系。巨噬细胞在脆性或不稳定性脂质丰富斑块的破裂中起很重要的作用,巨噬细胞可吞噬代谢脂质,促进脂质池的形成;可分泌细胞因子促进平滑肌细胞的迁移、增殖;可释放蛋白酶(弹性酶和胶原酶)与巨噬细胞代谢产生的自由基和脂质过氧化物一起加速血管壁的损伤。文献[8]报道氧化型低密度脂蛋白可以诱导内皮细胞、平滑肌细胞和单核细胞凋 亡,其作用机制多样,与氧自由基产生过多、膜脂质过氧化和溶酶体损伤有关。氧化型低密度脂蛋白与 U937孵育,可诱导U937向单核细胞分化并增强其粘附吞噬能力,U937吞噬并大量蓄积脂质形成一 种稳定的、同一性好的泡沫细胞模型[5,9]。我们在研究中通过细胞周期分析和DNA断裂分析发现 较高浓度的ox-LDL可以诱导U937细胞凋亡,且随ox-LDL浓度增高,细胞凋亡增多 。我们还发现ox-LDL在诱导U937凋亡过程中可上调原癌基因c-fos、c-jun和c- myc基因表达(待发表资料)。
, 百拇医药
p53基因是一个重要的抑癌基因,它是细胞基因的“看守卫士”,监视基因的完整性,p53蛋 白是细胞周期阻滞和细胞凋亡的关键介质。物理和化学因素造成的DNA损伤和某些原癌基因的激活和氧化应激(oxidative stress)均可促进p53基因和蛋白表达,p53可通过p21wAf-1途径,既调控G1关卡,也参与G2/M关卡的调控,影响细胞周期的进程。Bcl-2基因家族是凋亡研究中最受重视的癌基因,其成员分为两类:一类能促进细胞的凋亡,有Bax, Bcl -xs, Bad, Bak;一类能抵抗细胞凋亡,有Bcl-2, Bcl-xl, Mcl-1等。Bax能和Bcl-2形成异源 二聚体分子,Bax自身还能形成同源二聚体,细胞内Bcl-2/Bax和Bax/Bax二聚体的 比例决定了细胞对凋亡信号的易感性[10]。我们研究表明ox-LDL诱导U937凋亡过程 中有突变型p53和p21的基因转录及蛋白表达增高,Bcl-2的转录表达下调 。U937源泡沫细胞的脂质蓄积代谢使细胞内氧自由基和脂质过氧化物增多,引起细胞DNA损 伤,促进突变型p53表达增高,启动p21基因表达。p21表达升高导致U937停滞在G1期,U937增 殖受抑,向单核/巨噬细胞分化增多,增强其对ox-LDL 的吞噬。细胞内脂质过氧化物和氧自 由基增多促进突变型p53基因表达进而抑制抗凋亡基因Bcl-2的表达,或是 ox-LDL通过胞内其它途径调节Bcl-2的表达,改变了Bcl-2/Bax[ WTBZ 的比例,增加细胞对凋亡信号敏感性,最终诱导U937凋亡。泡沫细胞的凋亡和裂解降 低了血管壁斑块中脂质的外运,促进脂质核心的形成,增加了斑块的不稳定性。U937细胞 p 53为突变型,一般认为p53突变后失去其抑瘤功能,且能促进细胞增殖,但最近有文献报道 突变型p53亦能诱发某些肿瘤细胞如肝癌细胞Hep3B凋亡,c-myc的表达对H ep3B的凋亡有强的促进作用,我们的实验结果与其一致,突变型p53和c-myc在ox-LDL致U937源泡沫细胞凋亡中的作用机制需进一步深入研究[12,13]。
, http://www.100md.com
[致谢]中国中医研究院基础理论研究所庞大本和池旭生两位老师为 流式检测提供帮助。
[基金项目] 本课题由1997年湖南省科委青年基金资助(199 7-7)
[作者简介] 杨向东,男,29岁,现为湖南医科大学病理生 理学专业97级博士,主要从事动脉粥样硬化性心脑血管疾病的机理研究。
参考文献
[1] Bjorkerud S,Bjorkerud B. Apoptosis is abundant in human atherosclerotic lesions,especially in inflammatory cells (macrophages and T cells),and may contribute to the accumulation of gruel and plaque instability[J]. Am J Pathol,1996,149: 367-380
, http://www.100md.com
[2] Hockenbrey DM, Oltvai ZN, Yin XiaoMing,et al. Bcl-2 function in an antioxidant pathway to prevent apoptosis[J]. Cell, 1993, 75: 241-251
[3] Palinski W, Rosenfeld ME, YlaHettuala S, et al. Low density lipoprotein undergoes oxidative modifacation in vivo[ J]. Proc Natl Acad Sci USA, 1989, 86: 372-376
[4] Kinscherf R, Claus R, Wanger M, et al. Apoptosis caused by oxidized LDL is manganese superoxide dismutase and p53 dependent[J]. FASEB J, 1998, 12: 461-467
, http://www.100md.com
[5] Mariko HS, Mikio K, Hiroshi K, et al. Oxidized low density lipoprotein induces apoptosis in cultured human umbilical vein endothelial cells by common and unique mechanisms[J]. J Biol Chem, 1 998, 273: 9 681-687
[6] 李全忠, 杨永宗, 易光辉, 等. U937泡沫细胞模型的建立[J]. 中国动脉硬化杂志, 1999, 7(2): 152-154
[7] 姜 泊,张亚历,周殿元(主编). 分子生物学常用实验方法[M]. 北京:人民军医出版社,1996;65
[8] Yuan XM, Li W, Olsson AG, et al. The toxicity to macrophages of low-density lipoprotein is mediated through lysosomal damage[J]. Atherosclerosis, 1997, 133(2):153-161
, 百拇医药
[9] Li DY, Yang BC, Mehta JL. ox-LDL induces apoptosis in human co ronary artery endothelial cells:role of PKC,PTK,bcl-2,and Fas[J]. Am J Physiol, 1998, 275(2Pt2): H568-576
[10] Frostegard J, Nilsson J, Haegerstrand A, et al. Oxidized lo w density lipoprotein induces differentiation and adhesion of human monocytes and the monocyte cell line U937[J]. Proc Natl Acad Sci USA, 1990, 87: 904-908
[11] Rosse T, Olivier R, Monney L, et al. Bcl-2 prolongs survival after Bax-induced release of cytochromec[J]. Nature, 1998, 391:496-499
, 百拇医药
[12] Ehinger M, Bergh G, Olofsson T, et al. Expression of the p53 tumor suppressor gene induces differentiation and promotes induction of differentiation by 1,25-Dihydroxycholecalciferol in leukemic U937 cells[J]. Blood, 1996, 87(3): 1 064-074
[13] Stahler F,Roemer K. Mutant p53 can provoke apoptosis in p53-deficient Hep3B cells with delayed kinetics relative to wild-type p53[J]. Oncogene, 1998, 17(26): 3 507-512
(此文1999-07-09收到, 2000-01-20修回), 百拇医药