舒喘灵对缺氧大鼠肺动脉高压和肺组织肾上腺素能β2受体mRNA表达的影响*
作者:丁耀贤△ 王晓芳 薛全福 王立荣 斯 琴
单位:中国医学科学院基础医学研究所 中国协和医科大学基础医学院 病理生理研究室 (北京 100005)
关键词:沙丁胺醇;低氧;肺动脉;受体;肾上腺素能;β;RNA;信使
舒喘灵对缺氧大鼠肺动脉高压和肺组织肾上腺素能β2受体mRNA表达的影响 摘 要 目的:研究β2激动剂舒喘灵对缺氧大鼠肺动脉高压及肺β2受体mRNA的作用。方法:常压缺氧4周,同时用舒喘灵灌胃(5mg.kg-1.d-1),用肺动脉插管测压,用RT-PCR术测肺β2受体mRNA。结果:缺氧同时给舒喘灵可减轻缺氧大鼠肺动脉高压、右心室压及右心室肥厚,同时使降低的β2受体mRNA回升到对照水平,动脉血氧分压不受影响,对体动脉压无明显作用。结论:舒喘灵能防止缺氧引起的肺动脉高压和肺肾上腺素能β2受体mRNA水平的降低
, 百拇医药
Effect of salbutamol on pulmonary arterial pressure and lung β2 adrenoceptor mRNA expresion in hypoxic rat
DING Yao-Xian,WANG Xiao-Fang,XUE Quan-Fu,WANG Li-Rong,SI Qin
Department of Pathophysiology,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,School of Basic Medicine,Peking Union Medical College,Beijing(100005)
Abstract AIM:Effect of β2 agonist salbutamol on pulmonary arterial pressure and lung β2 adrenoceptor mRNA was investigated.METHOD:Rats underwent isobaric hypoxia for 4 weeks and salbutamol was poured into stomach(5mg.kg-1.d-1)at some time.Pulmonary arterial pressure was measured.Weights of right ventricle(RV),left ventricle and septum(LV+S) were measured and RV/(LV+S) ratio was calculated.Lung β2 adrenoceptor was measured by RT-PCR.RESULTS:Salbutamol could alleviate pulmonary arterial pressure,right ventricular pressure and right heart hypertrophy induced by hypoxia in rat.The decreased β2 adrenoceptor mRNA recovered to normal control level at some time.No significant effect was found on arterial blood oxygen partial pressure and blood pressure.CONCLUSION:Salbutamol can alleviate pulmonary arterial pressure and right ventricular hypertrophy and the decrease of lung β2 adenoceptor mRNA incuced by hypoxia in rat.
, 百拇医药
MeSH Albuterol;Anoxia;Pulmonary artery;Receptors,adrenergic,beta;RNA,messenger
慢性缺氧能引起肺动脉高压[1~3],肺小动脉收缩和肌化、结构重建在其中起重要作用。我室以往的研究表明间断常压缺氧引起肺动脉高压的大鼠,其肺组织肾上腺素能α受体增加,β受体尤其是β2受体明显减少[2,3]。同时β2受体mRNA也明显下降[3]。目前已知特异性β受体激动剂长期作用可使细胞β受体减少即向下调节。其受体rRNA水平也降低[5]。但病理情况下β受体mRNA的变化及药物作用后的影响报道极少。
本文研究肾上腺素β2受体激动剂舒喘灵(羟甲叔丁肾上腺素,salbutamol)对大鼠缺氧性肺动脉高压的作用和对肺组织β2受体mRNA表达的影响,以期探明当缺氧使肺β2受体已下降情况下,长期应用β2受体激动剂是否会使β2受体进一步下调以至影响防治效果,抑或仍能奏效,同时肺β2受体mRNA发生何种变化,从而在分子水平阐明药物作用环节,为缺氧性肺动脉高压的防治提供启示。
, 百拇医药
材料与方法
一、动物缺氧与药物处理:
缺氧性肺动脉高压模型按薛氏法复制[1],雄性Wistar大鼠,体重(200±20)g(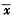 ±s),置于自制能自动调节舱内氧浓度的常压缺氧舱内(10%O2)每天6 h,每周6 d,间断缺氧4周。缺氧期间每次缺氧前后灌胃给予舒喘灵(每次2.5mg/kg,2次/d)。另设常氧对照和常氧加药物对照组,为选择合适剂量,事先还选用舒喘灵2.5,5,12.5 mg/kg 3种剂量比较其效果。
±s),置于自制能自动调节舱内氧浓度的常压缺氧舱内(10%O2)每天6 h,每周6 d,间断缺氧4周。缺氧期间每次缺氧前后灌胃给予舒喘灵(每次2.5mg/kg,2次/d)。另设常氧对照和常氧加药物对照组,为选择合适剂量,事先还选用舒喘灵2.5,5,12.5 mg/kg 3种剂量比较其效果。
二、血流动力学测定:
大鼠用12%乌拉坦麻醉(1 mL/100g BW,ip),由颈外静脉插管经右心室到达肺动脉,连至RW 6000多导生理仪记录右心室压和肺动脉压。颈动脉插管纪录体动脉压。
, 百拇医药
三、血气分析和心室重量测定:
经动脉插管取血作血气分析。开胸取心肺,肺置液氮中保存。心脏剖成右心室壁(R),和左心室壁加室间隔(L+S)两部分,分别称重,计算R/L+S值作为有无右心室肥厚的指标。
四、肺组织RNA提取和电泳鉴定:
将冷冻肺组织置水上剪碎后,用异硫氰酸胍-酚-氯仿法提取肺组织RNA[3]。用Tris-EDTA溶解RNA,-20℃保存[7]。取RNA在含甲醛的琼脂糖凝胶上电泳和测定OD 260和OD 280算出RNA浓度。
五、多聚酶链式反应和特异性条带放射性测定:
1.引物设计:按Bucrlan等[8]报道的大鼠β2受体的基因序列设计和合成一对寡核苷酸引物(由中国科学院微生物研究所合成)。上游引物(5′-ATCGAGACCCTGTGCGTGA-3′)与β2受体cDNA序列361-379碱基对应。下游引物(5′-CATAGGCCTGGTTCGTGAA-3′)与581-600碱基对应。产生240bp的DNA片断。
, http://www.100md.com
2.逆转录反应:在总体积为10μL的缓冲液(50mmol/L Tris.HCl pH8.3,8mmol MgCl2,30mmol/L KCl,10mmol/L DTT)中进行。另加dNTP 0.2 mmol/L,10U RNA酶抑制剂,25 U MMLV逆转录酶,下游引物100pmol,样本RNA 1μg,37℃水浴反应1 h,95℃水浴5 min,灭活逆转录酶。
3.多聚酶链式反应:在总体积为50μL的缓冲液(10mmol/L Tris.HCl pH8.3,50mmol/L KCl,2mmol/L MgCl2)中进行,另加1U Tag酶,上游引物100 pmol,[α-32P]-dCTP 1.85×107Bq(11.1×1010Bq/mmol),逆转录产物3μL。95℃预变性5 min,然后按95℃变性1 min,60℃退火和延伸1 min,循环30周期,最后1次延伸持续7 min。
, http://www.100md.com
4.特异性DNA带放射性测定:多聚酶链式反应产物在2%琼脂糖凝胶上电泳,紫外灯下观察并照相。将特异的240bp条带切下,放入加有0.4mL3%双氧水的闪烁杯中,沸水浴10 min后加5 mL甲苯闪烁液,测定其放射性,以每分钟计数值(counts.min-1)表示,以此反映β2受体mRNA的含量。
六、引物特异性鉴定:
将含有经克隆的β2受体cDNA质粒DNA与样本RNA逆转录产物用同一对引物进行扩增,扩增产物经电泳后照相。
结果
一、舒喘灵对大鼠肺动脉压、右心室压和右心室壁重的影响:
常压间断缺氧(intermittent hypoxia,IH 9只)大鼠平均肺动脉压(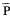 ap)和平均右心室压(
ap)和平均右心室压(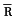 vp)明显高于常氧对照大鼠(NC,8只),见表1。R/(L+S)和右心室壁重/体重(R/BW)也明显增高。舒喘灵给予常氧对照大鼠(NC+S,9只)上述指标无明显变化。缺氧大鼠加用舒喘灵(IH+S,8只)
vp)明显高于常氧对照大鼠(NC,8只),见表1。R/(L+S)和右心室壁重/体重(R/BW)也明显增高。舒喘灵给予常氧对照大鼠(NC+S,9只)上述指标无明显变化。缺氧大鼠加用舒喘灵(IH+S,8只)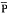 ap,
ap,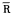 vp,R/(L+S)和R/BW明显低于缺氧大鼠。但仍未达到对照大鼠水平(表1)。
vp,R/(L+S)和R/BW明显低于缺氧大鼠。但仍未达到对照大鼠水平(表1)。
, 百拇医药
3种剂量舒喘灵均可部分防止缺氧引起的肺动脉高压和右心室高压。中、低剂量能减轻右心室壁肥厚(表2)。
表1 舒喘灵对大鼠肺动脉压、右心室压和右心室重量的影响
Tab 1 Effect of salbutamol on pulmonary arterial pressure,right ventricular pressure and right heart weight in rat(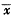 ±s)
±s)
Group
n ap(kPa)
ap(kPa)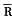 vp(kPa)
vp(kPa)
, http://www.100md.com
R/BW(mg/g)
R/(L+S)(mg/mg)
NC
8
2.85±0.47
3.18±0.47
0.56±0.06
0.24±0.03
NC+S
9
3.10±0.73
3.42±0.73
, 百拇医药
0.53±0.11
0.22±0.03
IH
9
5.28±0.65**
6.05±0.73**
0.73±0.05**
0.31±0.03**
IH+S
8
4.24±0.61**△△
, 百拇医药
4.82±0.70**△△
0.68±0.09**
0.28±0.03**△△
**P<0.01,vs NC group;△△P<0.01,vs IH group;NC=Normal control;NC+S=Normal control+salbutamol;IH=Intermittent hypoxia;IH+S=Intermittent hypoxia+salbutamol 表2 不同剂量舒喘灵对大鼠肺动脉压、右心室压和右心重量的影响
Tab 2 Effect of different dosage salbutamol on pulmonary arterial pressure,right ventricular pressure and right heart weight in rat(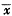 ±s)
±s)
, 百拇医药
Group
n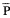 ap(kPa)
ap(kPa)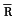 vp(kPa)
vp(kPa)
R/W(mg/g)
R/(L+S)(mg/mg)
NC
9
2.65±0.18
2.82±0.10
, 百拇医药
0.43±0.03
0.19±0.01
IH
7
4.43±0.58**
5.39±0.97**
0.67±0.12**
0.27±0.04**
IH+S(2.5 mg/kg)
4
3.24±0.48**△△
, 百拇医药
3.61±0.57**△△
0.50±0.08**△
0.21±0.05**
(5.0mg/kg)
4
3.15±0.13**△△
3.55±0.11**△△
0.52±0.05**△
0.23±0.01**
, http://www.100md.com
(12.5mg/kg)
4
2.91±0.48△△
3.31±0.52**△△
0.63±0.03**
0.23±0.01**
**P<0.01,vs NC group;△P<0.05,△△P<0.01,vs IH group
二、舒喘灵对大鼠动脉血氧分压和体动脉压的影响:
大鼠动脉血氧分压(PaO2)各组间差异无显著。缺氧+舒喘灵组(8只)为11.45±1.14与对照组(7只)11.93±1.03kPa相近。缺氧+舒喘灵大鼠(8只)体动脉压(Sap)高于对照大鼠(7只)(12.40±10.4 vs 10.75±1.36,P<0.05)。
, 百拇医药
图1所示样本RNA电泳图谱,显示清晰的18 s和28 s条带。OD 260/OD 280均在1.9以上,提示RNA未降解,纯度高。图2所示多聚酶链式反应产物电泳图,显示特异的240 bp条带。肺组织β2受体mRNA表达在缺氧大鼠(9只)明显低于常氧对照大鼠(9只),仅为后者的68.5%(counts.min-1 1254±210 vs 1831±538,P<0.001),缺氧加舒喘灵大鼠(8只)与常氧对照大鼠接近无差异(counts.min-1 1945±462 vs 1831±538,P>0.05)。而常氧加舒喘灵大鼠(10只)明显低于常氧对照大鼠(counts.min-1 1282±342 vs 1831±538,P<0.05)。
图3所示克隆β2受体cDNA和样本RNA逆转录cDNA多聚酶链式反应产物电泳图,显示预期的大小相同的240 bp DNA片断。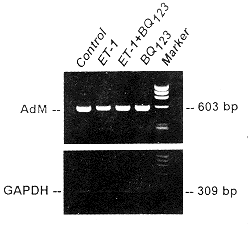
, 百拇医药
Fig 1 Electrophoresis identification of lung tissue RNA
图1 肺组织RNA鉴定电泳图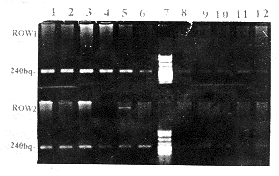
Fig 2 Electrophoresis of RT-PCR products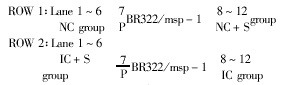
图2 逆转录-多聚酶链式反应产物电泳图
讨论
, 百拇医药
我们曾反复实验证明长期以10% O2间断常压缺氧使大鼠肺组织β受体数量1周后增加,2~4周减少,尤以β2受体减少明显[1~3]。虽然文献中也有报道无明显改变或增加者[9,10],可能与实验条件或实验阶段不同有关。故本文采用缺氧4周肺动脉高压稳定形成,肺β2受体明显下降时进行药物干予实验。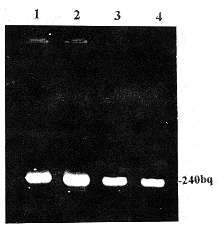
Fig 3 Electrophresis of cloned cDNA and sample RNA RT-PCR products
Lane 1,2:cloned cDNA PCR products
, http://www.100md.com
Lane 3,4:sample RNA RT-PCR products
图3 克隆β2受体cDNA和标本RNA逆转录后多聚酶链式反应产物电泳图
舒喘灵是较特异的β2受体激动剂,除能舒张气管支气管平滑肌外,作用于肺血管β2受体有舒张肺血管的作用。本实验结果表明在缺氧同时给大鼠舒喘灵灌胃可减轻缺氧性肺动脉高压,而且不降低动脉血氧分压和体动脉压。故优于那些虽降肺动脉高压但同时降体动脉压和动脉血氧分压的药物。
生理情况下长期使用特异性β激动剂可使β受体数目及其mRNA减少,其机理尚未阐明,但发生向下调节时受体与GS蛋白偶联和依赖cAMP的蛋白是必需的。可能是通过腺苷酸环化酶或其它因素传递信息产生向下调节[5]。在病理情况下有所不同,本文结果表明缺氧使肺β2受体mRNA减少,舒喘灵使常氧对照大鼠肺组织β2受体mRNA减少,即向下调节,但舒喘灵不仅不使缺氧大鼠肺β2受体mRNA进一步减少,反而能抑制缺氧的作用使肺β2受体mRNA恢复到正常对照水平,提示舒喘灵对β2受体mRNA的调节作用在机体处于不同状态是不同的。我们曾取肺动脉作同样实验,所测得β2受体mRNA的变化与上述肺组织所得结果是一致的。进而又用离体培养的牛肺动脉平滑肌细胞经受6.65kPa氧分压缺氧24 h,分离细胞核进行核转录β2受体mRNA活性测定,表明缺氧使β2受体mRNA基因转录活性减弱至对照的40.7%(P<0.05),缺氧加用舒喘灵可使转录活性达到常氧对照水平(为对照的99.1%),而常氧加舒喘灵使转录活性降至对照的57.5%(P<0.05)。可见缺氧时β2受体的mRNA已处于低下水平时,舒喘灵不使其进一步下调,反使其复原可能是其能预防缺氧性肺动脉高压作用的机理之一。同时提示生理性向下调节与缺氧引起的β2受体mRNA水平降低产生的机理可能有所不同有待进一步研究。
, 百拇医药
综上可见舒喘灵能预防和减轻缺氧引起的肺动脉高压和肺肾上腺素β2受体mRNA水平的降低,但不降低动脉血氧分压和体动脉压,对防治缺氧性肺动脉高压有良好的研究和开发前景。此外,病理情况下机体受体调节发生变化时,应用受体药物后的变化也与生理情况下不同。故应查明病理情况下药物作用后受体变化规律来指导临床用药物,这些在受体药物应用方面可能有普遍意义。
* 国家八五攻关项目
△ 同济医科大学临床药理教研室(武汉 430030)
参考文献
1 谢剑鸣,薛全福,王立荣.常压缺氧对大鼠肺组织β和α肾上腺素能受体数目的影响.中国病理生理杂志,1989,5:261.
2 王晓芳,薛全福.常压缺氧性肺动脉高压大鼠肺组织肾上腺素能受体亚型数目的变化.中国病理生理杂志,1993,9:342.
, 百拇医药
3 王节发,薛全福,刘敬忠,等.慢性缺氧时大鼠肺肾上腺素能β2受体mRNA水平的动态变化.中国病理生理杂志,1993,9:298.
4 Wesley EL,Hadcock JR,Makbon CC.Tissue-specific regulation of α1,β2 and β2-adrenergic receptor mRNAs by thyroid state in the rat.Endocrinology,1991,129:1116.
5 Hadcock J R,Ros M,Malbon C C. Agonist regulation of β-adrenergic receptor mRNA.J Biol Chem,1989,264:13956.
6 徐霆.大鼠慢性缺氧肺动脉高压的实验治疗.国外医学生理病理科学与临床分册,1991,11:62.
, 百拇医药
7 Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform-extraction.Anal Biochem 1987,162:156.
8 Buckland PR,Hill RM,Tidmersh SF.Primary structure of the rat Beta-2 adrenergic receptor gene.Nucleic Acids Res,1990,18:682.
9 Bohm M,Gengenbach S,Hauck RW. Beta-adrenergic receptor and M-cholinergic receptors in human lung.Chest,1991,100:1246.
10 Winter RJD,Dickinson KEJ,Rudd RM. Tissue specific modulation of β-adrenoceotor number in rat with chronic hypoxia with an attenuated response to down-regulation by salbutamol.Clin Sci,1986,70:158
1997年8月28日收稿,1999年2月8日修回, 百拇医药
单位:中国医学科学院基础医学研究所 中国协和医科大学基础医学院 病理生理研究室 (北京 100005)
关键词:沙丁胺醇;低氧;肺动脉;受体;肾上腺素能;β;RNA;信使
舒喘灵对缺氧大鼠肺动脉高压和肺组织肾上腺素能β2受体mRNA表达的影响 摘 要 目的:研究β2激动剂舒喘灵对缺氧大鼠肺动脉高压及肺β2受体mRNA的作用。方法:常压缺氧4周,同时用舒喘灵灌胃(5mg.kg-1.d-1),用肺动脉插管测压,用RT-PCR术测肺β2受体mRNA。结果:缺氧同时给舒喘灵可减轻缺氧大鼠肺动脉高压、右心室压及右心室肥厚,同时使降低的β2受体mRNA回升到对照水平,动脉血氧分压不受影响,对体动脉压无明显作用。结论:舒喘灵能防止缺氧引起的肺动脉高压和肺肾上腺素能β2受体mRNA水平的降低
, 百拇医药
Effect of salbutamol on pulmonary arterial pressure and lung β2 adrenoceptor mRNA expresion in hypoxic rat
DING Yao-Xian,WANG Xiao-Fang,XUE Quan-Fu,WANG Li-Rong,SI Qin
Department of Pathophysiology,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,School of Basic Medicine,Peking Union Medical College,Beijing(100005)
Abstract AIM:Effect of β2 agonist salbutamol on pulmonary arterial pressure and lung β2 adrenoceptor mRNA was investigated.METHOD:Rats underwent isobaric hypoxia for 4 weeks and salbutamol was poured into stomach(5mg.kg-1.d-1)at some time.Pulmonary arterial pressure was measured.Weights of right ventricle(RV),left ventricle and septum(LV+S) were measured and RV/(LV+S) ratio was calculated.Lung β2 adrenoceptor was measured by RT-PCR.RESULTS:Salbutamol could alleviate pulmonary arterial pressure,right ventricular pressure and right heart hypertrophy induced by hypoxia in rat.The decreased β2 adrenoceptor mRNA recovered to normal control level at some time.No significant effect was found on arterial blood oxygen partial pressure and blood pressure.CONCLUSION:Salbutamol can alleviate pulmonary arterial pressure and right ventricular hypertrophy and the decrease of lung β2 adenoceptor mRNA incuced by hypoxia in rat.
, 百拇医药
MeSH Albuterol;Anoxia;Pulmonary artery;Receptors,adrenergic,beta;RNA,messenger
慢性缺氧能引起肺动脉高压[1~3],肺小动脉收缩和肌化、结构重建在其中起重要作用。我室以往的研究表明间断常压缺氧引起肺动脉高压的大鼠,其肺组织肾上腺素能α受体增加,β受体尤其是β2受体明显减少[2,3]。同时β2受体mRNA也明显下降[3]。目前已知特异性β受体激动剂长期作用可使细胞β受体减少即向下调节。其受体rRNA水平也降低[5]。但病理情况下β受体mRNA的变化及药物作用后的影响报道极少。
本文研究肾上腺素β2受体激动剂舒喘灵(羟甲叔丁肾上腺素,salbutamol)对大鼠缺氧性肺动脉高压的作用和对肺组织β2受体mRNA表达的影响,以期探明当缺氧使肺β2受体已下降情况下,长期应用β2受体激动剂是否会使β2受体进一步下调以至影响防治效果,抑或仍能奏效,同时肺β2受体mRNA发生何种变化,从而在分子水平阐明药物作用环节,为缺氧性肺动脉高压的防治提供启示。
, 百拇医药
材料与方法
一、动物缺氧与药物处理:
缺氧性肺动脉高压模型按薛氏法复制[1],雄性Wistar大鼠,体重(200±20)g(
二、血流动力学测定:
大鼠用12%乌拉坦麻醉(1 mL/100g BW,ip),由颈外静脉插管经右心室到达肺动脉,连至RW 6000多导生理仪记录右心室压和肺动脉压。颈动脉插管纪录体动脉压。
, 百拇医药
三、血气分析和心室重量测定:
经动脉插管取血作血气分析。开胸取心肺,肺置液氮中保存。心脏剖成右心室壁(R),和左心室壁加室间隔(L+S)两部分,分别称重,计算R/L+S值作为有无右心室肥厚的指标。
四、肺组织RNA提取和电泳鉴定:
将冷冻肺组织置水上剪碎后,用异硫氰酸胍-酚-氯仿法提取肺组织RNA[3]。用Tris-EDTA溶解RNA,-20℃保存[7]。取RNA在含甲醛的琼脂糖凝胶上电泳和测定OD 260和OD 280算出RNA浓度。
五、多聚酶链式反应和特异性条带放射性测定:
1.引物设计:按Bucrlan等[8]报道的大鼠β2受体的基因序列设计和合成一对寡核苷酸引物(由中国科学院微生物研究所合成)。上游引物(5′-ATCGAGACCCTGTGCGTGA-3′)与β2受体cDNA序列361-379碱基对应。下游引物(5′-CATAGGCCTGGTTCGTGAA-3′)与581-600碱基对应。产生240bp的DNA片断。
, http://www.100md.com
2.逆转录反应:在总体积为10μL的缓冲液(50mmol/L Tris.HCl pH8.3,8mmol MgCl2,30mmol/L KCl,10mmol/L DTT)中进行。另加dNTP 0.2 mmol/L,10U RNA酶抑制剂,25 U MMLV逆转录酶,下游引物100pmol,样本RNA 1μg,37℃水浴反应1 h,95℃水浴5 min,灭活逆转录酶。
3.多聚酶链式反应:在总体积为50μL的缓冲液(10mmol/L Tris.HCl pH8.3,50mmol/L KCl,2mmol/L MgCl2)中进行,另加1U Tag酶,上游引物100 pmol,[α-32P]-dCTP 1.85×107Bq(11.1×1010Bq/mmol),逆转录产物3μL。95℃预变性5 min,然后按95℃变性1 min,60℃退火和延伸1 min,循环30周期,最后1次延伸持续7 min。
, http://www.100md.com
4.特异性DNA带放射性测定:多聚酶链式反应产物在2%琼脂糖凝胶上电泳,紫外灯下观察并照相。将特异的240bp条带切下,放入加有0.4mL3%双氧水的闪烁杯中,沸水浴10 min后加5 mL甲苯闪烁液,测定其放射性,以每分钟计数值(counts.min-1)表示,以此反映β2受体mRNA的含量。
六、引物特异性鉴定:
将含有经克隆的β2受体cDNA质粒DNA与样本RNA逆转录产物用同一对引物进行扩增,扩增产物经电泳后照相。
结果
一、舒喘灵对大鼠肺动脉压、右心室压和右心室壁重的影响:
常压间断缺氧(intermittent hypoxia,IH 9只)大鼠平均肺动脉压(
, 百拇医药
3种剂量舒喘灵均可部分防止缺氧引起的肺动脉高压和右心室高压。中、低剂量能减轻右心室壁肥厚(表2)。
表1 舒喘灵对大鼠肺动脉压、右心室压和右心室重量的影响
Tab 1 Effect of salbutamol on pulmonary arterial pressure,right ventricular pressure and right heart weight in rat(
Group
n
, http://www.100md.com
R/BW(mg/g)
R/(L+S)(mg/mg)
NC
8
2.85±0.47
3.18±0.47
0.56±0.06
0.24±0.03
NC+S
9
3.10±0.73
3.42±0.73
, 百拇医药
0.53±0.11
0.22±0.03
IH
9
5.28±0.65**
6.05±0.73**
0.73±0.05**
0.31±0.03**
IH+S
8
4.24±0.61**△△
, 百拇医药
4.82±0.70**△△
0.68±0.09**
0.28±0.03**△△
**P<0.01,vs NC group;△△P<0.01,vs IH group;NC=Normal control;NC+S=Normal control+salbutamol;IH=Intermittent hypoxia;IH+S=Intermittent hypoxia+salbutamol 表2 不同剂量舒喘灵对大鼠肺动脉压、右心室压和右心重量的影响
Tab 2 Effect of different dosage salbutamol on pulmonary arterial pressure,right ventricular pressure and right heart weight in rat(
, 百拇医药
Group
n
R/W(mg/g)
R/(L+S)(mg/mg)
NC
9
2.65±0.18
2.82±0.10
, 百拇医药
0.43±0.03
0.19±0.01
IH
7
4.43±0.58**
5.39±0.97**
0.67±0.12**
0.27±0.04**
IH+S(2.5 mg/kg)
4
3.24±0.48**△△
, 百拇医药
3.61±0.57**△△
0.50±0.08**△
0.21±0.05**
(5.0mg/kg)
4
3.15±0.13**△△
3.55±0.11**△△
0.52±0.05**△
0.23±0.01**
, http://www.100md.com
(12.5mg/kg)
4
2.91±0.48△△
3.31±0.52**△△
0.63±0.03**
0.23±0.01**
**P<0.01,vs NC group;△P<0.05,△△P<0.01,vs IH group
二、舒喘灵对大鼠动脉血氧分压和体动脉压的影响:
大鼠动脉血氧分压(PaO2)各组间差异无显著。缺氧+舒喘灵组(8只)为11.45±1.14与对照组(7只)11.93±1.03kPa相近。缺氧+舒喘灵大鼠(8只)体动脉压(Sap)高于对照大鼠(7只)(12.40±10.4 vs 10.75±1.36,P<0.05)。
, 百拇医药
图1所示样本RNA电泳图谱,显示清晰的18 s和28 s条带。OD 260/OD 280均在1.9以上,提示RNA未降解,纯度高。图2所示多聚酶链式反应产物电泳图,显示特异的240 bp条带。肺组织β2受体mRNA表达在缺氧大鼠(9只)明显低于常氧对照大鼠(9只),仅为后者的68.5%(counts.min-1 1254±210 vs 1831±538,P<0.001),缺氧加舒喘灵大鼠(8只)与常氧对照大鼠接近无差异(counts.min-1 1945±462 vs 1831±538,P>0.05)。而常氧加舒喘灵大鼠(10只)明显低于常氧对照大鼠(counts.min-1 1282±342 vs 1831±538,P<0.05)。
图3所示克隆β2受体cDNA和样本RNA逆转录cDNA多聚酶链式反应产物电泳图,显示预期的大小相同的240 bp DNA片断。

, 百拇医药
Fig 1 Electrophoresis identification of lung tissue RNA
图1 肺组织RNA鉴定电泳图

Fig 2 Electrophoresis of RT-PCR products
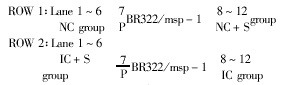
图2 逆转录-多聚酶链式反应产物电泳图
讨论
, 百拇医药
我们曾反复实验证明长期以10% O2间断常压缺氧使大鼠肺组织β受体数量1周后增加,2~4周减少,尤以β2受体减少明显[1~3]。虽然文献中也有报道无明显改变或增加者[9,10],可能与实验条件或实验阶段不同有关。故本文采用缺氧4周肺动脉高压稳定形成,肺β2受体明显下降时进行药物干予实验。

Fig 3 Electrophresis of cloned cDNA and sample RNA RT-PCR products
Lane 1,2:cloned cDNA PCR products
, http://www.100md.com
Lane 3,4:sample RNA RT-PCR products
图3 克隆β2受体cDNA和标本RNA逆转录后多聚酶链式反应产物电泳图
舒喘灵是较特异的β2受体激动剂,除能舒张气管支气管平滑肌外,作用于肺血管β2受体有舒张肺血管的作用。本实验结果表明在缺氧同时给大鼠舒喘灵灌胃可减轻缺氧性肺动脉高压,而且不降低动脉血氧分压和体动脉压。故优于那些虽降肺动脉高压但同时降体动脉压和动脉血氧分压的药物。
生理情况下长期使用特异性β激动剂可使β受体数目及其mRNA减少,其机理尚未阐明,但发生向下调节时受体与GS蛋白偶联和依赖cAMP的蛋白是必需的。可能是通过腺苷酸环化酶或其它因素传递信息产生向下调节[5]。在病理情况下有所不同,本文结果表明缺氧使肺β2受体mRNA减少,舒喘灵使常氧对照大鼠肺组织β2受体mRNA减少,即向下调节,但舒喘灵不仅不使缺氧大鼠肺β2受体mRNA进一步减少,反而能抑制缺氧的作用使肺β2受体mRNA恢复到正常对照水平,提示舒喘灵对β2受体mRNA的调节作用在机体处于不同状态是不同的。我们曾取肺动脉作同样实验,所测得β2受体mRNA的变化与上述肺组织所得结果是一致的。进而又用离体培养的牛肺动脉平滑肌细胞经受6.65kPa氧分压缺氧24 h,分离细胞核进行核转录β2受体mRNA活性测定,表明缺氧使β2受体mRNA基因转录活性减弱至对照的40.7%(P<0.05),缺氧加用舒喘灵可使转录活性达到常氧对照水平(为对照的99.1%),而常氧加舒喘灵使转录活性降至对照的57.5%(P<0.05)。可见缺氧时β2受体的mRNA已处于低下水平时,舒喘灵不使其进一步下调,反使其复原可能是其能预防缺氧性肺动脉高压作用的机理之一。同时提示生理性向下调节与缺氧引起的β2受体mRNA水平降低产生的机理可能有所不同有待进一步研究。
, 百拇医药
综上可见舒喘灵能预防和减轻缺氧引起的肺动脉高压和肺肾上腺素β2受体mRNA水平的降低,但不降低动脉血氧分压和体动脉压,对防治缺氧性肺动脉高压有良好的研究和开发前景。此外,病理情况下机体受体调节发生变化时,应用受体药物后的变化也与生理情况下不同。故应查明病理情况下药物作用后受体变化规律来指导临床用药物,这些在受体药物应用方面可能有普遍意义。
* 国家八五攻关项目
△ 同济医科大学临床药理教研室(武汉 430030)
参考文献
1 谢剑鸣,薛全福,王立荣.常压缺氧对大鼠肺组织β和α肾上腺素能受体数目的影响.中国病理生理杂志,1989,5:261.
2 王晓芳,薛全福.常压缺氧性肺动脉高压大鼠肺组织肾上腺素能受体亚型数目的变化.中国病理生理杂志,1993,9:342.
, 百拇医药
3 王节发,薛全福,刘敬忠,等.慢性缺氧时大鼠肺肾上腺素能β2受体mRNA水平的动态变化.中国病理生理杂志,1993,9:298.
4 Wesley EL,Hadcock JR,Makbon CC.Tissue-specific regulation of α1,β2 and β2-adrenergic receptor mRNAs by thyroid state in the rat.Endocrinology,1991,129:1116.
5 Hadcock J R,Ros M,Malbon C C. Agonist regulation of β-adrenergic receptor mRNA.J Biol Chem,1989,264:13956.
6 徐霆.大鼠慢性缺氧肺动脉高压的实验治疗.国外医学生理病理科学与临床分册,1991,11:62.
, 百拇医药
7 Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform-extraction.Anal Biochem 1987,162:156.
8 Buckland PR,Hill RM,Tidmersh SF.Primary structure of the rat Beta-2 adrenergic receptor gene.Nucleic Acids Res,1990,18:682.
9 Bohm M,Gengenbach S,Hauck RW. Beta-adrenergic receptor and M-cholinergic receptors in human lung.Chest,1991,100:1246.
10 Winter RJD,Dickinson KEJ,Rudd RM. Tissue specific modulation of β-adrenoceotor number in rat with chronic hypoxia with an attenuated response to down-regulation by salbutamol.Clin Sci,1986,70:158
1997年8月28日收稿,1999年2月8日修回, 百拇医药