实验性急性肝衰竭时门脉高压发生机制的研究
作者:刘立新 韩德五 许瑞龄 马学惠 赵元昌
单位:刘立新 山西医科大学第一医院;韩德五 许瑞龄 马学惠 赵元昌 山西医科大学病理生理教研室(太原030001)
关键词:高血压;门静脉;内毒素类;微循环;肝
实验性急性肝衰竭时门脉高压发生机制的研究 摘 要 目的:阐明急性肝衰竭时门脉高压的发生与肠源性内毒素血症和肝内微循环障碍的关系。方法:动态观察皮下注射硫代乙酰胺大鼠门脉血流动力学、血浆内毒素、内皮素-1、肿瘤坏死因子-α及台盼蓝肝脏原位灌流等。结果:随着给注射时间的延长,血浆内毒素水平、ALT和LDH明显升高,血浆及肝组织TNF-α和ET-1显著增多,台盼蓝灌流时间明显延长。肝组织可见肝窦直径显著变窄,肝细胞肿胀变性坏死使肝窦被挤压。结论:肠源性内毒素血症及其引发的肝微循环障碍在急性门脉高压形成中具有重要作用。
, 百拇医药 Studies on the pathogenesis of portal hypertension in the experimental acute hepatic failure
LIU Li-Xin1,HAN De-Wu2,XU Rui-Ling2
1?The First Hospital, 2?Department of Pathophysiolgy, Shanxi Medical University, Taiyuan(030001)
Abstract AIM:To observe the relationship among acute portal hypertension, intestinal endotoxemia and hepatic microcirculatory disturbance.METHODS:Portal venous flow dynamics, portal venous pressure, changes of plasma and hepatic biochemistry and histopathology, trypan blue distribution time were measured in rats with severe hepatic injury induced by thioacetamide.RESULTS:(1)Portal venous flow markedly decreased and portal venous pressure markedly increased. (2) Plasma level of endotoxin, tumor necrosis factor-α,endothelin-1 and trypan blue distribution time were significantly higher. (3) The diameter of hepatic sinusoids remarkably narrowed.CONCLUSION:The intestinal endotoxemia and hepatic microcirculatory disturbance played an important role in development of acute portal hypertension.
, 百拇医药
MeSH Hypertension, portal; Endotoxin; Microcirculation; Liver
急性门脉高压的发生与门脉后阻力增高密切相关,而后者可因肝细胞大片坏死引起的网状支架塌陷所致[1],也可由于缩血管物质的释放使肝微血管(包括门静脉)与肝窦收缩所导致[2]。然而,在严重肝损伤时急性门脉高压的发生与肠源性内毒素血症和肝内微循环障碍的关系报道甚少。为此,本研究对肠源性内素血症及其所致肝微循环障碍在门脉高压发生中的作用进行了探讨。
材料与方法
(一)动物分组及模型复制:雄性Wistar大鼠(本校实验动物中心提供),随机分为5组。正常对照组(N组)6只,10 mL/kg体重生理盐水皮下注射;急性肝损伤组,硫代乙酰胺(thioacetamide, TAA)600 mg/kg体重皮下注射,并于TAA皮下注射6 h(6 h组)、12 h(12 h组)、24 h(24 h组)、36 h(36 h组),测定门脉血流动力学和生化指标的变化。取肝左叶行HE染色,光镜观察。另取相同的大鼠,随机分为5组:给注射物方法同前,行台盼蓝肝脏原位灌流,以观察肝微循环状态[3]。
, http://www.100md.com
(二)门静脉血流量和门脉压的测定:各组大鼠用2%戊巴比妥钠(0.03 g/kg体重ip)麻醉后,经腹正中切口暴露门静脉,用MFV-3100型(日本NIHON KOHDEN公司)电磁流量计测定门静脉血流量(PVF)。穿刺回结肠静脉,接压力换能器(TP-400T型),用四道生理记录仪(日本NIHON KOHDEN公司)测定门静脉压力(PVP)。
(三)内毒素及生化指标测定:
1.血浆内毒素含量测定:采用改良过氯酸法,试剂盒由上海市医学化验所提供。
2.血浆及肝匀浆中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和内皮素-1(endothelin-1,ET-1)含量测定:应用放射免疫分析法。试剂盒由东亚免疫研究所提供。
3.血浆丙氨酸转氨酶(alanine transaminase, ALT)活性测定:采用赖氏法。
, http://www.100md.com
4.血清乳酸脱氢酶(lactate dehydrogenase, LDH)活性测定:试剂盒由上海长征医学科学有限公司提供。
(四)台盼蓝肝脏原位灌流:按文献[3]进行,但灌流速度改为4 mL/g liver.min-1,记录肝脏全部均匀蓝染时间。
(五)病理组织学观察:经HE染色的肝组织切片用MIAS-300型图像分析仪测量肝窦直径的变化。
(六)统计学处理:数据以均数±标准差( ±s)表示,采用方差分析,q检验,并对有关指标进行相关与回归分析。采用SPSS+/PC4.0通用软件进行。
±s)表示,采用方差分析,q检验,并对有关指标进行相关与回归分析。采用SPSS+/PC4.0通用软件进行。
, 百拇医药
结果
一、门脉血流动力学的变化:
如表2所示,TAA皮下注射6 h后,PVF明显减少(P<0.05),随着时间的延长,PVF呈进行性降低,36 h组降低至正常组的大约1/3。而PVP则随TAA皮下注射时间的延长逐渐升高,36 h组升高至约为对照组的2倍,组间相比均有显著差异(P<0.05)。
二、血浆内毒素含量变化:
随着注射TAA时间的增加,血浆内毒素含量逐渐升高,24 h、36 h组均与正常组有显著差异(P<0.05),见表1。
三、血浆及肝匀浆TNF-α含量变化:
注射TAA后血浆TNF-α含量明显升高,36 h组约为正常对照组2倍;肝匀浆中TNF-α含量变化趋势与血浆变化一致,只是升高速度更快,24 h组约达到正常对照组2倍,36 h组约达3倍(表1、3)。
, http://www.100md.com
表1 血浆内毒素及生化指标的动态变化
Tab 1 The dynamic changes of plasma endotoxin and biochemistry (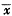 ±s)
±s)
Group
n
ALT
(U/L)
Endotoxin
(×103U/L)
, http://www.100md.com
TNT-α
(μg/L)
ET-1
(ng/L)
N
6
63.83±23.96
0.156±0.010
0.65±0.12
107.12±14.73
6 h
6
, http://www.100md.com 101.24±58.52
0.216±0.056
0.89±0.10a
119.35±15.02
12 h
6
103.02±20.26a
0.195±0.033
0.90±0.17a
120.70±26.64
24 h
, 百拇医药
7
1497.36±575.94abc
0.249±0.036a
0.98±0.08a
150.91±58.27a
36 h
7
3365.72±494.60abcd
0.265±0.024a
1.23±0.25abcd
, http://www.100md.com
164.68±46.72abc
a:P<0.05, vs N; b:P<0.05 vs 6h; C:P<0.05 vs 12 h;d:P<0.05, vs 24 h; 表2 门脉压、门脉血流量、肝窦直径及台盼蓝灌流时间的变化
Tab 2 The changes of PVP, PVF, SD and TBD Time (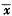 ±s)
±s)
Group
n
PVP
(kPa)
, http://www.100md.com
PVF
(mL.min-1/100 g liver)
HSD
(μm)
TBD Time
(s)
N
6
1.35±0.27
149.15±12.41
6.37±1.42
, http://www.100md.com
195.7±45.7
6 h
6
2.13±0.37a
112.50±10.18a
2.08±0.49a
564.8±181.4a
12 h
6
1.87±0.22a
76.17±22.62ab
, 百拇医药
1.77±0.18a
809.7±126.2ab
24 h
7
2.56±0.79ac
75.48±21.27ab
1.15±0.45abc
1082.4±333.8ab
36 h
7
, http://www.100md.com
2.90±0.66abc
45.53±14.66abcd
0.40±0.05abcd
1370.1±410.5abc
TBD Time=typan blue distribution time;PVP=portal venous pressure; PVF=portal venous flow; HSD=hepatic sinusoid diameter a:P<0.05,vs N; b:P<0.05,vs 6 h; c: P<0.05,vs 12h; d:P<0.05 vs 24 h
四、血浆及肝匀浆ET-1水平变化:
, 百拇医药
TAA损伤各组血浆及肝匀浆ET-1浓度明显高于正常对照组(表1、3)。
五、血浆ALT与血清LDH活性变化:
注射TAA后,随着时间的延长,血浆ALT和血清LDH活性均明显高于正常组(P<0.05),LDH活性的改变较ALT的改变为早(表1、3)。
六、肝脏台盼蓝灌流时间的变化(表2):
随着注射TAA时间的延长,灌流时间明显延长。
七、肝窦直径的变化:
注射TAA后,肝窦直径显著减小(表2)。
表3 血清乳酸脱氢酶及肝匀浆细胞因子的动态变化
, 百拇医药 Tab 3 The dynamic changes of serum LDH and hepatichomogenate cytokine (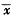 ±s)
±s)
Group
n
Serum LDH
(U/L)
Liver
TNF-α(ng/100 mg)
ET-1(pg/100 mg)
, http://www.100md.com
N
6
76.96±62.12
0.80±0.12
166.82±68.00
6 h
6
349.96±169.14a
1.17±0.34a
268.47±109.89a
12 h
, 百拇医药
6
500.72±215.11a
1.49±0.45a
405.60±59.60ab
24 h
7
1893.84±1 271.65abc
1.71±0.36a
348.27±138.66a
36 h
, 百拇医药
7
4192.54±2 170.96abcd
2.72±0.60abcd
327.73±138.91a
a:P<0.05, vs N; b:P<0.05,vs 6 h; c:P<0.05,vs 12 h; d:P<0.05 vs 24 h
八、肝组织病理学改变:
随着注射TAA时间的延长,肝细胞变性坏死逐渐加重,36 h组形成桥接坏死,肝窦被挤压。
九、相关分析:
TAA损伤各组血浆内毒素水平与血浆TNF-α含量呈显著正相关(r=0.4 159,P<0.05)。血浆TNF-α含量与血浆ET-1水平呈显著正相关(r=0.4524,P<0.05)。血浆ET-1含量与PVP水平亦呈显著正相关(r=0.4785,P<0.05)。注射TAA 6 h与12 h组肝ET浓度与肝窦直径呈显著负相关(r=-0.7404,P<0.05)。
, 百拇医药
讨论
本实验结果表明,TAA引起严重肝损伤同时伴有肠源性内毒素血症发生。内毒素可通过激活枯否细胞释放的TNF-α使内皮细胞释放内皮素,或内毒素直接刺激内皮细胞释放内皮素。内皮素可使肝内微血管收缩,并可作用于贮脂细胞使钙离子增多而引起其收缩,从而使肝窦直径缩小变窄,增加门脉阻力,故在急性门静脉高压形成中起重要作用[4]。
实验又表明,随着血浆内毒素水平的升高,台盼蓝在肝内分布时间显著增加(P<0.05),而台盼蓝在肝内的分布时间与肝微循环灌注状况密切相关[3]。微循环障碍使肝组织缺血、缺氧,进而加重肝损伤。由于肝组织破坏加剧,网状支架塌陷,肝窦被挤压,加剧了门脉高压。有实验报道,组织缺氧可使肝内皮细胞和/或肝窦壁其他细胞合成和释放内皮素增多[5,6],内皮素的释放不但可直接引起门静脉压升高,同时还可加剧肝内微循环障碍,从而造成恶性循环,使门脉压进行性升高。
, 百拇医药
TNF-α一方面通过受体进入肝细胞后,与线粒体等细胞器结合,激活某些蛋白酶和磷脂酶A2活性升高,并诱导肝细胞内自由基产生,引起肝细胞膜性结构损伤和DNA链断裂,从而导致肝细胞变性和坏死;另一方面,TNF-α还能促进小血管基底膜纤维连接蛋白(fibronection)含量减少,导致血管壁通透性增强,造成肝内微循环障碍和缺血缺氧性肝细胞坏死[7]。肝细胞的大片状坏死可挤压肝窦,在促进门脉高压的形成中也有一定作用。
参考文献
1 Lee SS, Hadengue A, Girod C, et al. Reduction of intrahepatic vascular space in the pathogenesis of portal hypertension. Gastroenterology, 1987, 93:157.
, 百拇医药
2 Hemsen A. Biochemical and functional characterization of endothelin peptides with special reference to vascular effects. Acta Physiol Scand (Suppl), 1991, 602:1.
3 Jones SM, Thurman RG. L-arginine minimizes reperfusion injury in a low-flow, reflow model of liver perfusion. Hepatology, 1996, 24;163.
4 Rockey D. The cellular pathogenesis of portal hypertension: stellate cell contractility, endothelin, and nitric oxide. Hepatology, 1997, 25:2.
, http://www.100md.com
5 Kourembanas S, Marsden PA, Mcquillan LP, et al. Hypoxia induces endothelin gene expression and secretion in cultrued human endothelium. J Clin Invest, 1991, 88:1054.
6 Okumura S, Takei Y, Kawano S, et al. Vasoactive effect of endothelin-1 on rat liver in vivo. Hepatology, 1994,19:155.
7 顾长海.暴发性病毒性肝炎的发病机理.见:顾长海,王宇明,主编.急性肝衰竭.第1版.成都:四川科学技术出版社,1997.11~21.
1997年12月8日收稿,1998年8月28日修回, 百拇医药
单位:刘立新 山西医科大学第一医院;韩德五 许瑞龄 马学惠 赵元昌 山西医科大学病理生理教研室(太原030001)
关键词:高血压;门静脉;内毒素类;微循环;肝
实验性急性肝衰竭时门脉高压发生机制的研究 摘 要 目的:阐明急性肝衰竭时门脉高压的发生与肠源性内毒素血症和肝内微循环障碍的关系。方法:动态观察皮下注射硫代乙酰胺大鼠门脉血流动力学、血浆内毒素、内皮素-1、肿瘤坏死因子-α及台盼蓝肝脏原位灌流等。结果:随着给注射时间的延长,血浆内毒素水平、ALT和LDH明显升高,血浆及肝组织TNF-α和ET-1显著增多,台盼蓝灌流时间明显延长。肝组织可见肝窦直径显著变窄,肝细胞肿胀变性坏死使肝窦被挤压。结论:肠源性内毒素血症及其引发的肝微循环障碍在急性门脉高压形成中具有重要作用。
, 百拇医药 Studies on the pathogenesis of portal hypertension in the experimental acute hepatic failure
LIU Li-Xin1,HAN De-Wu2,XU Rui-Ling2
1?The First Hospital, 2?Department of Pathophysiolgy, Shanxi Medical University, Taiyuan(030001)
Abstract AIM:To observe the relationship among acute portal hypertension, intestinal endotoxemia and hepatic microcirculatory disturbance.METHODS:Portal venous flow dynamics, portal venous pressure, changes of plasma and hepatic biochemistry and histopathology, trypan blue distribution time were measured in rats with severe hepatic injury induced by thioacetamide.RESULTS:(1)Portal venous flow markedly decreased and portal venous pressure markedly increased. (2) Plasma level of endotoxin, tumor necrosis factor-α,endothelin-1 and trypan blue distribution time were significantly higher. (3) The diameter of hepatic sinusoids remarkably narrowed.CONCLUSION:The intestinal endotoxemia and hepatic microcirculatory disturbance played an important role in development of acute portal hypertension.
, 百拇医药
MeSH Hypertension, portal; Endotoxin; Microcirculation; Liver
急性门脉高压的发生与门脉后阻力增高密切相关,而后者可因肝细胞大片坏死引起的网状支架塌陷所致[1],也可由于缩血管物质的释放使肝微血管(包括门静脉)与肝窦收缩所导致[2]。然而,在严重肝损伤时急性门脉高压的发生与肠源性内毒素血症和肝内微循环障碍的关系报道甚少。为此,本研究对肠源性内素血症及其所致肝微循环障碍在门脉高压发生中的作用进行了探讨。
材料与方法
(一)动物分组及模型复制:雄性Wistar大鼠(本校实验动物中心提供),随机分为5组。正常对照组(N组)6只,10 mL/kg体重生理盐水皮下注射;急性肝损伤组,硫代乙酰胺(thioacetamide, TAA)600 mg/kg体重皮下注射,并于TAA皮下注射6 h(6 h组)、12 h(12 h组)、24 h(24 h组)、36 h(36 h组),测定门脉血流动力学和生化指标的变化。取肝左叶行HE染色,光镜观察。另取相同的大鼠,随机分为5组:给注射物方法同前,行台盼蓝肝脏原位灌流,以观察肝微循环状态[3]。
, http://www.100md.com
(二)门静脉血流量和门脉压的测定:各组大鼠用2%戊巴比妥钠(0.03 g/kg体重ip)麻醉后,经腹正中切口暴露门静脉,用MFV-3100型(日本NIHON KOHDEN公司)电磁流量计测定门静脉血流量(PVF)。穿刺回结肠静脉,接压力换能器(TP-400T型),用四道生理记录仪(日本NIHON KOHDEN公司)测定门静脉压力(PVP)。
(三)内毒素及生化指标测定:
1.血浆内毒素含量测定:采用改良过氯酸法,试剂盒由上海市医学化验所提供。
2.血浆及肝匀浆中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和内皮素-1(endothelin-1,ET-1)含量测定:应用放射免疫分析法。试剂盒由东亚免疫研究所提供。
3.血浆丙氨酸转氨酶(alanine transaminase, ALT)活性测定:采用赖氏法。
, http://www.100md.com
4.血清乳酸脱氢酶(lactate dehydrogenase, LDH)活性测定:试剂盒由上海长征医学科学有限公司提供。
(四)台盼蓝肝脏原位灌流:按文献[3]进行,但灌流速度改为4 mL/g liver.min-1,记录肝脏全部均匀蓝染时间。
(五)病理组织学观察:经HE染色的肝组织切片用MIAS-300型图像分析仪测量肝窦直径的变化。
(六)统计学处理:数据以均数±标准差(
, 百拇医药
结果
一、门脉血流动力学的变化:
如表2所示,TAA皮下注射6 h后,PVF明显减少(P<0.05),随着时间的延长,PVF呈进行性降低,36 h组降低至正常组的大约1/3。而PVP则随TAA皮下注射时间的延长逐渐升高,36 h组升高至约为对照组的2倍,组间相比均有显著差异(P<0.05)。
二、血浆内毒素含量变化:
随着注射TAA时间的增加,血浆内毒素含量逐渐升高,24 h、36 h组均与正常组有显著差异(P<0.05),见表1。
三、血浆及肝匀浆TNF-α含量变化:
注射TAA后血浆TNF-α含量明显升高,36 h组约为正常对照组2倍;肝匀浆中TNF-α含量变化趋势与血浆变化一致,只是升高速度更快,24 h组约达到正常对照组2倍,36 h组约达3倍(表1、3)。
, http://www.100md.com
表1 血浆内毒素及生化指标的动态变化
Tab 1 The dynamic changes of plasma endotoxin and biochemistry (
Group
n
ALT
(U/L)
Endotoxin
(×103U/L)
, http://www.100md.com
TNT-α
(μg/L)
ET-1
(ng/L)
N
6
63.83±23.96
0.156±0.010
0.65±0.12
107.12±14.73
6 h
6
, http://www.100md.com 101.24±58.52
0.216±0.056
0.89±0.10a
119.35±15.02
12 h
6
103.02±20.26a
0.195±0.033
0.90±0.17a
120.70±26.64
24 h
, 百拇医药
7
1497.36±575.94abc
0.249±0.036a
0.98±0.08a
150.91±58.27a
36 h
7
3365.72±494.60abcd
0.265±0.024a
1.23±0.25abcd
, http://www.100md.com
164.68±46.72abc
a:P<0.05, vs N; b:P<0.05 vs 6h; C:P<0.05 vs 12 h;d:P<0.05, vs 24 h; 表2 门脉压、门脉血流量、肝窦直径及台盼蓝灌流时间的变化
Tab 2 The changes of PVP, PVF, SD and TBD Time (
Group
n
PVP
(kPa)
, http://www.100md.com
PVF
(mL.min-1/100 g liver)
HSD
(μm)
TBD Time
(s)
N
6
1.35±0.27
149.15±12.41
6.37±1.42
, http://www.100md.com
195.7±45.7
6 h
6
2.13±0.37a
112.50±10.18a
2.08±0.49a
564.8±181.4a
12 h
6
1.87±0.22a
76.17±22.62ab
, 百拇医药
1.77±0.18a
809.7±126.2ab
24 h
7
2.56±0.79ac
75.48±21.27ab
1.15±0.45abc
1082.4±333.8ab
36 h
7
, http://www.100md.com
2.90±0.66abc
45.53±14.66abcd
0.40±0.05abcd
1370.1±410.5abc
TBD Time=typan blue distribution time;PVP=portal venous pressure; PVF=portal venous flow; HSD=hepatic sinusoid diameter a:P<0.05,vs N; b:P<0.05,vs 6 h; c: P<0.05,vs 12h; d:P<0.05 vs 24 h
四、血浆及肝匀浆ET-1水平变化:
, 百拇医药
TAA损伤各组血浆及肝匀浆ET-1浓度明显高于正常对照组(表1、3)。
五、血浆ALT与血清LDH活性变化:
注射TAA后,随着时间的延长,血浆ALT和血清LDH活性均明显高于正常组(P<0.05),LDH活性的改变较ALT的改变为早(表1、3)。
六、肝脏台盼蓝灌流时间的变化(表2):
随着注射TAA时间的延长,灌流时间明显延长。
七、肝窦直径的变化:
注射TAA后,肝窦直径显著减小(表2)。
表3 血清乳酸脱氢酶及肝匀浆细胞因子的动态变化
, 百拇医药 Tab 3 The dynamic changes of serum LDH and hepatichomogenate cytokine (
Group
n
Serum LDH
(U/L)
Liver
TNF-α(ng/100 mg)
ET-1(pg/100 mg)
, http://www.100md.com
N
6
76.96±62.12
0.80±0.12
166.82±68.00
6 h
6
349.96±169.14a
1.17±0.34a
268.47±109.89a
12 h
, 百拇医药
6
500.72±215.11a
1.49±0.45a
405.60±59.60ab
24 h
7
1893.84±1 271.65abc
1.71±0.36a
348.27±138.66a
36 h
, 百拇医药
7
4192.54±2 170.96abcd
2.72±0.60abcd
327.73±138.91a
a:P<0.05, vs N; b:P<0.05,vs 6 h; c:P<0.05,vs 12 h; d:P<0.05 vs 24 h
八、肝组织病理学改变:
随着注射TAA时间的延长,肝细胞变性坏死逐渐加重,36 h组形成桥接坏死,肝窦被挤压。
九、相关分析:
TAA损伤各组血浆内毒素水平与血浆TNF-α含量呈显著正相关(r=0.4 159,P<0.05)。血浆TNF-α含量与血浆ET-1水平呈显著正相关(r=0.4524,P<0.05)。血浆ET-1含量与PVP水平亦呈显著正相关(r=0.4785,P<0.05)。注射TAA 6 h与12 h组肝ET浓度与肝窦直径呈显著负相关(r=-0.7404,P<0.05)。
, 百拇医药
讨论
本实验结果表明,TAA引起严重肝损伤同时伴有肠源性内毒素血症发生。内毒素可通过激活枯否细胞释放的TNF-α使内皮细胞释放内皮素,或内毒素直接刺激内皮细胞释放内皮素。内皮素可使肝内微血管收缩,并可作用于贮脂细胞使钙离子增多而引起其收缩,从而使肝窦直径缩小变窄,增加门脉阻力,故在急性门静脉高压形成中起重要作用[4]。
实验又表明,随着血浆内毒素水平的升高,台盼蓝在肝内分布时间显著增加(P<0.05),而台盼蓝在肝内的分布时间与肝微循环灌注状况密切相关[3]。微循环障碍使肝组织缺血、缺氧,进而加重肝损伤。由于肝组织破坏加剧,网状支架塌陷,肝窦被挤压,加剧了门脉高压。有实验报道,组织缺氧可使肝内皮细胞和/或肝窦壁其他细胞合成和释放内皮素增多[5,6],内皮素的释放不但可直接引起门静脉压升高,同时还可加剧肝内微循环障碍,从而造成恶性循环,使门脉压进行性升高。
, 百拇医药
TNF-α一方面通过受体进入肝细胞后,与线粒体等细胞器结合,激活某些蛋白酶和磷脂酶A2活性升高,并诱导肝细胞内自由基产生,引起肝细胞膜性结构损伤和DNA链断裂,从而导致肝细胞变性和坏死;另一方面,TNF-α还能促进小血管基底膜纤维连接蛋白(fibronection)含量减少,导致血管壁通透性增强,造成肝内微循环障碍和缺血缺氧性肝细胞坏死[7]。肝细胞的大片状坏死可挤压肝窦,在促进门脉高压的形成中也有一定作用。
参考文献
1 Lee SS, Hadengue A, Girod C, et al. Reduction of intrahepatic vascular space in the pathogenesis of portal hypertension. Gastroenterology, 1987, 93:157.
, 百拇医药
2 Hemsen A. Biochemical and functional characterization of endothelin peptides with special reference to vascular effects. Acta Physiol Scand (Suppl), 1991, 602:1.
3 Jones SM, Thurman RG. L-arginine minimizes reperfusion injury in a low-flow, reflow model of liver perfusion. Hepatology, 1996, 24;163.
4 Rockey D. The cellular pathogenesis of portal hypertension: stellate cell contractility, endothelin, and nitric oxide. Hepatology, 1997, 25:2.
, http://www.100md.com
5 Kourembanas S, Marsden PA, Mcquillan LP, et al. Hypoxia induces endothelin gene expression and secretion in cultrued human endothelium. J Clin Invest, 1991, 88:1054.
6 Okumura S, Takei Y, Kawano S, et al. Vasoactive effect of endothelin-1 on rat liver in vivo. Hepatology, 1994,19:155.
7 顾长海.暴发性病毒性肝炎的发病机理.见:顾长海,王宇明,主编.急性肝衰竭.第1版.成都:四川科学技术出版社,1997.11~21.
1997年12月8日收稿,1998年8月28日修回, 百拇医药