预缺氧对急性缺氧大鼠心肌线粒体功能及ATP含量的影响
作者:罗刚 谢增柱 刘福玉 张国斌
单位:第三军医大学高原医学研究室(重庆 400038)
关键词:低氧;线粒体;心脏;腺苷三磷酸
中国病理生理杂志990415 摘 要 目的:观察预缺氧对急性缺氧大鼠心肌线粒体功能及ATP含量的影响。方法:实验大鼠分三组。1.常氧对照组;2.急性缺氧组;3.预缺氧组。测定了心肌ATP含量及线粒体呼吸功能,以荧光偏振法测定线粒体膜流动性。结果:经预缺氧处理的大鼠遭受急性缺氧后ATP含量从(31.8±2.42)mg-1.g-1增加到(60.55±3.52)mg-1.g-1(P<0.01);线粒体呼吸控制率(RCR)从1.84±0.58上升到4.55±0.32(P<0.01);线粒体膜流动性(MMF)明显增加(P<0.05),F0F1-ATP酶及Na+-K+-ATP酶活性分别提高66%和25%。结论:预缺氧可有效改善缺氧大鼠心肌能量代谢,其作用环节可能和提高线粒体膜流动性,改善线粒体呼吸功能有关。
, http://www.100md.com
Effects of hypoxic preconditioning on myocardial mitochondrial respiratory function and ATP content in acute hypoxic rats
LUO Gang, XIE Zeng-Zu, LIU Fu-Yu, ZHANG Guo-Bin
Department of Pathophysiology, Third Military Medical University, Chongqing (400038)
Abstract AIM:To observe the effects of the hypoxic preconditioning on myocardial mitochondrial respiratory function and ATP content in acute hypoxic rats. METHODS:Rats were divided into 3 groups:normoxic group (control), acute hypoxic group, preconditioing hypoxic group. The myocardial ATP content and mitochondrial respiratory function were measured. Mitochondrial membrane fluidity was assayed with fluorescence polariative method. RESULTS:After administrating hypoxic preconditioning, ATP content in myocardial tissue was enhanced from(31.89±2.42) mg-1.g-1 to (60.55±3.52) mg-1.g-1(P<0.01); mitochondrial respiratory control rate (RCR) was increased from 1.84±0.58 to 4.55±0.32(P<0.01);mitochondrial membrane fluidity was enhanced (P<0.05); F0F1-ATP ase activity and Na+-K+-ATPase activity were increased 66% and 25% respectively. CONCLUSION:Hypoxic preconditioning efficiently improved the myocardial mitochondrial enerygy metabolism possibly through enhancing mitochondrial membrane fluidity and mitochondrial respiratory function.
, 百拇医药
MeSH Anoxia; Mitochondria, heart; Adenosine triphosphate
自从1986年Murry等发现,预缺血可减轻再次缺血造成的心肌损伤以来,人们对其发生机制已进行了广泛而深入的研究[1]。近来国外研究发现:预缺氧(preconditioning hypoxia,PH)也可减轻狗冠状动脉闭塞造成的缺血性心肌损伤[2]。Rising等也观察发现小鼠短暂缺氧后,其耐受致死性缺氧的能力大为提高[3]。但有关预缺氧能否改善缺氧动物心肌的能量代谢,目前国内尚未见报道,国外也研究甚少。本文通过观察预缺氧对急性缺氧大鼠心肌线粒体功能和ATP含量的影响,籍以了解预缺氧动物心肌能量代谢的变化情况。
材料与方法
一、动物分组:
, http://www.100md.com
30只Wistar大鼠,雌雄各半随机分为(1)平原对照组(control, n=10);(2)急性缺氧组(actue hypoxia,A H,n=10);模拟海拔4000 m高原停留24 h;(3)预缺氧处理组(AH+PH,n=10):动物预先在模拟海拔3000 m高原停留4 h,2次,间隔时间2 h,然后4000 m高原停留24 h。
二、血流动力学指标测定:
大鼠麻醉固定后,行右心室和主动脉插管连接八导生理记录仪(RM-6000,岛津,日本),记录右心室收缩压(right ventricle systolic pressure, RVSP),主动脉平均压(mean aortic pressure, MAP)和心率(heart rate, HR)。从动脉取血用ABL-3(丹麦)作血气分析。然后迅速开胸取心尖部约0.2g组织放入液氮冻存,用于ATP含量测定。其余部分用于线粒体分离。除平原对照组外,以上实验均在低压舱内模拟4000 m高原环境中进行。
, 百拇医药
三、线粒体分离及呼吸功能测定:
线粒体分离及呼吸功能测定采用Poderosos等方法[4],底物为苹果酸钠和谷氨酸钠。
四、ATP-酶活力及ANS荧光强度测定:
ATP酶活力及1-苯胺基,8-萘磺酸镁(ANS)荧光强度测定采用毛中兴等方法[5],略加改进。反应总体积为500 μL,样本加入量为25 μL。酶活性单位以μmol Pi.mg-1pro.min-1表示。
五、线粒体膜流动性测定:
采用荧光偏振法,以1,6-二苯基-1,3,5-己三烯(DPH)为荧光指标剂,参照Omodeo-sale等方法进行[6]。
, 百拇医药
六、心肌组织腺嘌呤核苷酸测定[7]:
参照Botker等方法进行,色谱条件:Gilson(法国)系列高效液相色谱系统,UV检测器,检测波长254 nm,灵敏度0.01 AUFS。色谱柱:4.6 nm×250 nm,YWG-ODS C18 10 μm;流动相:2 mmol/L PBS(pH:5.5),样本加入量20 μL。采用衡速洗脱,全程20 min,流速1 mL/min。
七、结果统计:
测定数据经方差分析和FLSD检验,并进行相关分析及曲线拟合,结果以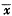 ±s表示。
±s表示。
结果
, http://www.100md.com 一、血气参数及右心室功能改变:
与平原组比较,急性缺氧组动物RVSP明显升高[(5.65±0.25) kPa vs(3.51±0.24) kPa,P<0.01],动脉血氧分压(PaO2)明显降低[(14.63±1.88) kPa,vs (7.24±1.18) kPa,P<0.01],预缺氧组动物RVSP较单纯缺氧组动物明显降低[(5.14±0.32) kPa vs (5.68±0.25) kPa,P<0.01],而PaO2虽稍升高,但无明显差异。
二、心肌线粒体呼吸功能的变化:
急性缺氧时心肌线粒体Ⅳ态呼吸(ST4)显著升高,Ⅲ态呼吸(ST3)、RCR及ADP/O明显下降。经预缺氧处理动物呼吸功能明显改善,但仍低于正常水平(表1)。
, 百拇医药 表1 预缺氧对急性缺氧大鼠心肌线粒体呼吸功能的影响
Tab 1 Effects of hypoxic preconditioning on myocardial mitochondrial respiratroy function in acute hypoxic rats (n=10,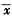 ±s) Group
±s) Group
ST3
(nanoatoms
oxygen/mg.min-1)
ST4
, http://www.100md.com (nanoatoms
oxygen/mg.min-1)
RCR
ADP/O=(nanoatoms
oxygen/mg*min-1)
Control
330.30±20.0
60.95±8.31
5.24±0.41
2.82±0.17
, 百拇医药
AH
250.50±14.3*
132.60±18.4*
1.84±0.58*
2.12±0.14*
AH+HP
315.40±20.1△
69.31±8.48△
4.55±0.32*△
2.67±0.09*△
, 百拇医药
*P<0.01, vs control; △P<0.01, vs AH; AH=acute hypoxcx; HP=hypoxic preconditioning; RCR=respiratory control rate
三、心肌线粒体F0F1-ATP酶、Na+-K+-ATP酶活力的变化:
急性缺氧组大鼠心肌线粒体F0F1-ATP酶、Na+-K+-ATP酶活力及ANS相对荧光强度明显降低。预缺氧组动物上述指标明显恢复(表2)。
表2 预缺氧对急性缺氧大鼠F0F1-ATP酶Na+-K+-ATP酶和ANS荧光强度的影响
, 百拇医药
Tab 2 Changes of F0F1-ATPase and Na+-K+-ATPase activities,ANS fluorescence
intensity in each group (n=10,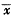 ±s) Group
±s) Group
F0F1-ATPase
(μmol Pi.mg-1
pro.min-1)
, http://www.100md.com
Na+-K+-ATPase
(μmol Pi.mg-1
pro.min-1)
ANS fluorescence
intensity
(relative unit)
Control
7.16±0.31
1.36±0.17
, 百拇医药
54.16±2.86
AH
4.05±0.16*
1.02±0.11*
40.55±1.24*
AH+HP
6.75±0.21*△
1.28±0.11
48.48±2.06△
*P<0.01, vs control;△P<0.01,vs AH
, 百拇医药
四、线粒体膜流动性的变化:
急性缺氧组线粒体荧光偏振度(P)和各向异性(γ)较平原组显著升高。预缺氧组上述指标虽明显恢复,但仍高于平原组。表明:预缺氧可有效提高急性缺氧大鼠线粒体膜流动性(表3)。
表3 预缺氧对急性缺氧大鼠心肌线粒体膜流动性的影响
Tab 3 Changes of mitochondrial membrane fluidity in each group(n=9, ±s) Group
±s) Group
Polarization degree(P)
Anisotropy(γ)
Control
, 百拇医药
0.2318±0.0090
0.1674±0.0060
AH
0.2459±0.0110*
0.1806±0.0100*
AH+HP
0.2398±0.0090*△
0.1720±0.0080*△
*P<0.05, vs control; △P<0.05, vs AH
五、腺嘌呤核苷酸变化:
, 百拇医药
急性缺氧组动物心肌组织ATP含量降低约57%,ADP、AMP含量显著升高。预缺氧组大鼠ATP含量显著高于单纯缺氧组,而ADP和AMP含量则明显低于单纯缺氧组(表4)。
表4 预缺氧对急性缺氧大鼠ATP、ADP和AMP含量的影响
Tab 4 Changes of myocardium ATP, ADP and AMP content in each group (n=10,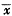 ±s) Group
±s) Group
ATP(μg/mg)
ADP(μg/mg)
AMP(μg/mg)
Control
, 百拇医药
71.34±5.17
93.24±9.01
14.00±3.27
AH
31.89±2.42*
117.81±5.66*
21.81±3.08*
AH+HP
60.55±3.25*△
102.58±5.30*△
, 百拇医药
15.09±2.40*△
*P<0.01,vs control; △P<0.01, vs AH
六、各指标间相关性分析。
F0F1-ATP酶活力分别与ANS荧光强度、线粒体膜流动性及ATP含量呈正相关(ANS:r=0.9473,P<0.01;线粒体膜流动性:r=0.9509,P<0.01:ATP:r=0.9820,P<0.01)。Na+-K+-ATP酶活力与膜流动性呈正相关(r=0.8610,P<0.01)。
讨论
本研究发现:经预缺氧处理后的大鼠遭受急性缺氧对心肌ATP含量明显增加,与Shizukuda等报道预缺氧大鼠冠状动脉闭塞后心肌ATP含量的变化类似[2]。Charles等认为预缺血动物可通过降低能量的利用来维持心肌ATP含量[8]。而预缺氧是否具有相同的机制尚不清楚。在实验中我们注意到:预缺氧可使动物心肌线粒体呼吸功能(ST3,ST4,RCR,ADP/O)明显改善。Robert实验发现预缺氧可增加动物心肌组织腺苷含量[9]。我们推测:预缺氧动物心肌组织ATP含量的提高,可能和腺苷生成增加,引起冠脉扩张并提高心肌供氧,糖酵解作用减弱,从而解除了对苹果酸穿梭系统的抑制有关。苹果酸穿梭系统恢复以后,NADH氧化脱氢得以顺利进行,增加了呼吸链的电子传递,因而改善了线粒体呼吸功能,增加ATP的生成。
, 百拇医药
F0F1-ATP酶位于线粒体内膜,是合成ATP的关键酶。我们运用ANS作为荧光探针和F0F1-ATP酶的疏水微区特异结合,通过测定其荧光强度的改变来观察该酶构象的变化,同时运用DPH作为荧光指示剂观察线粒体膜流动性的改变情况。结果发现:预缺氧组该酶活性、ANS荧光强度及线粒体膜流动性均明显高于单纯缺氧组。相关分析表明:F0F1-ATP酶活力分别与ANS荧光、线粒体膜流动性及ATP含量呈正相关。提示:预缺氧可通过减轻线粒体结构的损伤,增加其流动性来维持F0F1-ATP酶的构象,从而提高了F0F1-ATP酶活力,增加ATP的生成。
Na+-K+-ATP酶镶嵌于线粒体内膜,是保证线粒体结构和功能的重要离子泵。我们发现预缺氧动物该酶活性明显提高,与线粒体膜流动性呈正相关。提示:预缺氧动物心肌线粒体膜结构损伤减轻,膜流动性增加可能和Na+-K+-ATP酶活力的恢复有关。此外,Das等提出:预缺血可使动物心肌自由基产生减少及清除自由基能力提高[10]。而预缺氧动物线粒体膜流动性的增加是否也与此有关,仍有待进一步研究证实。
, 百拇医药
参考文献
1 Murry C E, Jennings R B, Reimer K A. Precondition with ischemia: a delay of cell injury in ischemia myocardium. Circulation, 1986, 94:1124.
2 Yukitaka S, Toshihiro I T, Robert T M, et al. Hypoxic preconditioning attenuates stunning caused by repeated coronary artery occlusions in dog heart. Cardiovasc Res, 1993,27:559.
3 Rising C L, Dalecy L C. Hypoxia-induced increase in hypoxic tolerance augmented by β-hydroxy butyrate in mice. Stroke, 1989, 20:1219.
, http://www.100md.com
4 Poderoso JJ, Fernandez S, Carreras MC, et al. Liver oxygen uptake dependence and mitochondrial function in septic rats. Circ Shock, 1994, 44:175.
5 毛中兴,杨泽田.冷暴露大鼠心肌线粒体H+运转ATP酶活力及能量偶联的改善.第四军医大学学报,1990,11(4):292.
6 Omodeo-Sale F, Lindi C, Palestini P, et al. Role of phosphorytidylethanol in membranes. Effects on membrane fluidity, tolerance to ethanol, and activity of membrane bound enzyme. Biochemistry, 1991, 30:2477.
, http://www.100md.com
7 Botker HE, Kimose HH, Helligso P, et al. Analytical evaluation of high energy phosphate determination by high performance liquid chromatography in myocardial tissue. J Mol Cell Cardiol, 1994, 26:41.
8 Charies E M, Vincent J R, Keith A R, et al. Ischemia preconditioning slows energy metabolism and delays ultrastructural damage during a sustained ischemic episode. Circ Res,1990, 66:913.
9 Robert D L, Gregory M A, Robert MM, et al. Ischemic and hypoxic preconditioning enhance postischemic recovery for function in the rat heart. Cardiovasc Res, 1993, 27:542.
10 Das DK, Engelman R M, Kimura J M. Molecular adaptation of cellular defenses following preconditioning of the heart by repeated ischemia. Cardiovasc Res, 1993, 27:578.
1997年4月23日收稿,1997年10月29日修回, http://www.100md.com
单位:第三军医大学高原医学研究室(重庆 400038)
关键词:低氧;线粒体;心脏;腺苷三磷酸
中国病理生理杂志990415 摘 要 目的:观察预缺氧对急性缺氧大鼠心肌线粒体功能及ATP含量的影响。方法:实验大鼠分三组。1.常氧对照组;2.急性缺氧组;3.预缺氧组。测定了心肌ATP含量及线粒体呼吸功能,以荧光偏振法测定线粒体膜流动性。结果:经预缺氧处理的大鼠遭受急性缺氧后ATP含量从(31.8±2.42)mg-1.g-1增加到(60.55±3.52)mg-1.g-1(P<0.01);线粒体呼吸控制率(RCR)从1.84±0.58上升到4.55±0.32(P<0.01);线粒体膜流动性(MMF)明显增加(P<0.05),F0F1-ATP酶及Na+-K+-ATP酶活性分别提高66%和25%。结论:预缺氧可有效改善缺氧大鼠心肌能量代谢,其作用环节可能和提高线粒体膜流动性,改善线粒体呼吸功能有关。
, http://www.100md.com
Effects of hypoxic preconditioning on myocardial mitochondrial respiratory function and ATP content in acute hypoxic rats
LUO Gang, XIE Zeng-Zu, LIU Fu-Yu, ZHANG Guo-Bin
Department of Pathophysiology, Third Military Medical University, Chongqing (400038)
Abstract AIM:To observe the effects of the hypoxic preconditioning on myocardial mitochondrial respiratory function and ATP content in acute hypoxic rats. METHODS:Rats were divided into 3 groups:normoxic group (control), acute hypoxic group, preconditioing hypoxic group. The myocardial ATP content and mitochondrial respiratory function were measured. Mitochondrial membrane fluidity was assayed with fluorescence polariative method. RESULTS:After administrating hypoxic preconditioning, ATP content in myocardial tissue was enhanced from(31.89±2.42) mg-1.g-1 to (60.55±3.52) mg-1.g-1(P<0.01); mitochondrial respiratory control rate (RCR) was increased from 1.84±0.58 to 4.55±0.32(P<0.01);mitochondrial membrane fluidity was enhanced (P<0.05); F0F1-ATP ase activity and Na+-K+-ATPase activity were increased 66% and 25% respectively. CONCLUSION:Hypoxic preconditioning efficiently improved the myocardial mitochondrial enerygy metabolism possibly through enhancing mitochondrial membrane fluidity and mitochondrial respiratory function.
, 百拇医药
MeSH Anoxia; Mitochondria, heart; Adenosine triphosphate
自从1986年Murry等发现,预缺血可减轻再次缺血造成的心肌损伤以来,人们对其发生机制已进行了广泛而深入的研究[1]。近来国外研究发现:预缺氧(preconditioning hypoxia,PH)也可减轻狗冠状动脉闭塞造成的缺血性心肌损伤[2]。Rising等也观察发现小鼠短暂缺氧后,其耐受致死性缺氧的能力大为提高[3]。但有关预缺氧能否改善缺氧动物心肌的能量代谢,目前国内尚未见报道,国外也研究甚少。本文通过观察预缺氧对急性缺氧大鼠心肌线粒体功能和ATP含量的影响,籍以了解预缺氧动物心肌能量代谢的变化情况。
材料与方法
一、动物分组:
, http://www.100md.com
30只Wistar大鼠,雌雄各半随机分为(1)平原对照组(control, n=10);(2)急性缺氧组(actue hypoxia,A H,n=10);模拟海拔4000 m高原停留24 h;(3)预缺氧处理组(AH+PH,n=10):动物预先在模拟海拔3000 m高原停留4 h,2次,间隔时间2 h,然后4000 m高原停留24 h。
二、血流动力学指标测定:
大鼠麻醉固定后,行右心室和主动脉插管连接八导生理记录仪(RM-6000,岛津,日本),记录右心室收缩压(right ventricle systolic pressure, RVSP),主动脉平均压(mean aortic pressure, MAP)和心率(heart rate, HR)。从动脉取血用ABL-3(丹麦)作血气分析。然后迅速开胸取心尖部约0.2g组织放入液氮冻存,用于ATP含量测定。其余部分用于线粒体分离。除平原对照组外,以上实验均在低压舱内模拟4000 m高原环境中进行。
, 百拇医药
三、线粒体分离及呼吸功能测定:
线粒体分离及呼吸功能测定采用Poderosos等方法[4],底物为苹果酸钠和谷氨酸钠。
四、ATP-酶活力及ANS荧光强度测定:
ATP酶活力及1-苯胺基,8-萘磺酸镁(ANS)荧光强度测定采用毛中兴等方法[5],略加改进。反应总体积为500 μL,样本加入量为25 μL。酶活性单位以μmol Pi.mg-1pro.min-1表示。
五、线粒体膜流动性测定:
采用荧光偏振法,以1,6-二苯基-1,3,5-己三烯(DPH)为荧光指标剂,参照Omodeo-sale等方法进行[6]。
, 百拇医药
六、心肌组织腺嘌呤核苷酸测定[7]:
参照Botker等方法进行,色谱条件:Gilson(法国)系列高效液相色谱系统,UV检测器,检测波长254 nm,灵敏度0.01 AUFS。色谱柱:4.6 nm×250 nm,YWG-ODS C18 10 μm;流动相:2 mmol/L PBS(pH:5.5),样本加入量20 μL。采用衡速洗脱,全程20 min,流速1 mL/min。
七、结果统计:
测定数据经方差分析和FLSD检验,并进行相关分析及曲线拟合,结果以
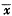 ±s表示。
±s表示。结果
, http://www.100md.com 一、血气参数及右心室功能改变:
与平原组比较,急性缺氧组动物RVSP明显升高[(5.65±0.25) kPa vs(3.51±0.24) kPa,P<0.01],动脉血氧分压(PaO2)明显降低[(14.63±1.88) kPa,vs (7.24±1.18) kPa,P<0.01],预缺氧组动物RVSP较单纯缺氧组动物明显降低[(5.14±0.32) kPa vs (5.68±0.25) kPa,P<0.01],而PaO2虽稍升高,但无明显差异。
二、心肌线粒体呼吸功能的变化:
急性缺氧时心肌线粒体Ⅳ态呼吸(ST4)显著升高,Ⅲ态呼吸(ST3)、RCR及ADP/O明显下降。经预缺氧处理动物呼吸功能明显改善,但仍低于正常水平(表1)。
, 百拇医药 表1 预缺氧对急性缺氧大鼠心肌线粒体呼吸功能的影响
Tab 1 Effects of hypoxic preconditioning on myocardial mitochondrial respiratroy function in acute hypoxic rats (n=10,
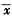 ±s) Group
±s) GroupST3
(nanoatoms
oxygen/mg.min-1)
ST4
, http://www.100md.com (nanoatoms
oxygen/mg.min-1)
RCR
ADP/O=(nanoatoms
oxygen/mg*min-1)
Control
330.30±20.0
60.95±8.31
5.24±0.41
2.82±0.17
, 百拇医药
AH
250.50±14.3*
132.60±18.4*
1.84±0.58*
2.12±0.14*
AH+HP
315.40±20.1△
69.31±8.48△
4.55±0.32*△
2.67±0.09*△
, 百拇医药
*P<0.01, vs control; △P<0.01, vs AH; AH=acute hypoxcx; HP=hypoxic preconditioning; RCR=respiratory control rate
三、心肌线粒体F0F1-ATP酶、Na+-K+-ATP酶活力的变化:
急性缺氧组大鼠心肌线粒体F0F1-ATP酶、Na+-K+-ATP酶活力及ANS相对荧光强度明显降低。预缺氧组动物上述指标明显恢复(表2)。
表2 预缺氧对急性缺氧大鼠F0F1-ATP酶Na+-K+-ATP酶和ANS荧光强度的影响
, 百拇医药
Tab 2 Changes of F0F1-ATPase and Na+-K+-ATPase activities,ANS fluorescence
intensity in each group (n=10,
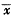 ±s) Group
±s) GroupF0F1-ATPase
(μmol Pi.mg-1
pro.min-1)
, http://www.100md.com
Na+-K+-ATPase
(μmol Pi.mg-1
pro.min-1)
ANS fluorescence
intensity
(relative unit)
Control
7.16±0.31
1.36±0.17
, 百拇医药
54.16±2.86
AH
4.05±0.16*
1.02±0.11*
40.55±1.24*
AH+HP
6.75±0.21*△
1.28±0.11
48.48±2.06△
*P<0.01, vs control;△P<0.01,vs AH
, 百拇医药
四、线粒体膜流动性的变化:
急性缺氧组线粒体荧光偏振度(P)和各向异性(γ)较平原组显著升高。预缺氧组上述指标虽明显恢复,但仍高于平原组。表明:预缺氧可有效提高急性缺氧大鼠线粒体膜流动性(表3)。
表3 预缺氧对急性缺氧大鼠心肌线粒体膜流动性的影响
Tab 3 Changes of mitochondrial membrane fluidity in each group(n=9,
 ±s) Group
±s) GroupPolarization degree(P)
Anisotropy(γ)
Control
, 百拇医药
0.2318±0.0090
0.1674±0.0060
AH
0.2459±0.0110*
0.1806±0.0100*
AH+HP
0.2398±0.0090*△
0.1720±0.0080*△
*P<0.05, vs control; △P<0.05, vs AH
五、腺嘌呤核苷酸变化:
, 百拇医药
急性缺氧组动物心肌组织ATP含量降低约57%,ADP、AMP含量显著升高。预缺氧组大鼠ATP含量显著高于单纯缺氧组,而ADP和AMP含量则明显低于单纯缺氧组(表4)。
表4 预缺氧对急性缺氧大鼠ATP、ADP和AMP含量的影响
Tab 4 Changes of myocardium ATP, ADP and AMP content in each group (n=10,
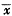 ±s) Group
±s) GroupATP(μg/mg)
ADP(μg/mg)
AMP(μg/mg)
Control
, 百拇医药
71.34±5.17
93.24±9.01
14.00±3.27
AH
31.89±2.42*
117.81±5.66*
21.81±3.08*
AH+HP
60.55±3.25*△
102.58±5.30*△
, 百拇医药
15.09±2.40*△
*P<0.01,vs control; △P<0.01, vs AH
六、各指标间相关性分析。
F0F1-ATP酶活力分别与ANS荧光强度、线粒体膜流动性及ATP含量呈正相关(ANS:r=0.9473,P<0.01;线粒体膜流动性:r=0.9509,P<0.01:ATP:r=0.9820,P<0.01)。Na+-K+-ATP酶活力与膜流动性呈正相关(r=0.8610,P<0.01)。
讨论
本研究发现:经预缺氧处理后的大鼠遭受急性缺氧对心肌ATP含量明显增加,与Shizukuda等报道预缺氧大鼠冠状动脉闭塞后心肌ATP含量的变化类似[2]。Charles等认为预缺血动物可通过降低能量的利用来维持心肌ATP含量[8]。而预缺氧是否具有相同的机制尚不清楚。在实验中我们注意到:预缺氧可使动物心肌线粒体呼吸功能(ST3,ST4,RCR,ADP/O)明显改善。Robert实验发现预缺氧可增加动物心肌组织腺苷含量[9]。我们推测:预缺氧动物心肌组织ATP含量的提高,可能和腺苷生成增加,引起冠脉扩张并提高心肌供氧,糖酵解作用减弱,从而解除了对苹果酸穿梭系统的抑制有关。苹果酸穿梭系统恢复以后,NADH氧化脱氢得以顺利进行,增加了呼吸链的电子传递,因而改善了线粒体呼吸功能,增加ATP的生成。
, 百拇医药
F0F1-ATP酶位于线粒体内膜,是合成ATP的关键酶。我们运用ANS作为荧光探针和F0F1-ATP酶的疏水微区特异结合,通过测定其荧光强度的改变来观察该酶构象的变化,同时运用DPH作为荧光指示剂观察线粒体膜流动性的改变情况。结果发现:预缺氧组该酶活性、ANS荧光强度及线粒体膜流动性均明显高于单纯缺氧组。相关分析表明:F0F1-ATP酶活力分别与ANS荧光、线粒体膜流动性及ATP含量呈正相关。提示:预缺氧可通过减轻线粒体结构的损伤,增加其流动性来维持F0F1-ATP酶的构象,从而提高了F0F1-ATP酶活力,增加ATP的生成。
Na+-K+-ATP酶镶嵌于线粒体内膜,是保证线粒体结构和功能的重要离子泵。我们发现预缺氧动物该酶活性明显提高,与线粒体膜流动性呈正相关。提示:预缺氧动物心肌线粒体膜结构损伤减轻,膜流动性增加可能和Na+-K+-ATP酶活力的恢复有关。此外,Das等提出:预缺血可使动物心肌自由基产生减少及清除自由基能力提高[10]。而预缺氧动物线粒体膜流动性的增加是否也与此有关,仍有待进一步研究证实。
, 百拇医药
参考文献
1 Murry C E, Jennings R B, Reimer K A. Precondition with ischemia: a delay of cell injury in ischemia myocardium. Circulation, 1986, 94:1124.
2 Yukitaka S, Toshihiro I T, Robert T M, et al. Hypoxic preconditioning attenuates stunning caused by repeated coronary artery occlusions in dog heart. Cardiovasc Res, 1993,27:559.
3 Rising C L, Dalecy L C. Hypoxia-induced increase in hypoxic tolerance augmented by β-hydroxy butyrate in mice. Stroke, 1989, 20:1219.
, http://www.100md.com
4 Poderoso JJ, Fernandez S, Carreras MC, et al. Liver oxygen uptake dependence and mitochondrial function in septic rats. Circ Shock, 1994, 44:175.
5 毛中兴,杨泽田.冷暴露大鼠心肌线粒体H+运转ATP酶活力及能量偶联的改善.第四军医大学学报,1990,11(4):292.
6 Omodeo-Sale F, Lindi C, Palestini P, et al. Role of phosphorytidylethanol in membranes. Effects on membrane fluidity, tolerance to ethanol, and activity of membrane bound enzyme. Biochemistry, 1991, 30:2477.
, http://www.100md.com
7 Botker HE, Kimose HH, Helligso P, et al. Analytical evaluation of high energy phosphate determination by high performance liquid chromatography in myocardial tissue. J Mol Cell Cardiol, 1994, 26:41.
8 Charies E M, Vincent J R, Keith A R, et al. Ischemia preconditioning slows energy metabolism and delays ultrastructural damage during a sustained ischemic episode. Circ Res,1990, 66:913.
9 Robert D L, Gregory M A, Robert MM, et al. Ischemic and hypoxic preconditioning enhance postischemic recovery for function in the rat heart. Cardiovasc Res, 1993, 27:542.
10 Das DK, Engelman R M, Kimura J M. Molecular adaptation of cellular defenses following preconditioning of the heart by repeated ischemia. Cardiovasc Res, 1993, 27:578.
1997年4月23日收稿,1997年10月29日修回, http://www.100md.com