HL-60细胞中IL6基因的克隆及鉴定*
作者:郑黎燕 奚永志 孔繁华 金 荔 陈兴国 屠 敏 刘 楠 鱼咏涛
单位:
郑黎燕 奚永志 孔繁华 金 荔 陈兴国 屠 敏 刘 楠 军事医学科学院附属医院免疫学研究室;鱼咏涛 放射医学研究所(北京 100039)
关键词:白细胞介素6;基因;白血病;细胞
HL 摘 要 目的: 为探索性构建重组人白细胞介素6-绿脓杆菌外毒素融合蛋白(IL6-PE40)以选择性杀伤高表达IL6受体(IL6R)的白血病细胞,本研究试图从人急性早幼粒细胞白血病细胞株(HL-60)中克隆N-末端缺失24个氨基酸的人IL6基因(IL6 cDNA)并构建含此基因的重组质粒。方法:根据IL6基因序列设计合成可扩增IL6cDNA的特异性引物;利用基因重组技术,构建含IL6基因的重组质粒pUC-IL6。结果与结论:本文首次从HL-60中扩增出预期480 bp的IL6 cDNA,将其克隆至pUC18质粒中,命名为pUC-IL6,并经EcoRI/BamHI双酶切电泳及序列分析鉴定加以确证,为进一步构建重组人IL6-PE40奠定了坚实基础。
, 百拇医药
Cloning of IL6 gene from human promyelocytic leukemia cell line
ZHENG Li-Yan, XI Yong-Zhi, KONG Fan-Hua, YU Yong-Tao,JIN Li, CHENG Xing-Guo, TU Min, LIU Nan
Department of Immunology, North TaiPing Road Hospital, Beijing (100039)
Abstract AIM:In order to construct recombinant interleukin 6-Pseudomonas exotoxin fusion protein (IL6-PE40) to selecting kill leukemia cells expressing high levels of IL6 receptors, we tried to clone IL6 gene from human promyelocytic leukemia cell line (HL-60) and construct the recombinant plasmid encoding IL6.METHODS:Two pairs of primes for IL6 were designed and synthesized according to the sequences of human IL6 gene derived from gene bank. A recombinant plasmid pUC-IL6 coding for IL6 was constructed by recombinant gene technique.RESULTS and CONCLUSION:The recombinant plasmid pUC-IL6 was constructed by cloning 480 bp IL6 cDNA fragment into pUC18 plasmid, confirmed by DNA sequencing and EcoRI/BamHI restriction enzyme digesting. The recombinant plasmid pUC-IL6 can be used to construct recombinant interleukin 6-Pseudomonas exotoxin fusion protein (IL6-PE40).
, 百拇医药
MeSH Interleukin-6; Gene; Leukemic; Cells
白血病病态造血最显著的特征之一,是通过自泌与旁泌路径获取维持其自泌性生长所必须的细胞因子。近年的研究表明,许多白血病细胞高表达并分泌IL6,自泌的IL6除直接刺激白血病细胞生长外,还与CSFs、IL1、IL3、IL4及SCF协同刺激白血病细胞的增殖,因此,IL6是AML及ALL的重要自泌因子。新近日、美学者又发现,IL6及IL6R基因明显表达在AML和AMLL(混合型白血病)细胞中,且大于50%的ALL细胞也高表达IL6R基因,而正常造血干/祖细胞几乎不表达或仅表达微量的IL6R。由此提示,IL6/IL6R系统在急性白血病的发生与发展中可能发挥重要作用[1~4]。同时,也为利用IL6/IL6R系统介导重组IL6-毒素融合蛋白靶向杀伤高表达IL6R的急性白血病细胞提供了充分的理论依据[1]。为了更及时地将这一新策略付诸于人类白血病的导向杀伤研究和治疗中,新近我们在成功地克隆了新型导向毒素蛋白PE40基因的基础上[5],又从HL-60细胞中克隆了含编码人IL6的cDNA并进行了序列分析,以便为探索性构建重组毒素IL6-PE40融合蛋白奠定基础。
, http://www.100md.com
材料与方法
1.材料:RNA提取试剂盒、RT-PCR试剂盒、PCR DNA回收试剂盒、质粒纯化试剂盒、各种DNA限制性内切酶和T4 DNA连接酶、Taq DNA聚合酶等工具酶均购自Promega公司。RPMI1640细胞培养基购自GIBCO/BRL公司。其他常规化学试剂为进口或国产分析纯产品。E.coli HB101由军事医学科学院基础医学研究所提供,pUC18质粒购自MBI公司,引物
由军事医学科学院放射医学研究所合成,PCR扩增仪为PE-480。
2.细胞株:人急性早幼粒细胞白血病细胞株HL-60细胞由军事医学科学院放射医学研究所鱼咏涛惠赠。用含10%胎牛血清的RPMI-1640培养液传代培养,置37℃、5% CO2条件下培养3 d。
3.HL-60细胞总RNA提取:收集培养细胞(108左右),4℃300×g(1 000 r/min)离心5 min,用25 mL的预冷灭菌的1×PBS洗涤沉淀,离心后弃上清。加入8 mL预冷的异硫氰酸胍变性溶液裂解细胞,再加入4 mL,变性液裂解残留的细胞,用匀浆器匀浆上述12 mL细胞裂解物,然后转移到一灭菌离心管中,加1.2 mL 2 mol/LNaAc(pH4.0)、12 mL苯酚:氯仿:异戊醇混合液,置冰浴15 min,4℃ 10 000×g(14 000 r/min)离心20 min,吸取上清,加入等体积的异丙醇,置-20℃至少30 min,4℃ 10 000×g(14 000 r/min)离心15 min沉淀RNA,把RNA重新溶解在5 mL的变性溶液中,加等体积异丙醇,离心取RNA沉淀,用75%冷乙醇洗涤沉淀,凉干后将沉淀溶于适当体积的无RNase的去离子水中。-20℃保存。
, http://www.100md.com
4.反转录PCR:以提取的RNA为模板,以PCR的上、下游引物为引物,进行反转录,反应参数参照试剂盒说明。
5.IL6重组质粒的构建及序列分析:DNA酶切、连接、转化、质粒鉴定均按《分子克隆》有关章节进行,IL6 cDNA的序列分析采用DNA自动测序仪进行。
结果
一、RT-PCR扩增IL6cDNA的引物设计:
为了便于克隆IL6cDNA以及进一步与PE40基因构建成重组IL6-PE40外毒素融合基因,根据IL6的全长基因序列,通过计算机模拟分析,设计了下述两组扩增IL6cDNA的引物:a组:上游引物为5'CGCGAATTCATGATTGACAAACAAATTC3’,下游引物为5’CCGGATCCTTACATTTGCCGAAGA 3′,所扩增的480 bp片段为N-末端缺失24个氨基酸的人IL6cDNA[6]。该对引物具有以下特点:①上、下游引物分别引入EcoR I和BamHI酶切位点,以使重组操作简单易行;②在EcoR I和BamHI酶切位点前分别设制2个保护碱基以保证酶切效率;③上、下游引物的5’端各含有起始密码子ATG和终止密码子TAA, 从而可确保经PCR扩增的产物为IL6 cDNA片段。b组:上游引物与a组相同,下游引物为5’CGACCCACCACCGC-CCGAGCCACCGCCACCGCTTCCACCGCCTCCAGATCCG-
, http://www.100md.com
CCGCCACCCATTTGCCGAAGAGCCCTC3’,该下游引物的5’端含有一60 bp的接头且与扩增PE40基因的上游引物5’端互补,以利于构建重组IL6-PE40外毒素融合基因。
二、pUC-IL6重组质粒的构建及序列分析:
以HL-60细胞RNA为模板,经RT-PCR扩增出480 bp的人IL6 cDNA片段(图1),回收提纯后以EcoRI/BamHI进行双酶切,并克隆至具有相同酶切位点的pUC18质粒中,经X-gal/IPTG筛选后得到重组质粒pUC-IL6。将该质粒再用EcoRI/BamHI双酶消化鉴定,证实所预期的480 bp cDNA片段的存在(图2),测序分析证实,所克隆的IL6 cNDA序列除一个碱基突变外(第152位氨基酸密码子由TCC突变为CCC),其他碱基序列与文献报道的完全一致,该突变不影响IL6作为IL6-PE40的导向配体。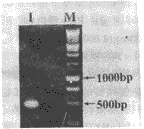
, 百拇医药
Fig 1 Agarose gel electrophoresis map of the RT-PCR products
M: 1 KD DNA Ladder; 1:RT-PCR products
图1 RT-PCR产物的电泳图谱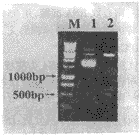
Fig 2 Restriction map of recombinant plasmid pUC-IL-6
M:1 KD DNA Ladder; 1:Recombinant plasmid pUC-IL-6;
2:Recombinant plasmid pUC-IL-6 EcoRI/BamHI digesting
, 百拇医药
图2 重组质粒pUC-IL-6酶切鉴定图谱
讨论
重组毒素是现代导向药物研究的一个令人瞩目的领域。研究资料表明,多种肿瘤细胞高表达IL-6受体[7]。利用这一特点,我们与荷兰皇家科学院合作已率先在国际上开展了利用IL6/IL6R系统介导靶向杀伤白血病细胞可行性的实验研究。目前国际上仅美国的两个实验室构建成功了IL6-毒素融合蛋白,其它国家尚在起步。
IL6-PE40是由编码人IL6cNDA以及绿脓杆菌外毒素PE40基因构建而成,IL6的作用是起到特异性的导向,而PE40则为删去Ia区后的绿脓杆菌外毒素蛋白,具有高效杀伤功效,是第二代导向杀伤策略中最重要的毒素蛋白[1]。为了探索性构建成功IL6-PE40,新近我们已成功地克隆并序列分析了PE40基因,在此基础上本研究又首次从HL-60中克隆了所预期的编码人IL6的cDNA,序列分析结果显示,所扩增的IL6cDNA序列同文献报道相同。为了提高融合蛋白的表达效率,我们在设计引物时,根据参考文献,通过计算机模拟分析,采取一系列优化表达的措施:从IL6-N端选择保持IL-6生物活性而不抑制转译起始的区域作为表达的起始区域,即在N端缺失24个氨基酸;优化ATG前后的碱基序列;避免载体SD序列、AUG同IL-6 mRNA的5’端区域形成二级结构;提高转译起始区AT含量;偏性终止密码子TAA取代天然IL-6的终止密码子TAG[6]。鉴于T、B、单核细胞以及成纤维细胞都构成性表达IL-6基因,国内外学者在克隆IL6基因时均以这些细胞为靶细胞,当然亦有从干扰素诱导的HeLa细胞以及扁桃腺中扩增IL6cDNA的研究。然而象我们以急性早幼粒白血病细胞为靶细胞来克隆IL6 cDNA的研究至今尚未见报道。
, http://www.100md.com
*国家自然科学基金资助(No.39500062和39870875)
参考文献
1 奚永志.IL6/IL6R系统与重组IL6-PE40融合蛋白.中国病理生理杂志,1998,14:433.
2 Rozemuller H, Rombouts WJC, Touw IP, et al. Treatment of acute myelocytic leukemia with interleukin-6 pseudomonas exotoxin fusion protein in a rat leukemia model. Leukemia, 1996, 10:1796.
3 Inoue K, Sugiyama H, Ogawa H, et al. Expression of the interleukin-6, IL6 receptor and gp130 genes in acute leukemia. Blood, 1994, 84:2672.
, 百拇医药
4 Boayue KB, Gu L, Yeager AM, et al. Pediatric acute myelogenous leukemia cells express IL-6 receptors and are sensitive to a recombinant IL6-pseudomonas exotoxin. Leukemia, 1998, 12:182.
5 郑黎燕,奚永志,孔繁华,等.新型导向毒素蛋白PE40的克隆与序列分析.解放军医学杂志,1999,24:223.
6 任启生,王嘉玺,邹民吉,等.pBV-IL6重组质粒的构建及其在细胞中的超高表达.中国免疫学杂志,1992,8:133.
7 Siegall CB, Chaudhary VK, FitzGerald DJ, et al. Cytotoxic activity of an interleukin 6-Pseudomonas exotoxin fusion protein on human myeloma cells. Proc Natl Acad Sci USA, 1988, 85:9738.
(1998年5月6日收稿,1999年1月14日修回), 百拇医药
单位:
郑黎燕 奚永志 孔繁华 金 荔 陈兴国 屠 敏 刘 楠 军事医学科学院附属医院免疫学研究室;鱼咏涛 放射医学研究所(北京 100039)
关键词:白细胞介素6;基因;白血病;细胞
HL 摘 要 目的: 为探索性构建重组人白细胞介素6-绿脓杆菌外毒素融合蛋白(IL6-PE40)以选择性杀伤高表达IL6受体(IL6R)的白血病细胞,本研究试图从人急性早幼粒细胞白血病细胞株(HL-60)中克隆N-末端缺失24个氨基酸的人IL6基因(IL6 cDNA)并构建含此基因的重组质粒。方法:根据IL6基因序列设计合成可扩增IL6cDNA的特异性引物;利用基因重组技术,构建含IL6基因的重组质粒pUC-IL6。结果与结论:本文首次从HL-60中扩增出预期480 bp的IL6 cDNA,将其克隆至pUC18质粒中,命名为pUC-IL6,并经EcoRI/BamHI双酶切电泳及序列分析鉴定加以确证,为进一步构建重组人IL6-PE40奠定了坚实基础。
, 百拇医药
Cloning of IL6 gene from human promyelocytic leukemia cell line
ZHENG Li-Yan, XI Yong-Zhi, KONG Fan-Hua, YU Yong-Tao,JIN Li, CHENG Xing-Guo, TU Min, LIU Nan
Department of Immunology, North TaiPing Road Hospital, Beijing (100039)
Abstract AIM:In order to construct recombinant interleukin 6-Pseudomonas exotoxin fusion protein (IL6-PE40) to selecting kill leukemia cells expressing high levels of IL6 receptors, we tried to clone IL6 gene from human promyelocytic leukemia cell line (HL-60) and construct the recombinant plasmid encoding IL6.METHODS:Two pairs of primes for IL6 were designed and synthesized according to the sequences of human IL6 gene derived from gene bank. A recombinant plasmid pUC-IL6 coding for IL6 was constructed by recombinant gene technique.RESULTS and CONCLUSION:The recombinant plasmid pUC-IL6 was constructed by cloning 480 bp IL6 cDNA fragment into pUC18 plasmid, confirmed by DNA sequencing and EcoRI/BamHI restriction enzyme digesting. The recombinant plasmid pUC-IL6 can be used to construct recombinant interleukin 6-Pseudomonas exotoxin fusion protein (IL6-PE40).
, 百拇医药
MeSH Interleukin-6; Gene; Leukemic; Cells
白血病病态造血最显著的特征之一,是通过自泌与旁泌路径获取维持其自泌性生长所必须的细胞因子。近年的研究表明,许多白血病细胞高表达并分泌IL6,自泌的IL6除直接刺激白血病细胞生长外,还与CSFs、IL1、IL3、IL4及SCF协同刺激白血病细胞的增殖,因此,IL6是AML及ALL的重要自泌因子。新近日、美学者又发现,IL6及IL6R基因明显表达在AML和AMLL(混合型白血病)细胞中,且大于50%的ALL细胞也高表达IL6R基因,而正常造血干/祖细胞几乎不表达或仅表达微量的IL6R。由此提示,IL6/IL6R系统在急性白血病的发生与发展中可能发挥重要作用[1~4]。同时,也为利用IL6/IL6R系统介导重组IL6-毒素融合蛋白靶向杀伤高表达IL6R的急性白血病细胞提供了充分的理论依据[1]。为了更及时地将这一新策略付诸于人类白血病的导向杀伤研究和治疗中,新近我们在成功地克隆了新型导向毒素蛋白PE40基因的基础上[5],又从HL-60细胞中克隆了含编码人IL6的cDNA并进行了序列分析,以便为探索性构建重组毒素IL6-PE40融合蛋白奠定基础。
, http://www.100md.com
材料与方法
1.材料:RNA提取试剂盒、RT-PCR试剂盒、PCR DNA回收试剂盒、质粒纯化试剂盒、各种DNA限制性内切酶和T4 DNA连接酶、Taq DNA聚合酶等工具酶均购自Promega公司。RPMI1640细胞培养基购自GIBCO/BRL公司。其他常规化学试剂为进口或国产分析纯产品。E.coli HB101由军事医学科学院基础医学研究所提供,pUC18质粒购自MBI公司,引物
由军事医学科学院放射医学研究所合成,PCR扩增仪为PE-480。
2.细胞株:人急性早幼粒细胞白血病细胞株HL-60细胞由军事医学科学院放射医学研究所鱼咏涛惠赠。用含10%胎牛血清的RPMI-1640培养液传代培养,置37℃、5% CO2条件下培养3 d。
3.HL-60细胞总RNA提取:收集培养细胞(108左右),4℃300×g(1 000 r/min)离心5 min,用25 mL的预冷灭菌的1×PBS洗涤沉淀,离心后弃上清。加入8 mL预冷的异硫氰酸胍变性溶液裂解细胞,再加入4 mL,变性液裂解残留的细胞,用匀浆器匀浆上述12 mL细胞裂解物,然后转移到一灭菌离心管中,加1.2 mL 2 mol/LNaAc(pH4.0)、12 mL苯酚:氯仿:异戊醇混合液,置冰浴15 min,4℃ 10 000×g(14 000 r/min)离心20 min,吸取上清,加入等体积的异丙醇,置-20℃至少30 min,4℃ 10 000×g(14 000 r/min)离心15 min沉淀RNA,把RNA重新溶解在5 mL的变性溶液中,加等体积异丙醇,离心取RNA沉淀,用75%冷乙醇洗涤沉淀,凉干后将沉淀溶于适当体积的无RNase的去离子水中。-20℃保存。
, http://www.100md.com
4.反转录PCR:以提取的RNA为模板,以PCR的上、下游引物为引物,进行反转录,反应参数参照试剂盒说明。
5.IL6重组质粒的构建及序列分析:DNA酶切、连接、转化、质粒鉴定均按《分子克隆》有关章节进行,IL6 cDNA的序列分析采用DNA自动测序仪进行。
结果
一、RT-PCR扩增IL6cDNA的引物设计:
为了便于克隆IL6cDNA以及进一步与PE40基因构建成重组IL6-PE40外毒素融合基因,根据IL6的全长基因序列,通过计算机模拟分析,设计了下述两组扩增IL6cDNA的引物:a组:上游引物为5'CGCGAATTCATGATTGACAAACAAATTC3’,下游引物为5’CCGGATCCTTACATTTGCCGAAGA 3′,所扩增的480 bp片段为N-末端缺失24个氨基酸的人IL6cDNA[6]。该对引物具有以下特点:①上、下游引物分别引入EcoR I和BamHI酶切位点,以使重组操作简单易行;②在EcoR I和BamHI酶切位点前分别设制2个保护碱基以保证酶切效率;③上、下游引物的5’端各含有起始密码子ATG和终止密码子TAA, 从而可确保经PCR扩增的产物为IL6 cDNA片段。b组:上游引物与a组相同,下游引物为5’CGACCCACCACCGC-CCGAGCCACCGCCACCGCTTCCACCGCCTCCAGATCCG-
, http://www.100md.com
CCGCCACCCATTTGCCGAAGAGCCCTC3’,该下游引物的5’端含有一60 bp的接头且与扩增PE40基因的上游引物5’端互补,以利于构建重组IL6-PE40外毒素融合基因。
二、pUC-IL6重组质粒的构建及序列分析:
以HL-60细胞RNA为模板,经RT-PCR扩增出480 bp的人IL6 cDNA片段(图1),回收提纯后以EcoRI/BamHI进行双酶切,并克隆至具有相同酶切位点的pUC18质粒中,经X-gal/IPTG筛选后得到重组质粒pUC-IL6。将该质粒再用EcoRI/BamHI双酶消化鉴定,证实所预期的480 bp cDNA片段的存在(图2),测序分析证实,所克隆的IL6 cNDA序列除一个碱基突变外(第152位氨基酸密码子由TCC突变为CCC),其他碱基序列与文献报道的完全一致,该突变不影响IL6作为IL6-PE40的导向配体。

, 百拇医药
Fig 1 Agarose gel electrophoresis map of the RT-PCR products
M: 1 KD DNA Ladder; 1:RT-PCR products
图1 RT-PCR产物的电泳图谱

Fig 2 Restriction map of recombinant plasmid pUC-IL-6
M:1 KD DNA Ladder; 1:Recombinant plasmid pUC-IL-6;
2:Recombinant plasmid pUC-IL-6 EcoRI/BamHI digesting
, 百拇医药
图2 重组质粒pUC-IL-6酶切鉴定图谱
讨论
重组毒素是现代导向药物研究的一个令人瞩目的领域。研究资料表明,多种肿瘤细胞高表达IL-6受体[7]。利用这一特点,我们与荷兰皇家科学院合作已率先在国际上开展了利用IL6/IL6R系统介导靶向杀伤白血病细胞可行性的实验研究。目前国际上仅美国的两个实验室构建成功了IL6-毒素融合蛋白,其它国家尚在起步。
IL6-PE40是由编码人IL6cNDA以及绿脓杆菌外毒素PE40基因构建而成,IL6的作用是起到特异性的导向,而PE40则为删去Ia区后的绿脓杆菌外毒素蛋白,具有高效杀伤功效,是第二代导向杀伤策略中最重要的毒素蛋白[1]。为了探索性构建成功IL6-PE40,新近我们已成功地克隆并序列分析了PE40基因,在此基础上本研究又首次从HL-60中克隆了所预期的编码人IL6的cDNA,序列分析结果显示,所扩增的IL6cDNA序列同文献报道相同。为了提高融合蛋白的表达效率,我们在设计引物时,根据参考文献,通过计算机模拟分析,采取一系列优化表达的措施:从IL6-N端选择保持IL-6生物活性而不抑制转译起始的区域作为表达的起始区域,即在N端缺失24个氨基酸;优化ATG前后的碱基序列;避免载体SD序列、AUG同IL-6 mRNA的5’端区域形成二级结构;提高转译起始区AT含量;偏性终止密码子TAA取代天然IL-6的终止密码子TAG[6]。鉴于T、B、单核细胞以及成纤维细胞都构成性表达IL-6基因,国内外学者在克隆IL6基因时均以这些细胞为靶细胞,当然亦有从干扰素诱导的HeLa细胞以及扁桃腺中扩增IL6cDNA的研究。然而象我们以急性早幼粒白血病细胞为靶细胞来克隆IL6 cDNA的研究至今尚未见报道。
, http://www.100md.com
*国家自然科学基金资助(No.39500062和39870875)
参考文献
1 奚永志.IL6/IL6R系统与重组IL6-PE40融合蛋白.中国病理生理杂志,1998,14:433.
2 Rozemuller H, Rombouts WJC, Touw IP, et al. Treatment of acute myelocytic leukemia with interleukin-6 pseudomonas exotoxin fusion protein in a rat leukemia model. Leukemia, 1996, 10:1796.
3 Inoue K, Sugiyama H, Ogawa H, et al. Expression of the interleukin-6, IL6 receptor and gp130 genes in acute leukemia. Blood, 1994, 84:2672.
, 百拇医药
4 Boayue KB, Gu L, Yeager AM, et al. Pediatric acute myelogenous leukemia cells express IL-6 receptors and are sensitive to a recombinant IL6-pseudomonas exotoxin. Leukemia, 1998, 12:182.
5 郑黎燕,奚永志,孔繁华,等.新型导向毒素蛋白PE40的克隆与序列分析.解放军医学杂志,1999,24:223.
6 任启生,王嘉玺,邹民吉,等.pBV-IL6重组质粒的构建及其在细胞中的超高表达.中国免疫学杂志,1992,8:133.
7 Siegall CB, Chaudhary VK, FitzGerald DJ, et al. Cytotoxic activity of an interleukin 6-Pseudomonas exotoxin fusion protein on human myeloma cells. Proc Natl Acad Sci USA, 1988, 85:9738.
(1998年5月6日收稿,1999年1月14日修回), 百拇医药