抗氧化剂抑制内皮细胞的白细胞粘附不依赖它们的抗氧化特性
作者:黄 虔 Graf H.B. Lehmkuhl G. Steinheider
单位:黄 虔 暨南大学医学院第一附属医院心内科(广州 510630);G. Steinheider Federal Institute for Medicaments and Medical Products, Berlin 13353, Germany
关键词:内皮;细胞;抗氧化药;NF-κB
抗氧化剂抑制内皮细胞的白细胞粘附 不依赖它们的抗氧化特性 M.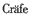 K.
K.
摘 要 目的:探讨抗氧化剂能否抑制内皮细胞表面的粘附分子表达和内皮细胞与白细胞粘附,以及抗氧化剂调节NF-κΒ的活性是否通过一种对氧化还原敏感的机制。方法: 在一种液体流动小室中进行细胞粘附实验;抗氧化剂的抗氧化活性用2’-7’-二氯荧光素双醋酸盐(DCFH-DA)染色血管内皮细胞经流式细胞仪测量;内皮细胞NF-κB的活性用电泳迁移率分析测定。结果:PDTC和chrysin抑制HL60往TNFα刺激的HUVEC上粘附,probucol和DCI则没有作用。DCI和chrysin抑制内皮细胞过氧化氢的形成,而PDTC和probucol无效。只有PDTC对NF-κB的活性有抑制作用,其他抗氧化剂对NF-κB的活性没有影响。结论:(1)PDTC对NF-κB的抑制作用与它的抗氧化特性无关;(2)DCI和chrysin对ROI的清除作用及其对白细胞粘附的抑制作用与抑制NF-κB活性无关。
, 百拇医药
Inhibition of endothelial cell-leukocyte adhesion by
Antioxidants is independent upon their antioxidative effect
HUANG Qian1, M.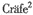 , K. Graf2, H.B. Lehmkuhl2, G. Steinheider3
, K. Graf2, H.B. Lehmkuhl2, G. Steinheider3
(1)Department of Cardiology, Medical College of Jinan University, Guangzhou 510630);
, 百拇医药
(2)Department of Internal Medicine / Cardiology, German Heart Institute Berlin & Virchow Hospitals, Humboldt University;
(3)Federal Institute for Medicaments and Medical Products, Berlin (13353), Germany
Abstract AIM: To investigate whether antioxidants modulate expression of endothelial cell adhesion molecules and inhibit adhesion of leukocytes to endothelium and furthermore, whether all antioxidants regulate NF-κB activation through a redox sensitive mechanism. METHODS:The effect of antioxidative substances dichloroisocumarin (DCI), chrysin, pyrrolidin dithiocarbamat (PDTC) and probucol on endothelial leukocyte adhesion under near physiological flow conditions were examined. The antioxidative activity of antioxidants was measured in a DCF fluorescence assay with flow cytometry. The activation of NF-κB in endothelial cells was investigated in a gel shift assay. RESULTS: PDTC and probucol did not show an inhibitory effect to the formation of intracellular H2O2 in TNFα activated human vascular endothelial cells (HUVEC), chrysin showed a moderate and DCI a strong antioxidative effect. In contrast, PDTC and chrysin inhibited the adhesion of HL60 cells. DCI and probucol did not have influence on the adhesion within the area of the examined shear stresses. Only PDTC inhibited the TNFα-induced activation of NF-κB in endothelial cells. CONCLUSION: The inhibition of endothelial leukocyte adhesion by antioxidative substances is not to be explained by its antioxidative characteristics only. The inhibitory effect of PDTC on NF-κB activation was probably not related to its antioxidative properties.
, http://www.100md.com
MeSH Endothelium; Cells; Antioxidants, NF-kappa-B
一般认为,氧自由基是炎症反应,动脉粥样硬化和再灌注损伤的致病因素。这些病变的早期共同特征是细胞粘附分子介导的内皮细胞-白细胞粘附增加。细胞粘附分子的基因表达主要由核转录因子NF-κB控制。近来发现许多抗氧化剂,如吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)等,能有效地抑制NF-κB的激活[2,3]。因此有人推测氧自由基与NF-κB的激活有关[4]。特异性地抑制NF-κB的活性能够抑制细胞粘附分子的表达,也许是防治动脉粥样硬化的潜在手段。然而,迄今尚未阐明现已广泛使用的抗氧化剂是否抑制NF-κB的活性或/和能否清除氧自由基;也不清楚抗氧化剂如何影响NF-κB的活性,和细胞表面粘附分子表达。
本研究用抗氧化剂PDTC,DCI(3,4-dichloroisocoumarin,二氯异香豆素), chrysin(柯因)及临床广泛使用的抗动脉硬化药probucol进行实验,旨在探讨抗氧化剂调节NF-κB的活性是否通过一种对氧化还原敏感的机制,及抗氧化剂能否抑制内皮细胞表面的粘附分子表达和内皮细胞的白细胞粘附。
, 百拇医药
材料与方法
一、细胞培养:
(一)人脐带静脉内皮细胞(human umbilical vein endothelial cell, HUVEC):HUVEC按常规方法分离自新生儿脐带静脉[5],培养在内皮细胞培养液(M199培养液加入20%小牛血清,2 mmol/L L-谷氨酸,100 mg/L链霉素,100×103 U/L青霉素,10 μg/L内皮细胞生长因子),保持在37℃,5% CO2培养箱中。
(二)HL60细胞:HL60细胞是一种表面有路易斯寡糖(sialylated Lewis x, sLeX)高水平表达的细胞系,sLeX是内皮细胞选择素(E-selectin)的配体。细胞培养在含10%小牛血清、抗生素、2 mmol/L L-谷氨酸的RPMI 1640培养液,保持在37℃,5% CO2培养箱中。
, 百拇医药
二、细胞粘附实验:
为了评价抗氧化剂对白细胞-内皮细胞粘附的影响,我们在一种液体流动小室(flow chamber)中进行细胞粘附实验。液体流动小室是一种平行板状结构,其管道由入口至出口呈双曲线状增宽,在恒流条件下管壁切变力是管道宽度的函数,提供一种接近生理的液体流动条件。液体流动小室安放在Zeiss显微镜上,与灌注系统相连,流速由输液泵控制。整个系统在实验过程中保持37℃。
将传了两代的HUVEC种在经过纤维连接素处理的载玻片上培养至完全融合。加抗氧化剂PDTC,DCI,chrysin和probucol(浓度从3×10-4到10-7 mol/L)孵育15 min后,用肿瘤坏死因子(TNFα)刺激4 h。将种有HUVEC的载玻片安放在流体小室内,从小室入口加入100μL HL60细胞(109/mL),任其产生粘附,5 min后计数固定粘附在内皮细胞上的白细胞个数。实验过程始终用加有0.1%牛血清蛋白、10 mmol/L Hepes缓冲液的M199培养液灌注。
, http://www.100md.com
三、流式细胞仪测细胞内过氧化氢浓度:
2’-7’-二氯荧光素双醋酸盐(DCFH-DA)用于测定内皮细胞过氧化氢(H2O2)的形成。不发光的DCFH-DA可以自由透过细胞膜,在细胞内被过氧化氢和过氧化物酶氧化生成发荧光的荧光素。这种绿色荧光可以用流式细胞仪测得,其荧光强度与产生的过氧化氢量成正比。
将融合的HUVEC用常规方法消化,制成细胞悬液。内皮细胞悬液与DCFH-DA孵育30 min后,离心除去含DCFH-DA的培养液,重新悬浮细胞于Hepes-Tyrode缓冲液中(109/L)。加抗氧化剂PDTC,DCI,chrysin和probucol(10-4~10-7 mol/L)15 min后,分组加入TNFα(500×103 U/L),H2O2 (400μmol/L),PMA(10-7 mol/L)刺激内皮细胞,以FACScan流式细胞仪测定荧光强度。
, 百拇医药
四、电泳迁移率分析:
融合的HUVEC加抗氧化剂孵育15 min后,以TNFα刺激1 h,按Dignam方法制备核提取物[6]。用放射性[γ32P-]ATP标记包含NF-κB顺序的寡核苷酸片段。结合反应在10 mmol/L Tris-HCl(pH 7.5), 50 mmol/L NaCl, 0.5 mmol/L DTT, 5 mmol/L EDTA, 0.25 mmol/L MgCl2, 3 μmol/L poly (dI-dC),4%甘油中进行。DNA-蛋白质复合物在4%不饱和聚丙烯酰胺凝胶中,在160V,4℃条件下电泳2 h。然后让凝胶干燥,放射自显影。
五、统计处理:
实验数据以平均数±标准差(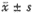 )表示,均数差异显著性用方差分析和t检验处理。n表示实验次数。最大半抑制浓度用非线性回归计算得出。
)表示,均数差异显著性用方差分析和t检验处理。n表示实验次数。最大半抑制浓度用非线性回归计算得出。
, 百拇医药
结果
一、抗氧化活性:
用DCFH-DA标记30 min,测定基础荧光强度和抗氧化剂对基础过氧化氢形成的影响。只有DCI和chrysin对细胞内过氧化氢形成有抑制作用。100 μmol/L DCI抑制基础过氧化氢形成70%,100 μmol/L chrysin抑制56%。浓度梯度试验表明DCI的最大半抑制浓度为25 μmol/L, chrysin是30 μmol/L。任何受试浓度的PDTC和probucol对细胞内过氧化氢的形成没有作用(图1)。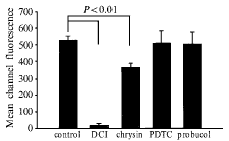
Fig 1 Effect of antioxidants (100 μmol/L) on intracellular
, http://www.100md.com
H2O2 formation in human endothelial cells
图1 抗氧化剂对内皮细胞过氧化氢形成的影响
将HUVEC暴露于TNFα和PMA不引起明显的细胞内过氧化氢的提高。与H2O2孵育后细胞内DCF荧光强度5 min后明显增加持续大约30 min恢复到基础水平。经DCI预处理后的细胞H2O2导致的荧光强度增加受到明显抑制,chrysin也能抑制这种增加,作用较DCI为弱。PDTC和probucol对外源性过氧化氢导致的细胞内荧光强度增加没有抑制作用。
二、对HL60细胞-HUVEC粘附的影响:
在所有流体小室实验中,固定粘附的细胞数随切变力的增加而减少。在对未经TNFα刺激的内皮细胞所做的实验中,在切变力是0.22 Pa时,HL60固定粘附的数目每高倍视野平均3±1个,在切变力是0.06 Pa时,固定粘附的数目每高倍视野平均160±14个。将HUVEC与TNFα一起孵育5 h,明显增加HUVEC上HL60粘附的数量。在高切变区(切变力>0.20 Pa)每高倍视野平均79±6个,在低切变区(切变力<0.10 Pa)是每高倍视野655±30个。PDTC对HL60-HUVEC粘附有很强的抑制作用(图2),最大半抑制浓度是52 μmol/L,chrysin的最大半抑制浓度是30 μmol/L。DCI和probucol对HL60-HUVEC粘附没有抑制作用(图3)。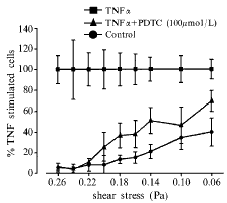
, 百拇医药
Fig 2 Effect of PDTC on HL60 cells adhesion to TNFα-stimulated endothelial cells
图2 PDTC对经TNFα活化的内皮细胞的HL60细胞粘附的影响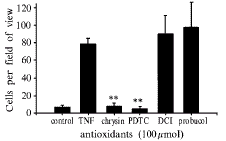
Fig 3 Effect of antioxidants on HL60 cells adhesion to TNFα-stimulated endothelial cells at shear stress 0.22~0.26 Pa
**P<0.01, vs TNF-stimulated cells
, http://www.100md.com
图3 抗氧化剂在切变力为0.22~0.26 Pa条件下对经TNFα活化的内皮细胞的HL60细胞粘附的影响
三、对NF-κB活性的影响:
内皮细胞NF-κB的活性是用电泳迁移率分析测定的。在未经TNFα刺激的HUVEC,很难测得NF-κB特异性的DNA-蛋白质复合物(P65和P50)。HUVEC在经TNFα处理1 h后,测得的P65和P50明显增加。经PDTC预处理后的HUVEC,TNFα刺激的NF-κB的激活受到明显抑制。DCI,chrysin和probucol对经TNFα处理的内皮细胞的NF-κB的激活没有影响(图4)。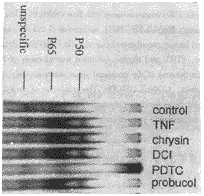
Fig 4 Effect of antioxidants on NF-κB activation in TNFα-stimulated HUVEC
, 百拇医药
图4 抗氧化剂对经TNFα活化的内皮细胞NF-κB活性的影响
讨论
本研究表明,抗氧化剂本身对白细胞-内皮细胞粘附的作用很不一致。它们对反应性氧中间体(reactive oxygen intermediate, ROI)生成的影响也不相同。PDTC和chrysin抑制HL60往TNFα刺激的HUVEC上粘附,probucol和DCI则没有作用。DCI和chrysin抑制内皮细胞过氧化氢的形成,而PDTC和probucol无效。只有PDTC对NF-κB的活性有抑制作用,其他抗氧化剂对NF-κB的活性没有影响。这些发现尽管肯定了PDTC作为NF-κB活性抑制剂在调节粘附分子表达方面起着重要作用,然而却表明,这种抑制作用并不依赖它的抗氧化活性。
以TNFα刺激内皮细胞,并未增加细胞内的荧光强度。正与其他作者的发现一样[7],以H2O2刺激内皮细胞,可使内皮细胞的荧光强度明显增加。以TNFα刺激内皮细胞未能增加细胞内的荧光强度的原因之一,可能是所用的方法对H2O2的产量变化不够敏感。据报道,这种实验是测定细胞内ROI的最敏感的方法[8]。H2O2刺激内皮细胞导致的细胞内荧光强度的增加可被DCI和chrysin明显地抑制,而其它抗氧化剂无效。出乎意料的是,尽管PDTC具有抗氧化作用的-SH基团,在这项实验中并未表现出抑制H2O2生成的能力。
, http://www.100md.com
本研究证实经TNFα刺激的HUVEC其NF-κB活性增加,而只有PDTC抑制NF-κB的激活,其它抗氧化剂则无作用。PDTC抑制NF-κB的激活与其抗氧化特性有关的假设暗示ROI参与细胞因子例如TNFα的信号传导过程[2,9]。而现在的结果显示,那两种具有很高抗氧化活性的抗氧化剂对NF-κB的活性没有影响,PDTC对NF-κB的活性有很强的抑制作用,我们却未能证实它的抗氧化作用。
条件设定在流室入口处的切变力0.26 Pa,出口处的切变力为0.06 Pa。因而才可能测得选择素依赖的白细胞滚动(发生在切变力大约0.10 Pa)和结合素依赖的白细胞固定粘附(<0.10 Pa)[10]。结果表明PDTC和chrysin明显抑制HL60往内皮细胞上粘附,probucol和DCI则没有抑制作用。
这些结果表明:(1)PDTC对NF-κB的抑制作用与它的抗氧化特性无关;(2)DCI和chrysin对ROI的清除作用及其对白细胞粘附的抑制作用与抑制NF-κB活性无关。
, 百拇医药
M. K. Graf H.B. Lehmkuhl Department of Internal Medicine/Cardiology, German Heart Institute Berlin & Virchow Hospitals, Humboldt University;
K. Graf H.B. Lehmkuhl Department of Internal Medicine/Cardiology, German Heart Institute Berlin & Virchow Hospitals, Humboldt University;
参考文献
1 Pober JS, Cotran RS. Cytokines and endothelial cell biology. Physiol Rev,1990, 70:427.
2 Schreck R, Meier B, Mannel DN, et al. Dithiocarbamates as potent inhibitors of nuclear factor kappa B activation in intact cells. J Exp Med,1992,175:1181.
, http://www.100md.com
3 Baeuerle PA. The inducible transcription activator NF-κB: regulation by distinct protein subunits. Biochim Biophys Acta,1991,1072:63.
4 Cybulsky MI, Gimbrone MA, Jr. Endothelial expression of a mononuclear leukocyte adhesion molecule during atherogenesis. Science,1991,251:788.
5 Grfe M, Auch-Schwelk W, Graf K, et al. Isolation and characterization of macrovascular and microvascular endothelial cells from human hearts. Am J Physiol,1994,267:H2138.
, http://www.100md.com
6 Dignam JD, Lebovitz RM, Roeder RG. Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res,1983,11:1475.
7 Carter WO, Narayanan PK, Pobinson JP. Intracellular hydrogen peroxide and superoxide anion detection in endothelial cells. J Leukocyte Biol,1994, 55:253.
8 Hecker M, Preiss C, Schini-Kerth VB, et al. Antioxidants differentially affect nuclear factor kB-mediated nitric oxide synthase expression in vascular smooth muscle cells. FEBS Letters,1996, 380:224.
, http://www.100md.com
9 Allen RC. Phagocytic leukocyte oxygenation activities and chemiluminescence: a kinetic approach to analysis. Methods Enzymol,1986,133:449
10 Rothlein R, Czajkowski M, O'Neill MM, et al. Induction of intercellular adhesion molecule 1 on primary and continuous cell lines by pro-inflammatory cytokines. Regulation by pharmacologic agents and neutralizing antibodies. J Immunol,1988,141:1665.
(1998年12月21日收稿,1999年3月15日修回), 百拇医药
单位:黄 虔 暨南大学医学院第一附属医院心内科(广州 510630);G. Steinheider Federal Institute for Medicaments and Medical Products, Berlin 13353, Germany
关键词:内皮;细胞;抗氧化药;NF-κB
抗氧化剂抑制内皮细胞的白细胞粘附 不依赖它们的抗氧化特性 M.
摘 要 目的:探讨抗氧化剂能否抑制内皮细胞表面的粘附分子表达和内皮细胞与白细胞粘附,以及抗氧化剂调节NF-κΒ的活性是否通过一种对氧化还原敏感的机制。方法: 在一种液体流动小室中进行细胞粘附实验;抗氧化剂的抗氧化活性用2’-7’-二氯荧光素双醋酸盐(DCFH-DA)染色血管内皮细胞经流式细胞仪测量;内皮细胞NF-κB的活性用电泳迁移率分析测定。结果:PDTC和chrysin抑制HL60往TNFα刺激的HUVEC上粘附,probucol和DCI则没有作用。DCI和chrysin抑制内皮细胞过氧化氢的形成,而PDTC和probucol无效。只有PDTC对NF-κB的活性有抑制作用,其他抗氧化剂对NF-κB的活性没有影响。结论:(1)PDTC对NF-κB的抑制作用与它的抗氧化特性无关;(2)DCI和chrysin对ROI的清除作用及其对白细胞粘附的抑制作用与抑制NF-κB活性无关。
, 百拇医药
Inhibition of endothelial cell-leukocyte adhesion by
Antioxidants is independent upon their antioxidative effect
HUANG Qian1, M.
(1)Department of Cardiology, Medical College of Jinan University, Guangzhou 510630);
, 百拇医药
(2)Department of Internal Medicine / Cardiology, German Heart Institute Berlin & Virchow Hospitals, Humboldt University;
(3)Federal Institute for Medicaments and Medical Products, Berlin (13353), Germany
Abstract AIM: To investigate whether antioxidants modulate expression of endothelial cell adhesion molecules and inhibit adhesion of leukocytes to endothelium and furthermore, whether all antioxidants regulate NF-κB activation through a redox sensitive mechanism. METHODS:The effect of antioxidative substances dichloroisocumarin (DCI), chrysin, pyrrolidin dithiocarbamat (PDTC) and probucol on endothelial leukocyte adhesion under near physiological flow conditions were examined. The antioxidative activity of antioxidants was measured in a DCF fluorescence assay with flow cytometry. The activation of NF-κB in endothelial cells was investigated in a gel shift assay. RESULTS: PDTC and probucol did not show an inhibitory effect to the formation of intracellular H2O2 in TNFα activated human vascular endothelial cells (HUVEC), chrysin showed a moderate and DCI a strong antioxidative effect. In contrast, PDTC and chrysin inhibited the adhesion of HL60 cells. DCI and probucol did not have influence on the adhesion within the area of the examined shear stresses. Only PDTC inhibited the TNFα-induced activation of NF-κB in endothelial cells. CONCLUSION: The inhibition of endothelial leukocyte adhesion by antioxidative substances is not to be explained by its antioxidative characteristics only. The inhibitory effect of PDTC on NF-κB activation was probably not related to its antioxidative properties.
, http://www.100md.com
MeSH Endothelium; Cells; Antioxidants, NF-kappa-B
一般认为,氧自由基是炎症反应,动脉粥样硬化和再灌注损伤的致病因素。这些病变的早期共同特征是细胞粘附分子介导的内皮细胞-白细胞粘附增加。细胞粘附分子的基因表达主要由核转录因子NF-κB控制。近来发现许多抗氧化剂,如吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)等,能有效地抑制NF-κB的激活[2,3]。因此有人推测氧自由基与NF-κB的激活有关[4]。特异性地抑制NF-κB的活性能够抑制细胞粘附分子的表达,也许是防治动脉粥样硬化的潜在手段。然而,迄今尚未阐明现已广泛使用的抗氧化剂是否抑制NF-κB的活性或/和能否清除氧自由基;也不清楚抗氧化剂如何影响NF-κB的活性,和细胞表面粘附分子表达。
本研究用抗氧化剂PDTC,DCI(3,4-dichloroisocoumarin,二氯异香豆素), chrysin(柯因)及临床广泛使用的抗动脉硬化药probucol进行实验,旨在探讨抗氧化剂调节NF-κB的活性是否通过一种对氧化还原敏感的机制,及抗氧化剂能否抑制内皮细胞表面的粘附分子表达和内皮细胞的白细胞粘附。
, 百拇医药
材料与方法
一、细胞培养:
(一)人脐带静脉内皮细胞(human umbilical vein endothelial cell, HUVEC):HUVEC按常规方法分离自新生儿脐带静脉[5],培养在内皮细胞培养液(M199培养液加入20%小牛血清,2 mmol/L L-谷氨酸,100 mg/L链霉素,100×103 U/L青霉素,10 μg/L内皮细胞生长因子),保持在37℃,5% CO2培养箱中。
(二)HL60细胞:HL60细胞是一种表面有路易斯寡糖(sialylated Lewis x, sLeX)高水平表达的细胞系,sLeX是内皮细胞选择素(E-selectin)的配体。细胞培养在含10%小牛血清、抗生素、2 mmol/L L-谷氨酸的RPMI 1640培养液,保持在37℃,5% CO2培养箱中。
, 百拇医药
二、细胞粘附实验:
为了评价抗氧化剂对白细胞-内皮细胞粘附的影响,我们在一种液体流动小室(flow chamber)中进行细胞粘附实验。液体流动小室是一种平行板状结构,其管道由入口至出口呈双曲线状增宽,在恒流条件下管壁切变力是管道宽度的函数,提供一种接近生理的液体流动条件。液体流动小室安放在Zeiss显微镜上,与灌注系统相连,流速由输液泵控制。整个系统在实验过程中保持37℃。
将传了两代的HUVEC种在经过纤维连接素处理的载玻片上培养至完全融合。加抗氧化剂PDTC,DCI,chrysin和probucol(浓度从3×10-4到10-7 mol/L)孵育15 min后,用肿瘤坏死因子(TNFα)刺激4 h。将种有HUVEC的载玻片安放在流体小室内,从小室入口加入100μL HL60细胞(109/mL),任其产生粘附,5 min后计数固定粘附在内皮细胞上的白细胞个数。实验过程始终用加有0.1%牛血清蛋白、10 mmol/L Hepes缓冲液的M199培养液灌注。
, http://www.100md.com
三、流式细胞仪测细胞内过氧化氢浓度:
2’-7’-二氯荧光素双醋酸盐(DCFH-DA)用于测定内皮细胞过氧化氢(H2O2)的形成。不发光的DCFH-DA可以自由透过细胞膜,在细胞内被过氧化氢和过氧化物酶氧化生成发荧光的荧光素。这种绿色荧光可以用流式细胞仪测得,其荧光强度与产生的过氧化氢量成正比。
将融合的HUVEC用常规方法消化,制成细胞悬液。内皮细胞悬液与DCFH-DA孵育30 min后,离心除去含DCFH-DA的培养液,重新悬浮细胞于Hepes-Tyrode缓冲液中(109/L)。加抗氧化剂PDTC,DCI,chrysin和probucol(10-4~10-7 mol/L)15 min后,分组加入TNFα(500×103 U/L),H2O2 (400μmol/L),PMA(10-7 mol/L)刺激内皮细胞,以FACScan流式细胞仪测定荧光强度。
, 百拇医药
四、电泳迁移率分析:
融合的HUVEC加抗氧化剂孵育15 min后,以TNFα刺激1 h,按Dignam方法制备核提取物[6]。用放射性[γ32P-]ATP标记包含NF-κB顺序的寡核苷酸片段。结合反应在10 mmol/L Tris-HCl(pH 7.5), 50 mmol/L NaCl, 0.5 mmol/L DTT, 5 mmol/L EDTA, 0.25 mmol/L MgCl2, 3 μmol/L poly (dI-dC),4%甘油中进行。DNA-蛋白质复合物在4%不饱和聚丙烯酰胺凝胶中,在160V,4℃条件下电泳2 h。然后让凝胶干燥,放射自显影。
五、统计处理:
实验数据以平均数±标准差(
, 百拇医药
结果
一、抗氧化活性:
用DCFH-DA标记30 min,测定基础荧光强度和抗氧化剂对基础过氧化氢形成的影响。只有DCI和chrysin对细胞内过氧化氢形成有抑制作用。100 μmol/L DCI抑制基础过氧化氢形成70%,100 μmol/L chrysin抑制56%。浓度梯度试验表明DCI的最大半抑制浓度为25 μmol/L, chrysin是30 μmol/L。任何受试浓度的PDTC和probucol对细胞内过氧化氢的形成没有作用(图1)。

Fig 1 Effect of antioxidants (100 μmol/L) on intracellular
, http://www.100md.com
H2O2 formation in human endothelial cells
图1 抗氧化剂对内皮细胞过氧化氢形成的影响
将HUVEC暴露于TNFα和PMA不引起明显的细胞内过氧化氢的提高。与H2O2孵育后细胞内DCF荧光强度5 min后明显增加持续大约30 min恢复到基础水平。经DCI预处理后的细胞H2O2导致的荧光强度增加受到明显抑制,chrysin也能抑制这种增加,作用较DCI为弱。PDTC和probucol对外源性过氧化氢导致的细胞内荧光强度增加没有抑制作用。
二、对HL60细胞-HUVEC粘附的影响:
在所有流体小室实验中,固定粘附的细胞数随切变力的增加而减少。在对未经TNFα刺激的内皮细胞所做的实验中,在切变力是0.22 Pa时,HL60固定粘附的数目每高倍视野平均3±1个,在切变力是0.06 Pa时,固定粘附的数目每高倍视野平均160±14个。将HUVEC与TNFα一起孵育5 h,明显增加HUVEC上HL60粘附的数量。在高切变区(切变力>0.20 Pa)每高倍视野平均79±6个,在低切变区(切变力<0.10 Pa)是每高倍视野655±30个。PDTC对HL60-HUVEC粘附有很强的抑制作用(图2),最大半抑制浓度是52 μmol/L,chrysin的最大半抑制浓度是30 μmol/L。DCI和probucol对HL60-HUVEC粘附没有抑制作用(图3)。

, 百拇医药
Fig 2 Effect of PDTC on HL60 cells adhesion to TNFα-stimulated endothelial cells
图2 PDTC对经TNFα活化的内皮细胞的HL60细胞粘附的影响

Fig 3 Effect of antioxidants on HL60 cells adhesion to TNFα-stimulated endothelial cells at shear stress 0.22~0.26 Pa
**P<0.01, vs TNF-stimulated cells
, http://www.100md.com
图3 抗氧化剂在切变力为0.22~0.26 Pa条件下对经TNFα活化的内皮细胞的HL60细胞粘附的影响
三、对NF-κB活性的影响:
内皮细胞NF-κB的活性是用电泳迁移率分析测定的。在未经TNFα刺激的HUVEC,很难测得NF-κB特异性的DNA-蛋白质复合物(P65和P50)。HUVEC在经TNFα处理1 h后,测得的P65和P50明显增加。经PDTC预处理后的HUVEC,TNFα刺激的NF-κB的激活受到明显抑制。DCI,chrysin和probucol对经TNFα处理的内皮细胞的NF-κB的激活没有影响(图4)。

Fig 4 Effect of antioxidants on NF-κB activation in TNFα-stimulated HUVEC
, 百拇医药
图4 抗氧化剂对经TNFα活化的内皮细胞NF-κB活性的影响
讨论
本研究表明,抗氧化剂本身对白细胞-内皮细胞粘附的作用很不一致。它们对反应性氧中间体(reactive oxygen intermediate, ROI)生成的影响也不相同。PDTC和chrysin抑制HL60往TNFα刺激的HUVEC上粘附,probucol和DCI则没有作用。DCI和chrysin抑制内皮细胞过氧化氢的形成,而PDTC和probucol无效。只有PDTC对NF-κB的活性有抑制作用,其他抗氧化剂对NF-κB的活性没有影响。这些发现尽管肯定了PDTC作为NF-κB活性抑制剂在调节粘附分子表达方面起着重要作用,然而却表明,这种抑制作用并不依赖它的抗氧化活性。
以TNFα刺激内皮细胞,并未增加细胞内的荧光强度。正与其他作者的发现一样[7],以H2O2刺激内皮细胞,可使内皮细胞的荧光强度明显增加。以TNFα刺激内皮细胞未能增加细胞内的荧光强度的原因之一,可能是所用的方法对H2O2的产量变化不够敏感。据报道,这种实验是测定细胞内ROI的最敏感的方法[8]。H2O2刺激内皮细胞导致的细胞内荧光强度的增加可被DCI和chrysin明显地抑制,而其它抗氧化剂无效。出乎意料的是,尽管PDTC具有抗氧化作用的-SH基团,在这项实验中并未表现出抑制H2O2生成的能力。
, http://www.100md.com
本研究证实经TNFα刺激的HUVEC其NF-κB活性增加,而只有PDTC抑制NF-κB的激活,其它抗氧化剂则无作用。PDTC抑制NF-κB的激活与其抗氧化特性有关的假设暗示ROI参与细胞因子例如TNFα的信号传导过程[2,9]。而现在的结果显示,那两种具有很高抗氧化活性的抗氧化剂对NF-κB的活性没有影响,PDTC对NF-κB的活性有很强的抑制作用,我们却未能证实它的抗氧化作用。
条件设定在流室入口处的切变力0.26 Pa,出口处的切变力为0.06 Pa。因而才可能测得选择素依赖的白细胞滚动(发生在切变力大约0.10 Pa)和结合素依赖的白细胞固定粘附(<0.10 Pa)[10]。结果表明PDTC和chrysin明显抑制HL60往内皮细胞上粘附,probucol和DCI则没有抑制作用。
这些结果表明:(1)PDTC对NF-κB的抑制作用与它的抗氧化特性无关;(2)DCI和chrysin对ROI的清除作用及其对白细胞粘附的抑制作用与抑制NF-κB活性无关。
, 百拇医药
M.
参考文献
1 Pober JS, Cotran RS. Cytokines and endothelial cell biology. Physiol Rev,1990, 70:427.
2 Schreck R, Meier B, Mannel DN, et al. Dithiocarbamates as potent inhibitors of nuclear factor kappa B activation in intact cells. J Exp Med,1992,175:1181.
, http://www.100md.com
3 Baeuerle PA. The inducible transcription activator NF-κB: regulation by distinct protein subunits. Biochim Biophys Acta,1991,1072:63.
4 Cybulsky MI, Gimbrone MA, Jr. Endothelial expression of a mononuclear leukocyte adhesion molecule during atherogenesis. Science,1991,251:788.
5 Grfe M, Auch-Schwelk W, Graf K, et al. Isolation and characterization of macrovascular and microvascular endothelial cells from human hearts. Am J Physiol,1994,267:H2138.
, http://www.100md.com
6 Dignam JD, Lebovitz RM, Roeder RG. Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res,1983,11:1475.
7 Carter WO, Narayanan PK, Pobinson JP. Intracellular hydrogen peroxide and superoxide anion detection in endothelial cells. J Leukocyte Biol,1994, 55:253.
8 Hecker M, Preiss C, Schini-Kerth VB, et al. Antioxidants differentially affect nuclear factor kB-mediated nitric oxide synthase expression in vascular smooth muscle cells. FEBS Letters,1996, 380:224.
, http://www.100md.com
9 Allen RC. Phagocytic leukocyte oxygenation activities and chemiluminescence: a kinetic approach to analysis. Methods Enzymol,1986,133:449
10 Rothlein R, Czajkowski M, O'Neill MM, et al. Induction of intercellular adhesion molecule 1 on primary and continuous cell lines by pro-inflammatory cytokines. Regulation by pharmacologic agents and neutralizing antibodies. J Immunol,1988,141:1665.
(1998年12月21日收稿,1999年3月15日修回), 百拇医药